Способ идентификации агента на основе высокопроизводительного скрининга
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и касается способа идентификации агента на основе высокопроизводительного скрининга. Представленный способ включает следующие стадии: подготовку клеток в первом наборе, включающем, по меньшей мере, 96 приемников; добавление агента, по крайней мере, к одному приемнику; инкубирование агента с клетками; лизирование клеток путем добавления буфера, который является гипотоническим или содержит детергент, и содержит ингибитор ДНКазы; удаление РНК из клеточного лизата с помощью РНКазы; центрифугирование первого набора приемников при низкой скорости; перенос супернатанта, содержащего фрагменты ДНК, на второй набор приемников; добавление обнаруживаемого соединения, способного к интеркаляции с фрагментами ДНК, в буфере для детекции, содержащем ингибитор ДНКазы, к, по крайней мере, одному приемнику; измерение количества интеркалированного обнаруживаемого соединения; и сравнение количества интеркалированного обнаруживаемого соединения с контролем для определения разницы, что позволяет идентифицировать указанный агент как модифицирующий агент, если разница превышает заранее установленный предел. Представленное изобретение позволяет обнаружить агенты, которые влияют на образование фрагментов ДНК в клетках, используя высокопроизводительные скрининговые приложения. 9 з.п. ф-лы, 14 ил., 2 табл., 11 пр.
Реферат
Уровень техники
В нормально функционирующих биологических системах численность клеток регулируется балансом между пролиферацией клеток и апоптозом. Нарушенный баланс между пролиферацией и апоптозом клеток ранее считался причиной множества заболеваний. Например, считается, что активизация апоптозных механизмов способствует развитию нейродегенеративных заболеваний, например болезни Альцгеймера, аутоиммунных заболеваний, примером которых является рассеянный склероз, а также поражений, связанных с ишемией, таких как инсульт. Напротив, снижение активности соответствующих каналов апоптоза рассматривается как основной механизм таких заболеваний, как рак.
Апоптоз характеризуется несколькими отличительными чертами, в том числе сокращением размера клетки и набуханием цитоплазматической мембраны, конденсацией хроматина, фрагментацией ядерной ДНК и распадом белка. Существует по крайней мере два различных канала апоптоза - внутренний и внешний (см. обзоры в Oncogene 23:2861-2874, 2004; Photochem. Photobiol.Sci. 3:721-729, 2004). Внешний, или опосредованный рецепторами канал индуцируется лигандами рецепторов смерти, например фактором некроза опухоли. Лиганды рецепторов смерти передают сигнал через каскад каспазы, что в конечном счете приводит к расщеплению ДНК нуклеазами, активированными каспазой. Внутренний канал, передающий сигнал через митохондриальные механизмы, чувствителен к внешним факторам стресса, например, ультрафиолету или лекарствам. Подобные факторы стресса делают проницаемой митохондриальную мембрану, что приводит к выбросу цитохрома с, эндонуклеазы G, апоптоз-индуцирующего фактора (АИФ), а также многих других неидентифицированных молекул. Относительный вклад внешнего или внутреннего каналов в апоптоз определяется балансом между проапоптотическими факторами и факторами выживания клетки (см. обзор в J. Intern. Med. 258:479-517, 2005).
Апоптоз может быть вызван связыванием лигандов рецепторов смерти, активацией индукторов апоптоза, активацией каспаз, супрессией молекул выживания клетки или другими известными или неизвестными новыми механизмами. Все это приводит к фрагментации ДНК, поэтому фенотипический анализ фрагментации ДНК позволит определить все вызывающие апоптоз вещества независимо от характера действия и, возможно, определить соединения с новыми механизмами. Ступенчатый анализ ДНК на основе гель-электрофореза является золотым стандартом анализа фрагментации ДНК. Вместе с тем трудоемкий и многостадийный ступенчатый анализ ДНК на основе гель-электрофореза не подходит для высокопроизводительного скрининга. Поэтому существует потребность в скрининговом анализе, который позволит определить агенты, действующие через классические каналы апоптоза, а также новые механизмы действия. В принципе, можно использовать цитотоксический анализ, но такого рода анализы неселективны в том отношении, что они определяют соединения, задействованные в гибели клеток, как опосредованной апоптозом, так и не связанной с ним, и могут приводить к завышенным ложным результатам. Предпочтительно будет использовать нерадиоактивные и стабильные методы анализа, которые подходят для высокопроизводительного скрининга.
В настоящее время используется три различных формата для скрининга соединений, задействованных в апоптозе. Первый основан на методе радиометрической фильтрации, где клетки выращивают в присутствии 3H-тимидина, а затем неповрежденную ДНК отделяют от фрагментированной на пластинке стекловолокнистого фильтра (Anal. Biochem. 242:187-196, 1996). Производительность радиометрического анализа лимитируется опасностью, связанной с большими количествами радиоактивного вещества и трудоемкой процедурой анализа. Вторым подходом к анализу является метод TUNEL, который основан на введении метки флуоресцентного dUTP в 3'-двуцепочечную ДНК (дцДНК) с помощью фермента трансферазы с последующим обнаружением проточной цитометрией или методами визуализации. Существует множество наборов для анализа TUNEL, но все они предполагают трудоемкую процедуру, и в ходе одного анализа можно протестировать лишь несколько образцов. Третьим методом анализа является сэндвичевый иммуноферментный анализ ELISA с использованием анти-ДНК и антигистонных антител. Такой метод анализа также трудоемкий, и потребность в двух антителах делает его сравнительно дорогостоящим для высокопроизводительного скрининга соединений.
Эффективный и нерадиоактивный метод анализа мог бы опираться на использование интеркалятора ДНК, например, PicoGreen или пропидия иодида для обнаружения фрагментированной ДНК. Например, PicoGreen представляет собой небольшую органическую молекулу, которая интеркалирует в большую бороздку дцДНК. PicoGreen был полезным инструментом для изучения уровня ДНК в образцах крови Scan. J. Immunol. 57:525 - 533, 2003; Clin. Immunol. 106:139 -147, 2003; Blood 102(6):2243 - 2250, 2003. На основе применения интеркаляторов ДНК в настоящем изобретении приводятся способы обнаружения агентов, которые влияют на образование фрагментов ДНК в клетках, подходящие для использования в высокопроизводительных скрининговых приложениях.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
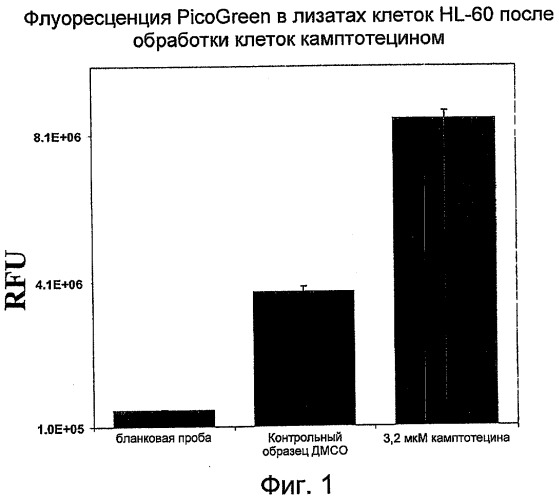
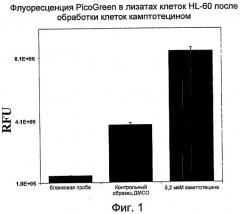
На Фиг.1 показано изменение интенсивности флуоресценции PicoGreen в относительных единицах флуоресценции (RFU) в лизатах HL-60 после обработки клеток камптотецином (кампто) или ДМСО (контроль). (RFU- относительные единицы флуоресценции; ДМСО - диметилсульфоксид).
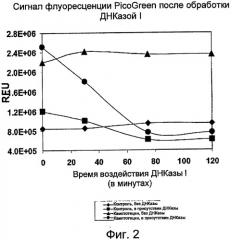
На Фиг.2 показана зависимость интенсивности сигнала флуоресценции PicoGreen (RFU - относительные единицы флуоресценции) от уровня ДНК в лизатах клеток после обработки клеток HL-60 камптотецином (кампто). (RFU - относительные единицы флуоресценции).
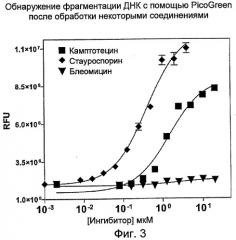
На Фиг.3 показаны эффекты воздействия некоторых соединений, например, камптотецина (кампто), стауроспорина и блеомицина на фрагментацию ДНК в клетках HL-60, регистрируемую с помощью PicoGreen. (RFU - относительные единицы флуоресценции).
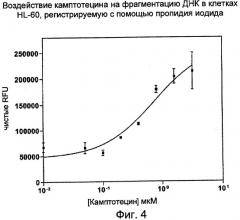
На Фиг.4 показаны эффекты воздействия камптотецина (кампто), на фрагментацию ДНК в клетках HL-60, регистрируемую с помощью пропидия иодида. (RFU - относительные единицы флуоресценции).
На Фиг.5 показаны эффекты воздействия камптотецина (кампто), стауроспорина и блеомицина на фрагментацию ДНК в клетках HL-60, регистрируемую с помощью ELISA. (Abs - поглощение)
На Фиг.6 показан эффект воздействия ингибитора апоптоза, ZnCl2, на вызванную камптотецином фрагментацию ДНК, регистрируемую с помощью PicoGreen. (RFU - относительные единицы флуоресценции).
На Фиг.7 показано, что обработка РНКазой улучшает отношение сигнал/шум для фрагментации ДНК в лизатах клеток HL-60, регистрируемой с помощью PicoGreen. (RFU - относительные единицы флуоресценции).
На Фиг.8 показана временная динамика воздействия камптотецина (кампто) на фрагментацию ДНК, регистрируемую с помощью PicoGreen в лизатах HL-60. (RFU - относительные единицы флуоресценции; ч. - час; ДМСО - диметилсульфоксид).
На Фиг.9 показан эффект влияния плотности клеток HL-60 на фрагментацию ДНК, регистрируемую с помощью PicoGreen в лизатах HL-60. (RFU, относительные единицы флуоресценции; ДМСО, диметилсульфоксид).
На Фиг.10 показан рост индукции сигнала фрагментации ДНК в присутствии PicoGreen в зависимости от плотности клеток HL-60.
На Фиг.11 показан эффект воздействия концентраций ДМСО на клетки HL-60. (RFU - относительные единицы флуоресценции; ДМСО - диметилсульфоксид)
На Фиг.12 показана индукция фрагментации ДНК, обнаруживаемая по PicoGreen, после инкубации клеток HL-60 с валиномицином, винбластином или винкристином.
На Фиг.13 показана индукция фрагментации ДНК, обнаруживаемая по PicoGreen, после инкубации клеток HL-60 с этопозидом, генистеином, пуромицином или рапамицином.
На Фиг.14 показано распределение данных скрининга произвольной химической библиотеки при обнаружении фрагментации ДНК в лизатах HL-60 с помощью PicoGreen. (RFU - относительные единицы флуоресценции).
Подробное описание изобретения
Все публикации, цитируемые в настоящем документе, в силу ссылки на них включаются в настоящий документ. Если не указано иначе, все технические и научные термины, используемые в настоящем документе, имеют такое же значение, которое общеизвестно рядовым специалистам в области, к которой относится настоящее изобретение.
Терминология, используемая в настоящем описании и прилагаемой формуле изобретения, предназначена исключительно для характеристики конкретных приложений, и ее использование в описании не подразумевает какого-либо ограничения изобретения. Формы единственного числа того или иного слова подразумевают охват форм множественного числа, если только в контексте не указано иное. Например, формы единственного числа для конкретных и общих терминологических определений также включают и формы множественного числа. Кроме того, ссылки на тот или иной агент могут относиться к смеси двух или более агентов. Поэтому термин «агент» включает множество агентов, в том числе смеси и/или их энантиомеры. Следует также отметить, что термин «или» обычно имеет свой основной смысл, в том числе «и/или», если только содержание однозначно не указывает на обратное. Кроме того, следует понимать, что термины «включает» и/или «включающий» при использовании в настоящем описании определяют наличие указанных особенностей, стадий, элементов и/или компонентов, но не отрицают наличия или добавления одной или нескольких иных особенностей, стадий, элементов, компонентов и/или их групп.
Кроме того, в соответствии с настоящим изобретением в рамках ноу-хау могут использоваться стандартные методики молекулярной биологии, микробиологии и технологии рекомбинантной ДНК. Содержание таких методик подробно изложено в литературе. См., например, Sambrook, Fritsch & Maniatis, Molecular Cloning: A Laboratory Manual, Second Edition (1989) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (далее "Sambrook et al., 1989"); DNA Cloning: A Practical Approach, Volumes I and II (D.N.Glover ed. 1985); Oligonucleotide Synthesis (M.J.Gait ed. 1984); Nucleic Acid Hybridization [B.D.Hames & S.J.Higgins eds. (1985)]; Transcription And Translation [B.D.Hames & S.J.Higgins, eds. (1984)]; Animal Cell Culture [R.I.Freshney, ed. (1986)]; Immobilized Cells And Enzymes [IRL Press, (1986)]; B.Perbal, A Practical Guide To Molecular Cloning (1984); F.M.Ausubel et al. (eds.), Current Protocols in Molecular Biology, John Wiley & Sons, Inc. (1994).
Поэтому осуществлением настоящего изобретения является способ идентификации агента, который влияет на образование фрагментов ДНК, и такой способ включает: (a) подготовку клеток в наборе приемников; (b) добавление агента, по крайней мере, к одному приемнику; (c) инкубирование агента с клетками в течение заранее определенного периода времени; (d) лизирование клеток; (e) добавление обнаруживаемого соединения, способного к интеркаляции во фрагменты ДНК, по крайней мере, к одному указанному приемнику; (f) измерение количества интеркалированного обнаруживаемого соединения; и (g) сравнение количества интеркалированного обнаруживаемого соединения с контролем с целью определить разницу, что позволяет идентифицировать указанный агент как модифицирующий агент, если разница превышает заранее установленный предел.
Анализ позволяет обнаруживать фрагменты ДНК. Фрагменты ДНК могут представлять собой небольшие фрагменты двуцепочечной ДНК (дцДНК) в цитоплазматической фракции лизатов клеток и фрагменты дцДНК, выделенные апоптотическими клетками в среду. Кроме того, фрагменты ДНК могут представлять собой фрагменты одноцепочечной ДНК (оцДНК) в цитоплазматической фракции лизатов клеток и фрагменты оцДНК, выделенные апоптотическими клетками в среду. В одном из осуществлений изобретения анализ используется для измерения спонтанного апоптоза, например, среди прочего, апоптоза во время совместного культивирования в присутствии или в отсутствие различных типов клеток или в различных условиях культивирования. Поэтому образование фрагмента ДНК может индуцироваться удалением ингредиента из культуральной среды, например, фетальной бычьей сыворотки. В другом осуществлении изобретения анализ используется для оценки отсутствия апоптоза. В еще одном осуществлении в ходе обработки клеток агентом может оцениваться наличие или рост уровня апоптоза, или отсутствие или снижение уровня апоптоза. В еще одном осуществлении изобретения анализ используется для измерения выживания или пролиферации клеток.
Еще одним осуществлением настоящего изобретения является способ идентификации агента, который влияет на образование фрагментов ДНК, и такой способ включает: (a) подготовку клеток в наборе приемников; (b) добавление соединения, выбираемого из группы, состоящей из индуктора, ингибитора, модулятора, модулятора индуктора и модулятора ингибитора, по крайней мере, к одному приемнику; (c) инкубирование компонента с клетками в течение заранее определенного периода времени; (d) добавление агента к указанному, по крайней мере, одному приемнику; (е) инкубирование агента с клетками в течение заранее определенного периода времени; (f) лизирование клеток; (g) добавление обнаруживаемого соединения, способного к интеркаляции во фрагменты ДНК, к указанному, по крайней мере, одному приемнику; (h) измерение количества интеркалированного обнаруживаемого соединения; и (i) сопоставление количества интеркалированного обнаруживаемого соединения с контролем с целью определить разницу, что позволяет идентифицировать указанный агент как модифицирующий агент, если разница превышает заранее установленный предел.
Такие усовершенствования, как добавление индуктора, ингибитора или модулятора вместе с агентом на одной стадии, вполне соответствуют уровню знаний и способностям квалифицированного специалиста и рассматриваются как различные осуществления настоящего изобретения.
Одним из осуществлений изобретения является компонент, который влияет на образование фрагментов ДНК за счет воздействия на апоптоз, выживание или пролиферацию клеток. Компонент выбирается из группы, включающей индуктор, ингибитор, модулятор, модулятор индуктора и модулятор ингибитора.
Выживание клеток представляет собой способность клеток сохранять жизненные функции в благоприятных или неблагоприятных условиях. Неблагоприятные условия включают, среди прочего, присутствие одного или нескольких токсичных компонентов, удаление питательных веществ или недостаток кислорода. В качестве одного из множества примеров - некоторые раковые клетки увеличивали экспрессию белков выживания, например, Bcl2, что делало такие клетки устойчивыми к апоптозу. Другие раковые клетки вырабатывали механизмы, которые обеспечивали более высокую выживаемость клеток или их меньшую склонность к апоптозу в условиях пониженного уровня кислорода.
Пролиферацией клеток называется увеличение их количества. Ко множеству примеров пролиферации клеток относятся увеличение количества клеток в результате их нормального деления, индукция деления клеток или ингибирование их гибели.
Одним из осуществлений настоящего изобретения является способ идентификации агента, который влияет на образование фрагментов ДНК в клетках, проходящих апоптоз. Вместе с тем настоящее изобретение не ограничивается какой-либо конкретной формой гибели клеток. Изобретение может применяться к любому механизму гибели клеток, где терминальным процессом является фрагментация ДНК.
Термин «ингибитор» включает любое лекарство, химическое вещество, белок или белковый фрагмент, способный блокировать, прерывать или предупреждать клеточный ответ, активность или канал, связанные с апоптозом, выживанием или пролиферацией клеток. Кроме того, ингибитором может быть, например, молекулярный шаперон, антитело или ингибирующая РНК (РНКи), которые блокируют экспрессию клеточных белков, тем самым прямо или косвенно ингибируя каналы воздействия. «Ингибитором» может быть регулирование условий культивирования, например увеличение или уменьшение уровня кислорода или изменение компонентов среды, так чтобы блокировать, прервать или предотвратить клеточный ответ.
Термин «индуктор» включает любое лекарство, химическое вещество, белок или белковый фрагмент, способный инициировать или стимулировать клеточный ответ, активность или канал, связанные с апоптозом, выживанием или пролиферацией клеток. Кроме того, индуктором может быть, например, молекулярный шаперон, антитело или ингибирующая РНК (РНКи), которые блокируют экспрессию клеточных белков, тем самым устраняя ингибирование или напрямую инициируя или стимулируя клеточный ответ, активность или канал воздействия. «Индуктором» может быть регулирование условий культивирования, например увеличение или уменьшение уровня кислорода, или изменение компонентов среды, так чтобы блокировать, прервать или предотвратить клеточный ответ.
Термин «модулятор» включает любое лекарство, химическое вещество, белок или белковый фрагмент, способный корректировать интенсивность, долю или характеристики клеточного ответа, активности или канала, связанного с апоптозом, выживанием или пролиферацией клеток. Кроме того, модулятором может быть, например, молекулярный шаперон, антитело или ингибирующая РНК (РНКи), которые блокируют экспрессию клеточных белков, тем самым устраняя ингибирование или индуцируя клеточный ответ, активность или канал воздействия. «Модулятором» может быть регулирование условий культивирования, например, увеличение или уменьшение уровня кислорода, или изменение компонентов среды, так чтобы блокировать, прервать или предотвратить клеточный ответ.
В еще одном осуществлении изобретения модулятор может использоваться в сочетании с индуктором, так что модулятор индуктора делает индуктор более эффективным (например, приводя к более активному клеточному ответу) или менее эффективным (например, приводя к пониженному клеточному ответу). Модулятор ингибитора делает ингибитор менее эффективным (например, более активный клеточный ответ) или более эффективным (например пониженный клеточный ответ).
Ингибиторы, индукторы или модуляторы могут использоваться для имитации каналов воздействия или характеристик болезненных состояний. В качестве одного из множества показательных примеров - одним из осуществлений настоящего изобретения будет возможность индуцировать апоптоз с помощью β-амилоидных фрагментов для имитации характеристик болезни Альцгеймера в присутствии или в отсутствие потенциальных модуляторов, например воспалительных цитокинов. Еще один из множества наглядных примеров - применение настоящего изобретения для идентификации агентов, которые стимулируют апоптоз в одном или нескольких аспектах рака. В рамках такой парадигмы предположительное применение настоящего изобретения подразумевает количественное определение способности испытываемого агента индуцировать или усиливать апоптоз в раковых клетках, тканях или органах. Индуктор апоптоза может обладать широким спектром действия, охватывая множество каналов, ведущих к гибели клетки. В альтернативном варианте, индуктор апоптоза может обладать высокой специфичностью к единичному каналу апоптоза или ограничиваться воздействием на конкретное заболевание или патологическое состояние. Поэтому осуществление настоящего изобретения включает способ скрининга для идентификации испытываемого агента, который может корректировать болезненное состояние, при котором предположительно происходит ингибирование апоптоза, например рак. К таким формам рака, среди прочего, относятся острая миелоидная лейкемия, множественная миелома, не-Ходжкинская лимфома, хроническая лимфоцитарная лейкемия и солидные опухоли.
Другим осуществлением настоящего изобретения является использование более одного индуктора, ингибитора или модулятора. Применение более одного индуктора, ингибитора или модулятора может, среди прочего, приводить к аддитивным эффектам, обратному действию, синергическим эффектам или воздействовать на различные каналы.
В одном из осуществлений изобретения используется интеркалирующее поддающееся обнаружению соединение. Одним из множества примеров является интеркалирующий флуоресцентный краситель. Интеркаляторы обычно представляют собой гетероароматические полициклические молекулы, которые встраиваются между двумя парами оснований в дуплексе ДНК. Вместе с тем изобретение не ограничивается гетероароматическими полициклическими молекулами. Любая интеркалирующая молекула, которая демонстрирует заметное усиление флуоресценции или сдвиг эмиссии или параметра (параметров) возбуждения в присутствии фрагментов ДНК в условиях незначительного или полного отсутствия неселективного связывания с РНК или белками, входит в сферу охвата настоящего изобретения. Такие интеркалирующие красители хорошо известны специалистам в области и, среди прочего, включают бис-бензимидный краситель Hoechst 33258. Другим удобным интеркалирующим обнаруживаемым соединением является пропидия иодид. В одном из осуществлений настоящего изобретения используется PicoGreen. PicoGreen относится к семейству несимметричных монометинцианиновых красителей. Он обладает высокими константами связывания с ДНК и демонстрирует высокую интенсивность флуоресценции при связывании с ней, при этом практически не проявляя флуоресцентных свойств в свободном состоянии в растворе. В еще одном осуществлении изобретения используется пропидия иодид. Кроме того, некоторые интеркалирующие соединения в состоянии связываться с оцДНК, например TOTO (Nucleic Acids Res. 23:1215-1222, 1995) и OliGreen (Molecular Probes, кат. №07582, кат. №011492). В еще одном осуществлении изобретения используются проникающие через мембрану зонды ДНК, например, BENA435 (Nucleic Acids Res. 34:), и за счет этого можно избавиться от необходимости лизирования клеток, чтобы ввести метку в ДНК. В другом применении настоящего изобретения используются YOPRO, Hoechst 33342, DAPI и DRAQ5.
Круг интеркалирующих обнаруживаемых молекул не ограничивается флуоресцентными красителями. Количество фрагментов ДНК может определяться с использованием любой методологии, известной специалистам в области. Количество интеркалирующих молекул, включенных в ДНК, может определяться с помощью меток, в том числе, среди прочих, радиоизотопных или активирующих сцинтиллятор соединений. К методам обнаружения, среди прочих, относятся пептидные метки, ферментативная активность, поглощение, флуоресценция, время-разрешенная флуоресценция, поляризованная флуоресценция, резонансный перенос энергии флуоресценции, люминесценция, резонансный перенос энергии биолюминесценции, радиоактивная метка и сцинтилляционное сближение или другие методы, широко используемые в данной области. В еще одном применении могут использоваться методы косвенной метки, в том числе, среди прочих, применение меченых антител, использование взаимодействия стрептавидин-биотин, аффинные реагенты, образующие хелаты с металлами, или аффинные реагенты GST-глутатиона. Любой прямой или косвенный метод метки, известный специалистам в области, рассматривается как входящий в сферу охвата настоящего изобретения. В еще одном осуществлении количество ДНК может определяться по поглощению на 260 нм (А260).
Еще одно осуществление изобретения включает отделение хромосомной ДНК от фрагментов ДНК до измерения количества интеркалировавшего обнаруживаемого соединения. Отделение хромосомальной ДНК от фрагментов ДНК может проводиться с использованием методов, известных специалистам в области. Среди множества примеров - центрифугирование, фильтрация, седиментация, электрофорез, гель-фильтрация, аффинная очистка и осаждение. Для отделения или удаления хромосомальной ДНК от фрагментов ДНК специалист в данной области может использовать любой метод разделения.
Одно из осуществлений настоящего изобретения предусматривает лизирование клеток. Лизирование клеток может осуществляться добавлением детергента, содержащего лизирующий буфер. При этом изобретение не ограничивается использованием детергента в лизирующем буфере, но может включать любой метод, который подходит для лизирования клеток. Например, лизирование клеток может проходить под действием гипотонического буфера, ультразвуковой обработкой или в цикле замораживание/оттаивание. Другие методы лизирования также хорошо известны специалистам в данной области.
В еще одном осуществлении настоящего изобретения используется свободная от ДНКаз РНКаза для удаления РНК из лизатов клеток с целью увеличить отношение сигнал/шум за счет уменьшения фонового сигнала флуоресценции, связанного с эндогенной клеточной РНК.
Осуществление настоящего изобретения предусматривает использование набора приемников, в которые могут помещаться клетки и другие материалы, например культуральные среды. Набор приемников может представлять собой любое количество приемников от по крайней мере одного до нескольких приемников, пригодных для помещения клеток в соответствии с охватом настоящего изобретения. К примерам, среди прочего, относятся колбы, чашки для культивирования, пробирки, например пробирки на 1,5 мл, 12-ячеечные планшеты, 96-ячеечные планшеты, 384-ячеечные планшеты и миниатюрные планшеты для микротитрования с около 4000 приемных ячеек (заявка U.S. Patent Application 20050255580). Набор приемников можно усовершенствовать, дополнив его защитной крышкой, тем самым исключив попадание загрязнений или испарение содержимого.
Дополнительной особенностью приемников является то, что в них можно проводить анализ, к примерам такого анализа относятся спектрофотометрический анализ, сцинтилляционный счет и измерения флуоресценции. Тем не менее это не является ограничением для приемников, которые могут использоваться в рамках охвата настоящего изобретения, с учетом того что образцы можно перенести в подходящую емкость, пригодную для дальнейшего анализа. Один из множества примеров предполагает такую модификацию способа, которая предусматривает подготовку второго набора приемников, причем стадия лизирования клеток дополнительно включает отделение супернатанта от клеточных остатков, а следующая стадия далее включает добавление обнаруживаемого соединения, способного к интеркаляции во фрагменты ДНК, по крайней мере к одному приемнику указанного второго набора, содержащего образец указанного отделенного супернатанта.
В одном из применений настоящего изобретения используется контроль. Контроль представляет собой термин, хорошо понятный квалифицированным специалистам в данной области. Надлежащий контроль может зависеть от используемых параметров анализа или исследуемой экспериментальной проблемы. Контролем может быть конкретный набор условий анализа или добавление в культуральную среду или удаление из нее конкретного соединения. Контроль может рассматриваться как положительный контроль, в том случае если условия анализа или добавленное контрольное соединение обеспечивают ожидаемый ответ. Например, если ожидается, что исследуемый агент вызывает апоптоз, положительным контролем будет соединение, которое является известным индуктором апоптоза. Одним из примеров положительного контроля является добавление винбластина сульфата. Контроль также может быть отрицательным. Отрицательным контролем может быть конкретный набор условий анализа, а также добавление в культуральную среду или удаление из нее конкретного соединения, которое будет вызывать ожидаемый отклик. Например, если ожидается, что исследуемый агент вызывает апоптоз, отрицательным контролем будет соединение, которое, предположительно, не приводит к апоптозу. Контролем может быть «носитель». Например, если испытываемый агент растворяется в ДМСО, тогда контролем с использованием носителя может быть ДМСО без испытываемого агента. Контролем может быть и просто использование полученных в прошлом данных.
В одном из осуществлений изобретения используются имеющиеся в продаже клеточные линии. Например, клетки, которые пригодны для использования, можно приобрести у American Tissue Culture Company. В одном из применений используются клетки HL-60. Клетки могут быть прокариотическими или эукариотическими. Настоящее изобретение не ограничивается видом используемых клеток. Могут также применяться первичные культуры. Недифференцированные клетки можно подвергать воздействию различных агентов, которые вызывают их дифференциацию в конкретный фенотип. Например, в одном из применений изобретения используются клетки-предшественники, которые после индуцирования дифференцируются в олигодендроциты. Конкретный тип используемых клеток можно выбрать с помощью маркеров, специально экспрессированных в соответствии с желаемым типом клеток, или, в альтернативном варианте, за счет потери конкретного маркера (маркеров). Клетки можно отделять или сортировать с помощью таких методов, как проточная цитометрия, которые широко используются квалифицированными специалистами в области.
В одном из применений настоящего изобретения используется однородная популяция клеток. В альтернативном применении настоящего изобретения используется неоднородная популяция клеток. Для проведения анализа в рамках настоящего изобретения можно использовать клетки любого типа и в любой пропорции.
Клетки могут быть получены из биологического образца. К биологическим образцам, среди прочего, могут относиться ткани или жидкости, срезы тканей, например образцы биопсии или вскрытия, а также замороженные срезы, взятые для гистологического анализа. Такие образцы включают кровь, слюну, ткани, культивированные клетки, например первичные культуры, эксплантаты и трансформированные клетки, кал, мочу и пр. Биологический образец может быть взята у эукариотического организма, в том числе у млекопитающего, например примата, такого как шимпанзе, макака или человек; коровы, собаки, кошки, грызуна, в том числе морской свинки, крысы, мыши, кролика, или птицы, рептилии или рыбы.
В другом осуществлении настоящего изобретения используются клетки, которые были временно или стабильно трансформированы, так чтобы обеспечить сверхэкспрессию или исключить экспрессию по крайней мере одного белка и определить, влияет ли такая экспрессия или ее отсутствие на фрагментацию ДНК. Экспрессия может быть индуцированной или конститутивной. Агенты могут проверяться на способность влиять на фрагментацию ДНК в трансформированных клетках. Кроме того, испытываемые агенты могут проверяться на способность влиять на фрагментацию ДНК в трансфектированных клетках в присутствии или в отсутствие индукторов или ингибиторов апоптоза. Такое применение может рассматриваться как контроль.
Рекомбинантный вектор экспрессии, представленный в изобретении, включают молекулу нуклеиновой кислоты в форме, подходящей для экспрессии нуклеиновой кислоты в клетке-хозяине. Таким образом, рекомбинантные векторы экспрессии настоящего изобретения могут содержать одну или несколько регуляторных последовательностей, выбранных на основе клетки-реципиента, используемой для экспрессии, причем эта последовательность функционально связана с нуклеиновой кислотой, которая должна быть экспрессирована. По отношению к рекомбинантному вектору экспрессии выражение «функционально связанный» призвано означать, что представляющая интерес последовательность нуклеотидов связана с регуляторной последовательностью (последовательностями) таким способом, который обеспечивает экспрессию последовательности нуклеотидов (например в системе транскрипции/трансляции «in vitro» или в клетке-хозяине, если вектор введен в клетку-хозяина). Термин «регуляторная последовательность» включает промоторы, энхансеры и другие элементы, контролирующие экспрессию (например сигналы полиаденилирования). Такие регуляторные последовательности описаны, например, в Goeddel, Gene Expression Technology: Methods in Enzymology Vol. 185, Academic Press, San Diego, Calif. (1990). Регуляторные последовательности включают направляющие конститутивную экспрессию последовательности нуклеотидов во многих типах клеток-хозяев (например специфичные к тканям регуляторные последовательности). Специалистам известно, что структура вектора экспрессии может зависеть от таких факторов, как выбор клетки-хозяина для трансформации, желаемый уровень экспрессии белка и т.д. Векторы экспрессии настоящего изобретения могут вводиться в клетки-хозяева для выработки белков или пептидов, кодированных нуклеиновыми кислотами, как это описано в настоящем документе.
Используемый в настоящем документе термин «сверхэкспрессия» относится к экспрессии полипептида (например молекулы, которая может быть задействована в апоптозе или механизмах выживания клеток) в той или иной клетке на уровне, превышающем нормальный уровень экспрессии полипептида в клетке, которая обычно экспрессирует полипептид, или в клетке, которая обычно не обеспечивает экспрессии полипептида. Например, уровень экспрессии полипептида может составлять 10%, 20%, 30%, 40%, 50%, 60%, 70, 80%, 90%, 100% или более по сравнению с экспрессией полипептида в немутантной клетке, которая обычно экспрессирует полипептид. Возможна сверхэкспрессия мутантов, вариантов или аналогов представляющего интерес полипептида.
Используемый в настоящем документе термин «транзиторная» экспрессия относится к экспрессии экзогенной молекулы (молекул) нуклеиновых кислот, которые отделены от хромосом клетки. Транзиторная экспрессия обычно достигает своего максимума через 2-3 дня после введения экзогенной нуклеиновой кислоты, а затем постепенно снижается.
Используемый в настоящем документе термин «стабильная» экспрессия относится к экспрессии экзогенной молекулы (молекул) нуклеиновых кислот, которые являются частью хромосом клетки. В общем случае векторы стабильной экспрессии генов включают один или несколько маркеров селекции.
Методы культивирования клеток для трансформированных, нетрансформированных образцов, первичных культур и биологических образцов хорошо известны специалистам в области. Биологические образцы или культивированные клетки могут храниться, пока не потребуется их использование. Среды, используемые для культивирования, могут готовиться специально или приобретаться из коммерческих источников.
В настоящем изобретении приводятся способы идентификации (например скрининга, обнаружения, характеризации, анализа и количественного определения) агентов, которые оказывают влияние на образование фрагментов дцДНК и оцДНК. Термин «агент», «испытываемый агент», «испытываемое соединение», «потенциальное лекарство» или «модулятор» или их грамматические эквиваленты, используемые в настоящем документе, описывает любую молекулу, как существующую в природе, так и синтетическую, например белок, олигопептид (например длиной примерно от 5 до 25 аминокислот, предпочтительно длиной примерно от 10 до 20 или от 12 до 18 аминокислот, предпочтительно длиной 12, 15 или 18 аминокислот), малую органическую молекулу, полисахарид, липид (например сфинголипид), жирную кислоту, полинуклеотид, олигонуклеотид и пр., которая используется в анализах, описанных в настоящем изобретении, и анализируется для установления способности влиять на фрагментацию ДНК или апоптоз. Не существует конкретных ограничений в отношении соединения, которое может использоваться для анализа. К примерам относятся отдельные агенты или библиотеки малых, средних или высокомолекулярных химических соединений, очищенные белки, продукты экспрессии генных библиотек, библиотеки синтетических пептидов, клеточные экстракты и супернатанты культур. Термин агент включает любую комбинацию различных агентов.
Агент может включать по крайней мере один или несколько растворимых и нерастворимых факторов, компоненты клеточной матрицы, кондиционированные среды, клеточные экстракты, экстракты тканей, эксплантаты, модификаторы рН, газы, модификаторы осмотического давления, модификаторы ионной силы, вирусы, ДНК, РНК или фрагменты генов. Агент может быть в форме библиотеки испытываемых агентов, например комбинаторной или рандомизированной библиотеки, которая обеспечивает достаточный диапазон разнообразия или, напротив, ограничена сходными структурами или характеристиками. Агенты могут быть дополнительно связаны с партнером слияния, например соединениями направленной доставки, спасающими соединениями, соединениями димеризации, стабилизирующими соединениями, адресуемыми соединениями и другими функциональными компонентами. Обычно для создания новых химических объектов с полезными свойствами выбирают испытываемый агент (называемый «ведущим соединением» или «ведущим») с рядом желател