Композиции тетрагидробиоптерина и способы его количественной оценки
Иллюстрации
Показать всеИзобретение относится к медицине и предназначено для лечения гиперфенилаланинемии. Применяют тетрагидробиоптерин или его фармацевтически приемлемую соль, причем введение осуществляется перорально в течение 0-30 минут после приема пищи. Способ позволяет повысить биодоступность тетрагидроптерина при пероральном приеме. 12 з.п.ф-лы, 31 табл., 9 пр., 38 ил.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
В настоящей заявке испрашивается приоритет предварительной заявки на патент США № 60/922821, поданной 11 апреля 2007, и предварительной заявки на патент США 61/019753, поданной 8 января 2008, которые во всей своей полноте включены в настоящее описание посредством ссылки.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Область техники, к которой относится изобретение
В общих чертах, настоящее изобретение относится к композициям и к способам, применяемым для лечения расстройств, восприимчивых к BH4, а также к способам и композициям для обнаружения и количественной оценки биоптеринов.
Предшествующий уровень техники
Тетрагидробиоптерин (обозначаемый здесь BH4) представляет собой биогенный амин, который принадлежит к семейству природных птеринов и является кофактором для ряда различных ферментов, включая фенилаланингидроксилазу (PAH), тирозингидроксилазу, триптофангидроксилазу и синтетазу оксида азота. Птерины присутствуют в физиологических жидкостях и тканях в восстановленной и в окисленной формах, однако биологически активным является только 5,6,7,8-тетрагидробиоптерин. Он представляет собой хиральную молекулу и 6R-энантиомер кофактора, который, как известно, является биологически активным энантиомером. Подробное описание синтеза ВН4 и восприимчивых к нему расстройств можно найти в публикации Blau et al., 2001 (Disorders of tetrahydrobiopterin and related biogenic amines. In: Scriver CR, Beaudet AL, Sly WS, Valle D, Childs B, Vogelstein B, eds. The Metabolic and Molecular Bases of Inherited Disease. 8th ed. New York: McGraw-Hill, 2001: 1275-1776).
В публикации Fiege, et al., Molecular Genetics and Metabolism 81:45-51 (2004), описаны фармакокинетические исследования по пероральному введению тетрагидробиоптерина (BH4), которые позволяют предположить о наличии «довольно широкой вариабельности перорально вводимого BH4, вероятно, обусловленной различными уровнями его абсорбции в кишечнике и/или эффектом первого прохождения».
Тетрагидробиоптерин был предложен для лечения ряда различных болезненных состояний, однако необходимость в разработке альтернативных и улучшенных способов введения этого лекарственного средства остается актуальной.
ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам введения 6R-(L-эритро)-5,6,7,8-тетрагидробиоптерина (BH4) или его фармацевтически приемлемой соли, где указанные способы позволяют улучшать или максимизировать его биологическую доступность при пероральном введении и/или улучшать или оптимизировать уровень биологической доступности непосредственно после его перорального введения. Такие способы могут быть применены для лечения любых восприимчивых к BH4 расстройств, включая метаболические расстройства, сердечно-сосудистые заболевания, анемию и психоневрологические расстройства. Способы согласно изобретению преимущественно позволяют с большей эффективностью ослаблять клинические симптомы, например снижать уровни флуктуации фенилаланина в плазме, регулировать кровяное давление, регулировать уровни нейромедиаторов или другие клинические параметры.
Используемое здесь обозначение BH4 означает 6R-(L-эритро)-5,6,7,8-тетрагидробиоптерин. Используемый здесь термин «BH4», если это не очевидно из контекста изобретения, может включать, но необязательно, фармацевтически приемлемую соль 6R-(L-эритро)-5,6,7,8-тетрагидробиоптерина.
В своем первом аспекте настоящее изобретение относится к способам перорального введения пациенту, нуждающемуся в этом, очищенного препарата BH4.
В репрезентативном варианте изобретения указанные способы включают стадию информирования пациента о том, что уровень абсорбции тетрагидробиоптерина повышается при его употреблении вместе с пищей по сравнению с абсорбцией, достигаемой при его употреблении без пищи. В некоторых вариантах изобретения пациента информируют о том, что прием состава сразу после приема пищи, например, пищи с высоким содержанием жира и высококалорийной пищи, приводит к увеличению любого одного, двух, трех или всех нижеследующих параметров, таких как средняя концентрация в плазме, Cmax, AUC, AUC(0-t) и/или AUC(inf). В репрезентативных вариантах изобретения пациента информируют о том, что введение BH4 вместе с пищей с высоким содержанием жира приводит к увеличению Cmax и AUC по сравнению с введением BH4 без употребления пищи (в условиях голодания). В некоторых вариантах изобретения относительное увеличение этих параметров может составлять по меньшей мере 20%, 30% или более.
В альтернативных или в дополнительных вариантах изобретения указанный способ введения тетрагидробиоптерина включает информирование пациента о том, что абсорбция тетрагидробиоптерина повышается при его приеме в виде целой таблетки по сравнению с абсорбцией, достигаемой при приеме состава, растворенного в жидкости. В некоторых вариантах изобретения пациента информируют о том, что прием целых таблеток приводит к увеличению любого из нижеследующих параметров: средней концентрации в плазме, Cmax, AUC, AUC(0-t) или AUC(inf). В репрезентативных вариантах изобретения пациента информируют о том, что введение ВН4 в виде целой таблетки приводит к увеличению Cmax и AUC по сравнению с введением BH4 после его растворения в жидкости. В некоторых вариантах изобретения относительное увеличение может составлять по меньшей мере 20% или более.
Любой из предыдущих способов может быть осуществлен путем приготовления тетрагидробиоптерина или его помещения в контейнер, содержащий отпечатанную памятку, информирующую пациента о возможном изменении вышеописанных параметров абсорбции.
Способы согласно изобретению могут также включать, но необязательно, стадию введения пациенту, нуждающемуся в этом, терапевтически эффективного количества тетрагидробиоптерина. Такое терапевтически эффективное количество варьируется в зависимости от состояния, подвергаемого лечению, и может быть легко определено лечащим врачом в целях желаемого ослабления клинических симптомов.
В одном из репрезентативных вариантов изобретения такие способы включают введение BH4 в растворенной форме, где указанный состав растворяют в жидкости, включая, но не ограничиваясь ею, воду, апельсиновый сок и яблочный сок. В одном из репрезентативных вариантов изобретения растворенный BH4 вводят пациенту в условиях голодания, то есть натощак. В настоящем изобретении также рассматривается введение растворенного BH4 в определенный период времени, например утром, днем и ночью того же дня, натощак один или несколько раз в день. В репрезентативных вариантах изобретения композицию вводят пациенту натощак, например, по меньшей мере за 30 минут, 45 минут, или по меньшей мере за один час до приема пищи, и/или по меньшей мере через 90 минут или через два часа, 2,5 часа или три часа после приема пищи. Таким образом, BH4 может приниматься пациентом в виде жидкого продукта или продукта, представляющего собой твердую или полутвердую лекарственную форму, предварительно растворенную до ее приема. В дополнительном варианте изобретения BH4 может также растворяться в полости рта при его приеме в виде твердой или полутвердой лекарственной формы, которую этот состав имел до его употребления в растворенной форме.
В другом репрезентативном варианте изобретения указанные способы включают введение BH4 в твердой лекарственной форме, включая, но не ограничиваясь ими, таблетки, капсулы, леденцы, пастилки, порошки и гранулы, или в полутвердой форме, включая, но не ограничиваясь ими, желе для перорального введения, содержащее лекарственное вещество, которое проглатывается без предварительного растворения в жидкости, например, такой как вода, апельсиновый сок, яблочный сок и т.п. В одном из вариантов изобретения пациент принимает BH4 для проглатывания в условиях голодания, то есть натощак. В настоящем изобретении также рассматривается введение BH4 в твердой или полутвердой лекарственной форме для проглатывания в определенный период времени, например утром, днем и ночью того же дня натощак, один или несколько раз в день. В репрезентативных вариантах изобретения композицию вводят пациенту натощак, например, по меньшей мере за 30 минут, 45 минут, или по меньшей мере за один час до приема пищи, и/или по меньшей мере через 90 минут или через два часа, 2,5 часа или три часа после приема пищи.
В другом варианте изобретения указанные способы включают введение BH4 независимо от того, проглатывает ли его пациент в виде твердой или полутвердой лекарственной формы или употребляет в виде растворенной в жидкости лекарственной формы вместе с пищей, например с пищей с высоким содержанием жира или вместе с жирной и/или высококалорийной пищей. В настоящем изобретении также рассматривается введение BH4 независимо от того, проглатывается ли он или употребляется в растворенном виде в определенный период времени, например утром, днем и ночью того же дня вместе с пищей, например с пищей с высоким содержанием жира или с жирной и/или высококалорийной пищей один или несколько раз в день. В репрезентативном варианте изобретения, пациент принимает ВН4 один раз в день в виде твердой лекарственной формы сразу после приема пищи. В предпочтительном варианте изобретения твердую лекарственную форму изготавливают в виде таблетки или капсулы. В более репрезентативных вариантах изобретения ВН4 употребляют вместе с пищей во время ее приема в течение примерно 0-30 минут или 5-20 минут. Независимо от того, употребляется ли ВН4 в виде твердой лекарственной формы, жидкой лекарственной формы или в виде раствора, его действие in vivo (или его биологическая доступность) является более эффективным при проглатывании сразу после приема пищи по сравнению с его действием натощак, оцениваемом в качестве контроля.
Прием BH4 может быть осуществлен приблизительно одновременно с приемом пищи, либо BH4 может приниматься до или после приема пищи. Период времени между приемом пищи и приемом BH4, независимо от того проглатывается ли он или выпивается в растворенном виде, может составлять по меньшей мере 5 минут. Так, например, ВН4 может быть введен за 60 минут, 30 минут, 25 минут, 20 минут, 15 минут, 10 минут или 5 минут до приема пищи или через указанное время после приема пищи.
В другом варианте изобретения для некоторых пациентов, например, для взрослых, или в случае некоторых болезненных состояний, например, сердечно-сосудистых заболеваний или других заболеваний, ассоциированных с дисфункцией синтетезы оксида азота (NOS), способы согласно изобретению включают прием целой, а не растворенной в жидкости таблетки в целях повышения биологической доступности.
Во втором аспекте настоящее изобретение относится к способу стабилизации ВН4 в желудочно-кишечном тракте у пациента путем снижения рН тонкой кишки, например, с использованием протонообменных полимеров. В настоящем изобретении также рассматриваются соответствующие продукты, содержащие ВН4 и подкисляющие эксципиенты, такие как протонообменные полимеры.
В третьем аспекте настоящего изобретения рассматривается способ увеличения времени пребывания ВН4 в кишечнике, включая, но не ограничиваясь им, замедление высвобождения из кишечника с использованием агента, способствующего замедлению высвобождения из кишечника, например такого агента, как сложный эфир жирной кислоты и/или сложный эфир жирной кислоты и глицерина. Такие гидрофобные агенты могут увеличивать время пребывания ВН4 в кишечнике и могут повышать количество абсорбируемого ВН4. Время пребывания BH4 в кишечнике, достигаемое с использованием такого(их) агента(ов), может по меньшей мере в полтора раза, по меньшей мере в два раза, по меньшей мере в три раза, по меньшей мере в четыре раза или по меньшей мере в пять раз превышать время пребывания в кишечнике состава BH4, не содержащего такого агента. Подходящими жирными кислотами являются олеиновая кислота, стеариновая кислота, арахиновая кислота, пальмитиновая кислота, арахидоновая кислота, линолевая кислота, линоленовая кислота, эруцидиновая кислота, миристиновая кислота, лауриновая кислота, миристолеиновая кислота и пальмитолеиновая кислота. Также рассматривается способ увеличения времени пребывания BH4 в кишечнике посредством его удерживания в желудке с использованием альгиновой кислоты и усиления биоадгезии с использованием поликарбофила. Также рассматриваются соответствующие продукты, содержащие BH4 и агенты, замедляющие перистальтику желудка.
В четвертом аспекте изобретения рассматривается способ модификации высвобождения BH4 с использованием состава пролонгированного высвобождения, такого как HPMC, карбомер и т.п. Также рассматриваются соответствующие продукты, которые представляют собой составы с замедленным высвобождением.
В пятом аспекте изобретения рассматривается введение BH4 в стерильной жидкости или в виде стерильной твердой лекарственной формы способами, отличающимися от перорального введения и включающими, но не ограничивающимися ими, местное введение, внутривенное введение, подкожное введение, внутримышечное введение, интратекальное введение, офтальмическое введение и введение путем ингаляции. В настоящем изобретении рассматриваются соответствующие композиции и наборы, подходящие для такого введения, а также способы их изготовления. Так, например, для чрескожного или защечного введения могут быть изготовлены ВН4-содержащие пластыри для чрескожного или защечного введения соответственно. Также рассматриваются подъязычные таблетки, содержащие ВН4. В настоящем изобретении рассматриваются подходящие наборы, включающие устройство для ингаляции, содержащее ВН4, или набор, содержащий ВН4 и включающий пипетку или распылитель.
В одном из варианте осуществления настоящее изобретение относится к жидкому составу тетрагидробиоптерина (BH4) или его фармацевтически приемлемой соли, включающему водный раствор BH4 или его фармацевтически приемлемой соли, антиоксидант и рН-корректирующий буфер.
В другом варианте осуществления настоящее изобретение относится к способу приготовления жидкого состава, содержащего тетрагидробиоптерин (BH4) или его фармацевтически приемлемую соль, где указанный способ включает получение водного раствора, содержащего BH4 или его фармацевтически приемлемую соль; добавление антиоксиданта и рН-корректирующего буфера к раствору, содержащему ВН4 или его фармацевтически приемлемую соль; барботирование инертным газом или диоксидом углерода водного раствора, содержащего BH4 или его фармацевтически приемлемую соль, до или после добавления антиоксиданта и рН-корректирующего буфера, и герметичную упаковку барботированного раствора, содержащего BH4 или его фармацевтически приемлемую соль, антиоксидант и рН-корректирующий буфер, в контейнере.
В своем шестом аспекте настоящее изобретение относится к улучшенному способу оценки уровня BH4 с помощью тандемной масс-спектрометрии и вычисления количества восстановленного биоптерина. Такие способы позволяют оценивать чувствительность к BH4 в концентрации 5-1000 нг/мл, при этом точность и достоверность является допустимой, если коэффициент изменчивости (CV)% ниже 15% (20% в случае нижнего предела количественной оценки, LLOQ). В репрезентативном варианте изобретения способ оценки BH4 с помощью ВЭЖХ (ОФ) в комбинации с тандемной масс-спектрометрией (ЖХ/МС/МС) включает стадии: (1) окисления проб крови, проб плазмы, гомогенатов ткани или мочи; (2) иодометрического анализа окисленных образцов; (3) пропускания указанных окисленных образцов через ионообменную колонку; (4) оценки уровней общего и окисленного биоптерина в указанных образцах с помощью ВЭЖХ и тандемной масс-спектрометрии; вычисления количества восстановленного биоптерина как разности между уровнями указанных общих биоптеринов и их указанной окисленной формы. В одном из вариантов изобретения образцы обрабатывают путем окисления кислотой, где указанный способ включает стадии (1) обработки указанных образцов KCl, HCl или TCA; (2) проведения иодометрического анализа указанных образцов, окисленных кислотой; (3) пропускания указанных окисленных образцов через ионообменную колонку; (4) определения уровня общего биоптерина, содержащего 6R-BH4, R-q-DHBP (который сразу восстанавливается in vivo до 6R-BH4, а поэтому измерение уровня восстановленного биоптерина основано, главным образом, на 6R-BH4), DHBP и BP, в указанных образцах с помощью ВЭЖХ и тандемной масс-спектрометрии. В другом варианте изобретения образцы окисляют щелочью, где указанный способ включает: (1) обработку указанных образцов KI, I или NaOH; (2) подкисление указанных окисленных щелочью образцов путем добавления HCl или TCA; (3) проведение иодометрического анализа указанных окисленных образцов; (4) пропускание указанных образцов через ионообменную колонку; (5) определение уровня окисленного биоптерина, содержащего DHBP и BP, с помощью ВЭЖХ и тандемной масс-спектрометрии, (6) вычисление количества восстановленного биоптерина (6R-BH4 + R-q-DHBP) как разности между уровнями общих биоптеринов и их окисленной формы.
В другом своем аспекте настоящее изобретение относится к раствору для разделения дигидробиоптерина, биоптерина и их аналогов с помощью обращенно-фазовой ВЭЖХ с использованием подвижной фазы, включающей водный раствор, содержащий метанол, ацетат натрия, лимонную кислоту, EDTA и 1,4-дитиоэритрит. Аналогичным образом, в настоящем изобретении рассматривается способ разделения дигидробиоптерина и биоптерина или их аналогов из смеси, содержащей основную и дигидро-форму, где указанный способ включает проведение обращенно-фазовой ВЭЖХ с использованием подвижной фазы, содержащей водный раствор, включающий метанол, ацетат натрия, лимонную кислоту, EDTA и 1,4-дитиоэритрит, на смеси, содержащей дигидробиоптерин и биоптерин, или аналог дигидробиоптерина и аналог биоптерина.
В другом своем аспекте настоящее изобретение относится к способу количественной оценки биоптеринов в смеси биоптериновых молекул, где указанный способ включает получение смеси, содержащей биоптерин и по меньшей мере одно из таких веществ, как дигидробиоптерин и тетрагидробиоптерин, или аналоги биоптерина и по меньшей мере одно из таких веществ, как дигидробиоптерин и тетрагидробиоптерин; разделение биоптериновых молекул в смеси с помощью обращенно-фазовой ВЭЖХ; а в случае тетрагидробиоптерина и его аналогов, проведение электрохимического детектирования путем окисления тетрагидробиоптерина и его аналогов, присутствующих на первом электроде, до хиноноидных дигидробиоптериновых форм с последующим восстановлением указанных хиноноидных форм до тетрагидробиоптерина и его аналогов, присутствующих на втором электроде; и измерение силы тока, генерируемого реакцией восстановления для определения концентрации молекул; и/или в случае дигидробиоптерина, его аналогов, биоптерина или его аналогов, оценку уровня таких молекул путем детектирования флуоресценции после окисления молекул дигидробиоптерина до биоптерина на хроматографической колонке.
Что касается описанных здесь композиций и способов, то предпочтительные компоненты и их состав могут быть выбраны из различных компонентов и составов, представленных в нижеследующих примерах.
Другие отличительные признаки и преимущества настоящего изобретения будут очевидны из нижеследующего подробного описания изобретения. Однако следует отметить, что в подробном описании изобретения и в конкретных его примерах описаны предпочтительные варианты изобретения, которые приводятся лишь в целях иллюстрации, и в них могут быть внесены различные изменения и модификации, не выходящие за рамки сущности и объема изобретения и которые будут очевидны для специалиста в данной области, исходя из подробного описания изобретения.
КРАТНОЕ ОПИСАНИЕ ГРАФИЧЕСКОГО МАТЕРИАЛА
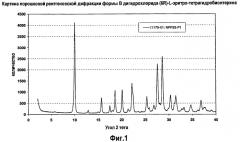
На фигуре 1 представлена картина порошковой рентгеновской дифракции, характеризующая кристаллическую полиморфную форму B 6R-(L-эритро)-5,6,7,8-тетрагидробиоптерина.
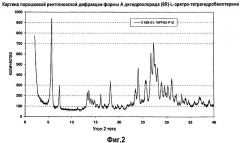
На фигуре 2 графически представлена картина характеристической рентгеновской дифракции, продуцируемая формой А дигидрохлорида (6R)-L-эритро-тетрагидробиоптерина.
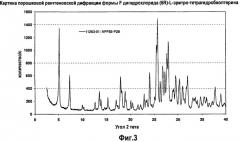
На фигуре 3 графически представлена картина характеристической рентгеновской дифракции, продуцируемой формой F дигидрохлорида (6R)-L-эритро-тетрагидробиоптерина.
На фигуре 4 графически представлена картина характеристической рентгеновской дифракции, продуцируемой формой J дигидрохлорида (6R)-L-эритро-тетрагидробиоптерина.
На фигуре 5 графически представлена картина характеристической рентгеновской дифракции, продуцируемой формой K дигидрохлорида (6R)-L-эритро-тетрагидробиоптерина.
На фигуре 6 графически представлена картина характеристической рентгеновской дифракции, продуцируемой гидратной формой C дигидрохлорида (6R)-L-эритро-тетрагидробиоптерина.
На фигуре 7 графически представлена картина характеристической рентгеновской дифракции, продуцируемой гидратной формой D дигидрохлорида (6R)-L-эритро-тетрагидробиоптерина.
На фигуре 8 графически представлена картина характеристической рентгеновской дифракции, продуцируемой гидратной формой E дигидрохлорида (6R)-L-эритро-тетрагидробиоптерина.
На фигуре 9 графически представлена картина характеристической рентгеновской дифракции, продуцируемой гидратной формой H дигидрохлорида (6R)-L-эритро-тетрагидробиоптерина.
На фигуре 10 графически представлена картина характеристической рентгеновской дифракции, продуцируемой гидратной формой O дигидрохлорида (6R)-L-эритро-тетрагидробиоптерина.
На фигуре 11 графически представлена картина характеристической рентгеновской дифракции, продуцируемой сольватной формой G дигидрохлорида (6R)-L-эритро-тетрагидробиоптерина.
На фигуре 12 графически представлена картина характеристической рентгеновской дифракции, продуцируемой сольватной формой I дигидрохлорида (6R)-L-эритро-тетрагидробиоптерина.
На фигуре 13 графически представлена картина характеристической рентгеновской дифракции, продуцируемой сольватной формой L дигидрохлорида (6R)-L-эритро-тетрагидробиоптерина.
На фигуре 14 графически представлена картина характеристической рентгеновской дифракции, продуцируемой сольватной формой M дигидрохлорида (6R)-L-эритро-тетрагидробиоптерина.
На фигуре 15 графически представлена картина характеристической рентгеновской дифракции, продуцируемой сольватной формой N дигидрохлорида (6R)-L-эритро-тетрагидробиоптерина.
На фигуре 16 представлена блок-схема измерения уровней биоптерина.
На фигуре 17 представлена систематизированная оценка достоверности анализа на биоптерин.
На фигуре 18 представлена таблица, иллюстрирующая фармакокинетические параметры общего биоптерина в плазме после однократного перорального введения сапроптерина (BH4) крысам.
На фигуре 19 указано отношение концентраций биоптерина и его восстановленной формы в плазме после одноразового введения сапроптерина (BH4) крысам.
На фигуре 20 указано отношение концентраций биоптерина в плазме и его восстановленной формы после одноразового введения сапроптерина (BH4) обезьянам.
На фигуре 21 представлена таблица, иллюстрирующая фармакокинетические параметры общего биоптерина в плазме после одноразового введения сапроптерина (BH4) обезьянам.
На фигуре 22 представлен протокол проведения оценки безопасности.
На фигуре 23 указаны средние концентрации ВН4 в плазме после перорального введения здоровым добровольцам 10 мг/кг BH4 в растворенном виде и в виде целых таблеток в условиях голодания, и в виде целых таблеток при приеме пищи - по линейной схеме.
На фигуре 24 указаны средние концентрации ВН4 в плазме после перорального введения здоровым добровольцам 10 мг/кг BH4 в растворенном виде и в виде целых таблеток в условиях голодания, и в виде целых таблеток при приеме пищи - по полулогарифмической схеме.
На фигуре 25 представлена таблица, в которой систематизированы фармакокинетические параметры для ВН4 после перорального введения здоровым добровольцам 10 мг/кг BH4, в растворенном виде и в виде целых таблеток в условиях голодания, и в виде целых таблеток при приеме пищи.
На фигуре 26 приводится статистическое сравнение фармакокинетических параметров для ВН4 после перорального введения здоровым добровольцам 10 мг/кг BH4 в растворенном виде и в виде целых таблеток в условиях голодания, и в виде целых таблеток при приеме пищи.
На фигуре 27 проиллюстрировано исследование стабильности состава BH4, приготовленного с использованием 5% маннита в водном растворе, во время хранения при -20°С, где указанное исследование проводили за две недели и через две недели после хранения.
На фигуре 28 представлен профиль растворимости BH4-содержащей капсулы до и после хранения в течение 54 дней при 40°С.
На фигуре 29 представлен профиль растворимости двух составов BH4 - BH4-содержащей биоадгезивной таблетки и BH4-содержащих биоадгезивных гранул.
На фигуре 30 представлен профиль растворимости различных составов ВН4 с замедленным высвобождением.
На фигуре 31 представлен профиль растворимости различных составов ВН4 с замедленным высвобождением.
На фигуре 32 представлена принципиальная схема флотации лекарственных составов BH4.
На фигуре 33 представлен профиль растворимости различных флотирующих лекарственных составов.
На фигуре 34 представлена принципиальная схема газообразующих лекарственных составов BH4.
На фигуре 35 представлен фармакокинетический профиль различных составов BH4.
На фигуре 36 проиллюстрировано исследование стабильности составов BH4 для внутривенного введения при pH 4 в течение 35 дней.
На фигуре 37 проиллюстрировано исследование стабильности различных составов BH4 для внутривенного введения в течение 350 часов.
На фигуре 38 проиллюстрировано исследование стабильности составов BH4 для внутривенного введения в различных концентрациях ВН4.
Описание предпочтительных вариантов осуществления изобретения
Настоящее изобретение относится к улучшенным способам перорального введения очищенного препарата 6R-(L-эритро)-5,6,7,8-тетрагидробиоптерина, включая его фармацевтически приемлемую соль. Настоящее изобретение основано на обнаружении того факта, что перорально вводимый тетрагидробиоптерин (ВН4) плохо абсорбируется в желудочно-кишечном тракте, и это его свойство является главной причиной низкой биологической доступности ВН4.
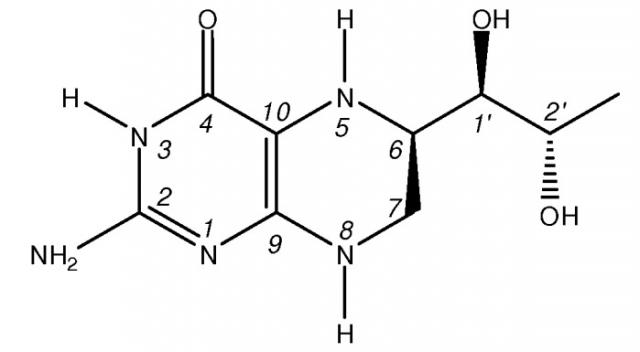
Ниже представлена химическая структура 6R-(L-эритро)-5,6,7,8-тетрагидробиоптерина (BH4):
Тетрагидробиоптерин представляет собой водорастворимое органическое соединение с низкой липидной растворимостью. Коэффициент распределения ВН4 в октаноле-воде, как было определено в экспериментальном анализе in silico с помощью компьютерной программы BioLoom (version 1.5, Biobyte Corp in Claremont California), составлял -1,17. Оптимальная проницаемость биологических мембран, приближенно выражаемая как коэффициент распределения в октаноле/воде, составляет примерно log P = 2 или в 100 раз превышает липидную растворимость. Хотя низкая величина ClogP позволяет этому субстрату легко солюбилизироваться в физиологических условиях, однако способность этого субстрата проникать в билипидные слои в биологических мембранах ограничена, что тем самым может ограничивать пероральную доступность.
Описанные здесь исследования in vivo, проводимые на крысах и обезьянах, показали, что по сравнению с внутривенным введением BH4 в аналогичных дозах лишь 8-11% BH4 абсорбируется в кишечнике, при этом его большая часть выделяется с фекалиями. Такая вариабельность абсорбции ВН4 была также обнаружена в описанных здесь исследованиях по влиянию пищи на биологическую доступность ВН4 у здоровых людей. Хотя введение BH4 в воде и в апельсиновом соке в условиях голодания дает сравнимые средние концентрации в плазме и средние величины Cmax и AUC(0-t), однако введение BH4 вместе с жирной и высококалорийной пищей приводит к значительному увеличению средних концентраций в плазме и средних величин для Cmax и AUC(0-t) в том случае, если BH4 был введен в воде.
Хотя имеется достаточное число публикаций, в которых описано увеличение биологической доступности ВН4 при его приеме вместе с пищей, однако воздействие этой пищи обычно наблюдается при ее приеме вместе с липофильными (то есть растворимыми в липидах) не растворимыми в воде лекарственными средствами, но обычно не с активным веществом, обладающим высокой водорастворимостью, таким как ВН4. Увеличение биологической доступности липофильных соединений при приеме пищи обычно объясняется тем, что жирная пища стимулирует солюбилизацию лекарственного средства, поскольку «подобное растворяется подобным», и, тем самым, делает данный состав доступным для абсорбции. Другим возможным объяснением является то, что пища с высоким содержанием жира стимулирует секрецию желчных кислот, которые представляют собой природные биологические поверхностно-активные вещества, которые стимулируют солюбилизацию и эмульгирование съедаемого жира, тем самым улучшая пищеварение. Также считается, что такие желчные кислоты солюбилизируют нерастворимые в воде соединения, что делает их доступными для абсорбции. Однако для абсорбции BH4 он необязательно должен быть солюбилизирован, поскольку это соединение растворяется при концентрации более чем 1000 мг/мл и является одним из самых известных растворимых лекарственных средств. Поэтому повышение его биологической доступности при приеме вместе с очень жирной высококалорийной пищей не происходит по указанному известному механизму.
Однако введение лекарственного средства в твердой или полутвердой форме и/или вместе с жирной пищей может максимизировать биологическую доступность в результате увеличения времени пребывания ВН4 в кислотной среде желудка и в верхнем отделе желудочно-кишечного тракта (ЖКТ), где BH4 является химически стабильным. Стабильность BH4 снижается по мере увеличения pH, а его время полужизни в буферном растворе при pH 6,8, то есть при рН, значение которого приблизительно равно значению рН тонкой кишки, составляет примерно 15 минут. При рН 3,1, то есть при рН, значение которого входит в интервал типичных значений рН в желудке здоровых добровольцев, стабильность ВН4 при концентрации 1 мг/мл сохраняется в течение 3 часов. Химическая стабильность BH4 может еще больше увеличиваться, если рН в желудке снижается до значения 3,1. Поэтому более продолжительное время пребывание интактного лекарственного средства в желудке приводит к увеличению его абсорбции к стенкам желудка, тогда как быстрое высвобождение ВН4 из желудка в тонкий кишечник приводит к его разложению, и тем самым, к его неспособности к абсорбции.
Таким образом, для максимизации пероральной биологической доступности BH4 при каждом его введении BH4 должен поглощаться с пищей, например с пищей с высоким содержанием жира, или с жирной и/или высококалорийной пищей. Альтернативно, для максимизации уровня пероральной биологической доступности между введениями BH4 необходимо принимать натощак (например, за 1 час или за 2 часа до приема пищи или через 1 час или 2 часа после приема пищи).
Используемый здесь термин «биологическая доступность» означает часть вводимой дозы лекарственного средства, попадаемой в систему кровообращения. При внутривенном введении лекарственного средства его биологическая доступность теоретически должна составлять 100%. Однако при введении лекарственного средства другими способами (такими как пероральное введение) его биологическая доступность должна составлять менее 100%, что обусловлено, например, неполной абсорбцией в желудочно-кишечном тракте, разложением или метаболизмом до абсорбции и/или эффектом первого прохождения в печени.
Термин «пища с высоким содержанием жира», по существу, означает пищу, имеющую по меньшей мере примерно 700 ккал и по меньшей мере примерно 45% жира (относительное процентное содержание жира в ккал), или альтернативно, по меньшей мере примерно 900 ккал и по меньшей мере примерно 50% жира. Термин «жирная пища», по существу, означает пищу, содержащую по меньшей мере 20 г жира, или по меньшей мере 25, 30, 35, 40, 45 или 50 г жира, и/или по меньшей мере примерно 45% или 50% жира. В соответствии с рекомендациями Управления по контролю за качеством пищевых продуктов, медикаментов и косметических средств (FDA), «пища с высоким содержанием жира» определена как пища, в которой общее содержание калорий составляет приблизительно 50% от общего содержания калорий в пище, а «высококалорийная пища» определяется как пища, имеющая приблизительно 800-1000 калорий. FDA рекомендует использовать пищу с высоким содержанием жира и высококалорийную пищу в качестве тест-пищи для проведения исследований влияния этой пищи на биологическую доступность и биологическую эквивалентность этой пищи. Эта тест-пища должна иметь приблизительно 150, 250 и 500-600 калорий белка, углеводов и жира соответственно. Примером может служить тест-пища, состоящая из двух яиц, зажаренных в масле, двух кусочков бекона, четырех унций мелко нарезанного поджаренного картофеля и восьми унций цельного молока. При этом возможна замена на другую пищу, если она имеет аналогичное количество калорий белка, углеводов и жира и сравнимый объем и вязкость (Guidance for Industry, Food-Effect Bioavailability and Fed Bioequivalence Studies, U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research (CDER), December 2002).
В первом аспекте настоящее изобретение относится к способам перорального введения очищенного прерарата 6R-(L-эритро)-5,6,7,8-тетрагидробиоптерина (BH4), включая его фармацевтически приемлемую соль.
В некоторых вариантах изобретения указанные способы включают информирование пациента о том, что введение тетрагидробиоптерина с пищей оказывает влияние на фармакокинетические свойства. В репрезентативном варианте изобретения указанные способы включают стадию информирования пациента о том, что абсорбция тетрагидробиоптерина повышается при его приеме вместе с пищей по сравнению с абсорбцией, достигаемой при его приеме натощак. В некоторых вариантах изобретения пациента информируют о том, что прием состава сразу после приема пищи, например пищи с высоким содержанием жира и высококалорийной пищи, приводит к увеличению любого одного, двух, трех или всех нижеследующих параметров, таких как средняя концентрация в плазме, Cmax, AUC, AUC(0-t) и/или AUC(inf). В репрезентативных вариантах изобретения пациента информируют о том, что введение BH4 вместе с пищей с высоким содержанием жира приводит к увеличению Cmax и AUC по сравнению с введением BH4 натощак (в условиях голодания). В некоторых вариантах изобретения относительное увеличение может составлять по меньшей мере 20%, 30% или более.
В альтернативных вариантах или в дополнительных вариантах указанный способ введения тетрагидробиоптерина включает информирование пациента о том, что абсорбция тетрагидробиоптерина повышается при проглатывании целой таблетки по сравнению с абсорбцией, достигаемой при употреблении состава, растворенного в жидкости. В некоторых вариантах изобретения пациента информируют о том, что проглатывание целой таблетки приводит к увеличению любого из нижеследующих параметров: средней концентрации в плазме, Cmax, AUC, AUC(0-t) или AUC(inf). В репрезентативных вариантах изобретения пациента информируют о том, что прием ВН4 в виде целой таблетки приводит к увеличению Cmax и AUC по сравнению с приемом BH4 после его растворения в жидкости. В некоторых вариантах изобретения относительное увеличение может составлять по меньшей мере 20% или более.
Любой из предыдущих способов может быть осуществлен путем предоставления тетрагидробиоптерина или его введения в контейнер, содержащий отпечатанную памятку, информирующую пациента об изменении вышеописанных параметров абсорбции.
Способы согласно изобретению могут также включать, но необязательно, стадию введения пациенту, нуждающемуся в этом, терапевтически эффективного количества тетрагидробиоптерина. Такое терапевтически эффективное количество варьируется в зависимости от состояния, подвергаемого лечению, и может быть легко определено лечащим врачом исходя из желательного ослабления клинических симптомов.
В одном из репрезентативных вариантов изобретения такие способы включают введение BH4 в растворенной форме, где указанный состав растворяют в жидкости, включая, но не ограничиваясь ею, воду, апельсиновый сок и яблочный сок. В одном из вариантов изобретения растворенный BH4 вводят пациенту в условиях голодания, то