Способ получения гетерологичных белков
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, а именно к способу продукции требуемого полипептида (варианты), способу получения фармацевтической композиции, клетке СНО для получения требуемого белка, клетке СНО-реципиенту ДНК, кодирующей требуемый полипептид, способу продукции требуемого полипептида. Способ продукции требуемого полипептида включает культивирование клетки СНО, которая является трансформированной ДНК, кодирующей аланинаминотрансферазу, и ДНК, кодирующей требуемый полипептид. В частном случае клетки СНО культивируют в содержащей α-кетоглутарат среде. Способ получения фармацевтической композиции включает получение требуемого полипептида указанным выше способом. Смешивают полипептид с фармацевтически приемлемыми носителями или добавками. Готовят препарат. Клетка СНО для получения требуемого белка обладает перенесенной в нее ДНК, кодирующей аланинаминотрансферазу, и перенесенной в нее ДНК, кодирующей требуемый полипептид. Предложенное изобретение позволяет получать требуемый полипептид с высоким выходом. 5 н. и 5 з.п. ф-лы, 22 ил., 3 пр.
Реферат
ТЕХНИЧЕСКАЯ ОБЛАСТЬ
Настоящее изобретение относится к способу продукции гетерогенного белка, более конкретно, к способу продукции полипептида с использованием клетки, которая на высоком уровне экспрессирует аланинаминотрансферазу.
УРОВЕНЬ ТЕХНИКИ
Когда белки, полезные в фармацевтике, получают способами рекомбинантных ДНК, применение клеток животных обеспечивает сложную посттрансляционную модификацию и сворачивание, которые прокариотические клетки не могут осуществлять. Таким образом, для продукции рекомбинантных белков часто в качестве клеток-хозяев используют клетки животных.
В последнее время было разработано большое количествО биофармацевтических средств, таких как антитела и физиологически активные белки. Способы, которые позволяют эффективную продукцию рекомбинантных белков клетками животных, обеспечивают снижение расходов на биофармацевтические средства и перспективу стабильного снабжения ими пациентов.
В этих обстоятельствах, является желательным способ продукции белков с более высокой эффективностью продукции.
Аланин представляет собой одну из протеиногенных аминокислот, и он является заменимой аминокислотой. В живом организме его биосинтез осуществляется путем переноса аминогруппы с глутамата на пируват, а его деградация осуществляется путем обратной реакции.
В качестве фермента деградации аланина известна аланинаминотрансфераза (EC 2.6.1.2.) (непатентный документ 1). Этот фермент переносит аминогруппу с аланина на 2-оксоглутарат, синтезируя глутамат. Аланинаминотрансферазу также называют глутамат-пируват трансаминазой, которую сокращенно обозначают как GPT (непатентный документ 2). GPT и GOP (аспартатаминотрансфераза) представляют собой ферменты, находящиеся в печени. Поскольку GPT и GOP высвобождаются в кровь при разрушении печеночных клеток, когда выявляют аномально высокие уровни GPT и GOT, то диагностируют в печени нарушение какого-либо типа.
Как показано выше, аланинаминотрансферазу используют в качестве маркера функции печени. Однако, неизвестно поведение клеток-хозяев, таких как клетки CHO, если в них на высоком уровне экспрессируется аланинаминотрансфераза.
[Непатентный документ 1]
Sanjay B. J., et. al., Hepatology (2004) 39(5), 1297-1302
[Непатентный документ 2]
Melanie M. S., et. al., Genomics (1997) 40, 247-252
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ПРОБЛЕМА, РЕШАЕМАЯ С ПОМОЩЬЮ ИЗОБРЕТЕНИЯ
Задачей настоящего изобретения является предоставление способа, посредством которого можно продуцировать природный или рекомбинантный белок с высоким выходом.
СРЕДСТВА РЕШЕНИЯ ПРОЛЕМЫ
В результате обширных и тщательных исследований для решения указанной выше проблемы авторы настоящего изобретения выявили, что можно повысить выход требуемого полипептида с использованием клетки, которая на высоком уровне экспрессирует аланинаминотрансферазу (в дальнейшем в настоящем документе иногда обозначаемую как “ALT”). Таким образом, было осуществлено настоящее изобретение. Более того, требуемый полипептид можно получить даже в более высоком количестве с использованием клеток, способных коэкспрессировать ALT и переносчик таурина. Поскольку аланин продуцируется в большом количестве с течением времени в клеточной культуре, аланин, накапливаемый в клетках, секретируется в среду. Если бы реакцию биосинтеза пирувата и глутамата из аланина можно было обеспечить экспрессией ALT на высоком уровне, продукты бы использовались в метаболизме в ходе цикла TCA и продукции глюкозы посредством гликогенеза. Это может улучшить поведение клеток в культуре, и, таким образом, ожидается продукция с высоким выходом требуемого полипептида.
Настоящее изобретение можно обобщить следующим образом.
(1) Способ продукции полипептида, включающий культивирование клетки, которая на высоком уровне экспрессирует аланинаминотрансферазу и обладает перенесенной в нее ДНК, кодирующей требуемый полипептид и, тем самым, обеспечение возможности клетке продуцировать указанный полипептид.
(2) Способ по (1), выше, где клетка, которая на высоком уровне экспрессирует аланинаминотрансферазу, представляет собой клетку, в которую перенесена ДНК, кодирующая аланинаминотрансферазу.
(3) Способ продукции по (1) или (2), выше, где клетки, которые на высоком уровне экспрессируют аланинаминотрансферазу, далее на высоком уровне экспрессируют переносчик таурина.
(4) Способ продукции по (3), выше, где клетки, которые на высоком уровне экспрессируют переносчик таурина, представляют собой клетки, в которые перенесена ДНК, кодирующая переносчик таурина.
(5) Способ по (2) или (4), выше, где клетка представляет собой клетки яичника китайского хомяка.
(6) Способ по любому из (1)-(5), выше, где требуемым полипептидом является антитело.
(7) Способ по любому из (2)-(6), выше, где ДНК, кодирующая аланинаминотрансферазу, представляет собой любую из следующих с (a) по (e):
(a) ДНК, кодирующая полипептид, имеющий аминокислотную последовательность, как показано в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58 или 60;
(b) ДНК, кодирующая полипептид, который обладает аминокислотной последовательностью, образованной из аминокислотной последовательности, как показано в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58 или 60, путем замены, делеции, вставки и/или инсерции одного или нескольких аминокислотных остатков и, кроме того, обладает активностью аланинаминотрансферазы;
(c) ДНК, кодирующая полипептид, имеющий 70% или более гомологию аминокислотной последовательности с аминокислотной последовательностью, как показано в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58 или 60, и, кроме того, обладает активностью аланинаминотрансферазы;
(d) ДНК, обладающая нуклеотидной последовательностью, как показано в SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57 или 59;
(e) ДНК, которая гибридизуется с ДНК, комплементарной ДНК, обладающей нуклеотидной последовательностью, как показано в SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57 или 59, в строгих условиях, и, кроме того, кодирует полипептид, обладающий активностью аланинаминотрансферазы.
(8) Способ получения фармацевтического препарата, содержащего полипептид, полученный способом по любому из (1)-(7), выше.
(9) Клетка, которая обладает перенесенной в нее ДНК, кодирующей аланинаминотрансферазу, и перенесенной в нее ДНК, кодирующей требуемый полипептид.
(10) Клетка согласно (9), выше, которая далее обладает перенесенной в нее ДНК, кодирующей переносчик таурина.
(11) Клетка, которая обладает перенесенной в нее ДНК, кодирующей аланинаминотрансферазу, и перенесенной в нее ДНК, кодирующей переносчик таурина.
(12) Способ продукции полипептида, включающий культивирование в содержащей α-кетоглутарат среде клетки, которая на высоком уровне экспрессирует аланинаминотрансферазу и обладает перенесенной в нее ДНК, кодирующей требуемый полипептид, что, тем самым, дает клетке возможность продуцировать указанный полипептид.
ЭФФЕКТ ИЗОБРЕТЕНИЯ
В соответствии с настоящим изобретением, становится возможным повышать выход требуемого полипептида.
Настоящее описание охватывает содержание, описанное в описании и/или фигурах патентной заявки Японии № 2007-205158, на основе которой по настоящей патентной заявке испрашивается приоритет.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг.1 представлена плазмида для селекции пуромицином, которую использовали для экспрессии ALT1 человека (496 аминокислот).
На фиг.2 представлена плазмида для селекции гигромицином, которую использовали для экспрессии ALT1 человека (496 аминокислот).
На фиг.3 представлены графики выхода антитела против глипикана-3 на 17 сутки в культуре с подпиткой в перемешиваемом флаконе объемом 50 мл. Выход антитела в клетке, в которую была перенесена pPur-ALT1 (n=4), был выше выхода в клетке, в которую была перенесена pPur (n=3) (P<0,01).
На фиг.4 представлен график, на котором показаны выходы антитела в A72, который представляет собой штамм, экспрессирующий ALT1, и в P41 в качестве контрольного штамма, в культуре с подпиткой в емкости 1 л. Выход антитела против глипикана-3 в A72 составлял 2,9 г/л на 19 сутки в культуре, что превышало выход в P41.
На фиг.5 представлен график, на котором показаны уровни выживаемости A72, который представляет собой штамм, экспрессирующий ALT1, и P41 в качестве контрольного штамма. Уровень выживаемости A72 на поздней стадии культивирования превышал уровень выживаемости P41.
На фиг.6 показаны графики выхода антитела против глипикана-3 на 4 сутки в культуре с подпиткой в перемешиваемом флаконе объемом 50 мл. Выход антитела в клетке, котрансфицированной pHyg-TauT/pPur-ALT1 (n=6), превышал выход в клетке, котрансфицированной pHyg-TauT/pPur (n=8) (P<0,01).
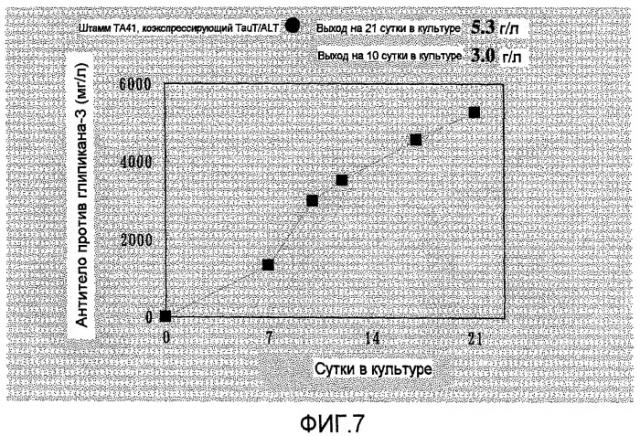
На фиг.7 представлен график, на котором показан выход антител в TA41, который представляет собой штамм, коэкспрессирующий TauT/ALT1, в культуре с подпиткой в емкости 1 л. Выход антитела против глипикана-3 составил 5,3 г/л на 21 сутки культивирования.
На фиг.8 представлена нуклеотидная последовательность вновь клонированного гена переносчика таурина хомяка из клеток CHO и установленная на ее основе аминокислотная последовательность.
На фиг.9 представлена топология на мембране вновь клонированного переносчика таурина TauT из CHO.
На фиг.10 представлена плазмида, которую использовали для экспрессии TauT хомяка (622 аминокислоты).
На фиг.11 представлены графики плотности жизнеспособных клеток на 7 сутки в культуре с подпиткой в перемешиваемом флаконе объемом 50 мл. Плотность жизнеспособных клеток в клетках, в которые была перенесена pHyg/TauT, была выше плотности жизнеспособных клеток в клетках, в которые была перенесена pHyg.
На фиг.12 представлены графики выхода лактата на 7 сутки в культуре с подпиткой в перемешиваемом флаконе объемом 50 мл. Клетка, в которую была перенесена pHyg/TauT, продуцировала меньшее количество лактата, и она была лучше клетки, в которую была перенесена pHyg.
На фиг.13 представлены графики выхода антитела против глипикана-3 на 7 сутки в культуре с подпиткой в перемешиваемом флаконе объемом 50 мл. Четыре из 7 штаммов клеток, в которые была перенесена pHyg/TauT, показали выходы антитела, превышающие наиболее высокий выход в клетках, в которые была перенесена pHyg.
На фиг.14 представлены графики выхода антитела против глипикана-3 на 7 сутки в культуре с подпиткой в перемешиваемом флаконе объемом 50 мл. Выход антитела в клетках, в которые была перенесена pHyg/TauT, превышал выход антитела в клетках, в которые была перенесена pHyg.
На фиг.15 представлен график, на котором показан уровень выживаемости клеток T10, в которые была перенесена pHyg/TauT, (которые показали высокую способность к росту) в культуре с подпиткой в емкости 1 л. Уровень выживаемости T10 составил 80% или более даже на 32 сутки в культуре.
На фиг.16 представлен график, на котором показан выход антител в клетках T10, в которые была перенесена pHyg/TauT, (которые показали высокую способность к росту в процессе размножения в стационарной культуре) в культуре с подпиткой в емкости 1 л. Выход антитела против глипикана-3 в T10 составил 2,9 г/л на 35 сутки в культуре.
На фиг.17 представлены результаты анализа проточной цитометрией, указывающие на то, что клетки T10, в которые был перенесен TauT, экспрессируют молекулы TauT на их клеточных мембранах.
На фиг.18 представлен график, на котором показано внутриклеточное содержание аммиака (уровни концентраций) в культуре с подпиткой в емкости 1 л. Ингибирование аммиака в штаммах, в которые была перенесена pHyg/TauT, было значительным по сравнению с родительским штаммом.
На фиг.19 представлен график, на котором показано, что таурин захватывается клетками в зависимости от концентрации таурина в среде. Не было выявлено отличий в захвате таурина между штаммами, в которые была перенесена pHyg/TauT, и родительскими штаммами.
На фиг.20 представлен график, на котором показано потребление глутамина в среде. По сравнению с родительским штаммом, штаммы, в которые была перенесена pHyg/TauT, показали в значительной степени высокое потребление глутамина/клетка, независимо от концентрации таурина в среде.
На фиг.21 представлен график, на котором показано, что выходы антитела против глипикана-3 в штаммах, в которые была перенесена pHyg/TauT, являются практически равными, независимо от исходной концентрации таурина в среде.
На фиг.22 показан выход антитела против глипикана-3 в штамме TA41, коэкспрессирующем TauT/ALT, на 14 сутки в культуре с подпиткой в устройстве для перемешивания. Выход антитела повышался при добавлении α-кетоглутарата.
НАИЛУЧШИЕ СПОСОБЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Ниже, варианты осуществления настоящего изобретения описаны более подробно.
Настоящее изобретение относится к способу продукции полипептида, включающему культивирование клетки, которая на высоком уровне экспрессирует ALT и обладает перенесенной в нее ДНК, кодирующей требуемый полипептид, что, тем самым, дает клетке возможность продуцировать полипептид.
В способе по настоящему изобретению, клетка может быть либо природной клеткой, способной продуцировать требуемый полипептид, либо трансформированной клеткой, в которую перенесена ДНК, кодирующая требуемый полипептид. Предпочтительно, используют трансформированную клетку, в которую перенесена ДНК, кодирующая требуемый полипептид.
В способе по настоящему изобретению требуемый полипептид конкретно не ограничен. Полипептид может представлять собой любой полипептид, такой как антитело (например, антитело против рецептора IL-6, антитело против IL-6, антитело против глипикана-3, антитело против CD3, антитело против CD20, антитело против GPIIb/IIIa, антитело против TNF, антитело против CD25, антитело против EGFR, антитело против Her2/neu, антитело против RSV, антитело против CD33, антитело против CD52, антитело против IgE, антитело против CD11a, антитело против VEGF, антитело против VLA4 и т.п.) или физиологически активный белок (например, гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), эритропоэтин, интерферон, интерлейкин, такой как IL-1 или IL-6, t-PA, урокиназа, сывороточный альбумин, фактор свертывания крови, PTH и т.п.). Антитело, в частности, является предпочтительным и оно может представлять собой любое антитело, такое как природное антитело, антитело низкомолекулярного размера (например, Fab, scFv, sc(Fv)2), химерное антитело, гуманизированное антитело, и т.д.
С использованием экспрессирующих на высоком уровне ALT клеток количество полипептида, продуцируемого клетками, можно повышать.
ALT, главным образом, известна как фермент, который образует глутамат переносом аминогруппы с аланина на 2-оксоглутарат. Авторы настоящего изобретения посчитали, что если реакцию биосинтеза пирувата и глутамата из аланина можно было бы обеспечить посредством экспрессии на высоком уровне ALT в клетках-хозяевах, таких как клетки CHO, продукты могут использоваться в метаболизме в ходе цикла TCA и продукции глюкозы путем гликогенеза, и это может улучшить поведение клеток в культуре, приводя к продукции с высоким выходом требуемого полипептида.
Клетки, на высоком уровне экспрессирующие ALT, в частности, не ограничены, при условии, что они способны экспрессировать ALT на более высоких уровнях, чем природные клетки. Природные клетки включают, но не ограничиваются конкретно ими, клетки, которые используют в качестве хозяев при продукции рекомбинантных белков и они могут быть проиллюстрированы клетками CHO.
Клетка, которая на высоком уровне экспрессирует ALT, конкретно не ограничена, при условии, что клетка обладает повышенным уровнем экспрессии ALT по сравнению с соответствующей природной клеткой. Природная клетка конкретно не ограничена. Можно использовать клетку, которую используют в качестве хозяина для продукции рекомбинантного белка (например, клетки CHO).
В качестве клетки, которая на высоком уровне экспрессирует ALT, может быть приведена клетка, в которую искусственно перенесен ген ALT. Клетку, в которую искусственно перенесен ген ALT, можно получать способами, известными специалистам в данной области. Например, такую клетку можно получать включением гена ALT в вектор и трансформацией вектором клетки. Более того, понятие "клетки, в которые искусственно перенесен ген ALT," охватывает в настоящем документе клетки, в которых эндогенный ген ALT активирован способами активации генов (см., например, международную публикацию WO94/12650), так чтобы ALT экспрессировалась на высоком уровне.
В качестве ALT, подлежащей экспрессии на высоком уровне в клетке, можно использовать ALT из любого организма. Конкретно, известны и можно использовать ALT из человека, мыши, крысы, собаки, африканской шпорцевой лягушки, плодовой мушки, нематод, японского риса, Cyanidioschyzon merolae, Saccharomyces cerevisiae, Ashbya gossypii, Candida albicans, Schizosaccharomyces pombe, Aspergillus nidulans, Aspergillus fumigatus, Aspergillus oryzae, Cryptococcus neoformans, Dictyostelium discoideum, Trypanosoma brucei, Leishmania major, Entamoeba histolytica и Trypanosoma cruzi. Предпочтительно, можно использовать ALT из человека, грызуна или того же вида, что и клетка-хозяин. Например, когда клетка, которой позволяют на высоком уровне экспрессировать ALT, представляет собой клетки яичника китайского хомяка (клетки CHO), источником ALT предпочтительно является человек или хомяк. Для ALT человека, мыши и дрожжей существуют варианты (ALT1 и ALT2). ALT2 обладает 80% или более гомологией с ALT1 на уровне аминокислот. Вынужденную экспрессию ALT1 проводили в примерах, описанных ниже.
Кроме того, в качестве гена ALT, подлежащего экспрессии на высоком уровне в клетке, можно использовать любую из следующих ДНК с (a) по (e), кодирующих ALT.
(a) ДНК, кодирующая полипептид, имеющий аминокислотную последовательность, как показано в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58 или 60;
(b) ДНК, кодирующая полипептид, который обладает аминокислотной последовательностью, образованной из аминокислотной последовательности, как показано в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58 или 60, путем замены, делеции, вставки и/или инсерции одного или нескольких аминокислотных остатков и, кроме того, обладает активностью аланинаминотрансферазы;
(c) ДНК, кодирующая полипептид, имеющий 70% или более гомологию аминокислотной последовательности с аминокислотной последовательностью, как показано в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58 или 60, и, кроме того, обладает активностью аланинаминотрансферазы;
(d) ДНК, обладающая нуклеотидной последовательностью, как показано в SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57 или 59;
(e) ДНК, которая гибридизуется с ДНК, комплементарной ДНК, обладающей нуклеотидной последовательностью, как показано в SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57 или 59, в строгих условиях, и, кроме того, кодирует полипептид, обладающий активностью аланинаминотрансферазы.
Клетка, которая на высоком уровне экспрессирует ALT, может представлять собой любую клетку, например, эукариотическую клетку, такую как клетки животных, растений и дрожжей, прокариотическую клетку, такую как E. coli и B. subtilis, и т.д. Предпочтительно, используют клетки животных, такие как клетки CHO и COS, особенно предпочтительными являются клетки CHO. Для получения требуемого полипептида, предпочтительными являются клетки, пригодные для переноса гена, кодирующего требуемый полипептид, такие как клетки CHO-dhfr.
Предпочтительно, клетка по настоящему изобретению, которая на высоком уровне экспрессирует ALT, кроме того, на высоком уровне экспрессирует переносчик таурина для получения требуемого полипептида. Посредством переноса гена, кодирующего требуемый полипептид, в клетку и культивирования полученной клетки в среде можно получать требуемый полипептид в более высоком количестве.
Когда требуемый полипептид продуцируют с использованием клетки, в которую искусственно перенесен ген ALT, порядок переноса гена ALT и переноса гена, кодирующего требуемый полипептид, конкретно не ограничен. Ген, кодирующий требуемый полипептид, может быть перенесен после переноса гена ALT. Альтернативно ген ALT может быть перенесен после переноса гена, кодирующего требуемый полипептид. Также можно переносить ген ALT и ген, кодирующий требуемый полипептид, одновременно.
Ген ALT и ген, кодирующий требуемый полипептид, можно переносить одновременно в одном векторе. Альтернативно их можно переносить по отдельности с использованием множества векторов.
С использованием клетки, которая на высоком уровне экспрессирует ALT и переносчик таурина, можно снижать внутриклеточную концентрацию аммиака.
Известно, что переносчик таурина представляет собой мембранный белок, обладающий осморегуляторной функцией захвата аминокислот (таких как таурин и β-аланин) в клетки.
Клетка, которая на высоком уровне экспрессирует переносчик таурина, конкретно не ограничена, при условии, что клетка обладает повышенным уровнем экспрессии переносчика таурина по сравнению с соответствующей природой клеткой. Природная клетка конкретно не ограничена. Можно использовать клетку, которую используют в качестве хозяина для продукции рекомбинантного белка (например, клетки CHO).
В качестве клетки, которая на высоком уровне экспрессирует переносчик таурина, может быть приведена клетка, в которую искусственно перенесен ген переносчика таурина. Клетку, в которую искусственно перенесен ген переносчика таурина, можно получать способами, известными специалистам в данной области. Например, такую клетку можно получать включением гена переносчика таурина в вектор и трансформации вектора в клетку.
В качестве переносчика таурина, подлежащего экспрессии на высоком уровне в клетке, можно использовать переносчик таурина из любого организма. Конкретно, можно использовать переносчик таурина из человека или грызуна (такого как мышь, крыса или хомяк). Предпочтительно, можно использовать переносчик таурина из человека, грызуна или того же вида, что и клетка-хозяин. Например, когда клетка, которой позволяют на высоком уровне экспрессировать переносчик таурина, представляет собой клетки яичника китайского хомяка (клетки CHO), источником переносчика таурина предпочтительно является человек или хомяк.
Кроме того, в качестве гена переносчика таурина, подлежащего экспрессии на высоком уровне в клетке, можно использовать любую из следующих ДНК с (a1) по (e1), кодирующих переносчик таурина.
(a1) ДНК, кодирующая полипептид, имеющий аминокислотную последовательность, как показано в SEQ ID NO: 62, 64, 66 или 68;
(b1) ДНК, кодирующая полипептид, которая обладает аминокислотной последовательностью, образованной из аминокислотной последовательности, как показано в SEQ ID NO: 62, 64, 66 или 68, путем замены, делеции, вставки и/или инсерции одного или нескольких аминокислотных остатков и, кроме того, обладает активностью переносчика таурина;
(c1) ДНК, кодирующая полипептид, обладающий 70% или более гомологией аминокислотной последовательности с аминокислотной последовательностью, как показано в SEQ ID NO: 62, 64, 66 или 68, и кроме того, имеющий активность переносчика таурина;
(d1) ДНК, обладающая нуклеотидной последовательностью, как показано в SEQ ID NO: 61, 63, 65 или 67;
(e1) ДНК, которая гибридизуется с ДНК, комплементарной ДНК, обладающей нуклеотидной последовательностью, как показано в SEQ ID NO: 61, 63, 65 или 67, в строгих условиях, и, кроме того, кодирует полипептид, обладающий активностью переносчика таурина.
Продукцию требуемого полипептида можно проводить переносом гена, кодирующего требуемый полипептид, в клетку, которая на высоком уровне экспрессирует ген переносчика таурина и ген ALT, и культивированием полученной клетки в среде. Более того, требуемый полипептид можно получать с использованием клетки, в которой эндогенный ген активирован способами активации генов (см., например, международную публикацию WO94/12650), так чтобы продуцировался требуемый полипептид.
Когда требуемый полипептид продуцируют с использованием клетки, в которую искусственно перенесен ген переносчика таурина и ген ALT, порядок переноса гена переносчика таурина, переноса гена ALT и переноса гена, кодирующего требуемый полипептид, конкретно не ограничен. Ген, кодирующий требуемый полипептид, можно переносить после переноса гена переносчика таурина и гена ALT. Альтернативно ген переносчика таурина и ген ALT можно переносить после переноса гена, кодирующего требуемый полипептид. Также можно переносить ген переносчика таурина, ген ALT и ген, кодирующий требуемый полипептид, одновременно.
Ген переносчика таурина, ген ALT и ген, кодирующий требуемый полипептид, могут быть перенесены одновременно в одном векторе. Альтернативно они могут быть перенесены по отдельности с использованием нескольких векторов.
Для культивирования клетки, которая на высоком уровне экспрессирует ALT (и которая на высоком уровне экспрессирует переносчик таурина), можно использовать среды, используемые в общепринятых клеточных культурах (предпочтительно, культурах клеток животных). Эти среды обычно содержат аминокислоты, витамины, липидные факторы, источники энергии, регуляторы осмотического давления, источники железа и регуляторы pH. Содержание этих компонентов обычно является следующим: аминокислоты 0,05-1500 мг/л, витамины 0,001-10 мг/л, липидные факторы 0-200 мг/л, источники энергии 1-20 г/л, регуляторы осмотического давления 0,1-10000 мг/л, источники железа 0,1-500 мг/л, регуляторы pH 1-10000 мг/л, микроэлементы металлов 0,00001-200 мг/л, поверхностно-активные вещества 0-5000 мг/л, кофакторы роста 0,05-10000 мкг/л и нуклеозиды 0,001-50 мг/л. Однако содержание не ограничивается этими диапазонами и его можно соответствующим образом выбирать, в зависимости от типа клетки, подлежащей культивированию, типа требуемого полипептида и т.д.
В дополнение к этим компонентам, можно добавлять микроэлементы металлов, поверхностно-активные вещества, кофакторы роста, нуклеозиды и т.п.
Конкретные примеры таких компонентов включают аминокислоты, такие как L-аланин, L-аргинин, L-аспарагин, L-аспарагиновая кислота, L-цистеин, L-цистин, L-глутамин, L-глутаминовая кислота, глицин, L-гистидин, L-изолейцин, L-лейцин, L-лизин, L-метионин, L-орнитин, L-фенилаланин, L-пролин, L-серин, L-треонин, L-триптофан, L-тирозин и L-валин, предпочтительно L-аланин, L-аргинин, L-аспарагин, L-аспарагиновую кислоту, L-цистин, L-глутамин, L-глутаминовую кислоту, глицин, L-гистидин, L-изолейцин, L-лейцин, L-лизин, L-метионин, L-фенилаланин, L-пролин, L-серин, L-треонин, L-триптофан, L-тирозин и L-валин; витамины, такие как изо-инозитол, биотин, фолиевая кислота, липоевая кислота, никотинамид, никотиновая кислота, п-аминобензойная кислота, пантотенат кальция, пиридоксаль гидрохлорид, гидрохлорид пиридоксина, рибофлавин, гидрохлорид тиамина, витамин B12 и аскорбиновая кислота, предпочтительно, биотин, фолиевую кислоту, липоевую кислоту, никотинамид, пантотенат кальция, пиридоксаль гидрохлорид, рибофлавин, гидрохлорид тиамина, витамин B12 и аскорбиновую кислоту; липидные факторы, такие как хлорид холина, тартрат холина, линолеиновая кислота, олеиновая кислота и холестерин, предпочтительно, хлорид холина; источники энергии, такие как глюкоза, галактоза, манноза и фруктоза, предпочтительно, глюкозу; регуляторы осмотического давления, такие как хлорид натрия, хлорид калия и нитрат калия, предпочтительно, хлорид натрия; источники железа, такие как железо-ЭДТА, цитрат трехвалентного железа, хлорид двухвалентного железа, хлорид трехвалетного железа, сульфат двухвалентного железа, сульфат трехвалентного железа и нитрат трехвалентного железа, предпочтительно, хлорид трехвалентного железа, железо-ЭДТА и цитрат трехвалентного железа; и регуляторы pH, такие как гидрокарбонат натрия, хлорид кальция, дигидрофосфат натрия, HEPES и MOPS, предпочтительно, гидрокарбонат натрия. В качестве примеров могут быть приведены культуральные среды, содержащие любые из этих компонентов.
Помимо указанных выше компонентов, можно добавлять микроэлементы металлов, такие как сульфат меди, сульфат марганца, сульфат цинка, сульфат магния, хлорид никеля, хлорид олова, хлорид магния и субсиликат натрия, предпочтительно, сульфат меди, сульфат цинка и сульфат магния; поверхностно-активные вещества, такие как Tween 80 и Pluronic F68; кофакторы роста, такие как рекомбинантный инсулин, рекомбинантный IGF-1, рекомбинантный EGF, рекомбинантный FGF, рекомбинантный PDGF, рекомбинантный TGF-α, гидрохлорид этаноламина, селенит натрия, ретиноевая кислота и дигидрохлорид путресцина, предпочтительно, селенит натрия, гидрохлорид этаноламина, рекомбинантный IGF-1 и дигидрохлорид путресцина; и нуклеозиды, такие как дезоксиаденозин, дезоксицитидин, дезоксигуанозин, аденозин, цитидин, гуанозин и уридин. В предпочтительных примерах, указанные выше среды могут содержать антибиотики, такие как стрептомицин, пенициллин-G калий и гентамицин, и индикаторы pH, такие как феноловый красный.
Кроме того, в среду можно добавлять α-кетоглутарат, служащий субстратом для ALT. Выход требуемого полипептида (например, антитела) можно повышать путем добавления α-кетоглутарата. В этом случае, количество α-кетоглутарата, подлежащее добавлению, обычно находится в диапазоне от 0,01 до 1000 мМ, предпочтительно от 0,1 до 100 мМ, и более предпочтительно от 1 до 10 мМ.
pH среды варьирует в зависимости от клетки, подлежащей культивированию. Как правило, подходящим является pH 6,8-7,6. Во многих случаях подходящим является pH 7,0-7,4.
Также можно использовать коммерческую среду для культивирования клеток животных, например, D-MEM (модифицированная способом Игла среда Дульбекко), смесь 1:1 D-MEM/F-12 (модифицированная способом Игла среда Дульбекко: смесь питательных веществ F-12), RPMI1640, CHO-S-SFMII (Invitrogen), CHO-SF (Sigma-Aldrich), EX-CELL 301 (JRH Biosciences), CD-CHO (Invitrogen), IS CHO-V (Irvine Scientific), PF-ACF-CHO (Sigma-Aldrich) или сходные с ними.
Альтернативно среда может представлять собой бессывороточную среду, такую как CD-CHO (Invitrogen).
Когда клетка, которая на высоком уровне экспрессирует ALT (и которая на высоком уровне экспрессирует переносчик таурина) представляет собой клетки CHO, клетки CHO можно культивировать способами, известными специалистам в данной области. Например, клетки CHO обычно можно культивировать в атмосфере с концентрацией CO2 в газообразной фазе от 0 до 40%, предпочтительно от 2 до 10%, при 30-39°C, предпочтительно при приблизительно 37°C.
Более того, в случае, когда требуемый полипептид, такой как антитело, продуцируется клеточной культурой, клетки становятся высоко конфлюэнтными на поздней стадии культивирования (приблизительно 1 × 107 клеток/мл), и эффект продуктов их жизнедеятельности, таких как лактат, становится крайне высоким. Если требуемый полипептид продуцируется клетками, на высоком уровне экспрессирующими ALT, поддерживается высокий уровень выживаемости даже на поздней стадии культивирования, и также можно ожидать повышения выхода требуемого полипептида.
Надлежащий период культивирования для получения требуемого полипептида с использованием клетки, которая на высоком уровне экспрессирует ALT, как правило, составляет от 1 суток до 3 месяцев, предпочтительно от 1 суток до 2 месяцев, более предпочтительно от 1 суток до 1 месяца.
В отношении различных устройств для культивирования клеток животных можно использовать устройство для культивирования в виде емкости ферментера, устройство для культивирования с перемешиванием струей воздуха, устройство для культивирования в виде культурального флакона, устройство для культивирования в виде вращающегося флакона, устройство для культивирования в виде микроносителя, устройство для культивирования в псевдоожиженном слое, устройство для культивирования в виде полых волокон, устройство для культивирования в виде вращающегося флакона, устройство для культивирования в фильтрующем слое или сходные с ними.
Культивирование можно проводить любым способом культивирования, таким как периодическая культура, культура с подпиткой или непрерывная культура. Предпочтительно, используют культуру с подпиткой или непрерывную культуру. Более предпочтительной является культура с подпиткой.
Когда культивируют клетку, которая на высоком уровне экспрессирует ALT (и которая может на высоком уровне экспрессировать переносчик таурина), в среду можно добавлять таурин для обеспечения захвата таурина в клетки. Концентрация таурина, подлежащая добавлению в среду, конкретно не ограничена, однако обычно она находится в диапазоне от 0 г/л до 100 г/л, предпочтительно от 0 г/л до 20 г/л, и более предпочтительно от 0 г/л до 10 г/л.
Когда полипептид, продуцируемый способом по настоящему изобретению, обладает биологической активностью, полезной в качестве фармацевтического средства, можно продуцировать фармацевтическое средство смешиванием этого полипептида с фармацевтически приемлемым носителями или добавками и изготовления из них препарата.
Конкретные примеры фармацевтически приемлемых носителей и добавок включают воду, органические растворители, которые являются фармацевтически приемлемыми, коллаген, поливиниловый спирт, поливинилпирролидон, карбоксивиниловый полимер, карбоксиметилцеллюлозу натрия, полиакрилат натрия, альгинат натрия, растворимый в воде декстран, карбоксиметилкрахмал натрия, пектин, метилцеллюлозу, этилцеллюлозу, ксантановую смолу, гуммиарабик, казеин, агар-агар, полиэтиленгликоль, диглицерин, глицерин, пропиленгликоль, вазелин, парафин, стеариловый спирт, стеариновую кислоту, сывороточный альбумин человека (HSA), маннит, сорбит, лактозу и поверхностно-активные вещества, которые являются приемлемыми в качестве фармацевтических добавок.
В действительности, добавки можно выбирать из указанных выше добавок по отдельности или в сочетании в соответствии с дозированной формой лекарственного средства по настоящему изобретению, но они не ограничиваются добавками, приведенными выше. Например, когда полипептид используют в качестве инъецируемого состава, очищенный полипептид можно растворять в растворителе, таком как физиологический раствор, буфер или раствор глюкозы, а затем в раствор можно добавлять ингибитор адсорбции, такой как Tween 80, Tween 20, желатин или сывороточный альбумин человека. Альтернативно, можно использовать лиофилизированное средство для получения дозированной формы, которую растворяют и разбавляют перед применением. Примеры эксципиента, пригодного для лиофилзации, включают спирты сахаров и сахариды, такие как маннит и глюкоза.
Эффективные дозы полипептида можно надлежащим образом выбирать, в зависимости от типа полипептида, тапа заболевания, подлежащего лечению или профилактике, возраста пациента, тяжести заболевания, и т.д. Например, когда полипептид представляет собой антитело против глипикана, эффективную дозу антитела против глипикана выбирают из диапазона от 0,001 мг до 1000 мг на кг массы тела на введение. Альтернативно можно выбирать дозу 0,01-100000 мг/на организм пациента. Однако эффективная доза не ограничивается этими диапазонами.
Полипептид можно вводить либо перорально, либо парентерально, однако предпочтительным является парентеральное введение. Конкретно, могут быть приведены инъекция (например, системное или местное введение путем внутривенной инъекции, внутримышечная инъекция, внутрибрюшинная инъекция, подкожная инъекция и т.д.), введение через нос, введение через легкие, чрескожное введение и сходные с ними.
В настоящем изобретении в качестве гена, кодирующего ALT, можно использовать ДНК, кодирующую полипептид, имеющий аминокислотную последовательность, как показано в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58 или 60. Альтернативно можно использовать ДНК, кодирующую полипептид, который обладает аминокислотной последовательностью, образованной из аминокислотной последовательности, как показано в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58 или 60, путем замены, делеции, вставки и/или инсерции одного или нескольких аминокислотных остатков и, кроме того, обладает активностью аланинаминотрансферазы.
Полипептид, который обладает аминокислотной последовательностью, образованной из аминокислотной последовательности, как показано в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 4