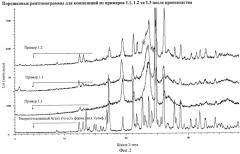
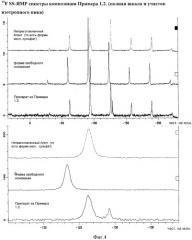
Фармацевтическая композиция 271
Иллюстрации
Показать всеИзобретение относится к фармацевтическим композициям, которые содержат кислую сернокислую соль (2-гидроксиэтокси)амида 6-(4-бром-2-хлорфениламино)-7-фтор-3-метил-3Н-бензоимидазол-5-карбоновой кислоты и сольваты, их кристаллические формы и аморфные формы, к применению указанных композиций в качестве лекарственного средства; и к способам получения указанных композиций. 4 н. и 16 з.п. ф-лы, 7 табл., 7 пр., 5 ил.
Реферат
Данное изобретение относится к фармацевтическим композициям, которые содержат кислую сернокислую соль (2-гидроксиэтокси)амида 6-(4-бром-2-хлорфениламино)-7-фтор-3-метил-3H-бензоимидазол-5-карбоновой кислоты (далее в данной заявке обозначается как "Агент"), в частности к композициям, которые доставляются перорально, содержащим Агент; к применению указанных композиций в качестве лекарственного средства; и к способам получения указанных композиций.
Агент раскрывается в международной патентной заявке WO 2007/076245 и представляет собой мощный ингибитор MEK. Агент представляет собой кислую сернокислую соль соединения со структурой формулы I:
Агент обладает антипролиферативной активностью и, как можно ожидать, будет полезным в лечении заболеваний или медицинских состояний, которые опосредуются полностью или частично MEK, и, в частности, разных видов рака, таких как рак мозга, легких, чешуйчатых клеток, желчного или мочевого пузыря, желудка, поджелудочной железы, молочных желез, головы, шеи, ренального рака, рака почки, яичника, предстательной железы, колоректального рака, рака пищевода, тестикулярного, гинекологического рака, рака щитовидной железы или злокачественной меланомы. Агент может также использоваться в лечении неракового гиперпролиферативного заболевания, такого как доброкачественная гиперплазия кожи (например, псориаз), рестеноз или гипертрофия предстательной железы (например, доброкачественная гипертрофия предстательной железы (ВРН)), и для лечения других опосредованных MEK заболеваний, включая заболевание поджелудочной железы или почек (включая пролиферативный гломерулонефрит и индуцированное диабетом почечное заболевание), или для лечения боли у млекопитающего. Также предполагается, что Агент также будет полезным для предотвращения бластоцитарной имплантации у млекопитающего или для лечения заболевания, связанного с васкулогенезом или ангиогенезом у млекопитающего. Такие заболевания могут включать опухолевый ангиогенез, хроническое воспалительное заболевание, такое как ревматоидный артрит, атеросклероз, воспалительное заболевание кишечника, заболевания кожи, такие как псориаз, экзема, а также склеродерму, диабет, диабетическую ретинопатию, ретролентальну фиброплазию, возрастную дегенерацию желтого пятна, гемангиому, глиому, меланому, саркому Капоши и рак яичника, молочной железы, легкого, поджелудочной железы, предстательной железы, кишечника и эпидермоидный рак.
Форма свободного основания Агента (то есть (2-гидроксиэтокси)амида 6-(4-бром-2-хлорфениламино)-7-фтор-3-метил-3H-бензоимидазол-5-карбоновой кислоты) была классифицирована как соединение класса 4 BCS (в соответствии с Фармацевтической Системой Классификации, как определено в Руководстве для промышленности: Исключение in vivo исследований биодоступности и биоэквивалентности для дозированных твердых пероральных форм немедленного высвобождения на основе Биофармацевтической Системы Классификации), что свидетельствует о том, что она имеет низкую скорость солюбилизации/растворимости и низкую проницаемость. Такие соединения типично демонстрируют низкую и/или изменчивую биодоступность и, кроме того, биодоступность формы свободного основания Агента из традиционной композиции для таблеток является относительно слабой (~18% у собак).
Заявители раньше идентифицировали специфическую форму соли (2-гидроксиэтокси)амида 6-(4-бром-2-хлорфениламино)-7-фтор-3-метил-3H-бензоимидазол-5-карбоновой кислоты, которая демонстрирует уникальные фармацевтические свойства, что делает ее особенно приемлемой для применения в качестве лекарственного средства. Эта специфическая форма соли, в частности кислая сернокислая соль (1:1 лечебное средство: H2SO4) (2-гидроксиэтокси)амида 6-(4-бром-2-хлорфениламино)-7-фтор-3-метил-3H-бензоимидазол-5-карбоновой кислоты (выше и ниже в данной заявке обозначается как "Агент"), была раскрыта в WO 2007/076245. Эта соль является кристаллической и неожиданно была выявлена такой, которая обладает улучшенными фармацевтическими свойствами при сравнении с формой свободного основания Агента и другими солями (2-гидроксиэтокси)амида 6-(4-бром-2-хлорфениламино)-7-фтор-3-метил-3H-бензоимидазол-5-карбоновой кислоты. В частности, скорость растворения этой соли, а также ее биодоступность были выявлены как особенно высокие по сравнению с формой свободного основания Агента и другими солями (2-гидроксиэтокси)амида 6-(4-бром-2-хлорфениламино)-7-фтор-3-метил-3H-бензоимидазол-5-карбоновой кислоты.
Для того чтобы рецептировать фармацевтически активное соединение, такое как Агент, в виде приемлемой дозированной формы, активное соединение должно дополнительно обладать приемлемыми биофармацевтическими свойствами, такими как способность к солюбилизации и свойства растворения, а также, соответственно, обладать приемлемой стабильностью и свойствами, которые делают его приемлемым для обработки. В этой связи особая проблема возникает с Агентом. Форма свободного основания Агента является слабо основным соединением и имеет две основные группы со значениями р К а ' приблизительно 2,7 и 8,2. Значение рКа выражает силу кислоты и основания, то есть тенденцию кислоты терять протон или тенденцию основания принимать протон (Bronsted J.N. Rec. trav. Chim. (47), 718, 1923). Агент (то есть кислая сернокислая соль) является таким, который, в частности, является способным к диссоциации с образованием своей формы свободного основания во время процессов рецептирования и/или хранения. Такое преобразование является нежелательным, поскольку форма свободного основания Агента обладает более низкими фармакологическими свойствами, в частности, в отношении скорости солюбилизации и растворения. Кроме того, необходимо избегать такого преобразования, поскольку можно ожидать, что это может вызвать снижение биодоступности и/или привести к повышению вариабельности концентраций в плазме крови между разными пациентами и у того самого пациента, эти обе причины могут приводить к снижению оптимального уровня лечения пациентов.
Таким образом, существует потребность в фармацевтической композиции, которая содержит Агент (то есть кислую сернокислую соль), в частности в композициях, в которых стабильность Агента поддерживается во время процессов обработки и хранения, для обеспечения приемлемой абсорбции и/или в которых биодоступность Агента достигается во время дозирования.
Согласно первому аспекту данного изобретения обеспечивается фармацевтическая композиция, которая включает Агент и матриксный носитель, где матриксный носитель существенно состоит из одного или более фармацевтически приемлемых носителей, выбранных из следующих:
(a) d-альфа-токоферилполиэтиленгликоль 1000 сукцинат;
(b) полигликозилированные глицериды;
(c) полиэтиленгликоли (ПЭГи); и
(d) твердые жиры;
и где Агент является диспергированным в матриксном носителе.
Мы неожиданно обнаружили, что стабильность Агента может поддерживаться в композициях данного изобретения. Много материалов, которые являются приемлемыми для образования матриксного носителя, являются традиционно известными в области техники, такие как, например, эмульгаторы, солюбилизирующие агенты и энхансеры абсорбции, и используются для улучшения кинетик растворения и биодоступности плохо растворимых лечебных средств. Однако заявители неожиданно обнаружили, что такие наполнители могут также использоваться как инертные матриксные носители для стабилизации Агента в его форме кислой сернокислой соли во время фармацевтической обработки и долгосрочного хранения.
Согласно этому композиции данного изобретения обеспечивают средства стабилизации Агента в виде его кислой сернокислой формы во время обработки композиции и дальнейшего долгосрочного хранения и, как следствие, обеспечивают тот факт, что приемлемая абсорбция и/или биодоступность Агента достигается во время дозирования.
Дополнительное преимущество данного изобретения относится к процессу производства, который используется для получения приемлемых композиций в соответствии с данным изобретением. В то время как большинство традиционных процессов рецептирования, таких как те, что используются для рецептирования форм дозирования в виде таблеток, могут втягивать большое количество продолжительных и сложных этапов, что возможно будет приводить к нестабильности Агента, композиции данного изобретения могут быть получены путем относительно простых и способных к изменениям процессов.
Матриксный носитель
Матриксный носитель включает один или больше фармацевтически приемлемых носителей, упомянутых выше. Матриксный носитель может включать единственный фармацевтически приемлемый носитель, выбранный из групп, определенных выше, или, альтернативно, он может включать смесь. Фармацевтически приемлемый носитель является выбранным из любой одной из следующих групп:
(a) d-альфа-токоферил полиэтиленгликоль 1000 сукцинат;
(b) полигликозилированные глицериды;
(c) полиэтиленгликоли; и
(d) твердые жиры.
D-альфа-токоферил полиэтиленгликоль 1000 сукцинат (который также является известным как витамин Е TPGS) представляет собой водорастворимую производную естественного витамина Е и имеет двойную природу, подобную амфифильности, гидрофильности и липофильности. Витамин Е TPGS получают путем эстерификации кристаллического сукцината d-α-токофериловой кислоты с помощью полиэтиленгликоля (см. Фармакопею США 25 - Национальный Формуляр 20). Витамин Е TPGS является также известным благодаря его применение при фармацевтических назначениях как эмульгатора, солюбилизирующего агента и энхансера абсорбции, при этом WO 96/36316, US 5891845 и WO 00/76482 могут быть приведенные как примеры. См. также "Eastman Vitamin Е TPGS" Eastman Brochure, Eastman Chemical Co., Kingsport, Tenn. (November 2002) для дополнительной информации о применении витамина Е TPGS при таких назначениях.
Полигликозилированные глицериды представляют собой смеси глицеридов жирных кислот и эстеров полиоксиэтилена с жирными кислотами. В этих смесях жирные кислоты являются насыщенными или ненасыщенными, а глицериды является моно-, ди- или триглицеридами или их смесями в любых соотношениях. Примеры приемлемых полигликозилированных глицеридов включают, но не ограничены, каприлокапроил макроголглицериды (например, Лабразол), олеоил макроголглицериды (например, Лабрафил M1944 CS), линолеоил макроголглицериды (например, Лабрафил М2125 CS), лауроил макроголглицериды (например, лауроил макрогол-32 глицериды) и стеароил макроголглицериды, например, Гелуцир 50/13 (см. Pheur 6ое издание, 2008, для дополнительных подробностей относительно этих полигликозилированных глицеридов). В особой группе композиций полигликозилированные глицериды, которые содержатся в матриксном носителе, имеют значение гидрофильно/липофильного баланса (HLB) более 10. В дополнительной особой группе композиций полигликозилированные глицериды, которые содержатся в матриксном носителе, являются способными к диспергированию в воде. В дополнительной особой группе композиций полигликозилированные глицериды представляют собой лауроил макроголглицериды или стеароил макроголглицериды. Еще в одной дополнительной особой группе композиций полигликозилированные глицериды представляют собой лауроил макроголглицериды. Еще в одной дополнительной особой группе композиций полигликозилированные глицериды представляют собой лауроил макрогол-32 глицериды или Гелуцир 50/13. Еще в одной дополнительной особой группе композиций полигликозилированные глицериды представляют собой лауроил макрогол-32 глицериды. Лауроил макрогол-32 глицериды (коммерчески обеспечиваются как Гелуцир 44/14 или Акконон® С-44, ЕР) представляют собой насыщенный полигликозилированный глицерид, который состоит из моно-, ди- или триглицеридов и моно- и ди-жирных кислот полиэтиленгликоля (ПЭГ). Лауроил макрогол-32 глицериды являются полутвердыми/твердыми при комнатной температуре и имеют точку плавления при 44°С, их получают путем реакции гидрогенизировапного масла ядра кокосового ореха с полиэтиленгликолем 1500.
Полиэтиленгликоли USP (ПЭГи), которые альтернативно являются известными как макроголы (см. Pheur 6ое издание 2008), представляют собой гидрофильные полимеры оксиэтилена. ПЭГи, которые имеют средний молекулярный вес более 900 дальтон, в общем случае являются полутвердыми или твердыми при комнатной температуре. Приемлемый интервал среднего молекулярного веса для ПЭГов в данном изобретении составляет от 900 до 35000 дальтон. Приемлемые коммерчески доступные продукты включают, но не ограничены, ПЭГ 900, ПЭГ 1000, ПЭГ 1450, ПЭГ 2000, ПЭГ 6000 и ПЭГ 20000. В особой группе композиций ПЭГ(и), который(ые) присутствует(ют) в матриксном носителе, имеет интервал среднего молекулярного веса от 900 до 25000 дальтон. В дополнительной особой группе композиций этого воплощения этот ПЭГ имеет средний молекулярный вес приблизительно 6000 дальтон. Еще в одной дополнительной группе композиций этого воплощения ПЭГ имеет средний молекулярный вес приблизительно 20000 дальтон.
Твердые жиры представляют собой твердые смеси моноглицеридов, диглицеридов и триглицеридов, которые является практически не растворимыми в воде. Примеры приемлемых твердых жиров включают, но не ограничены, Гелуцир 33/01 (см. USP-NF 'твердый жир'), Гелуцир 39/01 (см. USP-NF и ЕР 'твердый жир') и Гелуцир 43/01 (см. ЕР 3е издание и USP24/NF19 'твердый жир').
В соответствии с одним воплощением изобретения матриксный носитель состоит из одного или более фармацевтически приемлемых носителей, выбранных из следующих:
(a) d-альфа-токоферил полиэтиленгликоль 1000 сукцинат;
(b) полигликозилированные глицериды; и
(c) полиэтиленгликоли (ПЭГи);
где Агент является диспергированным в матриксном носителе.
В дополнительном воплощении изобретения матриксный носитель представляет собой витамин Е TPGS.
Еще в одном дополнительном воплощении изобретения матриксный носитель представляет собой полигликозилированный глицерид. Является приемлемым, когда полигликозилированный глицерид представляет собой лауроил макрогол-32 глицериды или Гелуцир 50/13, в частности лауроил макрогол-32 глицериды.
В дополнительном воплощении изобретения матриксный носитель включает смесь витамина Е TPGS и, по крайней мере, одного полигликозилированного глицерида. Является приемлемым, когда, по крайней мере, один полигликозилированный глицерид, присутствующий в этом воплощении, представляет собой лауроил макрогол-32 глицериды, также является приемлемым, когда лауроил макрогол-32 глицериды являются присутствующими в количестве, которое составляет 1-60% по весу компонента матриксного носителя композиции, и приемлемым образом приблизительно 30-55% и еще более приемлемо приблизительно 50% по весу компонента матриксного носителя композиции. Желательно, когда лауроил макрогол-32 глицериды являются единственным полигликозилированным глицеридом, присутствующим в этом воплощении.
В дополнительном воплощении изобретения матриксный носитель включает смесь витамина Е TPGS и, по крайней мере, одного ПЭГа. Является приемлемым, когда, по крайней мере, один ПЭГ, который присутствует в этом воплощении, имеет средний молекулярный вес от 900 до 25000 дальтон, и является приемлемым, когда ПЭГ является присутствующим в количестве, которое составляет 1-30% по весу компонента матриксного носителя композиции, приемлемым образом приблизительно 5-15% и еще более приемлемо приблизительно 10% по весу компонента матриксного носителя композиции. Желательно, когда только один ПЭГ присутствует в этом воплощении. В особой группе композиций этого воплощения такой ПЭГ имеет средний молекулярный вес 6000 дальтон. Еще в одной дополнительной группе композиций этого воплощения ПЭГ имеет средний молекулярный вес 20000 дальтон. Еще в одной дополнительной группе композиций этого воплощения ПЭГ имеет средний молекулярный вес 1000 дальтон.
При этом является понятным, что термин 'приблизительно', как используется в данной заявке выше для соотношения наполнителей, таких как лауроил макрогол-32 глицериды или ПЭГ, в компоненте матриксного носителя композиции, относится к ±2% по весу компонента матриксного носителя.
Является приемлемым, когда композиция содержит от 40 до 99% по весу, в частности от приблизительно 60 до 95% по весу, в частности от приблизительно 65 до 95% по весу матриксного носителя.
В особой группе композиций данного изобретения композиция содержит приблизительно 90-95% по весу матриксного носителя, и в частности, приблизительно 95% по весу матриксного носителя.
В особой дополнительной группе композиций данного изобретения композиция содержит от приблизительно 85 до 90% по весу матриксного носителя, и в частности, приблизительно 90% по весу матриксного носителя.
Еще в одной дополнительной особой группе композиций данного изобретения композиция содержит от приблизительно 75 до 85% по весу матриксного носителя, и в частности приблизительно 80% по весу матриксного носителя.
Еще в одной дополнительной особой группе композиций данного изобретения композиция содержит от приблизительно 65 до 80% по весу матриксного носителя, и в частности приблизительно 70% по весу матриксного носителя.
При этом является понятным, что срок 'приблизительно', когда касается соотношения матриксного носителя в композиции, относится к ±2% от общего веса композиции. В качестве примера, если говорят, что композиция содержит приблизительно 70% по весу матриксного носителя, то это будет охватывать композиции, которые содержат от 68 до 72% по весу матриксного носителя.
Еще в одной дополнительной особой группе композиций данного изобретения композиция содержит 79-81%, например 79,83%, по весу матриксного носителя.
Агент
Типично Агент будет присутствовать в количестве, которое находится в интервале от 1 до 50%, приемлемым образом от приблизительно 1 до 35% и особенно от приблизительно 5 до 30% по весу композиции. В особой группе композиций Агент будет присутствовать в количестве приблизительно 5% по весу заключительной композиции. В дополнительной особой группе композиций Агент будет присутствовать в количестве приблизительно 10% от веса заключительной композиции. Еще в одной дополнительной особой группе композиций Агент будет присутствовать в количестве приблизительно 20% от веса заключительной композиции. Еще в одной дополнительной особой группе композиций Агент будет присутствовать в количестве приблизительно 30% от веса заключительной композиции. Еще в одной дополнительной особой группе композиций Агент будет присутствовать в количестве 19-21%, например 20,17%, от веса заключительной композиции.
При этом является понятным, что термин 'приблизительно', когда касается соотношения Агента, присутствующего в композиции, относится к ±2% от общего веса композиции.
Является приемлемым, когда единичная доза композиции в соответствии с изобретением может содержать от 0,01 мг до 500 мг Агента. Является приемлемым, когда каждая терапевтическая доза композиции будет содержать достаточное количество Агента для обеспечения суточной дозы Агента в одной или более единицах. Приемлемые количества Агента в единичных дозах в разных воплощениях включают, например, приблизительно 6,05, 12,1, 18,15, 30,25, 60,5, 72,6, 78,65, 84,7, 90,75, 96,8, 102,85, 108,9, 114,95, 121, 151,25, 181,5, 242, 302,5, 363, 423,5, 484 мг или более в зависимости от дозы, которая является необходимой, и от конкретной формы фармацевтической композиции. В отдельном воплощении единичная доза композиции содержит от 1 мг до 150 мг Агента, и в частности от 50 мг до 130 мг Агента, например приблизительно 72,6, 78,65, 84,7, 90,75, 96,8, 102,85, 108,9, 114,95 или 121 мг Агента, и особенно 72,6, 78,65, 84,7, 90,75 или 96,8 мг Агента. Термин 'приблизительно', как используется непосредственно выше в данной заявке, определяется как +/- 2 мг от указанного весового количества. В отдельном воплощении единичная доза композиции содержит 90,75 или 60,5 мг Агента. В отдельном воплощении единичная доза композиции содержит 90,75 мг Агента. В отдельном воплощении единичная доза композиции содержит 60,5 мг Агента.
Агент может использоваться в различных формах, которые все включаются в объем данного изобретения. Такие включают аморфные или кристаллические формы, безводные формы, а также сольваты и гидраты. В особой группе композиций Агент является кристаллическим и находится в безводной форме.
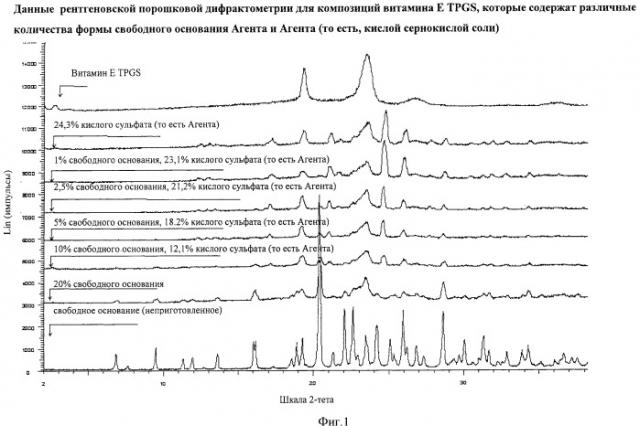
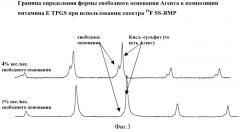
Мы обнаружили, что Агент может быть стабилизирован в приемлемом матриксном носителе данного изобретения. Как используется в данной заявке, термин "стабилизированный" означает, что активный ингредиент ((2-гидроксиэтокси)амид 6-(4-бром-2-хлорфениламино)-7-фтор-3-метил-3H-бензоимидазол-5-карбоновой кислоты), который присутствует в композиции после обработки и/или хранения, присутствует существенно в виде кислой сернокислой соли, то есть, в виде Агента, в отличие от формы свободного основания Агента. Специалист в данной области техники может легко оценить, что указание количества формы свободного основания Агента и количества Агента (то есть, формы кислой сернокислой соли) в композиции может быть получено при использовании методик, таких, как, например, XRPD и 19F ЯМР спектроскопия твердого тела, и может также подвергаться мониторингу путем анализа растворения.
Как используется в данной заявке, термин "диспергированный" описывает двухфазную систему, где одна фаза состоит из Агента, который распределяется во второй фазе, которая включает матриксный носитель, при этом Агент представляет собой диспергированную фазу, а матриксный носитель, который включает эту фазу, является беспрерывной фазой. В особой группе композиций Агент, который образует "диспергированную фазу", находится в форме тонко измельченных частиц, которые являются распределенными во "второй фазе", которая включает матриксный носитель. В особой группе композиций более 60% от веса общего количества Агента, который является присутствующим в композиции, находятся в диспергированном виде. Еще в одной особой группе композиций более 90% и преимущественно более 95% от веса общего количества Агента, который является присутствующим в композиции, находятся в диспергированном виде. Специалист в данной области техники сможет оценить, что указание соотношения лекарственного средства, которое присутствует в форме твердой дисперсии, может быть установлено при использовании методик, таких как дифференциальная сканирующая калориметрия (DSC), термический гравиметрический анализ (TGA), дифференциальная сканирующая калориметрия и 19F спектроскопия ЯМР твердого тела. Квалифицированный специалист в данной области техники сможет оценить, что кристаллическая структура лекарственного средства в композиции может быть определена при использовании методик, таких как, например, дифракция рентгеновских лучей.
В особой группе композиций данного изобретения размер частиц диспергированного Агента может варьировать от приблизительно 1 до 20 микрон. Является желательным, когда диспергированный Агент имеет распределение размера частиц, такое, что 90% частиц имеют диаметр менее чем 15 микрон.
В одном воплощении изобретения Агент является диспергированным в матриксном носителе и не содержит дополнительных растворителей или вспомогательных агентов. Композиции этого воплощения могут быть получены с особенно высокой загрузкой Агента, и это является желательным, поскольку дополнительные компоненты часто имеют недостатки, такие как потенциально повышенный риск токсичности и увеличенный размер дозированной формы. Оба эти недостатка могут осуществлять свой вклад в плохое соблюдение режима приема пациентом и в приемлемость лечения.
Согласно дополнительному аспекту данного изобретения обеспечивается фармацевтическая композиция, которая включает:
(i) Агент; и
(ii) матриксный носитель;
где матриксный носитель имеет любые определения, приведенные выше;
и где Агент является диспергированным в матриксном носителе, а композиция является полутвердой или твердой при комнатной температуре.
Как используется в данной заявке, термин "полутвердый" описывает компонент или композицию, которые имеют жесткость и вязкость, которые являются промежуточными между твердым веществом и жидкостью. Полутвердые вещества не имеют такой текучести, как порошок, и не являются жидкими при комнатной температуре (то есть они имеют точку плавления, которая выше комнатной температуры). Как используется в данной заявке, термин "затвердение" означает образование твердого или полутвердого вещества. Под комнатной температурой понимают значение температуры в интервале от 18 до 23°С.
В соответствии с дополнительным аспектом данного изобретения обеспечивается фармацевтическая композиция, которая включает:
(i) Агент; и
(ii) матриксный носитель, который существенно состоит из витамина Е TPGS;
где Агент является диспергированным в витамине Е TPGS, а композиция является полутвердой или твердой при комнатной температуре.
В соответствии с дополнительным аспектом данного изобретения обеспечивается фармацевтическая композиция, которая включает:
(i) Агент; и
(ii) матриксный носитель, который существенно состоит из полигликозилированного глицерида;
где Агент является диспергированным в полигликозилированном глицериде, а композиция является полутвердой или твердой при комнатной температуре.
В соответствии с дополнительным аспектом данного изобретения обеспечивается фармацевтическая композиция, которая включает:
(i) Агент; и
(ii) матриксный носитель, который существенно состоит из витамина Е TPGS и лауроил макрогол-32 глицеридов;
где Агент является диспергированным в матриксном носителе, а композиция является полутвердой или твердой при комнатной температуре.
В соответствии с дополнительным аспектом данного изобретения обеспечивается фармацевтическая композиция, которая включает:
(i) Агент; и
(ii) матриксный носитель, который существенно состоит из витамина Е TPGS и ПЭГ;
где Агент является диспергированным в матриксном носителе, а композиция является полутвердой или твердой при комнатной температуре.
В отдельном воплощении обеспечивается фармацевтическая композиция, которая включает:
(i) от 15 до 30 (в частности, от 15 до 25) частей Агента; и
(ii) от 70 до 85 (в частности, от 75 до 85) частей матриксного носителя;
где обе части являются весовыми, а сумма частей (i)+(ii)=100, матриксный носитель имеет любое из значений, определенных в данной заявке выше, и Агент является диспергированным в матриксном носителе, а композиция является полутвердой или твердой при комнатной температуре.
В отдельном воплощении обеспечивается фармацевтическая композиция, которая включает:
(i) от 15 до 25 (в частности, от 18 до 22) частей Агента; и
(ii) от 75 до 85 (в частности, от 78 до 82) частей матриксного носителя;
где обе части являются весовыми, а сумма частей (i)+(ii)=100, матриксный носитель имеет любое из значений, определенных в данной заявке выше, и Агент является диспергированным в матриксном носителе, а композиция является полутвердой или твердой при комнатной температуре.
В отдельном воплощении обеспечивается фармацевтическая композиция, которая включает:
(i) от 25 до 40 (в частности, от 25 до 35) частей Агента; и
(ii) от 60 до 75 (в частности, от 65 до 75) частей матриксного носителя;
где обе части являются весовыми, а сумма частей (i)+(ii)=100, матриксный носитель имеет любое из значений, определенных в данной заявке выше, и Агент является диспергированным в матриксном носителе, а композиция является полутвердой или твердой при комнатной температуре.
В отдельном воплощении обеспечивается фармацевтическая композиция, которая включает:
(i) от 25 до 35 (в частности, от 28 до 32) частей Агента; и
(ii) от 65 до 75 (в частности, от 68 до 72) частей матриксного носителя;
где обе части являются весовыми, а сумма частей (i)+(ii)=100, матриксный носитель имеет любое из значений, определенных в данной заявке выше, и Агент является диспергированным в матриксном носителе, а композиция является полутвердой или твердой при комнатной температуре.
В отдельном воплощении обеспечивается фармацевтическая композиция, которая включает:
(i) от 15 до 25 (в частности, от 18 до 22) частей Агента; и
(ii) от 75 до 85 (в частности, от 78 до 82) частей витамина Е TPGS;
где обе части являются весовыми, а сумма частей (i)+(ii)=100;
и где Агент является диспергированным в витамине Е TPGS, а композиция является полутвердой или твердой при комнатной температуре.
В отдельном воплощении обеспечивается фармацевтическая композиция, которая включает:
(i) от 25 до 35 (в частности, от 28 до 32) частей Агента; и
(ii) от 65 до 75 (в частности, от 68 до 72) частей витамина Е TPGS;
где обе части являются весовыми, а сумма частей (i)+(ii)=100;
и где Агент является диспергированным в витамине Е TPGS, а композиция является полутвердой или твердой при комнатной температуре.
В отдельном воплощении обеспечивается фармацевтическая композиция, которая включает:
(i) 19-21, например, 20,17, частей Агента; и
(ii) 79-81, например, 79,83, частей витамина Е TPGS;
где обе части являются весовыми, а сумма частей (i)+(ii)=100;
и где Агент является диспергированным в витамине Е TPGS, а композиция является полутвердой или твердой при комнатной температуре.
В отдельном воплощении обеспечивается фармацевтическая композиция, которая включает:
(i) от 25 до 35 (в частности, от 28 до 32) частей Агента; и
(ii) от 65 до 75 (в частности, от 68 до 72) частей матриксного носителя, который состоит из смеси витамина Е TPGS и, по крайней мере, одного полигликозилированного глицерида;
где обе части являются весовыми, а сумма частей (i)+(ii)=100;
и где Агент является диспергированным в витамине Е TPGS и, по крайней мере, одном полигликозилированном глицериде, а композиция является полутвердой или твердой при комнатной температуре.
Композиция
Необязательно, в композицию в соответствии с данным изобретением могут включаться дополнительные наполнители при условии, что включение таких наполнителей не будет неблагоприятным образом влиять на стабильность формы соли Агента в композиции. В соответствии с этим любой квалифицированный специалист в данной области техники сможет оценить, что в некоторых воплощениях изобретения Агент, который присутствует в композиции в соответствии с изобретением, может быть диспергированным в смеси, которая состоит из матриксного носителя и дополнительных наполнителей, таких как те, что описанные в некоторых конкретных примерах, которые приведены в данной заявке ниже. Дополнительные наполнители, которые могут присутствовать, включают, например, консерванты, стабилизаторы, эмульгаторы, антиоксиданты, подсластители, вкусовые агенты, агенты для доведения значения рН, агенты, которые содействуют диспергированию (например, поверхностно-активные соединения, такие как, например, этоксилированное касторовое масло (Кремофор EL), этоксилированное гидрогенизированное касторовое масло (Кремофор RH40) или полисорбат 80) и модификаторы вязкости. Такие дополнительные наполнители является хорошо известными специалисту в данной области техники и являются описанными, например, в Руководстве по фармацевтическим наполнителям, 4е издание, Американская фармацевтическая ассоциация; Теория и практика промышленной фармацевтики, 3е издания, Lachman и др. 1986; Фармацевтические дозированные формы: Таблетки, том 1, 2е издание, Lieberman, Hebert А., и др., 1989; Современная фармацевтика, Banker, Gilbert и Rhodes, Christopher Т, 3е издания, 1995; и Remington's Pharmaceutical Sciences, 20е издание, 2000.
Является приемлемым, когда композиция в соответствии с данным изобретением находится в форме, адаптированной для перорального введения, например в форме капсульной композиции или жидкой дисперсии, приемлемой для перорального введения. Приемлемые композиции для капсул является хорошо известными и включают, например, твердые, жидкие или полутвердые композиции, которые содержатся в мягких или твердых желатиновых капсулах; капсулы из водорастворимых этеров целлюлозы (например, гипромеллозы) или крахмальные капсулы.
В соответствии с этим дополнительный аспект изобретения представляет собой фармацевтическую композицию, адаптированную для перорального введения, которая включает Агент и матриксный носитель, где матриксный носитель имеет любое значение, как определено в данной заявке выше; и где Агент является диспергированным в матриксном носителе.
Еще один дополнительный аспект изобретения представляет собой фармацевтическую капсульную композицию, которая включает Агент и матриксный носитель, где матриксный носитель имеет любое значение, как определено в данной заявке выше; и где Агент является диспергированным в матриксном носителе.
Композиции в соответствии с данным изобретением могут быть получены при использовании традиционных способов, которые является хорошо известными в области фармацевтики. Например, в одном конкретном воплощении компонент(ы) матриксного носителя нагревают до плавления, а Агент, размер частиц которого может быть снижен, например, путем измельчения или микронизации, постепенно вводят в расплавленную смесь при постоянном встряхивании/перемешивании для обеспечения гомогенного распределения. Расплавленная смесь может потом вноситься в твердые или мягкие капсулы, после чего ее оставляют для охлаждения с образованием вязкой жидкости, твердой или полутвердой массы внутри капсулы. Потом капсулу закрывают при использовании традиционных способов, известных в данной области техники, таких как, например, объединение с помощью кромки.
Альтернативно, композиции в соответствии с данным изобретением могут быть получены с помощью других известных способов, таких, как, например, экструзия расплава или грануляция расплава (см. A. Royce, J, Drug Dev. Ind. Pharm. 22 (1996) 9 IP-924, G. Verreck, Bull. tech. Gattefosse (2004) 85-95 и J. Breitenbach, Eur. J. Pharm. Biopharm. 54 (2002) 107-117 для деталей приемлемых способов производства).
Агент обладает антипролиферативной активностью, и в соответствии с этим композиции данного изобретения являются полезными для лечения состояний, таких как те, что описанные в международной патентной заявке WO 2007/076245, которая раскрывает Агент (то есть кислую сернокислую соль), а также в WO 03/077914, где представлена форма свободного основания Агента. Например, композиция в соответствии с данным изобретением является полезной для лечения многих общих видов рака человека, таких как злокачественная меланома, рак мозга, легких, чешуйчатых клеток, мочевого и желчного пузыря, желудка, поджелудочной железы, молочной железы, рак головы и шеи, ренальный рак, рак почки, яичника, предстательной железы, колоректальний рак, рак пищевода, рак яичка, гинекологический рак и рак щитовидной железы. Дополнительно можно ожидать, что композиции в соответствии с данным изобретением будут полезными для лечения заболеваний, которые втягивают избыточную пролиферацию клеток, таких как доброкачественная гиперплазия кожи, например псориаза, рестеноза или доброкачественной гипертрофии предстательной железы (ВРН). Другие примеры опосредованных MEK заболеваний, которые также могут лечиться при использовании Агента, включают заболевания поджелудочной железы или почек (включая пролиферативный гломерулонефрит и индуцированное диабетом почечное заболевание) или лечение боли у млекопитающего. Кроме того. Агент также может использоваться для предотвращения бластоцитарной имплантации у млекопитающего или для лечения заболевания, связанного с васкулогенезом или ангиогенезом у млекопитающего. Такие заболевания могут включать опухолевый ангиогенез, хроническое воспалительное заболевание, такое как ревматоидный артрит, атеросклероз, воспалительное заболевание кишечника, заболевания кожи, такие как псориаз, экзема, а также склеродерму, диабет, диабетическую ретинопатию, ретролентальну фиброплазию, возрастную дегенерацию желтого пятна, гемангиому, глиому, меланому, саркому Капоши и рак яичника, молочной железы, легких, поджелудочной железы, предстательной железы, кишечника и эпидермоидный рак.
Дополнительный аспект данного изобретения обеспечивает фармацевтическую композицию в соответствии с изобретением, как определено в да