Способ получения микробусин и микробусины
Иллюстрации
Показать всеГруппа изобретений относится к способу получения микробусин и самим микробусинам и может использоваться для биохимических исследований. Указанный способ включает стадию S1 - формирование гидрофильного слоя, выполненного из гидрофильного органического материала на субстрате, стадию S2 - ламинирование на гидрофильном слое тонкой пленки, которая может отслаиваться в виде микробусин, стадию формования S3 тонкой пленки в заданную конфигурацию методом фотолитографии, стадию S6 - образование твердой фазы заданного вещества на сформованных тонких пленках, и стадию отслаивания от субстрата S7 сформованных тонких пленок, которые уже образовали твердую фазу с веществом, по меньшей мере, наряду с частью гидрофильного слоя, чтобы получить микробусины. Группа изобретений обеспечивает высокую аналитическую точность биохимических исследований. 2.н. и 12 з.п. ф-лы, 8 пр., 9 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу получения микробусин, а также к микробусинам. Более конкретно, изобретение относится к способу получения микробусин, на поверхности которых сформирована твердая фаза вещества заданного типа с использованием метода фотолитографии на субстрате, и тому подобного.
Уровень техники
В биохимических испытаниях нуклеиновых кислот, белков и тому подобного до сих пор используются гранулированные носители, названные "микробусины". Например, в испытаниях нуклеиновых кислот применяются микробусины, в которых зондирующая цепь нуклеиновых кислот, имеющая комплементарную последовательность оснований относительно цепи нуклеиновых кислот мишени, образует твердую фазу на их поверхности. Цепь нуклеиновых кислот мишени выделяется на основе взаимодействия между цепью нуклеиновых кислот мишени и зондирующей цепью нуклеиновых кислот. В испытаниях белков, микробусина, на поверхности которой сформирована твердая фаза антитела относительно белка мишени, применяется для того, чтобы изолировать белок мишени подобным образом.
В биохимических испытаниях с использованием этих микробусин в настоящее время требуется повышенная производительность, для достижения которой были разработаны методики реализации высокоскоростных испытаний.
Например, в патентном документе 1 (публикации патента Японии №3468750) описан "Способ детектирования веществ, определяемых при анализе (аналит), среди ряда аналитов в образце, упомянутый первым аналит распознается с помощью соответствующих аналитических реагентов, при этом способ включает этапы: (а) приведение в контакт с образцом, ряда совокупностей флуоресцентных частиц, причем эти совокупности, соответственно, имеют различные флуоресцентные сигналы и различные аналитические реагенты, где аналитический реагент специфически связывается с одним аналитом в образце, и на поверхности каждой флуоресцентной частицы имеется, по меньшей мере, одна наночастица, меченая каждым соответствующим флуоресцентным красителем, (b) добавление меченого реактива к образцу, (с) детектирование метки с целью анализа флуоресцентных частиц, демонстрирующего связывание аналитического реагента с аналитом и (d) одновременное определение совокупностей флуоресцентных частиц, связанных с соответствующими аналитами, по функции различных флуоресцентных сигналов, связанных с соответствующими совокупностями" (смотрите пункт 23 формулы изобретения).
В "Технологии матричной суспензии", разработанной фирмой Luminex Trading, Inc. на основе этого способа, микробусины метят двумя типами флуоресцентных красителей, которые передают изменение цвета излучения, и таким образом, удается различать друг от друга максимум до 100 типов микробусин. Согласно "Технологии матричной суспензии," когда на 100 типах микробусин сформирована твердая фаза с различными зондирующими цепями нуклеиновых кислот и антител, соответственно, становится возможной одновременная изоляция и детектирование 100 различных типов цепей нуклеиновых кислот и белков в ходе одного испытания.
В указанном выше документе изложено, что "совокупности флуоресцентных частиц дополнительно определяются в зависимости от их размеров и форм" (смотрите пункт 25), причем описано, что в качестве дополнительных параметров для различения микробусин, могут быть использованы размер и форма бусин (смотрите абзацы 0037 и т.п. в этом документе). Кроме того, в непатентном документе 1 (Multifunctional encoded particles for high- throughput biomolecule analysis». Science, 2007, Mar. 9; 315(5817): 1393-6. (Многофункциональные кодированные частицы для производительного биомолекулярного анализа)) описан способ получения ряда микробусин различной формы с использованием фотолитографии в потоке. В соответствии с указанным способом, обеспечивается возможность получения более чем одного миллиона типов микробусин.
Краткое раскрытие изобретения
Техническая проблема
Чрезвычайно большое разнообразие микробусин, описанных в патентном документе 1 и непатентном документе 1 и имеющих различные характеристики флуоресценции и формы, соответственно, сформированы в твердой фазе с зондирующей цепью нуклеиновых кислот или антител, отличающихся друг от друга и смешанных для использования в качестве набора бусин. Этот набор бусин и образец, содержащий цепи нуклеиновых кислот мишени, смешивается и промывается, с последующим детектированием соответствующих микробусин и захваченных на их поверхностях цепей нуклеиновых кислот мишени с помощью оптических, или магнитных, или электрических сигналов.
С целью достижения высокой аналитической точности необходимо, чтобы в наборе бусин находилось известное число микробусин. Например, в простейшем случае, когда сопоставляются интенсивности сигналов двух типов микробусин между собой, если число обоих типов микробусин (численность), содержащихся в наборе бусин, не является определенным, то результирующие интенсивности сигналов нельзя сравнивать между собой. В этом случае, для точного сопоставительного анализа интенсивности сигналов желательно, чтобы оба типа микробусин присутствовали в равном количестве, или в случае их неравенства, необходимо, чтобы было известно соотношение числа обоих типов микробусин.
До сих пор численность в наборе бусин регулировалась путем количественного определения соответствующих микробусин после приготовления на основе определения массы и оптической плотности и их смешивания. Однако с помощью этого метода невозможно точно регулировать число соответствующих типов бусин и, таким образом, вызываются изменения численности, что приводит к затруднениям при получении высокой аналитической точности.
Следовательно, главная цель настоящего изобретения заключается в разработке способа получения микробусин, способного обеспечить снабжение набора бусин, содержащих большое разнообразие микробусин, в котором численности соответствующих типов бусин являются определенными.
Техническое решение
С целью решения указанной выше проблемы, в изобретении разработан способ получения микробусин, который включает следующие стадии: формирование гидрофильного слоя, выполненного из гидрофильного органического материала на субстрате, ламинирование на гидрофильном слое тонкой пленки, которая способна отслаиваться в виде микробусин, формование тонкой пленки в заданную форму с помощью фотолитографии, причем вещество заданного типа образует твердую фазу на сформованных тонких пленках, отслаивание сформованных тонких пленок, образовавших твердую фазу с веществом из субстрата, по меньшей мере, наряду с частью гидрофильного слоя, чтобы получить микробусины. Согласно указанному способу получения микробусин, могут быть получены микробусины с произвольной разнообразной морфологией, в произвольном количестве, соответственно, путем конструирования формы фотошаблона, применяемого в фотолитографии.
В этом способе получения микробусин гидрофильный органический материал, растворенный в растворителе, наносится на субстрат и сушится с образованием гидрофильного слоя. Впоследствии, на стадии отслаивания используется растворитель, имеющий заданную температуру, при которой гидрофильный органический материал может быть растворен снова, с целью растворения части гидрофильного слоя, или сформованная тонкая пленка отслаивается, по меньшей мере, наряду с частью гидрофильного слоя с помощью обработки ультразвуком, и таким образом, образуются микробусины. Таким образом, могут быть получены микробусины, которые имеют пространственную конфигурацию, в которой предусмотрены практически параллельные противостоящие грани, и в которой вещество заданного типа образует твердую фазу только на одной из граней, при этом другой грани, по меньшей мере частично, придается гидрофильность.
В этом случае гидрофильный слой образуется из одного или нескольких гидрофильных органических материалов, которые выбирают из поливинилового спирта, крахмала, декстрина, амилозы, желатина, агара, каррагенана, пектина, смолы рожкового дерева и светочувствительных гидрофильных смол.
Способ получения микробусин дополнительно может включать стадию формирования расходуемого слоя на субстрате. В этом случае гидрофильный слой наслаивается на расходуемый слой. На стадии отслаивания расходуемый слой подвергается физической или химической эрозии с целью отслаивания сформованной тонкой пленки наряду с гидрофильным слоем, чтобы получить микробусины. Таким образом, также как в вышеупомянутом случае, могут быть получены микробусины, обладающие пространственной конфигурацией, в которой предусмотрены две практически параллельные противостоящие грани и где вещество заданного типа образует твердую фазу только на одной из граней, при этом другой грани, по меньшей мере, частично придается гидрофильность.
В этом случае гидрофильный слой образуется из одного или нескольких гидрофильных органических материалов, которые выбирают из светочувствительных гидрофильных смол, поливинилового спирта, крахмала, декстрина, амилозы, желатина, агара, каррагенана, пектина и смолы рожкового дерева.
Расходуемый слой может быть сформирован из фторсодержащего органического материала или полиимидного органического материала, или может быть сформирован из гидрофильного органического материала того же типа, что используется для гидрофильного слоя, или из гидрофильного органического материала другого типа.
Когда расходуемый слой формируется с использованием фторсодержащего органического материала, этот расходуемый слой, выполненный из фторсодержащего органического материала, сублимируется или растворяется с использованием фторсодержащего растворителя на стадии отслаивания, таким образом, обеспечивается возможность того, что сформованная тонкая пленка будет отслаиваться от субстрата наряду с гидрофильным слоем, чтобы получить микробусины.
Когда расходуемый слой формируется с использованием полиимидного органического материала, расходуемый слой, выполненный из полиимидного органического материала, растворяется в апротонном растворителе на стадии отслаивания, таким образом, обеспечивается возможность того, что сформованная тонкая пленка будет отслаиваться от субстрата наряду с гидрофильным слоем, чтобы получить микробусины.
Когда расходуемый слой формируется с использованием гидрофильного органического материала того же типа, что используется для гидрофильного слоя, или другого типа гидрофильного органического материала, расходуемый слой, выполненный из гидрофильного органического материала, растворяется в растворителе, нагретом до температуры, при которой гидрофильный органический материал способен растворяться снова, на стадии отслаивания, или проводится обработка ультразвуком таким образом, что обеспечивается возможность того, что сформованная тонкая пленка будет отслаиваться от субстрата наряду с гидрофильным слоем, чтобы получить микробусины.
В этом способе получения микробусин, предпочтительно, стадия формирования твердой фазы должна быть осуществлена путем химического синтеза вещества на тонкой пленке. Более конкретно, что касается вещества, один или несколько биополимеров, выбранных из заданных последовательностей нуклеиновых кислот или пептидов и сахаридных цепочек, образуют твердую фазу. Предпочтительно, области среди сформованных тонких пленок подвергаются водоотталкивающей обработке после стадии формирования, но до стадии формирования твердой фазы. За счет водоотталкивающей обработки можно предотвратить просачивание растворов через поверхность сформованной тонкой пленки и их перемешивание между собой, таким образом, обеспечивается образование твердой фазы веществ желательного типа на соответствующих микробусинах.
В способе получения микробусин тонкая пленка удобно образуется с использованием фоторезиста или диоксида кремния.
В смысле настоящего изобретения "вещество," которое образует твердую фазу на тонкой пленке, то есть на микробусине, в широком смысле, включает те вещества, которые способны взаимодействовать с нуклеиновой кислотой мишени или белком мишени, что представляет собой цель анализа при биохимическом испытании с использованием микробусин. Предпочтительно это вещество является биополимером, выбранным из заданных последовательностей нуклеиновых кислот или пептидов и сахаридных цепочек, и должно включать молекулы, которые способны взаимодействовать с нуклеиновыми кислотами мишени или тому подобное. Когда "биополимер" нацелен на нуклеиновую кислоту, эта нуклеиновая кислота должна быть кислотой, имеющей заданную последовательность оснований. Термин "взаимодействие" означает образование дуплекса между нуклеиновыми кислотами, имеющими комплементарные последовательности оснований. Когда "биополимер" нацелен на пептид, указанный пептид должен быть пептидом с заданной последовательностью аминокислот. В этом случае "взаимодействие" означает, например, связывание белка с белком, такое как связывание между акцепторным белком и лигандным белком или связывание между антигеном и антителом. Кроме того, если биополимер нацелен на сахаридную цепочку, указанная сахаридная цепочка должна быть сахарид-связывающей цепочкой или указанная связывающая цепочка дополнительно связана с липидом или белком и представляет собой олигосахарид, сахарный липид или сахарный белок. Кроме того, указанное "вещество" включает в себя множество соединений в виде небольших молекул. Эти соединения способны связываться с нуклеиновой кислотой мишени или с белком мишени, которые представляют собой цель биохимического анализа и которые способны промотировать или препятствовать функционированию нуклеиновой кислоты или белка и становятся так называемыми "затравочными соединениями" в области поиска лекарственных препаратов. Следует отметить, что используемый здесь термин "нуклеиновая кислота" включает в себя, кроме ДНК и РНК, аналоги нуклеиновых кислот (например, LNA (заблокированная нуклеиновая кислота)), полученная путем модифицирования структур их рибозных фрагментов.
Преимущества изобретения
Согласно изобретению разработан способ получения микробусин, который может обеспечить набор бусин, содержащий разнообразные микробусины, где численности соответствующих микробусин являются определенными.
Краткое описание чертежей
Фигура 1 представляет собой схематичный чертеж, где показаны микробусины и набор бусин, полученный в соответствии со способом получения микробусин изобретения.
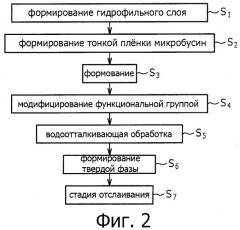
Фигура 2 представляет собой схему последовательности операций, где показаны стадии способа получения микробусин согласно одному варианту осуществления изобретения.
Фигура 3 представляет собой вид в перспективе, где схематично показана конфигурация на субстрате, на стадии формирования пленки S1 до стадии формования S3 и стадии отслаивания S7 способа получения микробусин согласно первому варианту осуществления изобретения.
Фигура 4 представляет собой вид сверху, где схематично показана конфигурация на субстрате, на стадии водоотталкивающей обработки S4 способа получения микробусин согласно первому варианту осуществления изобретения.
Фигура 5 представляет собой вид в перспективе, где схематично показана конфигурация на субстрате, на стадии формирования твердой фазы S6 способа получения микробусин согласно изобретению.
Фигура 6 представляет собой вид в разрезе, где схематично показан субстрат (А) после стадии формирования пленки S1 до стадии формирования твердой фазы S6 и субстрат (В) после стадии отслаивания S7 способа получения микробусин согласно первому варианту осуществления изобретения.
Фигура 7 представляет собой схему последовательности операций, где показаны стадии способа получения микробусин согласно второму варианту осуществления изобретения.
Фигура 8 представляет собой вид в разрезе, где схематично показан субстрат (А) после стадии формирования пленки S0 до стадии формирования твердой фазы S6 и субстрат (В) после стадии отслаивания S7 способа получения микробусин согласно второму варианту осуществления изобретения.
На фигуре 9 показаны структуры олиго-ДНК и олиго-ДНК мишени, образовавших твердую фазу на поверхности микробусин в примерах 1 и 3, где (А) соответствует олиго-ДНК-1, (В) олиго-ДНК-2 и (С) соответствует олиго-ДНК-3.
Способ осуществления изобретения
Предпочтительные варианты осуществления изобретения описаны со ссылкой на чертежи. Следует отметить, что рассмотренные ниже варианты осуществления представляют собой примеры типичных вариантов изобретения, причем область действия примеров не следует истолковывать для ограничения изобретения.
1. Микробусины
(1) Конфигурация и численность
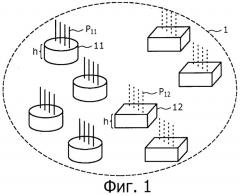
Фигура 1 представляет собой схематичный чертеж, где показаны микробусины и набор бусин, полученный в соответствии со способом получения микробусин согласно изобретению.
На фигуре 1, набор бусин, обозначенный позицией номер 1, выполнен из двух типов микробусин, включающих практически цилиндрические микробусины 11 и практически кубические микробусины 12. Микробусины, полученные в соответствии со способом получения микробусин настоящего изобретения, имеют такую пространственную конфигурацию, в которой предусмотрены две практически параллельные противостоящие грани.
Микробусины 11 и микробусины 12 полностью отличаются по форме и их можно распознавать друг от друга с помощью обычного устройства распознавания изображения на основе различия их конфигурации. Указанный набор бусин 1 включает заданное число микробусин 11 и микробусин 12 (по четыре в каждой группе на фигуре 1).
Набор микробусин, полученный в соответствии со способом получения микробусин настоящего изобретения, отличается тем, что включает множество типов микробусин, различающихся по конфигурации, в заданном количестве, которое точно определено.
Количества (численности) соответствующих типов микробусин, присутствующих в наборе бусин 1, может быть установлено произвольно. Для простоты, на фигуре 1 показаны два типа микробусин, практически цилиндрической и практически кубической формы, по четыре бусины каждого типа. В наборе бусин 1 могут присутствовать три или больше типов микробусин, причем число соответствующих типов микробусин может отличаться друг от друга. Конфигурации соответствующих типов микробусин могут быть выбраны произвольно, при условии, что их можно различить с помощью обычного устройства распознавания изображения. Используемый в изобретении термин "конфигурация", кроме общей конфигурации бусин, включает мелкие детали формы, созданные внутри или на поверхности бусин (обычно так называемый "штрих-код").
(2) Зонд
На поверхности микробусин 11 сформирована твердая фаза биополимера, такого как нуклеиновая кислота или пептид, или сахаридная цепочка, или небольшая молекула (в последующем называется "нуклеиновая кислота или тому подобное"), обозначенная символом Р11 на фигуре 1. Характерно, что эти вещества образуют твердую фазу только на одной из двух практически параллельных противостоящих граней (на фигуре на верхней грани) среди всех граней микробусин 11.
Нуклеиновая кислота или тому подобное Р11 могут быть предусмотрены в виде заданной последовательности оснований или последовательности аминокислот, в зависимости от типа аналитического объекта. Кроме того, нуклеиновая кислота или тому подобное Р11 могут быть предусмотрены в виде сахаридной цепочки или разнообразных соединений. В последующем, главным образом, будет описан случай, когда нуклеиновая кислота или пептид используются в качестве нуклеиновой кислоты или тому подобного P11.
Например, в случае, когда нуклеиновая кислота является аналитическим объектом, цепочка нуклеиновой кислоты, имеющая комплементарную последовательность оснований относительно цепи нуклеиновых кислот мишени, образует твердую фазу в виде нуклеиновой кислоты или тому подобного Р11. Это обеспечивает то, что цепь нуклеиновых кислот мишени в образце будет захвачена и изолирована на микробусинах 11 за счет образования гибрида (дуплекса, двойной спирали) с нуклеиновой кислотой или тому подобным Р11. Можно отметить, что число (длина цепи) оснований в цепочке нуклеиновой кислоты или тому подобном Р11 является произвольным, причем число оснований не имеет значения при условии, что последовательность оснований в цепи нуклеиновых кислот мишени имеет комплементарную последовательность оснований, по меньшей мере, в части цепи, и возможно образование дуплекса. Обычно число оснований в цепочке нуклеиновой кислоты или тому подобном Р11 составляет от нескольких единиц до десятков, предпочтительно от 10 до 30.
Например, в случае, когда белок является аналитическим объектом, пептид (например, частичная последовательность аминокислот лигандного белка), способный взаимодействовать с белком мишени (например, рецепторный белок), образует твердую фазу как нуклеиновая кислота или тому подобное Р11. Это обеспечивает то, что белок мишени в образце будет захвачен и изолирован на микробусине 11 за счет взаимодействия с нуклеиновой кислотой или тому подобным Р11.
С другой стороны, нуклеиновая кислота или тому подобное, обозначенная символом P12 на фигуре 1, образует твердую фазу на поверхности микробусин 12. Нуклеиновая кислота или тому подобное P12 могут быть предусмотрены в виде заданной последовательности оснований или последовательности аминокислот, в зависимости от типа нуклеиновой кислоты или белка, которые являются аналитическим объектом, также как от вида сахаридной цепочки или разнообразных соединений. В микробусинах 12 указанные вещества образуют твердую фазу на одной (верхней грани) из двух граней, которые практически параллельны и находятся напротив друг друга.
Например, когда различные типы веществ, такие как нуклеиновые кислоты или пептиды, имеющие различные последовательности оснований или последовательности аминокислот, предусмотрены в качестве нуклеиновой кислоты или тому подобного Р11, которые образуют твердую фазу на поверхности микробусин 11, и нуклеиновой кислоты или тому подобное P12, которые образуют твердую фазу на поверхности микробусины 12, различные типы нуклеиновых кислот мишени или белков мишени могут быть захвачены и изолированы на соответствующих типах микробусин.
Нуклеиновые кислоты мишени или белки мишени, захваченные и изолированные с микробусинами 11, 12, детектируются с помощью меток флуоресцентных красителей, например, путем оптического детектирования, и одновременно микробусины 11, 12 распознаются с помощью устройства распознавания изображения, таким образом, обеспечиваются два типа нуклеиновых кислот мишеней или белков мишени, которые могут быть проанализированы одновременно.
Например, в случае анализа одиночного нуклеотидного полиморфизма (SNP), последовательность оснований нуклеиновой кислоты или тому подобного Р11 определяется как последовательность оснований, соответствующая одному SNP, a последовательность оснований нуклеиновой кислоты или тому подобного P12 определяется как последовательность оснований, соответствующая другому SNP. Этот набор бусин смешивается с образцом, и сигналы на микробусинах 11 (например, интенсивность сигнала флуоресценции) и сигналы на микробусинах 12 сопоставляются между собой, таким образом, обеспечивается возможность определения соотношения между SNP типов нуклеиновых кислот, содержащихся в образце.
(3) Гидрофильность
Из двух практически параллельных противостоящих граней микробусин 11, 12, грани (нижняя грань на фигуре), на которой ни нуклеиновая кислот или тому подобное Р11, ни P12 не образует твердую фазу, придается гидрофильность, обусловленная "гидрофильным слоем", описанным в дальнейшем.
Обычно микробусины образуются из гидрофобного материала для того, чтобы сохранить свою конфигурацию в используемом водном растворе. Микробусины 11, 12 настоящего изобретения также образуются из тонкой пленки гидрофобного материала с использованием фотолитографии, описанной в дальнейшем.
Однако когда микробусины образуются из гидрофобного материала, поверхность бусин становится гидрофобной, таким образом, возникает проблема взаимной коагуляции микробусин в результате гидрофобного взаимодействия. Указанная взаимная коагуляция микробусин препятствует образованию твердой фазы нуклеиновых кислот или тому подобного Р11, P12. Кроме того, когда микробусины подвергаются анализу, распознавание их конфигураций с помощью устройства распознавания изображения становится невозможной, и эффективный захват и изоляция нуклеиновых кислот мишени или белков мишени практически не может быть осуществлена, поэтому нельзя получить точные результаты анализа.
По этой причине микробусины 11, 12 имеют конфигурацию, в которой придается гидрофильность на одной (нижняя грань на фигуре) из двух практически параллельных противостоящих граней бусин, и таким образом, предотвращается взаимная коагуляция микробусин.
2. Набор бусин
Таким образом, набор бусин 1 составлен из многочисленных типов микробусин, которые имеют различные конфигурации, в которых цепочки нуклеиновых кислот или пептидов, с отличающимися друг от друга последовательностями оснований или последовательностями аминокислот, образуют твердую фазу. Это дает возможность одновременно анализировать множество нуклеиновых кислот или белков мишени, присутствующих в образце.
Как изложено выше, с целью получения высокой точности анализа необходимо, чтобы число соответствующих типов микробусин, содержащихся в наборе бусин, было определенным. Например, в случае указанного выше SNP анализа, если не известна численность микробусин 11, 12 в наборе бусин 1, то невозможно точно определить соотношение между SNP типов нуклеиновых кислот в образце путем сопоставления сигналов, полученных при анализе.
В этой связи, касательно набора бусин 1, когда известны числа многочисленных типов микробусин, имеющих различные конфигурации, количества микробусин 11 и микробусин 12 могут быть тщательно выровнены между собой, таким образом, устанавливается их одинаковое число. Следовательно, сигналы, полученные от обоих микробусин, сопоставляются между собой, и таким образом, может быть получена высокая точность анализа.
3. Способ получения микробусин I (случай гидрофильного слоя, предоставленного в качестве расходуемого слоя)
Теперь, со ссылкой на фигуру 2, будет описан первый вариант осуществления, относящийся к способу получения микробусин и набора бусин. На фигуре 2 приведена схема последовательности операций, демонстрирующая стадии способа получения микробусин согласно первому варианту изобретения.
(1) Стадия формирования пленки гидрофильного слоя
На фигуре 2, "стадия формирования гидрофильного слоя," обозначенная символом S1, представляет собой стадию, на которой "гидрофильный слой" образуется на субстрате таким образом, чтобы придать гидрофильность нижней грани микробусин. В способе получения микробусин согласно этому варианту изобретения гидрофильный слой играет роль так называемого расходуемого слоя, с которого отслаиваются микробусины.
Используемый субстрат включает, например, стеклянный субстрат, силиконовый субстрат или тому подобное. Материал субстрата не имеет значения, и соответственно могут быть использованы те материалы, которые обычно приняты в технологии фотолитографии.
Термин "расходуемый слой," используемый в изобретении, означает слой материала, который способен подвергаться физической или химической эрозии на стадии отслаивания S7, описанной в дальнейшем. Тонкая пленка, способная отслаиваться в виде микробусин, формируется на указанном расходуемом слое в виде верхнего слоя и подвергается эрозии расходуемого слоя на стадии отслаивания для того, чтобы получить микробусины.
Предпочтительно расходуемый слой должен быть слоем, который не подвергается эрозии и повреждению в такой степени, чтобы микробусины на субстрате отслаивались под действием химических реагентов, применяемых на стадиях получения бусин до стадии отслаивания, особенно на стадии образования твердой фазы нуклеиновой кислоты или тому подобного.
Предпочтительно расходуемый слой должен обладать способностью подвергаться эрозии на стадии отслаивания, без денатурирования или выделения нуклеиновой кислоты или тому подобного, образовавшей твердую фазу на микробусине. Если нуклеиновая кислота или тому подобное, образовавшая твердую фазу на микробусине, подвергается денатурированию, повреждению, выделению и тому подобному, нуклеиновая кислота мишени или белок мишени не могут захватываться на бусине. Следовательно, используемый расходуемый слой должен обладать способностью подвергаться эрозии при сохранении согласованности действий с нуклеиновыми кислотами мишени или белками мишени, такими как нуклеиновые кислоты или тому подобное, образовавшие твердую фазу на микробусине.
В способе получения микробусин согласно первому варианту изобретения гидрофильный слой, которому придана гидрофильность на нижней грани микробусины, также играет роль так называемого расходуемого слоя. Этот гидрофильный слой формируется с использованием гидрофильного органического материала. Более конкретно, гидрофильный органический материал, растворенный в растворителе, наносится на субстрат и сушится с образованием гидрофильного слоя. Гидрофильный органический материал может быть нанесен методом центрифугирования, покрытия погружением, трафаретной печати, методом разбрызгивания, струйной печати краской или тому подобным.
Сформированный таким образом гидрофильный слой может быть частично растворен с использованием растворителя, нагретого до температуры, при которой гидрофильный органический материал способен растворяться снова на стадии отслаивания S7, которая будет описана ниже. Поэтому предпочтительно используемый гидрофильный органический материал должен быть материалом, который не растворяется снова, например, приблизительно при комнатной температуре (30°С), но растворяется снова приблизительно при температуре 45°С или выше. Более конкретно, в качестве гидрофильного органического материала, который растворяется снова в горячей или теплой воде, могут быть использованы один или несколько материалов, выбранных из водорастворимых полимеров, таких как поливиниловый спирт, крахмал, декстрин, амилоза и тому подобное. Особенно предпочтительным для использования в качестве расходуемого слоя является поливиниловый спирт, поскольку после того, как он нанесен на субстрат после растворения в нагретом растворителе и высушен, он не растворяется снова, до повторного нагревания.
Кроме того, в качестве гидрофильного органического материала могут быть выбраны желатин (главным компонентом которого является коллаген), агар (главные компоненты которого включают агарозу и агаропектин), карагенан (главные компоненты которого включают галактозу и ангидрогалактозу), пектин (главные компоненты которого включают галактуроновую кислоту и метиловый эфир галактуроновой кислоты), смола рожкового дерева (главным компонентом которой является галактоманнан), светочувствительные гидрофильные смолы и тому подобное.
(2) Стадия формирования тонкой пленки микробусин
На фигуре 2 "стадия формирования тонкой пленки микробусин," обозначенная символом S2, представляет собой стадию формирования тонкой пленки, изготовленной из материала для микробусин, ламинированных на гидрофильном слое, образовавшемся на субстрате.
Формируется тонкая пленка, изготовленная из разнообразных полимеров, диоксида кремния или металла (такого как алюминий, хром, золото, серебро или тому подобное), применяемых в качестве материала микробусин. Образование пленки может быть осуществлено с помощью уже известных приемов, таких как методика покрытия с использованием устройства для нанесения покрытий центрифугированием, или щелевого устройства для нанесения покрытий, или путем выдувания, или осаждения из паровой фазы, такое как физическое осаждение из паровой фазы (PVD) и химическое осаждение из паровой фазы (CVD), хотя это зависит от типа материала для тонкой пленки. Толщина тонкой пленки соответственно устанавливается в зависимости от толщины изготовленных микробусин (смотрите символ h на фигуре 1).
В качестве материала для тонкой пленки предпочтительно используются фоторезисты, в том числе эпоксидные резисты, такие как SU-8, полиимидные резисты, акриловые резисты, новолачные резисты и тому подобное. С использованием полимерной фоторезистивной тонкой пленки, микробусины могут быть изготовлены с меньшими затратами, чем в случае тонкой пленки из диоксида кремния или металлической тонкой пленки, причем получаются микробусины с малым удельным весом. В ходе анализа микробусины смешиваются с образцом и диспергируются в жидкой фазе. На этой стадии, когда удельный вес микробусин является большим, невозможно сохранить диспергированное состояние в жидкой фазе в течение длительного периода.
Среди указанных полимеров предпочтительным является SU-8, который представляет собой химически усиленный негативный фоторезист на основе эпоксида. Полимер SU-8 разработан фирмой IBM (США), для использования в качестве материала для формирования микроструктур в сочетании с методикой формирования резистивной сверхтонкой пленки и методикой фотолитографии.
При использовании SU-8 можно легко регулировать толщину путем формирования пленки методом центрифугирования. SU-8 обладает высокой оптической прозрачностью и обеспечивается хорошей сопротивляемостью к растворению и высокотемпературному действию различных растворителей, кислот и щелочей. Поэтому применение SU-8 позволяет получать микробусины, имеющие различную толщину, простым способом и обеспечивает стабильную работу процесса производства микробусин, а также аналитической процедуры с использованием микробусин.
(3) Стадия формования
"Стадия формования", обозначенная символом S3 на фигуре 2, представляет собой стадию, на которой тонкую пленку, образовавшуюся на стадии формирования пленки S2, формуют в желаемую форму методом фотолитографии. Эту стадию осуществляют с использованием различных методик (3-1) для пленки из резиста, такого как SU-8 и (3-2) для пленки из диоксида кремния или различных металлов в качестве материала для микробусин.
(3-1) Случай применения резиста, такого как SU-8, в качестве материала для микробусин, который подвергают процессу формирования пленки
Тонкая пленка, образовавшаяся на стадии S2 формирования пленки, сначала нагревается, в случае необходимости, и затвердевает (предварительное спекание). Затем используется фотошаблон (в дальнейшем называется просто "маска"), имеющий вычерченную конфигурацию микробусин, и подвергается световой экспозиции. Экспонированный субстрат погружают в жидкий проявитель для того, чтобы удалить ненужные области тонкой пленки, с последующей промывкой жидким промывочным агентом (изопропиловый спирт: ИПС) с целью полного удаления ненужных областей. Затем осуществляют последующее спекание, после которого в тонкой пленке, оставшейся на субстрате, появляется конфигурация микробусин.
Когда конфигурация в маске проектируется в зависимости от конфигурации микробусин, которые будут произведены, микробусины, имеющие произвольную конфигурацию, могут быть сформированы на субстрате. Более того, произвольное конструирование маски обеспечивает микробусины, соответственно имеющие различные конфигурации, которые будут произведены в произвольных количествах. С использованием безмасочного экспонирующего устройства, таким же образом может быть получено произвольное число микробусин, имеющих произвольные конфигурации без изготовления фотошаблона.
(3-2) Случай осуществления формирования пленки с использованием диоксида кремния или разнообразных м