Антиопластические комбинации, содержащие нкi-272 и винорелбин
Иллюстрации
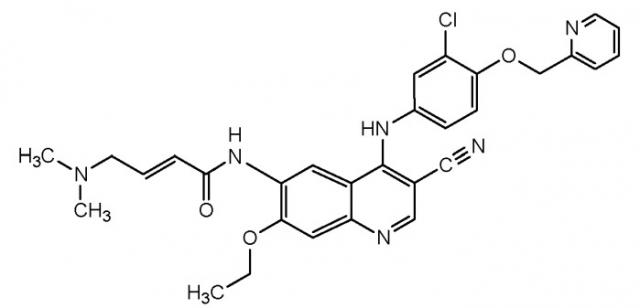
Показать всеГруппа изобретений относится к медицине и предназначена для лечения новообразований. Используют эффективное количество первого соединения, выбранного из (E)-N-{4-[3-хллор-4-(2-пиридинилметокси)анилино]-3-циано-7-этокси-6-хинолинил}-4-(диметиламино)-2-бутенамида, его сложного эфира, простого эфира, карбамата или фармацевтически приемлемой соли, и второго соединения, выбранного из винорелбина или его фармацевтически приемлемой соли. Кроме того, описаны фармацевтическая комбинация и продукт для лечения новообразований. Группа изобретений позволяет замедлить пролиферацию клеток и замедлить прогрессирование заболевания. 3 н. и 20 з.п.ф-лы, 3 пр., 3 табл.
Реферат
Предпосылки изобретения
Рак груди является наиболее часто выявляемым у женщин злокачественным заболеванием, и он представляет собой одну из двух наиболее распространенных причин смертности женщин по всему миру, связанных с раком. Заболеваемость раком груди в мире растет, и, согласно оценкам, это заболевание в следующем десятилетии поразит 5 миллионов женщин. Существующие способы лечения позволяют регулировать симптомы, продлевать срок жизни и поддерживать качество жизни. Однако примерно у 40-50% всех пациентов, которых лечат с целью добиться выздоровления, развиваются неизлечимые метастатические заболевания. Поскольку не существует способов лечения рака груди с метастазами, задачей современной терапии является паллиативное лечение.
При некоторых типах рака наблюдается нарушение передачи сигналов фактора роста, связанное с гиперактивацией рецепторов ErbB. Семейство рецепторов ErbB включает ErbB-1 (известный также как HER-1, рецептор эпидермального фактора роста (EGFR)), ErbB-2 (известный также, как neu или HER-2), HER-3 (известный также, как ErbB-3) и HER-4 (известный также, как ErbB-4). Избыточная экспрессия ErbB-1 наблюдается также при немелкоклеточном раке легких (NSCLC) (40-80%), раке груди (14-91%) и раке поджелудочной железы (30-89%). При NSCLC активация в результате мутации, связанной с амплификацией ERbB-1, также наблюдается у 10-30% пациентов.
Избыточная экспрессия ErbB-2, обычно являющаяся результатом амплификации гена erbB-2, наблюдается в опухолевой ткани у 25-30% пациентов из числа больных раком груди с метастазами (MBC) и связана со злокачественным перерождением. Избыточная экспрессия ErbB-2 обычно соответствует более агрессивному фенотипу опухолей, худшему общему прогнозу и сокращению времени до появления рецидивов на всех стадиях развития ракового заболевания. У женщин с MBC этот вид избыточной экспрессии вызывает относительную невосприимчивость к лечению как антрациклинами/алкилирующими агентами, так и к химиотерапии на основе таксанов. Избыточная экспрессия ErbB-2 при образовании опухолей была исследована главным образом на примере рака груди, но наблюдалась также и при других видах рака.
В число современных средств для лечения раковых заболеваний, а именно, заболеваний, характеризуемых избыточной экспрессией ErbB-2, входят винорелбин, трастузумаб и HKI-272. Винорелбин, т.е. полусинтетический алкалоид барвинка, имеющий широкий спектр противоопухолевой активности, действует за счет разрушения микротрубочек. Винорелбин обладает более благоприятным профилем нейротоксичности, чем винкристин или винбластин. Было показано, что винорелбин в терапевтических концентрациях менее токсичен для микротрубочек аксонов, чем винкристин или винбластин. В исследованиях, проведенных на субъектах с раком груди на поздних стадиях, лечение винорелбином в качестве единственного лекарственного средства является, по крайней мере, столь же эффективным, как и другие виды химиотерапии, но с меньшим риском токсического действия. Однако опасность токсического поражения возрастает вместе с количеством проведенных ранее курсов противораковой терапии.
Трастузумаб (HERCEPTIN® герцептин - наименование лекарственного препарата) является гуманизированным моноклональным антителом, специфичным для внеклеточного домена ErbB-2. Он приносит большую клиническую пользу и обладает значительной противоопухолевой активностью при индивидуальном применении или в сочетании с таксанами при раке груди с метастазами в качестве лечения первой линии или у пациентов, у которых имеет место прогрессирование опухоли после химиотерапии. Благодаря улучшению выживаемости терапия на основе трастузумаба стала стандартом лечения женщин с ErbB-2-положительным MBC. У женщин с раковым заболеванием на поздней стадии или с метастазами, несмотря на лечение трастузумабом, рак груди, в конечном счете, рецидивирует. Кроме того, лечение трастузумабом связано с потенциальной кардиотоксичностью. Некоторые клетки рака груди устойчивы к трастузумабу вследствие наличия вторичных ErbB-2 мутаций, например, укорачивания внеклеточного домена рецептора ErbB-2. Такие мутации могут привести к образованию раковых клеток, которые не распознаются антителом.
В недавних исследованиях трастузумаб в комбинации с винорелбином или таксанами (паклитакселом с карбоплатином или без него, или доцетакселом) применяли для лечения субъектов с MBC, характеризующимся избыточной экспрессией ErbB-2. Как и ожидалось, при применении комбинации трастузумаба и винорелбина наиболее частым результатом их токсического действия являлась нейтропения.
HKI-272 представляет собой малую молекулу, являющуюся необратимым ингибитором рецепторов ErbB нескольких типов, специфичным для рецепторов эпидермального фактора роста ErbB-1 (или EGFR), ErbB-2 (HER-2) и ErbB-4 (HER-4). HKI-272 блокирует киназную активность рецептора за счет связывания с внутриклеточным сайтом связывания рецептора с аденозинтрифосфатом (АТФ). HKI-272 блокирует автофосфорилирование рецептора ErbB в клетках в дозировках, соответствующих ингибированию клеточной пролиферации. In vitro HKI-272 блокирует киназную активность ErbB-1, ErbB-2 и HER-4, ингибирует рост опухолевых клеток, относящихся к линиям опухолевых клеток легких и груди, и является мощным ингибитором роста клеток рака легких, устойчивых к гефитинибу или эрлотинибу. In vivo HKI-272 блокирует рост опухолей у животных моделей с ксенотрансплантатами. В целом, HKI-272 менее эффективен против ErbB-1-зависимых опухолей, по сравнению с ErbB-2-зависимыми опухолями in vivo, несмотря на то, что он имеет одинаковую активность против 2 видов киназ in vitro.
В технике по-прежнему существует потребность в терапевтических способах, схемах лечения, композициях и наборах, которые применимы для лечения рака груди с метастазами и солидных опухолей.
Сущность изобретения
Данное изобретение отвечает на существующую в технике потребность путем разработки схем, композиций и способов, предназначенных для лечения различных видов рака, например, солидных опухолей и рака груди с метастазами, в которых применяются HKI-272 или его аналоги, и винорелбин или его аналоги.
В одном из аспектов изобретения разработаны схемы лечения новообразования у субъекта, которые включают введение винорелбина или его аналога и HKI-272 или его аналога. Желательно, чтобы аналог винорелбина представлял собой винорелбин, и аналог HKI-272 представлял собой HKI-272. В одном из вариантов осуществления упомянутое новообразование является раком груди.
В другом аспекте изобретения разработана схема лечения солидных опухолей, связанных с избыточной экспрессией или амплификацией HER-2 у субъекта, где один цикл указанной схемы включает 21 день. Данная схема предусматривает пероральное введение по меньшей мере одной разовой дозы HKI-272, начиная со дня 1 цикла, и внутривенное введение по меньшей мере одной разовой дозы винорелбина в дни цикла 1 и 8.
В следующем аспекте изобретения разработана схема лечения метастатического рака, связанного с избыточной экспрессией и амплификацией HER-2 у субъекта. Один цикл этой схемы лечения включает 21 день, и схема предусматривает пероральное введение по меньшей мере одной разовой дозы HKI-272, начиная со дня цикла 2, и внутривенное введение по меньшей мере одной разовой дозы винорелбина в дни цикла 1 и 8.
В еще одном аспекте разработан продукт, включающий винорелбин или его аналог и HKI-272 или его аналог в качестве комбинированного препарата, предназначенного для одновременного, раздельного или последовательного применения при лечении новообразований у млекопитающего.
В следующем аспекте разработана упаковка фармацевтического средства для лечения новообразований у одного индивидуума из числа млекопитающих, которая включает (a) по меньшей мере одну разовую дозу винорелбина и (b) по меньшей мере одну разовую дозу HKI-272.
В другом аспекте в изобретении предложена фармацевтическая композиция, которая содержит винорелбин, HKI-272 и по меньшей мере один фармацевтически приемлемый носитель.
В еще одном аспекте изобретения разработан способ лечения новообразования, связанного с избыточной экспрессией или амплификацией HER-2 у млекопитающего, при необходимости такого лечения, который включает введение разовой дозы винорелбина или его аналога и введение разовой дозы HKI-272 или его аналога.
Другие аспекты и преимущества данного изобретения будут очевидны из приведенного ниже подробного описания изобретения.
Описание изобретения
Данное изобретение относится к композициям, способам и терапевтическим схемам, в которых для лечения раковых заболеваний применяется комбинация HKI-272 или его аналога и винорелбина или его аналога. В одном из вариантов осуществления в данном изобретении разработаны композиции, включающие HKI-272 и винорелбин и предназначенные для лечения новообразований. Кроме того, в изобретении разработаны продукты, содержащие HKI-272 и винорелбин и предназначенные для одновременного, раздельного или последовательного применения при лечении новообразований у млекопитающих. Данное изобретение также применимо в качестве адъювантного и/или неоадъювантного лечения начальных стадий рака груди. В другом варианте осуществления изобретение относится к способам комбинированного применения или введения HKI-272 или его аналога и винорелбина или его аналога.
Схема лечения и ее компоненты
Не желая ограничивать себя какой-либо теорией, авторы изобретения предполагают, что комбинация HKI-272 и винорелбина желательна для лечения новообразований, поскольку HKI-272 нацелен на внутриклеточный домен киназы ErbB-2, а не на ее внеклеточный домен. Таким образом, данная комбинация имеет различные механизмы чувствительности и устойчивости, и поэтому обеспечивает преимущество перед терапевтической комбинацией трастузумаба и винорелбина. Далее, ожидается, что комбинация HKI-272 и винорелбина будет более эффективна, чем комбинации винорелбина с другими ингибиторами нескольких рецепторов ErbB, благодаря тому, что HKI-272 ингибирует активность тирозинкиназы за счет необратимого связывания по целевому остатку цистеина в АТФ-связывающем кармане рецептора.
Способы, комбинации и продукты по данному изобретению применимы при лечении ряда новообразований, в особенности, новообразований, связанных с избыточной экспрессией или амплификацией HER-2. В одном из вариантов осуществления новообразование представляет собой солидную опухоль или солидную опухоль на поздней стадии. В другом варианте осуществления новообразование является метастатическим. В следующем варианте осуществления новообразования, которые можно лечить по способу данного изобретения, включают, например, раковые заболевания легких (например, бронхоальвеолярную карциному и немелкоклеточный рак легких), различные виды рака груди (например, рак груди с метастазами и HER-2-положительный рак груди), раковые заболевания простаты, миелому, раковые образования головы и шеи, переходно-клеточную карциному, мелкоклеточную и крупноклеточную нейроэндокринную карциному шейки матки. В еще одном варианте осуществления новообразование невосприимчиво к трастузумабу.
Схемы лечения, способы и композиции, описанные в настоящей заявке, включают совместное, одновременное, последовательное или раздельное введение компонентов, т.е. HKI-272 или его аналога и винорелбина или его аналога. Предполагается, что термин «композиция» в настоящем описании охватывает как фармацевтические композиции, в которых фактически смешаны 2 или несколько компонентов, так и композиции, представляющие собой наборы и упаковки фармацевтических средств, в которых компоненты упакованы индивидуально для совместного, одновременного, последовательного или раздельного введения. В одном из аспектов данного изобретения термин «комбинация» включает одновременное введение HKI-272 или его аналога и винорелбина или его аналога. В другом аспекте данного изобретения термин «комбинация» включает последовательное введение HKI-272 или его аналога и винорелбина или его аналога. В одном из вариантов осуществления HKI-272 или его аналог вводят до винорелбина или его аналога. В другом варианте осуществления винорелбин или его аналог вводят до HKI-272 или его аналога. В другом аспекте термин «комбинация» включает раздельное введение HKI-272 и винорелбина или их аналогов в конкретной схеме лечения, в которой два компонента комбинации вводят в определенные моменты времени в количествах, которые соответствуют друг другу. В одном из вариантов осуществления комбинация HKI-272 и винорелбина или их аналогов обеспечивает более благоприятный терапевтический эффект по сравнению с тем, которого можно было бы добиться при индивидуальном введении HKI-272 или его аналога и индивидуальном введении винорелбина или его налога. Если введение указанных агентов является последовательным или раздельным, отрезок времени перед введением второго компонента не должен быть таким, чтобы были утрачены положительные результаты, обеспечиваемые комбинированной терапией.
В одном из вариантов осуществления комбинация HKI-272 и винорелбина или их аналогов особенно хорошо подходит для лечения рака груди с метастазами. В другом варианте осуществления комбинация HKI-272 и винорелбина или их аналогов хорошо подходит для лечения новообразований груди, почек, мочевого пузыря, рта, гортани, пищевода, желудка, толстой кишки, яичников и легких, а также поликистозной болезни почек.
В настоящем описании, за исключением специально указанных случаев, термины «индивидуум», «субъект» и «пациент» являются взаимозаменяемыми и относятся к любому животному, включая млекопитающих, предпочтительно, мышей, крыс, других грызунов, кроликов, собак, кошек, свиней, крупный рогатый скот, овец, лошадей, приматов, кроме человека, а также людей. Преимущественно термины «индивидуум», «субъект» или «пациент» относятся к людям. В определенных ситуациях эти термины относятся к экспериментальным животным, например, кроликам, крысам и мышам, а также другим животным. В большинстве случаев субъекты или пациенты нуждаются в терапевтической помощи. Соответственно, термины «субъект» или «пациент» в настоящем описании означают пациента или субъекта из числа млекопитающих, которому могут быть введены HKI-272 и винорелбин или их аналоги. В одном из вариантов осуществления для выявления пациентов, которым подходит лечение способами по данному изобретению, применяются общепринятые методики обследования для определения факторов риска, связанных с выявленным или предполагаемым заболеванием или состоянием, или для определения статуса существующего заболевания или состояния у субъекта. Эти методики обследования включают, например, обычные клинические исследования для определения факторов риска, которые связаны с выявленным или предполагаемым заболеванием или состоянием. Эти и другие стандартные методики позволяют врачу выбрать пациентов, которые нуждаются в лечении с применением способов и составов по данному изобретению. В одном из вариантов осуществления «индивидуум», «субъект» или «пациент» до того мог не подвергаться химиотерапии. В другом варианте осуществления «индивидуум», «субъект» или «пациент» мог ранее проходить курс химиотерапии. В другом варианте осуществления «индивидууму», «субъекту» или «пациенту» ранее могли вводиться ингибиторы класса анилинохиназолинов. В еще одном варианте осуществления «индивидууму», «субъекту» или «пациенту» ранее могли вводиться такие ингибиторы класса анилинохиназолинов, как лапатиниб или гефтиниб. Желательно, чтобы количество форменных элементов крови пациента перед началом лечения комбинациями по данному изобретению было стабильно достаточным для того, чтобы дать возможность вводить комбинации, описанные в настоящей заявке. В одном из вариантов осуществления содержание нейтрофилов в крови пациента до введения винорелбина и HKI-272 или их аналогов составляет не менее 1500. В другом варианте осуществления содержание тромбоцитов в крови пациента до введения винорелбина и HKI-272 или их аналогов составляет не менее 100000/л.
В настоящем описании термин «HKI-272 или его аналог» в одном из вариантов осуществления относится к соединению, имеющему следующую основную структуру:
или его производному, или фармацевтически приемлемой соли. Подходящие производные могут включать, например, сложные эфиры, простые эфиры или карбаматы. Представленная выше основная структура, в частности, отображает такой «аналог HKI-272», как собственно HKI-272, который имеет химическое наименование (E)-N-{4-[3-хлор-4-(2-пиридинилметокси)анилино]-3-циано-7-этокси-6-хинолинил}-4-(диметиламино)-2-бутенамид. В одном из вариантов осуществления аналогом HKI-272, применимым в композициях и способах, описанных в настоящей заявке, является собственно HKI-272.
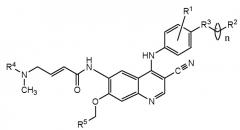
В другом варианте осуществления аналог HKI-272 имеет структуру:
где:
заместитель R1 является галогеном;
заместитель R2 представляет собой пиридинил, тиофенил, пиримидинил, тиазолил или фенил, причем R2 необязательно замещен заместителями в количестве до трех;
фрагмент R3 представляет собой O или S;
заместитель R4 представляет собой CH3 или CH2CH2OCH3;
заместитель R5 представляет собой CH3 или CH2CH3 и
n означает 0 или 1.
Термин «галоген» относится в настоящей заявке к атомам Cl, Br,I и F.
Указанные аналоги HKI-272, одним из которых является собственно HKI-272, характеризуются способностью действовать в качестве эффективных ингибиторов HER-2. См., например, патенты США №№ 6288082 и 6297258 и заявку на патент США № 2007/0104721, которые включены в настоящую заявку посредством ссылки. Эти соединения и способы их получения подробно раскрыты в опубликованной заявке на патент США № 2005/0059678, которая включена в настоящую заявку посредством ссылки. Для удобства во всем тексте настоящей заявки используется термин «HKI-272 или его аналог». Однако любое соединение, имеющее приведенную выше структуру (структуры), может быть заменено на HKI-272 в комбинациях, которые подробно описаны ниже.
HKI-272, аналоги HKI-2, способы их получения и составы на их основе уже были описаны. См., например, опубликованную заявку на патент США № 2005/0059678 и патент США № 6002008, которые включены в настоящую заявку посредством ссылки. Способы, описанные в этих документах, могут применяться также для получения замещенных производных 3-хинолина, применяемых в настоящей заявке, и сами документы включены в настоящее описание посредством ссылки. Помимо способов, описанных в указанных документах, в международных патентных публикациях №№ WO-96/33978 и WO-96/33980, включенных в настоящую заявку посредством ссылки, описаны способы, которые применимы для получения этих аналогов HKI-272. Хотя эти способы подходят для получения некоторых хиназолинов, они применимы также для получения 3-цианохинолинов с соответствующими заместителями и включены в настоящую заявку посредством ссылки.
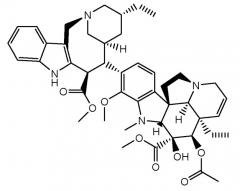
В настоящем описании термин «винорелбин или его аналог» означает винорелбин или его фармацевтически приемлемые соли, которые обладают широким спектром противоопухолевой активности и действуют за счет разрушения микротрубок. См. Widakowich et al., Anticancer Agents Med.Chem., 8(5):488-496 (June 2008) и Wissner et al., Arch. Pharm. (Weinheim), (May 20, 2008 e-publication). Этот термин включает нейтральный винорелбин, т.е. 4-(ацетокси)-6,7-дидегидро-15-((2R,6R,8S)-4-этил-1,3,6,7,8,9-гексагидро-8-(метоксикарбонил)-2,6-метано-2H-азецино(3,4-b)индол-8-ил)-3-гидрокси-16-метокси-1-метил, метиловый эфир (2β,3β,4β,5α,12R,19α)-аспидоспермидин-3-карбоновой кислоты (винорелбин; торговое наименование: Навельбин). Винорелбин и его фармацевтически приемлемые соли можно приобрести у коммерческих поставщиков, в т.ч. Adventrx/SD Pharmaceutical (лекарственный препарат SDP-012®), Hana (лекарственный препарат ALOSERT®) и Inex Pharmaceutical Corp. (лекарственный препарат INX-0125TM), а также другие аналоги винорелбина, включая описанные в патенте США № 7235564, который включен в настоящую заявку посредством ссылки. В одном из вариантов осуществления аналог винорелбина включает соединение, обладающее структурным сходством с приведенной ниже структурой аналога винорелбина, например, соединения с аналогичной алкалоидной структурой, которые были модифицированы для улучшения терапевтического эффекта.
Получение винорелбина и его аналогов описано Langlois et al., в J. Am. Chem. Soc 98:7017-7024 (1976); и Mangeney et al., в Tetrahedron, 35:2175-2179 (1979).
HKI-272, винорелбин и их аналоги, а также соответствующие фармацевтически приемлемые соли или сложные эфиры этих соединений включают изомеры, индивидуально или в виде смесей, как, например, смеси энантиомеров, диастереомеров и изомеров положения.
Термин «фармацевтически приемлемые соли и сложные эфиры» относится к солям и сложным эфирам, которые являются фармацевтически приемлемыми и обладают желаемыми фармакологическими свойствами. Такие соли включают, например, соли, которые могут образоваться в случае, если присутствующие в соединениях кислотные протоны могут взаимодействовать с неорганическими или органическими основаниями. Подходящие неорганические соли включают, например, соли, образованные щелочными металлами или щелочноземельными металлами, например, натрием и калием, магнием, кальцием и алюминием. Подходящие органические соли включают, например, соли, образованные органическими основаниями, например, аминами, такими как этаноламин, диэтаноламин, триэтаноламин, трометамин, N-метилглюкамин и т.п. Фармацевтически приемлемые соли могут также включать кислотно-аддитивные соли, образующиеся при взаимодействии основных фрагментов, например, аминогрупп исходного соединения, с неорганическими кислотами (например, хлористоводородной и бромистоводородной кислотами) и органическими кислотами (например, уксусной кислотой, лимонной кислотой, малеиновой кислотой, а также алкан- и арен-сульфоновыми кислотами, например, метансульфоновой кислотой и бензолсульфоновой кислотой).
Фармацевтически приемлемые сложные эфиры включают эфиры, образованные карбокси, сульфонилокси и фосфонокси группами, присутствующими в соединениях по данному изобретению, например, С1-6 алкиловые эфиры. Если в соединении присутствуют две кислотные группы, фармацевтически приемлемая соль или эфир может быть моносолью, или эфиром монокислоты, или дисолью, или диэфиром; и аналогично, если в соединении имеется более двух кислотных групп, некоторые или все из этих групп могут образовывать соли или сложные эфиры. Соединения, применяемые в данном изобретении, могут иметь форму свободного соединения (т.е. не образовывать соль или сложный эфир) или иметь форму соли и/или сложного эфира, и предполагается, что наименование такого соединения включает как оригинальное соединение (т.е. не являющееся ни солью, ни сложным эфиром), так и его фармацевтически приемлемые соли и сложные эфиры. Кроме того, одно или несколько соединений, применяемых в данном изобретении, могут иметь более одной стереоизомерной формы и предполагается, что упоминание этих соединений включает все индивидуальные стереоизомеры и все смеси (рацемические или другие) этих стереоизомеров.
Фармацевтически приемлемые соли HKI-272, винорелбина и их аналогов с кислотными фрагментами могут быть образованы органическими и неорганическими основаниями, включая, например, соли щелочных металлов или щелочноземельных металлов, например, натрия, калия, лития, кальция или магния или соли органических оснований и N-тетраалкиламмония, как, например, соли N-тетрабутиламмония.
Аналогично, если одно или несколько соединений, применяемых в данном изобретении, содержат основной фрагмент, могут образовываться соли с органическими и неорганическими кислотами. Например, соли могут быть образованы такими кислотами, как уксусная, пропионовая, молочная, лимонная, винная, янтарная, фумаровая, малеиновая, малоновая, миндальная, яблочная, фталевая, хлористоводородная, бромистоводородная, фосфорная, азотная, серная, метансульфоновая, нафталинсульфоновая, бензолсульфоновая, толуолсульфоновая, камфорсульфоновая и аналогичными известными подходящими кислотами, если соединение по данному изобретению содержит основную функциональную группу. Другие подходящие примеры фармацевтически приемлемых солей включают, не ограничиваясь перечисленными, сульфат, цитрат, ацетат, оксалат, хлорид, бромид, йодид, нитрат, бисульфат, фосфат, кислый фосфат, изоникотинат, лактат, салицилат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкуронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат, памоат (т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)); и соли жирных кислот, такие как, капроат, лаурат, миристат, пальмитат, стеарат, олеат, линолеат и линоленат. В одном из вариантов осуществления аналог винорелбина представляет собой тартрат винорелбина.
Соединения по данному изобретению можно также применять в форме сложных эфиров, карбаматов и других общеизвестных эфирных формах, также именуемых в настоящей заявке пролекарственными формами, которые, при введении в таких формах, превращаются в активные частицы in vivo. Типовые сложноэфирные формы соединений по данному изобретению включают, не ограничиваясь указанными, сложные эфиры с линейной алкильной цепью, включающей от 1 до 6 атомов углерода, или разветвленными алкильными группами, включающими от 1 до 6 атомов углерода, в т.ч. метиловые, этиловые, пропиловые, бутиловые, 2-метилпропиловые и 1,1-диметиловые сложные эфиры, циклоалкиловые сложные эфиры, алкилариловые сложные эфиры, бензиловые сложные эфиры и т.п.
Соответственно, в изобретении разработаны фармацевтические композиции, которые содержат эффективные количества HKI-272 и винорелбина или их аналогов в комбинации или ассоциации с одним или несколькими фармацевтически приемлемыми носителями. Подходящие примеры фармацевтически приемлемых носителей, применяемых в данном изобретении, включают, не ограничиваясь указанными, носители, разбавители, наполнители, дезинтегрирующие средства, смазывающие средства и другие агенты, которые могут применяться в качестве носителя. Термин «фармацевтически приемлемый наполнитель» означает наполнитель, который можно применять при получении фармацевтической композиции, который является в целом безопасным, нетоксичным и целесообразным, и этот термин охватывает наполнители, которые подходят для ветеринарного применения, а также с целью изготовления фармацевтических препаратов для лечения людей. Эти наполнители могут быть твердыми, жидкими, полутвердыми или, в случае аэрозольных композиций, газообразными. Фармацевтические композиции получают согласно приемлемым фармацевтическим методикам, например, описанным в Remingtons Pharmaceutical Sciences, 17th edition, ed. Alfonso R.Gennaro, Macck Publishing Company, Easton, Pa. (1985). Фармацевтически приемлемыми носителями являются такие носители, которые совместимы с другими ингредиентами состава и приемлемы с биологической точки зрения. Подходящие фармацевтически приемлемые наполнители или носители для составов таблеток или каплет включают, например, инертные наполнители, в т.ч. лактозу, карбонат натрия, фосфат кальция или карбонат кальция, гранулированные и диспергированные вещества, такие как кукурузный крахмал или альгиновая кислота; связующие агенты, например, желатин или крахмал; смазывающие агенты, такие как стеарат магния, стеариновая кислота или тальк; консервирующие агенты, такие как этил или пропил 4-гидроксибензоат и антиоксиданты, такие как аскорбиновая кислота. Таблетки или каплеты могут иметь или не иметь покрытия, причем покрытие служит для модификации их разрушения и последующей абсорбции действующего ингредиента в желудочно-кишечном тракте или для улучшения их устойчивости и/или внешнего вида, и для получения указанных покрытий применяются стандартные покрывающие агенты и методики, хорошо известные в технике. В одном из вариантов осуществления масса таблетки составляет не менее примерно 20, 30, 40, 50, 60 или 70 мг.
Необязательные компоненты схем лечения
Описанные в настоящей заявке схемы лечения могут также включать введение других агентов. В одном из вариантов осуществления схема лечения дополнительно включает введение таксана, например, доцетаксела или паклитаксела [например, суспензии паклитаксела, связанного наночастицами альбумина, который можно приобрести под торговым наименованием ABRAXANE®]. Паклитаксел можно также вводить по недельному расписанию в дозировках 60-100 мг/м2, при продолжительности введения равной 1 часу, один раз в неделю или 2-3 раза в неделю с последующим недельным перерывом. В одном из вариантов осуществления паклитаксел вводят внутривенно в течение 3 часов в дозировке 175 мг/м2, необязательно с последующим введением цисплатина в дозировке 75 мг/м2; или паклитаксел вводят внутривенно в течение 24 часов в дозировке 135 мг/м2, необязательно с последующим введением цисплатина в дозировке 75 мг/м2. В случае пациентов, подвергавшихся ранее лечению от рака, паклитаксел можно вводить в нескольких дозировках по различным расписаниям. Однако оптимальная схема введения до сих пор не ясна. Рекомендованной схемой лечения является внутривенное введение паклитаксела в дозировке 135 мг/м2 или 175 мг/м2 в течение 3 часов каждые три недели. Эти дозировки можно чередовать при необходимости или по желанию.
В другом варианте осуществления в комбинацию с HKI-272 или его аналогом и винорелбином или его аналогом могут быть включены другие действующие ингредиенты, в число которых входят, например, химиотерапевтические агенты, такие как алкилирующие агенты или ингибиторы mTOR (рапамицин и его производные); гормональные средства (т.е. эстрамустин, тамоксифен, торемифен, анастрозол или летрозол); антибиотики (т.е. пликамицин, блеомицин, митоксантрон, идарубицин, дактиномицин, митомицин или даунорубицин); другие антимитотические агенты (т.е. винбластин, винкристин, тенипозид); ингибиторы топоизомеразы (т.е. топотекан, иринотекан, этопозид или доксорубицин, например, продукты CAELYXTM или DOXIL®, т.е. ПЭГилированный липосомальный доксорубицина гидрохлорид); а также другие агенты (т.е. гидроксимочевина, алтретамин, ритуксимаб, паклитаксел, доцетаксел, L-аспарагиназа или гемтузумаб озогамицин); биохимические модулирующие агенты, иматиб, ингибиторы EGFR, такие как EKB-569 или другие мультикиназные ингибиторы, например, нацеленные на серин/треонин киназу и рецепторную тирозин киназу, как в опухолевых клетках, так и в сосудистой системе опухоли, или иммуномодуляторы (т.е. интерфероны, IL-2 или BCG). Примеры подходящих интерферонов включают интерферон α, интерферон β, интерферон γ и их смеси.
Желательно, чтобы комбинация HKI-272 или его аналога и винорелбина или его аналога могла быть дополнительно скомбинирована с антинеопластическими алкилирующими агентами, например, описанными в опубликованной заявке на патент США № 2002-0198137, которая включена в настоящее описание посредством ссылки. Антинеопластические алкилирующие агенты, в зависимости от их структуры или реакционноспособного фрагмента, приблизительно классифицируют на несколько категорий, в число которых входят азотистые иприты, например, препарат MUSTARGEN® (меклоретамин), циклофосфамид, ифосфамид, мелфалан и хлорамбуцил; азидины и эпоксиды, такие как тиотепа, митомицин C, диангидрогалактитол и дибромдульцитол; алкилсульфинаты, например бусульфан; нитрозомочевины, такие как бисхлорэтилнитрозомочевина (BCNU), циклогексилхлорэтилнитрозомочевина (CCNU) и метилциклогексилхлорэтилнитрозомочевина (MeCCNU); производные гидразина и триазина, такие как прокарбазин, дакарбазин и темозоломид; стрептазоин, мелфалан, хлорамбуцил, кармустин, метклоретамин, ломустин, а также соединения платины. Соединения платины являются агентами, содержащими платину, которые вступают в реакцию преимущественно по положению № 7 гуаниновых и адениновых остатков с образованием ряда монофункциональных и бифункциональных аддуктов (Johnson S W, Stevenson J P, O'Dwyer P J. Cisplatin and its Analogues. в Cancer Principles & Practice of Oncology 6th Edition. ed. DeVita V T, Hellman S, Rosenberg S A. Lippincott Williams & Wilkins. Philadelphia 2001. p.378). В число этих соединений входят цисплатин, карбоплатин, соединения платины IV и многоядерные комплексы платины. Типовые примеры алкилирующих агентов включают меклоретамин (для инъекций; препарат MUSTARGEN®), циклофосфамид (для инъекций; циклофосфамид, лиофилизованный препарат CYTOXAN® или препарат NEOSAR®; пероральные таблетки циклофосфамид или препарат CYTOXAN®), ифосфамид (для инъекций; IFEX), мелфалан (для инъекций, препарат ALKERAN®; и пероральные таблетки препарат ALKERAN®), хлорамбуцил (пероральные таблетки, препарат LEUKERAN®), тиотепа (для инъекций, тиотепа или препарат THIOPLEX®), митомицин (для инъекций, митомицин или препарат MUTAMYCIN®), бусульфан (для инъекций препарат BUSULFEX®; пероральные таблетки препарат MYLERAN®), ломустин (пероральные капсулы; CEENU), кармустин (внутричерепной имплантат, GLIADEL; для инъекций BICNU), прокарбазин (пероральные капсулы, препарат MATULANE®), темозоломид (пероральные капсулы, препарат TEMODAR®), цисплатин (для инъекций, цисплатин, препарат PLATINOL® или PLATINOL®-AQ), карбоплатин (для инъекций препарат PARAPLATIN®) и оксалиплатин (препарат ELOXATIN®).
В другом варианте осуществления описанная в настоящей заявке комбинация может дополнительно включать антинеопластический антиметаболит, описанный в опубликованных заявках на патент США №№ 2005/0187184 или 2002/0183239, которые включены в настоящую заявку посредством ссылки. В настоящей заявке термин «антиметаболит» означает вещество, которое обладает структурным подобием с важным природным интермедиатом (метаболитом) в биохимическом пути, ведущем к синтезу ДНК или РНК и используемым организмом хозяина в этом пути, но действует в направлении ингибирования завершения этого пути (т.е. синтеза ДНК или РНК). Более конкретно, антиметаболиты в основном действуют за счет (1) конкуренции с метаболитами за каталитический или регуляторный сайт ключевого фермента, участвующего в синтезе ДНК или РНК, или (2) замещения метаболита, который обычно включается в ДНК или РНК и, тем самым, выработки ДНК или РНК, которые не могут поддерживать репликацию. Основные категории антиметаболитов включают (1) аналоги фолиевой кислоты, которые являются ингибиторами дигидрофолат редуктазы (DHFR); (2) аналоги пурина, которые имитируют природные пурины (аденин или гуанин), но отличаются от них по структуре, так что они конкурентно или необратимо ингибируют процессинг ДНК или РНК в ядре; и (3) аналоги пиримидина, которые служат имитацией природных пиримидинов (цитозина, тимидина и урацила), но отличаются от них по структуре, и, в результате, конкурентно или необратимо ингибируют процессинг ДНК или РНК в ядре. Типовые примеры антиметаболитов включают, не ограничиваясь перечисленными, 5-фторурацил (5-FU; 5-фтор-2,4-(1H,3H) пиримидиндион; крем для местного нанесения, препараты FLUOROPLEX® или EFUDEX®; раствор для местного нанесения препараты FLUOROPLEX® или EFUDEX®; для инъекций препарат ADRUCIL® или фторурацил), флоксурадин (2'-деокси-5-фторуридин; для инъекций, FUDR или флоксурадин), тиогуанин (2-амино-1,7-дигидро-6H-пурин-6-тион, пероральные таблетки, тиогуанин), цитарабин (4-амино-1-(β)-D-арабинофуранозил-2(1H)-пиримидинон; липосомальный препарат для инъекций DEPOCYT; жидкий препарат для инъекций цитарабин или CYTOSAR-U®), флударабин (9H-пурин-6-амино-2-фтор-9-(5-O-фосфоно-(β)-D-арабинофуранозил; жидкий препарат для инъекций FLUDARA), 6-меркаптопурин (1,7-дигидро-6H-пурин-6-тион; пероральные таблетки PURINETHOL), метотрексат (MTX; N-[4-[[(2,4-диамино-6-птеридинил)метил]метиламино]бензоил]-L-глутаминовая кислота; жидкий препарат для инъекций метотрексат натрия или FOLEX; пероральные таблетки метотрексат натрия), гемцитабин (2'-деокси-2',2'-дифторцитидиа моногидрохлорид ((β)-изомер); жидкий препарат для инъекций GEMZAR), капецитабин (5'-деокси-5-фтор-N-[(пентилокси)карбонил]цитидин; пероральные таблетки XELODA), пентостатин ((R)-3-(2-деокси-(бета)-D-эритропентофуранозил)-3,6,7,8-тетрагидроимидазо[4,5-d][1,3]диазепин-8-ол; жидкий препарат для инъекций, NIPENT), триметрексат (2,4-диамино-5-метил-6-[(3,4,5-триметоксианилино)метил]хиназолина моно-D-глюкуронат; жидкий препарат для инъекций NEUTREXIN), кладрибин (2-хлор-6-амино-9-(2-деокси-(β)-D-эритропентофуранозил)пурин; жидкий препарат для инъекций LEU