Азольные соединения
Иллюстрации
Показать всеИзобретение относится к соединениям, которые представляют собой пиридин-3-ил 4-(3-фенил-1H-1,2,4-триазол-5-ил)пиперидин-1-карбоксилат, 6-метилпиридин-3-ил 4-[3-(4-фторфенил)-1H-1,2,4-триазол-5-ил]пиперидин-1-карбоксилат, 6-метилпиридин-3-ил 4-[5-(4-фторфенил)-1,3-оксазол-2-ил]пиперидин-1-карбоксилат, 2,6-диметилпиридин-3-ил 4-[5-(3,4-дифторфенил)-1,2,4-оксадиазол-3-ил]пиперидин-1-карбоксилат, 2-метилпиридин-3-ил 4-[3-(2-фторфенил)-1H-1,2,4-триазол-5-ил]пиперидин-1-карбоксилат, 6-метилпиридин-3-ил 4-(3-фенил-1H-пиразол-1-ил)пиперидин-1-карбоксилат, 2-метилпиридин-3-ил 4-[5-(3-фторфенил)-1,3-оксазол-2-ил]пиперидин-1-карбоксилат и 6-метилпиридин-3-ил 4-[4-(4-фторфенил)-1,3-оксазол-2-ил]пиперидин-1-карбоксилат или к их фармацевтически приемлемой соли. Изобретение также относится к фармацевтической композиции, обладающей ингибирующей активностью в отношении гидролазы амидов жирных кислот (FAAH), на основе указанных соединений. Технический результат: получены новые соединения и фармацевтическая композиция на их основе, которые могут найти применение в медицине для лечения нейропатической боли. 5 н. и 8 з.п. ф-лы, 38 табл., 159 пр.
Реферат
Область техники
Изобретение относится к азольному соединению, которое можно применять в качестве активного ингредиента фармацевтической композиции, в частности, фармацевтической композиции для лечения нейропатической боли.
Предшествующий уровень техники
Известно, что гидролаза амидов жирных кислот (FAAH) гидролизует эндоканнабиноид для его инактивации (непатентный документ 1). «Эндоканнабиноид» является родовым термином для обозначения биомолекул, которые действуют на каннабиноидные рецепторы для проявления их физиологической активности. В качестве типичных эндоканнабиноидов известны анандамид, пальмитоилэтаноламид, олеамид и 2-арахидоноилглицерин. Кроме того, известно, что дельта-9-тетрагидроканнабинол, который считается активным ингредиентом гашиша (марихуаны), инактивирует каннабиноидный рецептор (непатентный документ 2).
У млекопитающих до настоящего времени было известно наличие двух типов каннабиноидных рецепторов - CB1 и CB2. CB1 экспрессирован в центральной и периферической нервной системе, и при активации он проявляет психологическое действие, анальгетическое действие или тому подобные. CB2 экспрессирован в иммунной системе и при активации он проявляет противовоспалительное действие, анальгетическое (противовоспалительное) действие или тому подобные.
Известно, что нестероидные противовоспалительные лекарственные средства и наркотические анальгетические лекарственные средства, такие как морфин и тому подобные, которые представляют собой обычные анальгетики, слабо эффективны для лечения нейропатической боли. В области медицины для облегчения боли применяются антиэпилептические лекарственные средства, такие как прегабалин и тому подобные, и антидепрессантные лекарственные средства, такие как дулоксетин и тому подобные, применяются для облегчения боли, но их анальгетические эффекты недостаточны, и имеются проблемы с центральными побочными эффектами, такими как сонливость, головокружение и тому подобные.
Агонист каннабиноидных рецепторов проявляет эффективность у пациентов с нейропатической болью, но его применение в значительной степени ограничено вследствие его психологического действия (непатентный документ 3).
С другой стороны, когда ингибитор FAAH вводится животному, то он проявляет анальгетический эффект против нейропатической боли и воспалительной боли, но побочные эффекты, отмечаемые, когда агонист каннабиноидных рецепторов вводится животному, такие как седативное действие, сниженная температура тела, каталепсия и тому подобные, не наблюдаются (непатентные документы 4 и 5), и, таким образом, ожидается, что ингибитор FAAH будет превосходным фармацевтическим средством для лечения боли, в частности, фармацевтическим средством для лечения нейропатической боли.
В качестве соединений, обладающих ингибирующей активностью в отношении FAAH, известны соединения, которые способны действовать в качестве анальгетического лекарственного средства, анксиолитического лекарственного средства, антиэпилептического лекарственного средства, противорвотного средства, средства для лечения сердечнососудистых заболеваний или средства против глаукомы.
Например, в патентом документе 1 описано соединение, представленное следующей формулой (А) в качестве соединения, обладающего ингибирующей активностью в отношении FAAH.
Формула 1
(В формуле В представляет разнообразные кольцевые группы, которые могут быть замещены, и тому подобные, а A представляет фенил, который может быть замещен, фенилалкил, который может быть замещен, дибензофуранил, дибензотиенил, нафтоил, индолил, флуоренил или карбазолил. Детали можно найти в данной публикации).
Кроме того, в патентном документе 2 описано соединение, представленное следующей формулой (B) в качестве соединения, обладающего ингибирующей активностью в отношении FAAH.
Формула 2
(В формуле R представляет разнообразные кольцевые группы, которые могут быть замещены, или тому подобные, а X и Q являются одинаковыми или отличаются друг от друга и представляют соответственно O и S. Кроме того, R1 и R2 могут комбинироваться с атомом N, с которым они могут быть соединены для образования замещенного или незамещенного кольца. Детали можно найти в данной публикации).
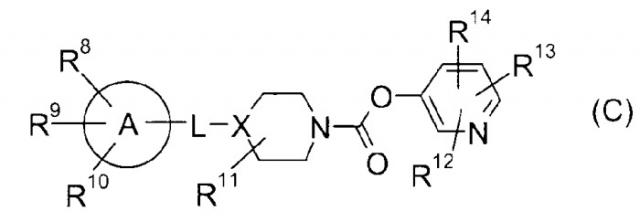
Кроме того, в патентном документе 3 описано соединение, представленное следующей формулой (C) в качестве соединения, обладающего ингибирующей активностью в отношении FAAH.
Формула 3
(Детали можно найти в данной публикации).
Все соединения, раскрытые в этом документе, имеют структуры, отличающиеся от соединения формулы (I) по настоящему изобретению.
Кроме того, в патентных документах 4 и 5 раскрывается соединение мочевины, представленное следующей формулой (D), в качестве ингибитора FAAH.
Формула 4
(В этой формуле Z представляет O или S, а R2 представляет пиперидин-1,4-диил или пиперазин-1,4-диил, каждый из которых может быть замещенным. Детали можно найти в указанных публикациях).
Список документов
Патентные документы
[Патентный документ 1] Описание Международной заявки № WO2003/065989
[Патентный документ 2] Описание Международной заявки № WO2004/033422
[Патентный документ 3] Описание Международной заявки № WO2006/088075
[Патентный документ 4] Описание Международной заявки № WO2006/054652
[Патентный документ 5] Описание Международной заявки № WO2007/020888
Не патентные документы
[Не патентный документ 1] "Annual review o f biochemistry", (USA), 2005, Vol. 74, p. 411-432
[Не патентный документ 2] "Current Medicinal Chemistry", (USA), 1999, Vol. 6, p. 635-664
[Не патентный документ 3] "Expert opinion on p harmacotherapy", (UK), 2006, Vol. 7, p. 607-615
[Не патентный документ 4] "British Journal of Ph armacology", (UK), 2007, Vol. 152, p. 624-32
[Не патентный документ 5] "Nature Medicine", (UK), 2003, Vol. 9, p. 76-81
Краткое описание сущности изобретения
Проблема, которую предстоит разрешить изобретением
Предоставляется соединение, которое может применяться в качестве активного ингредиента фармацевтической композиции, в частности, фармацевтической композиции для лечения боли, причем при использовании указанного соединения отсутствуют или снижаются опасения, связанные с побочными эффектами и зависимостью, подобными тем, которые наблюдаются при применении гашиша.
Средства для решения проблемы
Заявители провели обширные исследования соединений, обладающих ингибирующей активностью в отношении FAAH, и, в результате, обнаружили, что соединение формулы (I) проявляет превосходную ингибирующую активность в отношении FAAH, посредством чего и было создано настоящее изобретение.
То есть настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли и к фармацевтической композиции, содержащей соединение формулы (I) или его фармацевтически приемлемую соль, и фармацевтически приемлемый эксципиент.
Формула 5
где
кольцо A представляет азольное кольцо,
R является одинаковым или отличается друг от друга и представляет H или низший алкил,
X является одинаковым или отличается друг от друга и представляет H, галоген или галоген-низший алкил,
n и m являются одинаковыми или отличаются друг от друга и представляют 1 или 2.
Кроме того, настоящее изобретение относится к фармацевтической композиции для лечения нейропатической боли, содержащей соединение формулы (I) или его фармацевтически приемлемую соль, то есть средство для лечения нейропатической боли, содержащее соединение формулы (I) или его фармацевтически приемлемую соль.
Кроме того, настоящее изобретение относится к применению соединения формулы (I) или его фармацевтически приемлемой соли для получения фармацевтической композиции для лечения нейропатической боли, и к способу для лечения нейропатической боли, включающему введение пациенту эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли.
Эффекты изобретения
Соединение формулы (I), или его фармацевтически приемлемая соль, обладает ингибирующей активностью в отношении FAAH и может применяться в качестве средства для предотвращения и/или лечения заболеваний, связанных с FAAH, в частности, нейропатической боли.
Наилучший вариант осуществления изобретения
Далее настоящее изобретение будет описано в деталях.
«Низший алкил» представляет собой линейный или разветвленный алкил, имеющий 1-6 атомов углерода (который далее просто обозначен в виде C1-6), например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-гексильную группу или тому подобные. В другом варианте осуществления он представляет собой метил или этил, и в еще одном варианте осуществления - метил.
«Азольное кольцо», среди моноциклических, конъюгированных, ненасыщенных 5-членных колец, означает кольцо, имеющее 2-4 гетероатома, выбранных из O, S и N, в качестве атомов, составляющих кольцо, в котором по меньшей мере один из гетероатомов представляет N. В соответствии с расположением гетероатомов в кольце, его примеры включают 1,2-азол, 1,3-азол, 1,2,4-азол, 1,2,3,4-азол и тому подобные; примеры 1,2-азола включают пиразол, изоксазол и изотиазол; примеры 1,3-азола включают имидазол, оксазол и тиазол; примеры 1,2,4-азола включают 1,2,4-триазол, 1,2,4-оксадиазол и 1,2,4-оксатиазол; и примеры 1,2,3,4-азола включают тетразол и тому подобные соединения. Когда «азольное кольцо» представляет собой двухвалентную кольцевую группу, то она представляет собой двухвалентную группу, образованную удалением атомом водорода в любом положении.
«Галоген» означает F, Cl, Br или I.
«Галоген-низший алкил» означает линейный или разветвленный алкил, имеющий 1-6 атомов углерода (C1-6алкил), замещенный 1-5 атомами галогена.
«Нейропатическая боль» означает боль, вызванную дисфункцией периферической или центральной нервной системы, и ее примеры включают диабетическую нейропатическую боль, постгерпетическую боль, нейропатию, вызванную ВИЧ, нейропатию, вызванную противораковыми средствами, боль после повреждения спинного мозга или боль, сопровождающую рассеянный склероз, и тому подобные. Основные клинические симптомы нейропатической боли включают сжимающую боль, жгучую боль, гиперальгезию, аллодинию и тому подобные.
Ниже будут представлены варианты осуществления соединения формулы (I).
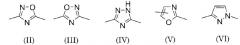
(1) Соединение, в котором кольцо А представляет 1,2-азол, 1,3-азол 1,2,4-азол или 1,3,4-азол; в другом варианте осуществления кольцо А представляет 1,2,4-оксадиазол, 1,2,4-триазол, 1,3-оксазол или пиразол, или в еще одном варианте осуществления кольцо А представляет собой одно из колец, представленных следующими формулами (II)-(VI):
Формулы 6
В другом варианте осуществления кольцо А представляет собой одно из колец, представленных формулами (IV)-(VI). В еще одном варианте осуществления соединение содержит кольцо А, которое представляет собой кольцо, представленное формулой (IV). В еще одном варианте осуществления соединение содержит кольцо А, которое представляет собой кольцо, представленное формулой (V). В еще одном варианте осуществления соединение содержит кольцо А, которое представляет собой кольцо, представленное формулой (VI).
(2) Соединение, в котором Rm представляет H, 2-метил, 6-метил или 2,6-диметил, а в другом варианте осуществления Rm представляет H, 2-метил или 6-метил.
(3) Соединение, в котором Xn представляет H, 2-фтор-, 3-фтор-, 4-фтор- или 3,4-дифтор-.
(4) Соединение, которое представляет комбинацию двух или более из групп, как описано выше в пунктах (1)-(3).
Примеры определенных соединений, охватываемых настоящим изобретением, включают соединения, представленные в пунктах (5) или (6) ниже, или их фармацевтически приемлемые соли:
(5) пиридин-3-ил 4-[3-(4-фторфенил)-1,2,4-оксадиазол-5-ил]пиперидин-1-карбоксилат,
пиридин-3-ил 4-(3-фенил-1H-1,2,4-триазол-5-ил)пиперидин-1-карбоксилат,
6-метилпиридин-3-ил 4-[3-(4-фторфенил)-1H-1,2,4-триазол-5-ил]пиперидин-1-карбоксилат,
6-метилпиридин-3-ил 4-[5-(4-фторфенил)-1,3-оксазол-2-ил]пиперидин-1-карбоксилат,
2-метилпиридин-3-ил 4-[5-(4-фторфенил)-1,3-оксазол-2-ил]пиперидин-1-карбоксилат,
2,6-диметилпиридин-3-ил 4-[5-(3,4-дифторфенил)-1,2,4-оксадиазол-3-ил]пиперидин-1-карбоксилат,
2-метилпиридин-3-ил 4-[3-(2-фторфенил)-1H-1,2,4-триазол-5-ил]пиперидин-1-карбоксилат,
6-метилпиридин-3-ил 4-(3-фенил-1H-пиразол-1-ил)пиперидин-1-карбоксилат,
2-метилпиридин-3-ил 4-[5-(3-фторфенил)-1,3-оксазол-2-ил]пиперидин-1-карбоксилат, и
6-метилпиридин-3-ил 4-[4-(4-фторфенил)-1,3-оксазол-2-ил]пиперидин-1-карбоксилат.
(6) пиридин-3-ил 4-(3-фенил-1H-1,2,4-триазол-5-ил)пиперидин-1-карбоксилат,
6-метилпиридин-3-ил 4-[3-(4-фторфенил)-1H-1,2,4-триазол-5-ил]пиперидин-1-карбоксилат,
6-метилпиридин-3-ил 4-[5-(4-фторфенил)-1,3-оксазол-2-ил]пиперидин-1-карбоксилат,
2,6-диметилпиридин-3-ил 4-[5-(3,4-дифторфенил)-1,2,4-оксадиазол-3-ил]пиперидин-1-карбоксилат,
2-метилпиридин-3-ил 4-[3-(2-фторфенил)-1H-1,2,4-триазол-5-ил]пиперидин-1-карбоксилат,
6-метилпиридин-3-ил 4-(3-фенил-1H-пиразол-1-ил)пиперидин-1-карбоксилат,
2-метилпиридин-3-ил 4-[5-(3-фторфенил)-1,3-оксазол-2-ил]пиперидин-1-карбоксилат и
6-метилпиридин-3-ил 4-[4-(4-фторфенил)-1,3-оксазол-2-ил]пиперидин-1-карбоксилат.
В некоторых случаях, в зависимости от вида заместителей, соединение формулы (I) может иметь таутомеры или геометрические изомеры. В настоящем описании соединение формулы (I) будет описано только в одной форме изомеров, тем не менее настоящее изобретение включает другие изомеры, изолированные формы изомеров или их смесь.
Кроме того, в некоторых случаях, соединение формулы (I) может иметь асимметричный(е) атом(ы) углерода или ось асимметрии, и, соответственно, оно может существовать в форме оптических изомеров. Настоящее изобретение включает и изолированную форму этих оптических изомеров соединения формулы (I), и их смесь.
Кроме того, фармацевтически приемлемые пролекарства соединения, представленного формулой (I), также включены в настоящее изобретение. Фармацевтически приемлемое пролекарство относится к соединению, имеющему группу, которая может быть превращена в аминогруппу, гидроксильную группу, карбоксильную группу или тому подобные, путем сольволиза или в физиологических условиях. Примеры групп для образования пролекарства включают группы, описанные в публикации Prog. Med., 5, 2157-2161 (1985) or "Iyakuhin no Kaihatsu (Pharmaceutical Research and DevE1opment)" (Hirokawa Publishing Company, 1990), vol. 7, Bunshi Sekkei (Drug Design), 163-198.
Кроме того, соединение формулы (I) может образовывать кислотно-аддитивную соль или соль с основанием, в зависимости от вида замещения, и эти соли включены в настоящее изобретение, пока они представляют собой фармацевтически приемлемые соли. В частности, их примеры включают кислотно-аддитивные соли с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная, иодистоводородная, серная, азотная, фосфорная и другими, и с органическими кислотами, такими как муравьиная, уксусная, пропионовая, щавелевая, малоновая, сукциновая, фумаровая, алеиновая, молочная, яблочная, миндальная, винная, дибензолвинная, дитолилвинная, лимонная, метансульфокислота, этансульфокислота, бензолсульфокислота, п-толуолсульфокислота, аспартановая, глутаминовая и другие, солями калия, магния, кальция, алюминия и тому подобными, или слои с органическими основаниями, такие как метиламин, этиламин, этаноламин, лизин, орнитин и тому подобные, соли с различными аминокислотами и производными аминокислот, такие как ацетиллейцин и тому подобные, соли аммония и другие.
Кроме того, настоящее изобретение также включает различные гидраты или сольваты и любые из кристаллических полиморфов соединения формулы (I) и их фармацевтически приемлемые соли. Настоящее изобретение также включает соединения, меченные различными радиоактивными или нерадиоактивными изотопами.
Способы получения
Соединения формулы (I) и их фармацевтически приемлемые соли могут быть получены применением различных известных способов синтеза с использованием характеристик, основанных на их основных скелетах или видах заместителей. В то же время, в зависимости от типа функциональных групп, с точки зрения методик получения, в некоторых случаях эффективно замещение функциональных групп соответствующей защитной группой (группой, которая способна легко превращаться в функциональную группу), на стадии получения исходного материала или промежуточного соединения. Примеры защитной группы включают защитные группы, описанные в руководстве “Protective Groups in Organic Synthesis (4th edition, 2007)”, написанном Greene и Wuts, и тому подобные, которые могут быть соответствующим образом выбраны и использованы, в зависимости от условий реакции. В этих способах желательное соединение может быть получено введением защитной группы для поведения реакции, а затем, при желании, удалением защитной группы.
Кроме того, пролекарства соединения формулы (I) могут быть получены введением определенной группы на стадии получения исходного материала или промежуточного соединения таким же образом, как для указанных выше защитных групп, или проведением реакции с использованием полученного соединения формулы (I). Реакция может проводиться путем применения способа, известного специалисту в данной области, такого как обычная этерификация, амидирование, дегидратация и тому подобные.
Ниже будут описаны репрезентативные способы получения соединения формулы (I). Каждый из способов получения может также проводиться с обращением к ссылкам, прилагаемым к объяснению. Кроме того, способы получения по настоящему изобретению не ограничиваются приведенными ниже примерами.
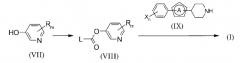
Способ получения 1
Схема 7
(В схеме L представляет уходящую группу).
Соединение формулы (I) может быть получено превращением соединения (VII) в производное сложного эфира карбоновой кислоты (VIII), которое затем взаимодействует с аминным соединением (IX).
Приведенные в настоящем описании примеры уходящих групп включают Cl, имидазолил, фенокси и 4-нитрофенокси группу.
Первая стадия проводится взаимодействием соединения (VII) с эквивалентным количеством или избытком карбонилирующего реагента в присутствии основания в условиях от охлаждения до нагревания, предпочтительно, при температуре от -20°С до 80°С в инертном растворителе, обычно в течение примерно от 0,1 часа до суток. На следующей стадии, без обработки реакционной смеси, полученной на первой стадии, эквивалентное количество или избыточное количество аминного соединения (IX) добавляется к реакционной смеси, и смесь подвергается реакции в условиях от охлаждения до нагревания, предпочтительно, при температуре от -20°С до 80°С в инертном растворителе, обычно в течение примерно от 0,1 часа до суток. Растворитель, используемый при этой реакции, конкретно не ограничивается, но его примеры включают галоидированные углеводороды, такие как дихлорметан (DCM), 1,2-дихлорэтан (DCE), хлороформ и тому подобные, ароматические углеводороды, такие как бензол, толуол, ксилол и тому подобные, простые эфиры, такие как простой диэтиловый эфир, тетрагидрофуран (THF), диоксан, диметоксиэтан (DME) и тому подобные, N,N-диметилформамид (DMF), диметилсульфоксид (DMSO), этилацетат, ацетонитрил или их смесь. Примеры карбонилирующего реагента включают дифосген, трифосген, 1,1'-карбонилдиимидазол (CDI), 4-нитрофенил хлорформиат, фенил хлорформиат и тому подобные. Когда производное сложного эфира карбоновой кислоты (VIII), которое представляет собой промежуточное соединение, устойчиво, то оно может быть сначала выделено, а затем подвергнуто следующей реакции. Далее, для реакции, используемой в этом способе получения, можно сослаться на следующую публикацию: “Organic Functional Group Preparations”, написанную S.R. Sandler и W. Karo, 2nd Edition< Viol. 2, Academic Press Inc., 1991.
Способ получения 2
Схема 8
(В схеме одна из Y1 и Y2 представляет, например, группу, выбранную из -CO2H, -CONH2, -CONH-NH2, -N3, -OH и тому подобных, и, таким образом, другая представляет группу, выбранную из -C(=N-OH)-NH2, -C(=O)NH-NH2, -C(=O)-CH2-Br, этинильной группы и тому подобных. То же относится к описанному ниже).
Настоящий способ получения представляет собой способ, в котором соединение (X) взаимодействует с соединением (XI) с получением кольца А, посредством этого получая соединение формулы (I). Соединение формулы (I) может быть получено выбором подходящего вида Y1 и Y2 в соответствии с желательным кольцом А с использованием способа синтеза азольного кольца. Например, когда осуществляется получение соединения формулы (I), в котором кольцо А представляет собой 1,2,4-оксадиазол-3,5-диил, то могут использоваться соединение (X) и соединение (XI), в которых Y1 представляет -CO2H, а Y2 представляет -C(=N-OH)-NH2. Далее, когда кольцо А представляет собой 1,3,4-оксадиазол-2,5-диил, то в качестве Y1 и Y2 могут использоваться соответственно -CO2H и -C(=N-OH)-NH2. Далее, когда кольцо А представляет собой 1,2,3-триазол-1,4-диил, то в качестве Y1 и Y2 могут использоваться соответственно -N3 и этинильная группа. Далее, когда кольцо А представляет собой 1,3-оксазол-2,4-диил, то в качестве Y1 и Y2 могут использоваться соответственно -CONH-NH2 и -C(=O)-CH2-Br. Далее, когда кольцо А представляет собой тетразол-2,5-диил, то в качестве Y1 и Y2 могут использоваться соответственно тетразол-3-ил и -OH. Кроме того, ссылку на различные способы синтеза азольного кольца можно найти в следующей публикации: @Yetrocyclic Compounds, New Edition, Applications, написанной Hiroshi Yamanaka, Tohru Hino, Masako Nakagawa Takao Sakamoto, опубликованной Kodansha Ltd., Scientific, 2004.
Способ получения 3
Схема 9
(В схеме L2 представляет двухвалентную связывающую цепь, имеющую 1-2 атома, релевантных длине цепи, и представляет собой, например, -HN-NH-, -CH2-NH- или метилен. То же относится к описанному ниже).
Настоящий способ получения представляет собой способ, в котором кольцо А синтезируется внутримолекулярной замыкающей кольцо реакцией соединения (XII) и, таким образом, получается соединение формулы (I). Например, соединение формулы (I), в котором кольцо А представляет собой пиразол-3,5-диил, может быть получено взаимодействием соединения (XII), в котором L2 представляет метилен, в присутствии гидразина моногидрата. Далее, соединение формулы (I), в котором кольцо А представляет собой 1,3,4-оксадиазол-2,5-диил, может быть получено взаимодействием соединения (XII), в котором L2 представляет собой -HN-NH-, в основных условиях с использованием тозилхлорида. Далее, соединение формулы (I), в котором кольцо А представляет собой 1,3-оксазол-2,5-диил, может быть получено взаимодействием соединения (XII), в котором L2 представляет собой -CH2-NH- в присутствии фосфорного оксихлорида. В этой связи, для различных способов синтеза азольного кольца, можно сослаться на следующую публикацию: Heterocyclic Compounds, New Edition, Appplicastions, написанную Hiroshi Yamanaka, Torhu Hino, Masako Nakagawa и Takao Sakammoto, опубликованную Kodansha, Ltd., Scientific, 2004.
Способы синтеза исходного материала
Способ 1 получения исходного материала
(Схема 10)
(В схеме P представляет защитную группу аминогруппы. И она представляет собой, например, трет-бутоксикарбонильную группу. То же относится к описанному ниже).
Аминное соединение (IX) может быть получено взаимодействием соединения (XI) с соединением (XIII) для образования кольца A и удалением защитной группы аминогруппы. В качестве Y1 и Y2 может использоваться такая же группа, как в описанном выше способе получения 2 в соответствии с видом целевого кольца A.
Способ 2 получения исходного материала
(Схема 11)
Соединение (X) может быть получено удалением защитной группы аминогруппы соединения (XIII), которое затем взаимодействует с описанным выше соединением (VIII). Реакция может проводиться таким же образом, как в описанном выше способе получения 1.
Способ 3 получения исходного материала
(Схема 12)
Соединение (XII) может быть получено взаимодействием соединения (XIV) с соединением (XV). В качестве Y3 подходящий заместитель выбирается в соответствии с видом L2 соединения (XII). Например, когда L2 соединения (XII) представляет собой метилен, то метил может использоваться в качестве Y3; когда L2 представляет -HN-NH-, то -HN-NH2 может использоваться в качестве Y3; и когда L2 представляет -CH2-NH-, то -CH2-NH2 может использоваться в качестве Y3.
Соединение формулы (I) может быть выделено и очищено в виде его свободного соединения, фармацевтически приемлемой соли, гидрата, сольвата или кристаллического полиморфного соединения. Фармацевтически приемлемая соль соединения формулы (I) может быть получена посредством обычной реакции образования соли.
Выделение и очистка могут проводиться использованием общих химических операций, таких как экстракция, фракционная кристаллизация, различные типы фракционной хроматографии и тому подобные.
Различные изомеры могут отделяться выбором соответствующего исходного соединения или использованием разности физико-химических свойств между изомерами. Например, оптические изомеры могут быть превращены в каждый стереохимически чистый изомер посредством общих способов оптического разрешения (например, фракционной кристаллизацией, превращающей соединение в диастереомерные соли с оптически активными основаниями или кислотами, хроматографией с использованием хиральной колонки или тому подобными способами). Далее, они могут также быть получены из соответствующего оптически активного исходного соединения.
Фармакологическая активность соединения по настоящему изобретению была подтверждена следующими тестами.
Пример тестирования 1
Скрининг для выявления вещества, ингибирующего активность FAAH с использованием клеток, полученных из раковой опухоли мочевого пузыря человека:
(1) Скрининг для выявления вещества, ингибирующего активность FAAH:
Полученные из раковой опухоли мочевого пузыря человека клетки клеточной линии 5637 (HTB-9; ATCC) высевали на 48-луночный культуральный планшет в количестве 1×105 клеток/лунку с использованием среды RPMII640 (Invitrogen), содержащей 10% фетальной телячьей сыворотки (HyClone). После культивирования при 37°С в течение 12 часов или дольше клетки промывали 400 мкг/лунку буфером (сбалансированный солевой раствор Хэнка, 20 мМ Hepes-NaOH (pH 7,4). Тестируемое вещество, растворенное в DMSO (диметилсульфоксиде), добавляли к раствору субстрата (указанный выше буфер, содержащий 3 мкКи/мл радиоактивно меченый анандамид (Анандамид [этаноламин 1-3H]) и 10 мкМ анандамида) с тем, чтобы концентрация составляла от 0,003 нМ до 30 нМ. В качестве контроля добавляли один DMSO. К указанным выше клеткам добавляли 100 мкл/лунку раствора субстрата и инкубировали в СО2 инкубаторе при 37°С в течение 30 минут. Затем, планшет для культуры клеток переносили на лед; раствор субстрата удаляли отсасыванием; и к нему добавляли ледяной раствор для лизиса клеток (указанный выше буфер, содержащий 0,5% Triton X-100 и 100 мкМ соединения, обладающего ингибирующей FAAH активностью, сложный 3'-карбамоилбифенил-3-иловый эфир циклогексилкарбаминовой кислоты (URB597; Cayman chemical; Kathuria et al., Nature Med., Vol. 9, pp. 76-81, 2003)). Полученный в результате клеточный лизат отдельно переносили в пробирки для образцов емкостью 1,5 мл, к которым добавляли 150 мкл раствора хлороформа/метанола в соотношении 1:1 (по объему) с последующим перемешиванием. После центрифугирования (15000 об/мин, 2 минуты) разрушенный продукт этаноламин (этаноламин 1-3H) отделялся в верхнем слое (слое воды/метанола), и не вступивший в реакцию радиоактивно меченый анадамид отделялся в нижнем слое (слое хлороформа). 25 мкл верхнего слоя переносили в 96-луночный, устойчивый к органическому растворителю микроплашет (PicoPlate-96; Perkin E1mer), к нему добавляли 150 мкл Microscint-20 (Perkin E1mer) и проводили измерение сцинтилляционным счетчиком микропланшет (TopCountTM; Beckman). Вещество, которое, по сравнению с контролем, давало уменьшенную величину измерения, выбирали в качестве вещества, ингибирующего активность FAAH.
(2) Измерение величины IC50 вещества, ингибирующего активность FAAH:
Соединение, растворенное в DMSO до концентрации 10 мМ, добавляли к раствору субстрата с тем, чтобы концентрация составляла от 0,003 нМ до 30 нМ. В соответствии со способом, описанным выше, соединение анализировали для выявления их влияния на активность FAAH. В качестве отрицательного контроля использовали DMSO, а в качестве положительного контроля к раствору субстрата добавляли URB597 до концентрации 10 мкМ. При измеренной величине положительного контроля, установленной на 0%, и измеренной величине отрицательного контроля, установленной на 100%, получали величины IC50 тестируемых веществ.
Пример тестирования 2
Скрининг для выявления вещества, ингибирующего активность FAAH с использованием гомогената ткани крыс, которым вводили тестируемое вещество:
(1) Введение крысам и получение гомогената ткани:
Тестируемое вещество, суспендированное в 0,5% растворе метилцеллюлозы (MC), перорально вводили 6-недельным самцам крыс SD (Japan SLC) в дозе 1 мг/кг. В качестве контроля двум крысам перорально вводили 0,5% раствор MC. Через 60 минут крыс умерщвляли декапитацией под эфирным наркозом, и затем у них брали правое полушарие.
К взятой ткани мозга крыс добавляли 2 мл ледяного буфера (50 мМ Tris-HCl (pH 8,0), 1 мМ EDTA (этилендиаминтетрауксусной кислоты)), и мозговую ткань гомогенизировали гомогенизатором на льду для получения однородного раствора. Далее, с использованием генератора ультразвуковых волн (UR-20P (Регулятор мощности 4), Tommy Seiko) раствор гомогената подвергали ультразвуковой фрагментации в течение 5 секунд. Концентрацию белка в полученных гомогенатах измеряли в соответствии со способом связывания красителя (раствор CBB (Кумасси бриллиантового синего) для анализа белка; Nacalai Te3sque Inc.)). С использованием буфера (50 мМ Hepes (pH 7,4), 1 мМ EDTA) гомогенаты мозговой ткани крыс разбавляли так, чтобы концентрация белка в них составляла 60 мкг/мл, посредством этого получая ферментные растворы.
(2) Измерение активности FAAH
К 200 мкл ферментного раствора добавляли 50 мкл раствора субстрата (2 мкМ анандамида с флюоресцентной меткой (Арахидонил-AMC (7-амино-4-метил Кумарин)) (BIOMOL), Hepes (pH 7,4) 1 мМ EDTA и 0,5 мг/мл BSA (бычьего сывороточного альбумина)) с последующей реакцией при комнатной температуре в течение 90 минут. Измерение проводили сцинтилляционным счетчиком микропланшет (TopCountTM; Beckman).
При установке активности FAAH контрольных крыс, не получавших тестируемое вещество, установленной на 100% и активности FAAH, не содержащего тканевого гомогената буфера (50 мСМ Hepes (pH 7,4), 1 мМ EDTA), установленной на 0%, определяли относительную величину (%)активности FAAH тканевого гомогената крыс, которым вводили тестируемое вещество.
Присутствие терапевтического эффекта при нейропатической боли может быть подтверждена способами, известными специалистам в данной области, или модифицированными указанными способами. Например, используя модель перевязки спинномозговых нервов L5/L6 у крыс, которая производится в соответствии с частичной модификацией способа Kim и Chung (Pain, Vol. 50, pp. 355-363, 1992), можно оценить улучшающий эффект соединения для значимого снижения порога реакции на тактильное раздражение (аллодинию), и на основании этого можно подтвердить эффект лечения нейропатической боли.
Пример тестирования 3
Эффект против аллодинии соединения у крыс с перевязкой L5/L6 спинномозговых нервов (модель нейропатической боли)
5-6-недельного самца крысы SD подвергали операции перевязки шелковыми нитями их левосторонних спинномозговых нервов L5 и L6 под пентобарбиталовым наркозом. Для оценки анальгетического эффекта использовали тест с волосками фон Фрея. То есть регистрировали одергивание задней лапы животного при раздражении волосками, при котором минимальную силу воздействия волосков, которая вызывала реакцию одергивания, рассматривали как порог реакции на механическое раздражение (логарифм грамм). В предварительном тесте было подтверждено, что порог реакции лапы животного на оперированной стороне был заметно снижен (при аллодинии) в пределах от 7-го дня до 14-го дня после операции, эффект против аллодинии тестируемого соединения оценивали в любой день в пределах от 7-го дня до 14-го дня после операции. В день перед днем, когда предполагалось испытывать тестируемое соединение, измеряли порог реакции перед введением тестируемого соединения. Испытуемых животных группировали так, чтобы было небольшим различие средних величин порога реакции между группами и их колебания внутри групп перед введением тестируемого соединения. При оценке тестируемых соединений измеряли порог реакции после введения тестируемого соединения. 3 мг/кг тестируемого соединения перорально вводили за 60 минут до измерения порога реакции. При установке порога реакции лап с оперированной и не оперированной стороны в группе с введением растворителя соответственно на 0% и 100% рассчитывали активность тестируемого соединения в отношении его эффекта против аллодинии (частоты восстановления).
Для нескольких репрезентативных соединений по настоящему изобретению результаты тестирования в примере тестирования 1 (величины IC50) и результаты тестирования в примере тестирования 3 (частота восстановления) показаны ниже. В связи с этим, в таблице “-“ означает, что измерение не проводилось.
| Таблица 1 | ||
| Пример | IC50 (нM) | Частота восстановления (%) |
| 1 | 0,30 | - |
| 2 | 0,11 | 71 |
| 3 | 0,077 | 81 |
| 14 | 0,85 | - |
| 15 | 0,35 | 97 |
| 9 | 2,2 | - |
| 97 | 0,20 | - |
| 31 | 1,8 | 98 |
| 108 | 0,70 | - |
| 102 | 0,43 | 74 |
| 42 | 0,56 | 97 |
| 43 | 0,98 | 86 |
| 60 | 2,6 | 117 |
| 50 | 0,38 | 119 |
| 72 | 0,11 | 90 |
| 73 | 0,15 | - |
| 69 | 1,40 | - |
| 76 | 0,067 | - |
| 136 | 0,16 | - |
| 79 | 0,047 | - |
| 144 | - | 94 |
| 140 | - | 83 |
| Сравнительное соединение А | 0,58 | 47 |
Сравнительное соединение А: Соединение примера 126 в патентном документе 3
В результате описанного выше теста было показано, что соединение формулы (I) обладает ингибирующей активностью в отношении FAAH и является эффективным на моделях нейропатической боли. Поэтому, соединение формулы (I) может применяться в качестве средства для предотвращения и/или лечения различных заболеваний, связанных с FAAH. Кроме того, его можно применять, наряду с другими показаниями, в качестве средства для лечения нейропатической боли.
Фармацевтическая композиция, содержащая один или более видов соединения формулы (I) или его фармацевтически приемлемой соли в качестве активного ингредиента, может быть получена в соответствии с общепринятым способом с использованием фармацевтического носителя, фармацевтического эксципиента или тому подобного, что обычно используется в данной области.
Введение может проводиться любым видом перорального введения посредством таблеток, пилюль, капсул, гранул, порошков, жидких препаратов и тому подобных, или парентерального введения посредством инъекций, таких как внутрисуставная, внутривенная, внутримышечная или другие, суппозиторий, глазных капель, глазных мазей, чрескожных жидких препаратов, мазей, трансдермальных систем, жидких препаратов для введения через слизистые оболочки, накладок для введения через слизистые оболочки, ингаляционных препаратов и тому подобных.
В качестве твердой композиции для перорального введения применяются таблетки, порошки, гранулы или тому подобные формы. В такой твердой композиции один или два или более активных ингредиентов смешиваются, по меньшей мере, с одним неактивным эксципиентом, таким как лактоза, маннит, глюкоза, гидроксипропилцеллюлоза, микрокристаллическая ц