Лечение аутоиммунных заболеваний
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно неврологии, и может быть использована для лечения аутоиммунных заболеваний, выбранных из бокового амиотрофического склероза (болезни Лу Герига), синдрома Гийена-Барре и увеита. Для этого применяют, в качестве единственного активного ингредиента, соединение, относящееся к аминоспиртам или его фосфатному производному. Также предложен способ лечения аутоиммунных заболеваний. Группа изобретений обеспечивает лечение указанных заболеваний, за счет влияния на Т-клетки. 2 н. и 7 з.п. ф-лы, 1 табл.
Реферат
Область изобретения
Настоящее изобретение относится в основном к аминоспиртам и их производным, и, более подробно, к лечению определенных аутоиммунных заболеваний, например, таких как рассеянный склероз, боковой амиотрофический склероз, синдром Гийена-Барре и увеит.
Предпосылки создания настоящего изобретения
Рассеянный склероз является хроническим воспалительным заболеванием центральной нервной системы (ЦНС) неустановленной патофизиологической природы. Клинические проявления данного заболевания связаны с инфильтрацией центральной нервной системы иммунно-компетентными клетками. Популяции специфических T-клеток, направленных против нейроантигенов, таких как основной миелиновый белок, можно выявить на периферии, что предполагает участие аутоиммунной ответной реакции в развитии заболевания. Поскольку в настоящее время не разработаны специальные методы лечения такого аутоиммунного нарушения, опосредованного T-клетками, то с целью ограничения развития воспалительного процесса пациенты проходят курс лечения иммунодепрессантами, включающими азатиоприн и кортикостероиды. Однако лечение рассеянного склероза иммуннодепрессантами является лишь частично эффективным, и в большинстве случаев приводит только к замедлению развития заболевания, несмотря на лечение противовоспалительными агентами и иммуннодепрессантами.
Соответственно, существует необходимость в разработке других лекарственных средств, которые являются эффективными для лечения рассеянного склероза и других связанных с ним заболеваний, включающих заболевания, связанные с опосредованными T-клетками повреждениями центральной или периферической нервной ткани, такие как периферический неврит, ретробульбарный неврит и боковой амиотрофический склероз.
Установлено, что аминоспирты, такие как описанные в данном контексте, оказывают благоприятный эффект при лечении аутоиммунных заболеваний, таких как рассеянный склероз, периферический неврит, ретробульбарный неврит, боковой амиотрофический склероз (болезнь Лу Герига) и увеит.
Аминоспиртами по настоящему изобретению являются соединения формулы I
где X означает O, S, SO или SO2,
R1 означает галоген, тригалогенметил, OH, C1-C7алкил, C1-C4алкокси, трифторметокси, фенокси, циклогексилметокси, пиридилметокси, циннамилокси, нафтилметокси, феноксиметил, СН2-OH, CH2-CH2-OH, C1-C4алкилтио, C1-C4алкилсульфинил, C1-C4алкилсульфонил, бензилтио, ацетил, нитро или циано, или фенил, фенил(C1-C4)алкил или фенил(C1-C4)алкокси, при этом каждая из фенильных групп необязательно замещена группами галоген, CF3, C1-C4алкил или C1-C4алкокси,
R2 означает H, галоген, тригалогенметил, C1-C4алкокси, C1-C7алкил, фенетил или бензилокси,
R3 означает H галоген, CF3, OH, C1-C7алкил, C1-C4алкокси, бензилокси, фенил или C1-C4алкоксиметил,
каждый R4 и R5 независимо означает H или остаток формулы (a)
где каждый из R8 и R9 независимо означают H или C1-C4алкил, необязательно замещенный атомом галогена, и
n равно целому числу от 1 до 4,
или их фармацевтически приемлемые соли,
или соединения формулы II
где
R1a означает галоген, тригалогенметил, C1-C4алкил, C1-C4алкокси, C1-C4алкилтио, C1-C4алкилсульфинил, C1-алкилсульфонил, аралкил, необязательно замещенный фенокси или аралкилокси,
R2a означает H, галоген, тригалогенметил, C1-C4алкил, C1-C4алкокси, аралкил или аралкилокси,
R3a означает H, галоген, CF3, C1-C4алкил, C1-C4алкокси, C1-C4алкилтио или бензилокси,
R4a означает H, C1-C4алкил, фенил, необязательно замещенные бензил или бензоил, или (низш.) алифатический C1-C5ацил,
R5a означает H, моногалогенметил, C1-C4алкил, C1-C4алкоксиметил, C1-C4алкилтиометил, гидроксиэтил, гидроксипропил, фенил, аралкил, C2-C4алкенил или -алкинил,
R6a означает H или C1-C4алкил,
R7a означает H, C1-C4алкил или остаток формулы (a), как описано выше,
Xa означает O, S, SO или SO2, и
na равно целому числу от 1 до 4,
или их фармацевтически приемлемые соли.
В соединениях формул (I) и (II) термин «галоген» означает фтор, хлор, бром и иод. Термин «тригалогенметил» означает трифторметил и трихлорметил. Термин «C1-C7алкил» означает алкил с прямой или разветвленной цепью, например, метил, этил, пропил, изопропил, бутил, трет-бутил, пентил, гексил или гептил. Термин «замещенный или незамещенный фенокси» означает феноксигруппу, замещенную в любом положении бензольного кольца атомом галогена, таким как фтор, хлор, бром и иод, группами трифторметил, C1-C4алкил или C1-C4алкокси. Термин «аралкил» или «аралкилокси» означает бензил, дифенилметил, фенетил или фенилпропил. Любой алкильный остаток в составе групп «C1-C4алкокси», «C1-C4алкилтио», «C1-C4алкилсульфинил» или «C1-C4 C1-C4алкилсльфонил» означает прямой или разветвленный C1-C4алкил, например, метил, этил, пропил, изопропил или бутил. Термин «замещенный или незамещенный аралкил» означает аралкильную группу, замещенную в любом положении бензольного кольца атомом галогена, таким как фтор, хлор, бром или иод, группами трифторметил, (низш.) алкил, содержащий от 1 до 4 атомов углерода, или (низш.) алкокси, содержащий от 1 до 4 атомов углерода.
Предпочтительными соединениями формулы I являются соединения формулы Ia
Другими предпочтительными соединениями формулы (I) являются соединения, в которых R3 означает хлор, например, 2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этилпропан-1,3-диол и его соответствующие фосфаты, моно-2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этилпропил]овый эфир фосфорной кислоты. Моно-2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этилпропил]овый эфир фосфорной кислоты получают в энантиомерно чистом виде по методикам, описанным в заявке WO 2005/021503.
Предпочтительными соединениями формулы II являются соединения формулы (IIa)
где
Y означает O или S, а
значения R2a, R3a, R5a, R7a и na определены выше.
Предпочтительными соединениями формулы (IIa) являются соединения, в которых R3 означает хлор, например, 2-амино-4-[4-(3-бензилоксифенилтио)-2-хлорфенил]-2-метилбутан-1-ол, соответствующий моно-2-амино-4-[4-(3-бензилоксифенилтио)-2-хлорфенил]-2-метилбутил]овый эфир фосфорной кислоты, 2-амино-4-[4-(3-бензилоксифенилтио)-2-хлорфенил]-2-этилбутан-1-ол и соответствующий моно-2-амино-4-[4-(3-бензилоксифенилтио)-2-хлорфенил]-2-этилбутил]овый эфир фосфорной кислоты.
Соединения формул I и II описаны, например, в заявках WO 03/029205, WO 03/029184 и WO 04/026817, соответственно, фосфорилированные производные описаны, например, в заявке WO 04/074297, содержание которых полностью включено в настоящее описание в качестве ссылок. Соединения формул I и II получают по методикам, как описано в приведенных выше документах.
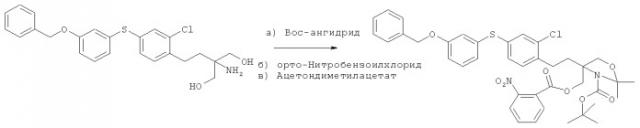
Фосфорилированные производные соединений формулы (I), например, моно-2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этилпропил]овый эфир фосфорной кислоты получают с использованием методов синтеза фосфорилированных соединений, как описано, например, в заявке WO 2005/021503 (см., например, стр.11 и 12). Оптически активные соединения формулы (I) и их фосфорилированные производные, прежде всего, соединения формулы (Ia) получают с высокой степенью чистоты по методике, как описано, например, в статье Hinterding и др., Synthesis, т.11, сс.1667-1670 (2003). Например, оптически активное соединение формулы (Ia), моно-2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]-2-этилпропил]овый эфир фосфорной кислоты, получают, как показано на схеме, приведенной ниже, с использованием методик, описанных в статье Hinterding и др. (2003), как указано выше.
а) 1 экв. соединения 1 и 1,2 экв. Boc-ангидрида в диоксане/ацетонитриле или ДМФА/вода (в зависимости от растворимости)+1,2 экв. NaOH 1 М в воде (КТ, в течение ночи).
б) 1 экв. соединения, полученного на стадии а), 1,5 экв. 2-нитробензоилхлорида и 1,6 экв. пиридина в CH2Cl2 (КТ, в течение ночи).
в) 1 экв. соединения, полученного на стадии б), 3 экв. ацетондиметилацетата и 0,1 экв. р-TsOH·H2O в толуоле (95°C, 3 ч).
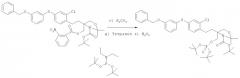
г) 1 экв. соединения, полученного на стадии в), и 0,075 экв. K2CO3 (порошок) в MeOH/ТГФ (1:1) (КТ, 4 ч).
д) 1 экв. соединения, полученного на стадии а), 6 экв. тетразола (перекристаллизованного из толуола или 0,45 М в CH2CN) и 2 экв. ди-трет-бутилдиэтилфосфорамидита в сухом ТГФ (КТ, 3 ч).
е) 5 экв. H2O2 (30%) добавляли непосредственно в реакционную смесь, полученную на стадии д) (0°C, 1 ч).
Выделение: реакцию останавливают добавлением тиосульфата натрия (насыщенного водного раствора) и экстрагируют этилацетатом (3 раза).
Соединения формул II и IIa, например, 2-амино-4-[4-(3-бензилоксифенилтио)-2-хлорфенил]-2-метилбутан-1-ол и 2-амино-4-[4-(3-бензилоксифенилтио)-2-хлорфенил]-2-этилбутан-1-ол получают, например, как описано в EP 1548003 A1. Получение соединений формул II и IIa с высокой степенью оптической чистоты осуществляют по методикам, описанным, например, в статье Hinterding и др. (2003), указано выше, и Hinterding и др., Tetra Lett, т.43, №.45, сс.8095-8097 (2002). Оптически активные фосфатные производные соединений формул II и IIa, например, моно-2-амино-4-[4-(3-бензилоксифенилтио)-2-хлорфенил]-2-метилбутил]овый эфир фосфорной кислоты и моно-2-амино-4-[4-(3-бензилоксифенилтио)-2-хлорфенил]-2-этилбутил]овый эфир фосфорной кислоты высокой степени чистоты получают, как описано в статье Hinterding и др. (2003), указано выше.
Соединения формул I и II существуют в свободной форме или в форме соли или в форме гидрата. Примеры фармацевтически приемлемых солей соединений формул I и II включают соли неорганических кислот, такие как гидрохлорид и гидробромид, соли органических кислот, такие как ацетат, трифторацетат, цитрат, тартрат и метансульфонат.
Если соединения формул I и II содержат один или более асимметрических центров в молекуле, то такие соединения могут существовать в форме различных оптических изомеров, а также рацематов, диастереомеров и их смесей.
В настоящем изобретении предлагаются следующие объекты:
1.1 Способ лечения аутоиммунного заболевания, которое выбирают из группы, включающей периферический неврит, ретробульбарный неврит, боковой амиотрофический склероз и увеит, у субъекта, нуждающегося в таком лечении, и указанный способ заключается во введении субъекту эффективного количества соединения формулы I или II или их фармацевтически приемлемой соли.
1.2 Способ лечения рассеянного склероза у субъекта, нуждающегося в таком лечении, и указанный способ заключается во введении субъекту эффективного количества соединения формулы I, где каждый R4 и R5 означает водород, или соединения формулы II, где R7a означает водород, или C1-C4алкил, или их фармацевтически приемлемой соли.
1.3 Способ снижения тяжести или замедления развития симптомов демиелинизирующего заболевания, например, рассеянного склероза или синдрома Гийена-Барре, у субъекта, нуждающегося в таком лечении, и указанный способ заключается во введении субъекту эффективного количества соединения формулы I, где каждый R4 и R5 означает водород, или соединения формулы II, где R7a означает водород, или C1-C4алкил, или их фармацевтически приемлемой соли.
1.4 Способ замедления развития физической недееспособности или снижения частоты клинических рецидивов у субъекта, страдающего от развитого рассеянного склероза, и указанный способ заключается во введении субъекту эффективного количества соединения формулы I, где каждый R4 и R5 означает водород, или соединения формулы II, где R7a означает водород, или C1-C4алкил, или их фармацевтически приемлемой соли.
1.5 Способ замедления развития повреждений мозга или развития демиелинизации центральной нервной системы у субъекта, у которого предполагается или установлен рассеянный склероз, и указанный способ заключается во введении субъекту эффективного количества соединения формулы I, где каждый R4 и R5 означает водород, или соединения формулы II, где R7a означает водород, или C1-C4алкил, или их фармацевтически приемлемой соли.
1.6 Способ профилактики или замедления развития вторичного демиелинизирующего явления, например, второго приступа рассеянного склероза, у субъекта, нуждающегося в таком лечении, и указанный способ заключается во введении субъекту эффективного количества соединения формулы I, где каждый R4 и R5 означает водород, или соединения формулы II, где R7a означает водород, или C1-C4алкил, или их фармацевтически приемлемой соли.
1.7 Способ лечения ретробульбарного неврита у субъекта, нуждающегося в таком лечении, и указанный способ заключается во введении субъекту эффективного количества соединения формулы I, где каждый R4 и R5 означает водород, или соединения формулы II, где R7a означает водород, или C1-C4алкил, или их фармацевтически приемлемой соли.
Ретробульбарный неврит является первым симптомом, связанным с высоким риском развития клинически установленного рассеянного склероза.
2.1 Соединение формулы I или II или их фармацевтически приемлемая соль, предназначенные для применения согласно способу по п.1.1, как описано выше.
2.2 Соединение формулы I, где каждый R4 и R5 означает водород, или соединение формулы II, где R7a означает водород, или C1-C4алкил, или их фармацевтически приемлемая соль, предназначенные для применения согласно способу по п.1.2-1.7, как описано выше.
3.1 Фармацевтическая композиция, предназначенная для применения согласно способу по п.1.1, как описано выше, включающая соединение формулы I или II или их фармацевтически приемлемую соль, в комбинации с одним или более фармацевтически приемлемых разбавителей или носителей.
3.2 Фармацевтическая композиция, предназначенная для применения согласно способу по п.1.2-1.7, как описано выше, включающая соединение формулы I, где каждый R4 и R5 означает водород, или соединение формулы II, где R7a означает водород, или C1-C4алкил, их фармацевтически приемлемую соль, в комбинации с одним или более фармацевтически приемлемых разбавителей или носителей.
4.1 Применение соединения формулы I или II или их фармацевтически приемлемой соли для получения лекарственного средства, предназначенного для применения согласно способу по п.1.1, как описано выше.
4.2 Применение соединения формулы I, где каждый R4 и R5 означает водород, или соединения формулы II, где R7a означает водород, или C1-C4алкил, или их фармацевтически приемлемой соли для получения лекарственного средства, предназначенного для применения согласно способу по п.1.2-1.7, как описано выше.
Термин «эффективное количество» означает количество соединения формулы I или II, при введении которого пациенту наблюдается эффективное лечение аутоиммунного заболевания, такого как рассеянный склероз, периферический неврит, ретробульбарный неврит, боковой амиотрофический склероз (болезнь Лу Герига) и увеит. Эффективность лечения аутоиммунного заболевания означает ослабление симптомов заболевания и любые другие показатели, известные в данной области техники и характеризующие ход лечения аутоиммунного заболевания.
Применимость соединений формул I и II для лечения заболеваний, нарушений или состояний, таких как описано в данном контексте, можно продемонстрировать на примере способов лечения животных, а также при клинических испытаниях, например, с использованием способов, описанных в данном контексте. Наиболее широко используемой моделью рассеянного склероза у животных является экспериментальный аутоиммунный энцефаломиелит (ЕАЕ), т.к. его гистопаталогические и клинические характеристики аналогичны характеристикам заболевания человека.
Способы
Модели животных
Монофазная модель (ЕАЕ) и хроническая рецидивирующая форма являются информативными моделями рассеянного склероза у животных. ЕАЕ индуцируют у чувствительных животных однократной инъекцией в основание хвоста ткани ЦНС или МВР, эмульгированных в полном адъюванте Фрейнда. Острое монофазное паралитическое заболевание развивается у чувствительных видов крыс, например, у крыс Льюис, Вистар, приблизительно через 8-11 дней после сенсибилизации. Симптоматические крысы выздоравливают в течение следующих 7 дней, но для других видов приступ обычно вызывает летальный исход. В модели хронического рецидивирующего заболевания у крыс наблюдается от 1 до 3 рецидивов с последующим острым присупом заболевания. Такие рецидивы обычно характеризуются степенью тяжести от слабой до тяжелой и наблюдаются с интервалом от 20 до 100 сут после острого приступа.
1. Модель острого ЕАЕ
Самок крыс Льюис иммунизировали внутрикожной инъекцией в задние лапы 0,1 мл смеси спинного мозга морской свинки и полного адъюванта Фрейнда (продукт Difco Н37 RA; 3,5 г спинного мозга морской свинки +3,5 мл 0,9% NaCl +105 мг M.tuberculosis (продукт Difco Н37 RA) +7 мл CFA (продукт Difco Н37 RA). Каждая группа включала от 5 до 10 крыс, у которых регистрировали соматические симптомы по бальной шкале от 0 до 3 ежедневно. Регистрировали число заболевших животных и время начала развития заболевания. Исследуемые соединения, например, соединения формул I или II, например, соединение A: 2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этилпропан-1,3-диол, соединение B: (R)-2-амино-4-[4-(3-бензилоксифенилтио)-2-хлорфенил]-2-метилбутан-1-ол и соединение C: (R)-2-амино-4-[4-(3-бензилоксифенилтио)-2-хлорфенил]-2-этилбутан-1-ол) вводили ежедневно в течение интервала от 0 до 13 дней через желудочный зонд. Статистическую достоверность различий между параметрами полученных леченых и контрольных животных анализировали методом дисперсионного анализа Anova с последующим сравнительным анализом множества параметров методом Данна. Без лечения лекарственным средством симптомы заболевания (паралич хвоста и обоих задних конечностей) обычно развивались в течение от 8 до 11 сут.
Шкала клинических симптомов:
1 означает потерю тонуса хвоста
2 означает слабость одной или обеих задних конечностей или атаксию в легкой степени
3 означает тяжелую атаксию или паралич, сопровождающиеся недержанием мочи
Было установлено (табл.1 ниже), что соединения A, B и C приводят к предотвращению развития симптомов заболевания при введении в дозах от 0,1 до 10 мг/кг/сут у животных с данной моделью заболевания.
| Табл. 1 | |||||
| Соединение | Доза мг/кг перорально | Число животных ЕАЕ/Общее число животных | Первые симптомы в день | ||
| День 12 | Средняя оценка контроля | День 14 | |||
| Контроль | - | 5/5 | тяжесть = 2,8 | 9 | |
| Соединение A | 0,1 | 0/5 | 3/4 | 9 | |
| 0,3 | 0/5 | 1/5 | 14 | ||
| 1 | 0/5 | 0/5 | >14 | ||
| Контроль | - | 5/5 | тяжесть = 3 | 10 | |
| Соединение B | 1 | 0/5 | 0/5 | >14 | |
| Соединение C | 1 | 0/5 | 0/5 | >14 |
Тяжесть клинических симптомов оценивали по трехбалльной шкале от 0 до 3.
Как показано на фиг.1 ниже, соединение A приводит к предотвращению развития симптомов заболевания при введении пероральным способом в дозах от 0,1 до 10 мг/кг/сут у животных с данной моделью.
На фиг.1 показано влияние соединения A на предотвращение развития симптомов у животных с моделью острого ЕАЕ.
2. Модель хронического рецидивирующего ЕАЕ
Хронический рецидивирующий ЕАЕ у крыс Льюис инициировали инъекцией эмульсии спинного мозга морской свинки в полном адъюванте Фрейнда в задние лапы. Каждая группа включала от 6 до 10 крыс и соматические симптомы регистрировали по шкале от 0 до 3 баллов ежедневно. Регистрировали число заболевших животных и время начала развития заболевания. Лечение исследуемым соединением, например, соединением формулы I или II, например, соединением A, как описано выше, начинали в день 16 (после первого приступа заболевания) продолжали до дня 31. Статистическую достоверность различий между параметрами полученных леченых и контрольных животных анализировали методом дисперсионного анализа Anova с последующим сравнительным анализом множества параметров методом Данна. Без лечения лекарственным средством у 80-100% сенсибилизированных крыс наблюдали клинические рецидивы в течение первых 40 дней после иммунизации. Шкала клинических симптомов:
1 означает потерю тонуса хвоста
2 означает слабость одной или обеих задних конечностей или атаксию в легкой степени
3 означает тяжелую атаксию или паралич, сопровождающиеся недержанием мочи
Как показано на фиг.2, соединение А предотвращает клинические рецидивы при введении пероральным способом в дозе 0,3 мкг/сут у животных с моделью хронического рецидивирующего ЕАЕ. На фиг.2 показано действие соединения A на предотвращение симптомов заболевания у животных с моделью хронического рецидивирующего ЕАЕ.
Как ожидалось, для соединений B и C наблюдались аналогичные результаты, полученные для соединения A.
3. Модель хронического ЕАЕ
Развитие ЕАЕ у крыс DA индуцировали, как описано в статьях Lorentzen и др, J. Neuroimmunol., т.63, №2, сс.193-205 (1995) и Adelmann и др, J. Neuroimmunol., т.63, №1, сс.17-27 (1995). Крыс иммунизировали смесью гомогенизированного мозга крыс DA и спинного мозга крыс DA и крупного рогатого скота, содержащего 0,02 мкг/мл очищенного рекомбинантного белка MOG крысы. Смесь гомогенизовали и затем смешивали в соотношении 1:1 с адъювантом Фрейнда, содержащим 4 мг/мл M.tuberculosis H37RA(CFA). Полученную смесь гомогенизовали с использованием гомогенизатора Polytron РТ3100 (фирмы Kinematica, Люцерн, Швейцария). Затем крысам вводили 200 мкл смеси антиген/CFA инъекцией подкожным способом в спинную часть хвоста. Развившееся хроническое заболевание оценивали по бальной шкале степеней прогрессирующего паралича: 0, отсутствие паралича; 1, потеря тонуса хвоста; 2, слабость или атаксия задних конечностей; 3, паралич задних конечностей, несопровождающийся или сопровождающийся недержанием мочи; 4, паралич задних и передних конечностей; 5, агония или летальный исход. Клинические симптомы оценивали ежедневно, а массу тела - через день. В момент максимального развития заболевания перед курсом лечения животных перераспределяли по группам таким образом, чтобы в каждую из них были включены животные с симптомами сопоставимой степени. Лечение животных начинали в день максимального развития заболевания в день 12 и продолжали ежедневно до дня 33 после иммунизации (всего 22 сут). Исследуемое соединение или носитель (для контрольной группы) вводили пероральным способом ежедневно.
В данном анализе при введении соединения A пероральным способом в дозе 0,3, 0,1 или 0,03 мг/кг/сут наблюдалось эффективное замедление развития хронического ЕАЕ. Статистический анализ свидетельствует о значительном ослаблении заболевания при введении каждой дозы соединения А по сравнению с контрольной группой.
Клинические испытания
Пригодными клиническими испытаниями являются, например, испытания с открытой этикеткой, с увеличением дозы, двойным слепым методом с рандомизацией пациентов, страдающих от указанных выше демиелинизирующих заболеваний, рассеянного склероза, периферического неврита, ретробульбарного неврита, бокового амиотрофического склероза и увеита. Положительное действие на симптомы таких заболеваний определяют непосредственно по результатам таких испытаний, известных специалистам в данной области техники. Такие испытания также являются пригодными для сравнения действия монотерапии с использованием соединений формулы I или II в качестве активного ингредиента с действием лечения комбинацией таких соединений со вторым лекарственным соединением.
Например, 50 пациентов, страдающих ремиссионно-рецидивирующим рассеянным склерозом, проходили курс лечения исследумым соединением, например, соединением формулы I или II, предпочтительно соединением формулы I, где каждый R4 иd R5 означает H, или соединением формулы II, где R7a означает H или C1-C4алкил, или их фармацевтически приемлемыми солями, в суточной дозе от 0,5 до 50 мг пероральным способом. Основное клиническое состояние пациента обследовали еженедельно по физическим параметрам и результатам лабораторных анализов. Состояние заболевания и изменения в развитии заболевания оценивали каждые 2 месяца магнитной резонансной томографией (МРТ) и по физическим параметрам. Изначально пациенты проходили курс лечения в течение от 2 до 6 месяцев. Затем им продолжали вводить лекарственное средство до тех пор, пока не прекращалось прогрессирование заболевания и лекарственное средство переносилось удовлетворительно.
Основные параметры для оценки: безопасность (побочные отрицательные действия), стандартный биохимический и гематологический анализ крови, магнитно-резонансная томография (МРТ).
Кроме пациентов, страдающих ремессионно-рецидивирующим рассеянным склерозом, проводили испытания с участием пациентов с первичным четко установленным неврологическим явлением, связанным с демиелинизацией и, например, включающим зрительный нерв (односторонний ретробульбарный неврит), спинной мозг (например, неполный поперечный миелит) или мозговой ствол или мозжечок (синдром поражения мозгового ствола или мозжечковый синдром), которые подтверждены при офтальмологическом или неврологическом обследовании. Для испытаний использовали соединение формулы I или II, предпочтительно соединение формулы I, где каждый R4 и R5 означает H, или соединение формулы II, где R7a означает H или C1-C4алкил, или их фармацевтически приемлемые соли.
Суточные дозы, требуемые при применении способа по настоящему изобретению на практике, зависят, например, от используемого соединения, организма пациента, способа введения и степени тяжести заболевания, подлежащего лечению. Предпочтительная величина суточной дозы составляет приблизительно от 0,1 до 100 мг в виде однократной дозы или в виде разделенных доз. Пригодные суточные дозы для пациентов при введении пероральным способом составляют, например, от 0,1 до 50 мг. Соединение вводят любым стандартным способом, прежде всего, энтеральным способом, например, пероральным способом, например, в форме таблеток, капсул, питьевых растворов, введением в нос, в легкие (ингаляции) или парентеральным способом, например, в форме растворов или суспензий для инъекций. Пригодная лекарственная форма для введения пероральным способом включает приблизительно от 0,1 до 30 мг, прежде всего от 0,25 до 30 мг активного ингредиента, например, приблизительно от 0,1 до 5 мг, в комбинации с одним или более фармацевтически приемлемых разбавитилей или носителей.
Соединения формулы I или II вводят любым стандартным способом, прежде всего, энтеральным способом, например, пероральным способом, например, в форме таблеток или капсул, или парентеральным способом, например, в форме растворов или суспензий для инъекций, местным способом, например, в форме лосьонов, гелей, мазей или кремов, или введением в нос или в форме суппозиториев. Фосфатные производные соединений формулы I или II предпочтительно вводят парентеральным способом. Фармацевтические композиции, включающие такие соединения в свободной форме или в форме фармацевтически приемлемой соли в комбинации по крайней мере с одним фармацевтически приемлемым носителем или разбавителем получают стандартными способами при смешивании с фармацевтически приемлемым носителем или разбавителем.
Соединения формулы I или II вводят в свободной форме или в форме фармацевтически приемлемой соли, например, как описано выше. Такие соли получают стандартными способами и они характеризуются уровнем активности, сопоставимым с уровнем активности соединений в свободной форме.
Соединения формулы I или II вводят в форме отдельного активного ингредиента или в комбинации, например, с адъювантом, другими лекарственными средствами, например, иммунодепрессантами или иммуномодуляторами, или другими противовоспалительными агентами, предназначенными для лечения указанных выше аутоиммунных заболеваний. Например, соединения используют в комбинации с интерферонами, например, пэгилированными или непэгилированными α-интерферонами, β-интерферонами или γ-интерферонами, например, при введении подкожным, внутримышечным или пероральным способом; модифицированным пептидным лигандом, таким как продукт Glatiramer, например, в форме ацетата; моноклональными антителами против различных поверхностных маркеров T-клеток, например, натализумаб (продукт ANTEGREN®) или алемтузумаб; аскомицином с иммунодепрессантными свойствами, например, продуктами ABT-281, ASM981 и т.п., стероидом, например, метилпреднизолоном, преднизоном или дексаметазоном, кортикостероидом, циклофосфамидом, азатиоприном, метотрексатом, митоксантроном, лефлуномидом, мизорибином, микофенольной кислотой, микофенолятом мофетила, 15-дезоксипергуалином или иммунодепрессантным гомологом, аналогом или их производным, иммунодепрессантными моноклональными антителами, например, моноклональными антителами против рецепторов лейкоцитов, например, MHC, CD2, CD3, CD4, CD7, CD8, CD25, CD28, CD40, CD45, CD58, CD80, CD86 или их лигандов, другими соединениями с иммуномодулирующими свойствами, например, рекомбинатной связывающей молекулой, содержащей фрагмент внеклеточного домена CTLA4 или его мутант, например, по крайней мере внеклеточный фрагмент CTLA4 или его мутант, присоединенный к белковой последовательности, не включающий CTLA4, например, CTLA41g, например, АТСС 68629, или их мутант, например, LEA29Y, ингибиторами молекулярной адгезии, например, антагонистами LFA-1, ICAM-1 или -3, антагонистами VCAM-4 или VLA-4, ингибиторами катепсина S, ингибиторами mTOR, например, рапамицином, 40-(9-(2-гидроксиэтил)рапамицином, продуктами CCI779 или АВТ578; ингибиторами кальциневрина, например, циклоспорином A, продуктами FK 506 или ISA Т×247.
При введении соединений формулы I или II в комбинации с другими иммунодепрессантами/иммуномодуляторами или противоспалительными средствами дозы вводимых в комбинации иммунодепрессанотов, иммуномодуляторов или противоспалительных соединений зависят от типа совместно вводимого соединения, например, дозы изменяются в зависимости от введенного стероида или ингибитора кальциневрина, от типа лекарственного средства, от состояния, предназначенного для лечения и т.п.
Соответственно, в еще одном варианте настоящего изобретения предлагается:
5. Способ, указанный выше, который заключается в совместном введении, например, одновременном или последовательном, терапевтически эффективного нетоксичного количества соединения формулы I или II или их фармацевтически приемлемой соли, например, соединения формулы I, где каждый R4 и R5 означает водород, или соединения формулы II, где R7a означает водород, или C1-C4алкил, и по крайней мере одного второго лекарственного средства, например, как описано выше.
6. Фармацевтическая комбинация, например, набор, включающий а) первый агент, которым является соединение формулы I или II или их фармацевтически приемлемая соль, например, соединение формулы I, где каждый R4 и R5 означает водород, или соединение формулы II, где R7a означает водород, или C1-C4алкил, свободной форме или в форме фармацевтически приемлемой соли, и б) и по крайней мере одно второе лекарственное средство, например, как описано выше. Набор может содержать инструкцию по его введению.
Термин «совместное введение» или «введение в комбинации», использованный в данном контексте, означает введение выбранных терапевтических агентов одному пациенту, а также включает курсы лечения, при которых агенты вводят не обязательно одинаковым способом или в одно и то же время.
Термин «фармацевтическая комбинация», использованный в данном контексте, означает продукт, полученный при смешивании более одного активного ингредиента, и включает фиксированные и нефиксированные комбинации активных ингредиентов. Термин «фиксированная комбинация» означает, что активные ингредиенты, например, соединение по настоящему изобретению и второе лекарственное вещество, вводят пациенту одновременно в форме единой лекарственной формы или дозы. Термин «нефиксированная комбинация» означает, что активные ингредиенты, например, соединение по настоящему изобретению и второе лекарственное вещество, вводят пациенту в виде отдельных лекарственных форм одновременно или последовательно без ограничения по времени, при этом введение указанным способом обеспечивает терапевтически эффективные уровни обоих соединений в организме пациента. Последнее также относится к комбинированной терапии, например, при введении 3 или более активных ингредиентов.
1. Применение, в качестве единственного активного ингредиента, соединения формулы Ia или его фосфатного производного формулы или или его фармацевтически приемлемой солидля лечения аутоиммунных заболеваний, выбранных из бокового амиотрофического склероза (болезни Лу Герига), синдрома Гийена-Барре и увеита.
2. Применение по п.1, в котором указанное соединение представлено соединением формулы Ia или его фармацевтически приемлемой солью.
3. Применение по п.1, в котором указанное лечение направлено на увеит.
4. Применение по п.1, в котором указанное лечение направлено на боковой амиотрофический склероз.
5. Применение по п.1, в котором указанное лечение направлено на синдром Гийена-Барре.
6. Способ лечения аутоиммунных заболеваний, выбранных из бокового амиотрофического склероза, синдрома Гийена-Барре и увеита, который заключается во введении субъекту, нуждающемуся в таком лечении, в качестве единственного активного ингредиента, эффективного количества соединения формулы Iа или его фосфатного производного формулы или или его фармацевтически приемлемой соли.
7. Способ по п.6, в котором указанное лечение направлено на увеит.
8. Способ по п.6, в котором указанное лечение направлено на боковой амиотрофический склероз.
9. Способ по п.6, в котором указанное лечение направлено на синдром Гийена-Барре.