Клетка для получения гетеропротеинов и способ получения на ее основе
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии и генной инженерии. Предложен способ получения полипептида, включающий культивирование клетки, которая усиленно экспрессирует переносчик бикарбоната и имеет перенесенную ДНК, кодирующую желаемый полипептид, что позволяет клетке продуцировать указанный полипептид, а также соответствующая клетка. 4 н. и 8 з.п. ф-лы, 15 ил., 6 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к клетке, применяемой для получения гетеропротеинов, и к способу их получения на ее основе. Более подробно, настоящее изобретение относится к клетке, которая усиленно экспрессирует переносчик бикарбоната, и к способу получения полипептида с использованием такой клетки.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
В том случае, когда белки, используемые в качестве фармацевтических средств, получают в рамках технологии рекомбинантных ДНК, применение клеток животных позволяет достичь сложной пост-трансляционной модификации и укладки, которые прокариотические клетки не могут осуществить. В этой связи, клетки животных часто используют в качестве клеток-хозяев для получения рекомбинантных белков.
В последнее время было разработано большое число биофармацевтических средств, таких как антитела и физиологически активные белки. Технологии, которые позволяют достичь эффективной продукции рекомбинантных белков клетками животных, ведут к снижению стоимости биофармацевтических средств и дают возможность стабильно снабжать ими пациентов.
В этих условиях желательно иметь способ получения белка с более высокой эффективностью.
Анионообменник представляет собой переносчик, который вовлекается в антипорт внутриклеточных и внеклеточных анионов через плазматическую мембрану (транспортный белок мембраны). Семейство SLC4 представляет собой семейство переносчиков HCO3 -, и три члена, относящиеся к семейству SLC4, а именно: AE1, AE2 и АЕЗ, выполняют функцию обмена Cl-, находящегося за пределами плазматической мембраны, на HCO3 - с внутренней стороны плазматической мембраны.
В почке, AE1 обнаружен в интеркалирующих клетках а в собирающих протоках в базолатеральной мембране (непатентный документ 1). Известно, что мутации в человеческом AE1 вызывают ацидоз дистальных почечных канальцев (непатентные документы 2 и 3).
Кроме того, в почке были выявлены три изоформы AE2, а именно: AE2a, AE2b и AE2c. Считается, что AE2 регулирует гомеостаз внутриклеточного pH для сигнальной трансдукции в клетке (непатентный документ 4). Однако было обнаружено, что мышь, нокаутная по AE2, которая погибает в период отлучения от матери, не имеет фенотипических аномалий почки (непатентный документ 5).
SLC26 представляет собой относительно новое семейство анионообменников, и было высказано предположение, что множество его членов (например, SLC26A3, SLC26A4, SLC26A6 и SLC26A9) являются переносчиками бикарбоната (непатентные документы 6-11).
С другой стороны, неизвестно, можно ли за счет усиленной экспрессии аниообменника, имеющего функцию переносчика бикарбоната, захвата анионов в культивируемой клетке и экскреции анионов за пределы клетки, в которые вовлекается переносчик бикарбоната, достичь искусственного усиления, которое способствовало бы улучшению продукции желаемого рекомбинантного белка в культивируемой клетке.
Непатентный документ 1. van Adelsberg JS. et. al., J Biol Chem 1993; 268:11283-11289
Непатентный документ 2. Shayakui С.et. al., Curr Opin Nephrol Hypertens 2000; 9:541-546
Непатентный документ 3. Alper SL. etal., Annu Rev Physiol 2002; 64:899-923
Непатентный документ 4. Komlosi P. et. al.. Am J Physiol Renal Physiol 2005; 288:F380-F386
Непатентный документ 5. Gawenis LR. et. al., J Biol Chem 2004; 279:30531-30539
Непатентный документ 6. Melvin et al, J Biol Chem 1999; 274:22855-22861
Непатентный документ 7. Ко et al., EMBO J. 2002; 21:5662-5672
Непатентный документ 8. Soleimani et al., Am. J. Physiol. Renal Physiol. 2001; 280:F356-F364
Непатентный документ 9. Wang et al. Am. J. Physiol. Gastrointest. Liver Physiol. 2002; 282:G573-G579
Непатентный документ 10. Petrovic et al., Am. J. Physiol. Renal Physiol. 2004; 286:F161-F169
Непатентный документ 11. Xu et al., Am. J. Physiol. Cell Physiol. 2005; 289:C493-C505
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ПРОБЛЕМА, РЕШАЕМАЯ НАСТОЯЩИМ ИЗОБРЕТЕНИЕМ
Целью настоящего изобретения является разработка способа, который позволял бы эффективно получать полипептид.
ПОДХОДЫ К РЕШЕНИЮ ПРОБЛЕМЫ
В результате масштабных и интенсивных исследований в направлении решения указанной выше проблемы, авторы настоящего изобретения обнаружили, что можно повысить выход желаемого полипептида за счет использования клетки, которая усиленно экспрессирует переносчик бикарбоната. И таким образом цель настоящего изобретения была достигнута. Более того, желаемый полипептид может быть получен в еще большем количестве при использовании клеток, способных к совместной экспрессии переносчика бикарбоната и декарбоксилазы цистеин-сульфиновой кислоты (далее иногда обозначаемой как "CSAD") или аланинаминотрансферазы (далее иногда обозначаемой как "ALT").
Настоящее изобретение можно в обобщенном виде представить следующим образом.
(1) Способ получения полипептида, включающий культивирование клетки, которая усиленно экспрессирует переносчик бикарбоната и которая имеет перенесенную ДНК, кодирующую желаемый полипептид, что позволяет клетке продуцировать указанный полипептид.
(2) Способ по указанному выше пункту (1), в котором клетка, которая усиленно экспрессирует переносчик бикарбоната, представляет собой клетку, в которую была перенесена ДНК, кодирующая переносчик бикарбоната.
(3) Способ получения по указанному выше пункту (1) или (2), в котором клетка, которая усиленно экспрессирует переносчик бикарбоната, дополнительно экспрессирует декарбоксилазу цистеинсульфиновой кислоты или аланинаминотрансферазу.
(4) Способ получения по любому из указанных выше пунктов (1)-(3), в котором переносчик бикарбоната представляет собой анионообменник SLC4 или анионообменник SLC26.
(5) Способ получения по любому из указанных выше пунктов (1)-(3), в котором переносчик бикарбоната представляет собой анионообменник SLC4.
(6) Способ получения по указанному выше пункту (5), в котором анионообменник SLC4 представляет собой AE1.
(7) Способ по любому из указанных выше пунктов (1)-(6), в котором клетка представляет собой клетку яичника китайского хомячка.
(8) Способ по любому из указанных выше пунктов (1)-(7), в котором желаемый полипептид представляет собой антитело.
(9) Способ по любому из указанных выше пунктов (4)-(6), в котором ДНК, кодирующая анионообменник SLC4, представляет собой любую ДНК по пунктам (a)-(e):
(a) ДНК, кодирующая полипептид, имеющий аминокислотную последовательность, представленную в SEQ ID NO:2;
(b) ДНК, кодирующая полипептид, который имеет аминокислотную последовательность, полученную из аминокислотной последовательности, представленной в SEQ ID NO:2, путем замещения, делегирования, добавления и/или инсерции одной или нескольких аминокислотных остатков и которая все еще обладает активностью анионообменника SLC4;
(c) ДНК, кодирующая полипептид, имеющий 50% или большую гомологию аминокислотной последовательности с аминокислотной последовательностью, представленной в SEQ ID NO:2, и которая все еще обладает активностью анионообменника SLC4;
(d) ДНК, имеющая нуклеотидную последовательность, представленную в SEQ ED NO:1;
(e) ДНК, которая гибридизуется в жестких условиях с ДНК, комплементарной ДНК, имеющей нуклеотидную последовательность, представленную в SEQ ID NO:1, и которая все еще кодирует полипептид, обладающий активностью анионообменника SLC4.
(10) Способ получения фармацевтического средства, содержащего полипептид, полученный способом по любому из указанных выше пунктов (1)-(9).
(11) Клетка, которая имеет перенесенную ДНК, кодирующую переносчик бикарбоната, и перенесенную ДНК, кодирующую желаемый полипептид.
(12) Клетка по указанному выше пункту (11), которая дополнительно имеет перенесенную ДНК, кодирующую декарбоксилазу цистеин-сульфиновой кислоты или аланинаминотрансферазу.
(13) Клетка, которая имеет перенесенную ДНК, кодирующую переносчик бикарбоната, и перенесенную ДНК, кодирующую декарбоксилазу цистеин-сульфиновой кислоты или аланинаминотрансферазу.
ЭФФЕКТ, ДОСТИГАЕМЫЙ ПРИ ОСУЩЕСТВЛЕНИИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
В соответствии с настоящим изобретением становится возможным получение желаемого полипептида с высоким выходом.
Настоящее описание охватывает информацию, раскрытую в описании и/или на рисунках заявки на патент Японии №2007-276182, на основании которой испрашивается приоритет настоящей заявки на патент.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
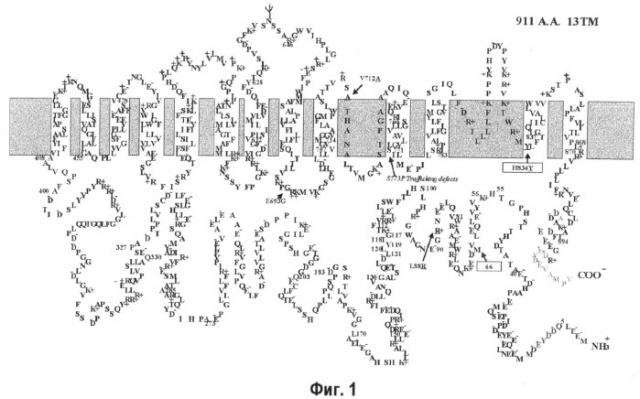
На фиг.1 показана топология мембранного AE1, полученная на основе трансмембранного домена и в направлении, прогнозируемом на основании аминокислотной последовательности человеческого AE1 из клеток печени, по данным программы TMpred, применительно к фиг.1, приведенной в Exo Physiol 91.1 pp.153-161, 2006, Seth L. Alper.
На фиг.2 показана плазмида, используемая для селекции по гигромицину, в которой экспрессировался человеческий АЕ1 (911 аминокислот).
На фиг.3 показана плазмида, используемая для селекции по пуромицину, в которой экспрессировался человеческий AE1 (911 аминокислот).
На фиг.4 показан график, демонстрирующий взаимосвязь количества антитела против гликана-3, продуцируемого на 12 день в периодической культуре с подпиткой в качалочных колбах на 50 мл. Количество анти-гликан-3 антитела, продуцируемого pHyg-AE1-трансформированными клетками (n=4), значительно превышало количество, продуцируемое pHyg-трансформированными клетками (n=4) (P<0,05).
На фиг.5 показан график, демонстрирующий взаимосвязь количества антитела против гликана-3, продуцируемого на 10 день в периодической культуре с подпиткой в качалочных колбах на 50 мл. Количество анти-гликан-3 антитела, продуцируемого штаммом совместно экспрессирующих клеток AE1/CSAD (n=9), которые бьши получены при введении pPur-CSAD в штамм pHyg-AE1-42, или pHyg-AE1-трансформированными клетками, способными к образованию антитела с высоким выходом, было значительно выше, чем количество, которое продуцировали совместно экспрессирующие AE1/pPur клетками (n=8), которые получали при введении pPur в штамм pHyg-AE1-42 (P<0,05).
На фиг.6 показан график, демонстрирующий на 10 день зависимость уровней выживания периодической культуры с подпиткой в качалочных колбах на 50 мл. Уровень выживания штамма совместно экспрессирующих клеток AE1/CSAD (n=9), которые были получены при введении pPur-CSAD в штамм pHyg-AE1-42, или pHyg-AE1-трансформированными клетками, способными к образованию антител с высоким выходом, был значительно выше, чем количество, образуемое совместно экспрессирующими AE1/pPur клетками (n=8), которые были получены при введении pPur в штамм pHyg-AE1-42 (Р<0,01).
Уровень выживания на 7 день выращивания культуры также характеризовался показателем Р<0,01 (данные не приведены).
На фиг.7 показан график, демонстрирующий зависимость количества образуемого антитела против гликана-3 на 8 день выращивания периодической культуры с подпиткой в качалочной колбе на 50 мл. Количество антитела против гликана-3, продуцируемого штаммом совместно экспрессирующих AE1/ALT клеток (n=10), который был получен при введении pPur-ALT1 в штамм pHyg-AE1-42, или pHyg-AE1-трансформированными клетками, способными к образованию антитела с высоким выходом, было выше, чем количество, продуцируемое штаммом AE1/CSAD (n=9) и, кроме того, количество антитела против гликана-3, продуцируемое штаммом совместно экспрессирующих AE1/ALT клеток, было значительно выше, чем количество, образуемое совместно экспрессирующими AE1/pPur клетками (n=8), которые были получены при введении pPur в штамм pHyg-AE1-42 (P<0,01).
На фиг.8 показан график, демонстрирующий взаимосвязь количества антитела, продуцируемого штаммом АА53, или штаммом совместно экспрессирующих AE1/ALT1 клеток, в ходе выращивания периодической культуры в сосуде на 1 л. Количество антитела против гликана-3, образованного на 7 день культивирования, составляло 1,9 г/л.
На фиг.9 показана нуклеотидная последовательность заново клонированного гена CSAD, полученного из CHO клеток хомячка, и рассчитанная на ее основе аминокислотная последовательность.
На фиг.10 показана плазмида, используемая для селекции по пуромицину, которую использовали для экспрессии CSAD хомячка (493 аминокислоты).
На фиг.11 показана плазмида, используемая для селекции по пуромицину, которую использовали для экспрессии ALT1 человека (496 аминокислот).
На фиг.12 показан график, демонстрирующий взаимосвязь количества антитела, образуемого клетками AE1-S08, продуцирующими антитело против IL-6R, полученными из клетки-хозяина, усиленно экспрессирующей АЕ1, в ходе периодического культивирования с подпиткой в сосуде на 1 л. Количество антитела против IL-6R, продуцируемого на 14 день культивирования, составляло 3,0 г/л.
На фиг.13 приведена нуклеотидная последовательность заново клонированного гена переносчика таурина, полученного из CHO клеток хомячка, и вычисленная на ее основе аминокислотная последовательность.
На фиг.14 показана топология мембраны переносчика таурина, которая была создана на основе информации о трансмембранных участках и в ориентации, полученной на основе прогноза с использованием программы TMpred, применительно к аминокислотной последовательности заново клонированного ТаиТ из СНО клеток хомячка, как показано на фиг.5 в работе Shinichi Uchida et al., Proc. Natl. Acad. Sci. USA Vol.89, pp.8230-8234, сентябрь 1992 г. Знак указывает на специфические для TauT хомячка аминокислотные остатки. Большое число аминокислотных остатков, отличных от остатков, имеющихся в TauT человека, присутствует во второй петле (EX: внеклеточный мембранный участок), на 12 трансмембранном участке (TM) и на C-концевом участке (IC: внутриклеточный участок).
На фиг.15 показана плазмида для селекции по гигромицину, которая была использована для экспрессии ТаиТ из хомячка (622 аминокислоты).
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Ниже описаны более подробно варианты осуществления настоящего изобретения.
Настоящее изобретение относится к способу получения полипептида, включающему культивирование клетки, которая усиленно экспрессирует переносчик бикарбоната и имеет перенесенную ДНК, кодирующую желаемый полипептид, что позволяет клетке продуцировать нужный полипептид.
Клетка, используемая в способе по настоящему изобретению, может представлять собой либо природную клетку, способную к продукции желаемого полипептида, либо трансформированную клетку, в которую была перенесена ДНК, кодирующая желаемый полипептид. Предпочтительный способ включает трансформированную клетку, в которую была перенесена ДНК, кодирующая желаемый полипептид.
В способе по настоящему изобретению, желаемый полипептид каким-либо образом не ограничен. Указанный.полипептид может представлять собой любой полипептид, такой как антитело (например, антитело против рецептора IL-6, антитело против гликана-3, антитело против CD-3, антитело против CD-20, антитело против GPIIb/IIIa, антитело против TNF, антитело против CD-25, антитело против EGFR, антитело против Her2/neu, антитело против RSV, антитело против CD-33, антитело против CD-52, антитело против IgE, антитело против CD11a, антитело против VEGF, антитело против VLA4 и т.п.) или физиологически активный белок (например, гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), эритропоэтин, интерферон, интерлейкин, такой как IL-1 или IL-6, t-PA, урокиназа, сывороточный альбумин, фактор свертывания крови, PTH и т.п.). Особенно предпочтительным является антитело, и может использоваться любое антитело, как природное тело, низкомолекулярное антитело (например, Fab, scFv, sc(Fv)2), химерное антитело, гуманизированное антитело и т.п.
При использовании клеток, усиленно экспрессирующих переносчик бикарбоната, количество продуцируемого клетками полипептида может быть повышено.
Переносчик бикарбонатаа представляет собой мембранный белок, который обладает функцией антипорта, с помощью которого бикарбонатные анионы (HCO3 -) или карбонатные анионы (CO3 2-) экскретируются, тогда как хлоридные анионы и сульфатные анионы захватываются. Примером переносчика бикарбоната может служить анионообменник SLC4 и анионообменник SLC26.
Анионообменник SLC4 представляет собой мембранный белок, который регулирует гомеостаз внутриклеточного pH и клеточный объем. В настоящее время в семействе SLC4 известно 10 видов (SLC4A1 (AE1), SLC4A2 (АЕ2), SLC4A3 (АЕ3), SLC4A4 (NBCel), SLC4A5 (NBCe2), SLC4A7 (NBCn1), SLC4A8 (kNBC3), SLC4A9 (NBCn2), SLC4A10 (NBCn3) и SLC4A11 (NaBC1)) и существует, по меньшей мере, один вид изоформы. Указанные анионообменники SLC4 имеют разные функции; например, SLC4A1 (АЕ1), SLC4A2 (АЕ2), SLC4A3 (АЕ3) и SLC4A9 (NBCn2 или АЕ4) являются независимыми от Na+, электрически нейтральными обменниками для Cl- и HCO3 -, SLC4A4 (NBCe1) и SLC4A5 (NBCe2) имеют электрогенный характер, SLC4A7 (NBCn1) представляет собой электрически-нейтральный переносчик для Na+ и HCO3 -, SLC4A8 (kNBC3) и SLC4A10 (NBCn3) представляют собой Na+-зависимые, электрически нейтральные обменники для Cl- и HCO3, и SLC4A11 (NaBC1) представляет собой электрогенный преносчик для Na+ и бората. Указанные выше анионообменники SLC4 демонстрируют сайт-специфическое действие. Так, например, в случае АЕ1, АЕ1, присутствующий в полярных эпителиальных клетках, способствует трансэпителиальной секреции и всасыванию кислот и оснований, тогда как АЕ1, присутствующий в эритроцитах форели, способствует транспорту растворенных веществ. Примерами анионообменника SLC4 являются SLC4A1 (АЕ1), SLC4A2 (АЕ2), SLC4A3 (AE3), SLC4A4 (NBCe1), SLC4A5 (NBCe2), SLC4A7 (NBCn1), SLC4A8 (kNBC3), SLC4A9 (NBCn2), SLC4A10 (NBCn3) и SLC4A11 (NaBC1), в числе которых предпочтительным является AE1.
Анионообменник SLC26 представляет собой многофункциональный мембранный белок, который действует почти во всех системах органов. В случае анионообменника SLC26 известен анионообменник, который опосредует антипорт сульфатных анионов, анионов иодида, анионов формиата, анионов оксалата, хлоридных анионов, гидроксильных анионов, бикарбонатных анионов и т.п., а также участвует в канале переноса ионов хлорида или в системе анион-независимого молекулярного переноса. Считается, что анионообменник SLC26 вовлечен в поддержание гомеостаза различных анионов, и известно 10 видов (SLC26A1, SLC26A2, SLC26A3, SLC26A4, SLC26A5, SLC26A6, SLC26A7, SLC26A8, SLC26A9 и SLC26A11) семейств анионообменников. Так, например, SLC26A3, SLC26A4, SLC26A6 и SLC26A9, которые являются переносчиками для гидроксильных анионов и анионов бикарбоната, регулируют pH внутри мембраны, а также с наружной стороны мембраны, примерно схожим, как и в случае анионообменника SLC4. SLC26A1, SLC26A2, SLC26A4, SLC26A6, SLC26A9 и SLC26A11 экспрессируются в почке. SLC26A1 переносит сульфатные анионы и оксалатные анионы, тогда как SLC26A6 вовлечен в функцию антипорта различных анионов, с тем чтобы захватывать хлорид натрия. SLC26A1, SLC26A4 и SLC26A6 и SLC26A5 являются факторами, вызывающими развитие почечнокаменной болезни, гипертензии и потери слуха, соответственно. SLC26A7 вовлечен в поддержание кислотно-щелочного равновесия и контроля давления крови, таким же образом, как это известно для SLC26A4. Примерами анионообменника SLC26 являются SLC26A1, SLC26A2, SLC26A3, SLC26A4, SLC26A5, SLC26A6, SLC26A7, SLC26A8, SLC26A9 и SLC26A11.
Клетка, которая усиленно экспрессирует переносчика бикарбоната, конкретно не ограничена, главное, чтобы эта клетка имела повышенный уровень экспрессии переносчика бикарбоната в сравнении с соответствующей природной клеткой. Природная клетка конкретным образом не ограничена. Может использоваться клетка, которая используется в качестве клетки-хозяина при получении рекомбинантного белка (например, клетки CHO).
Переносчик бикарбоната, который используется для усиленной экспрессии в клетке, может быть получен из любого организма, и на него не накладываются какие-то особые ограничения. Конкретно, переносчик бикарбоната может быть получен из таких организмов, которые включают человека, грызунов, таких как мышь, крыса и хомяк, млекопитающих, таких как шимпанзе, корова, лошадь, собака и волк, птиц, таких как курица, рыб, таких как данио и угорь, а также насекомых, таких как дрозофила; предпочтительно, переносчик бикарбоната получают из организма человека, грызунов или из организма того же вида, к которому относится клетка-хозяин. Так, например, в том случае, когда клетка, в которой нужно на усиленном уровне экспрессировать переносчик бикарбоната, представляет собой клетку яичника китайского хомячка (клетка CHO), то переносчик бикарбоната предпочтительно получают из организма человека или хомячка.
Клетка, в которой усиленно экспрессируется переносчик бикарбоната, может представлять собой любую клетку, например, эукариотическую клетку, такую как клетки животных, растений и дрожжей, прокариотическую клетку, такую как Е. coli и В. subfcilis и т.п. Предпочтительно используют клетки животных, такие как клетки СНО и COS; особенно предпочтительными являются клетки CHO. Для целей получения желаемого полипептида, предпочтительными являются клетки, подходящие для переноса гена, кодирующего жела-емый-полипептид, такие как CHO-dhfr-клетки.
В качестве клетки, которая усиленно экспрессирует переносчик бикарбоната, может быть взята клетка, в которую искусственно был перенесен ген переносчика бикарбоната (например, ген анионообменника SLC4, ген анионообменника SLC26 и т.п.). Клетка, в которую искусственно был перенесен ген переносчика бикарбоната, может быть получена с помощью способов, известным специалистам в данной области. Например, такая клетка может быть получена путем встраивания переносчика бикарбоната в вектор с последующей трансформацией вектора в клетку. Кроме того, такое понятие, как «клетки, в которые был искусственно перенесен ген переносчика бикарбоната», включает в контексте настоящего описания клетки, в которых эндогенный ген переносчика бикарбоната был активирован с использованием технологии активации гена (см., например, публикацию по международному патенту WO 94/12650), так что переносчик бикарбоната в этом случае будет экспрессироваться на высоком уровне.
В качестве гена анионообменника SLC4, подлежащего переносу в клетку, может использоваться любая из указанных ниже в пунктах от (a) до (e) ДНК, кодирующая анионообменник SLC4.
(a) ДНК, кодирующая полипептид, имеющий аминокислотную последовательность, представленную в SEQ ID NO:2;
(b) ДНК, кодирующая полипептид, который имеет аминокислотную последовательность, полученную из аминокислотной последовательности, представленной в SEQ ID NO:2, путем замещения, делеции, добавления и/или инсерции одного или нескольких аминокислотных остатков, так что при этом анионообменник SLC4 сохраняет активность;
(c) ДНК, кодирующая полипептид, имеющий 50% или большую степень гомологии аминокислотной последовательности с аминокислотной последовательностью, представленной в SEQ ID NO:2, и которая сохраняет активность анионообменника SLC4;
(d) ДНК, имеющая нуклеотидную последовательность, представленную в SEQ ID NO:1;
(e) ДНК, которая гибридизируется с ДНК, комплементарной ДНК, имеющей нуклеотидную последовательность, представленную в SEQ ID NO:1, в жестких условиях и которая все еще кодирует полипептид, обладающий активностью анионообменника SLC4.
Понятие «активность анионообменника SLC4» включает активность, направленную на захват Cl- и SO4 2-, присутствующих в среде, и экскрецию внутриклеточного HCO3 - и бората с целью поддержания гомеостаза по внутриклеточному pH и клеточному объему.
Активность анионообменника SLC4 может быть определена следующим образом.
Клетки, в которых происходит функциональная экспрессия SLC4, обрабатывают BCECF-AM, представляющим собой pH-чувствительный краситель. Затем сравнивают интенсивность флуоресценции между клетками, которые перфузировали средой, содержащей Cl- и Na+, и клетками, которые подвергали перфузии без Cl- и Na+, и в этом случае могут быть определены изменения во внутриклеточном pH (pHi) (Dahl NK. etal., J Biol Chem 2003; 278:44949-44958; Fujinaga J. et. al., J Biol Chem 1999; 274:6626-6633).
В настоящем изобретении с успехом используется ДНК, кодирующая полипептид, имеющий аминокислотную последовательность SEQ ID NO:2, в качестве ДНК, кодирующей анионообменник SLC4. Кроме того, может использоваться ДНК, кодирующая полипептид, имеющий аминокислотную последовательность SEQ ID NO:2, где одна или множество (например, несколько) аминокислот были замещены, делегированы, добавлены и/или встроены, и который также обладает активностью анионообменника SLC4. Аминокислотная последовательность SEQ ID NO:2 представляет собой аминокислотную последовательность АЕ1 человека. Кроме информации о последовательности АЕ1 человека, была зарегистрирована аналогичная информация о соответствующей последовательности для мыши, крысы, шимпанзе, коровы, лошади, собаки, волка, курицы, данио и т.п.; для мыши - GenBank NM_011403; для крысы - GenBank NM 012651; для шимпанзе - GenBank XM 001151353; для коровы -GenBank NM_181036; для лошади - GenBank NM_001081788; для собаки - GenBank AB242566; для волка - GenBank NM_001048031; для курицы - GenBank NM_205522; и для данио - GenBank NM_198338. Таким образом, указанные выше АЕ1 также могут использоваться. Другие анионообменники SLC4 также могут использоваться, если информация об их последовательностях была зарегистрирована в каких-либо базах данных.
Полипептид, который имеет аминокислотную последовательность, полученную из аминокислотной последовательности, представленной в SEQ ID NO:2, путем замещения, делеции, добавления и/или инсерции одного или нескольких аминокислотных остатков, и который все еще обладают активностью аниоонообменника SLC4, функционально эквивалентен анионообменнику SLC4, полученному из организма человека, мыши, крысы, шимпанзе, коровы, лошади, собаки, волка, курицы или данио (далее иногда называемому как «анионообменник SLC4, полученный из организма человека или т.п.»). Такой полипептид включает, например, мутанты анионообменника SLC4, полученного из организма человека или т.п. В описанном ниже примере использован мутант, в котором четыре из 911 аминокислот были замещены (L88R, E693Q V712A и H834Y).
В качестве соответствующих методов могут быть использованы хорошо известные специалистам в данной области способы получения полипептидов, которые функционально эквивалентны специфическому полипептиду, включающие введение мутаций в полипептиды. Так, например, специалисты в данной области могут получить полипептиды, функционально эквивалентные анионообменнику SLC4, полученному из организма человека или т.п., путем соответствующего встраивания мутаций в аминокислоты анионообменника SLC4, полученного из организма человека или т.п., путем сайт-направленного мутагенеза (Hashimoto-Gotoh, Т. et al. (1995) Gene 152, 271-275; ZoUer, MJ, and Smith, M. (1983) Methods Enzymol. 100, 468-500; Kramer, W. et al. (1984) Nucleic Acids Res. 12, 9441-9456; Kramer W, and Fritz HJ (1987) Methods. Enzymol. 154, 350-367; Kunkel, ТА (1985) Proc Nati Acad Sci USA. 82, 488-492; Kunkel (1988) Methods Enzymol. 85, 2763-2766). Мутации в аминокислотах также могут происходить в природе.
Конкретные примеры полипептидов, функционально эквивалентных анионообменнику SLC4, полученному из организма человека или т.п., включают, без ограничения, полипептид, имеющий аминокислотную последовательность, полученную из аминокислотной последовательности (например, SEQ ID NO:2) из анионообменника SLC4, полученного из организма человека или т.п., путем делеции одной или нескольких аминокислот, предпочтительно 1-30 аминокислот, более предпочтительно 1-10 аминокислот; полипептид, имеющий аминокислотную последовательность, полученную из аминокислотной последовательности анионообменника SLC4, полученного из организма человека или т.п., путем добавления одной или нескольких аминокислот, предпочтительно 1-30 аминокислот, более предпочтительно 1-10 аминокислот; полипептид, имеющий аминокислотную последовательность, полученную из аминокислотной последовательности анионообменника SLC4, полученного из организма человека или т.п., путем замещения одной или нескольких аминокислот, предпочтительно 1-30 аминокислот, более предпочтительно 1-10 аминокислот, другими аминокислотами.
Аминокислотные остатки, в которые можно вносить мутации, конкретно не ограничены. Предпочтительно, аминокислотные остатки подвергают мутации до других аминокислот, в которых сохраняется природа боковой цепи исходной аминокислоты. Конкретные примеры аминокислот с боковой цепью соответствующей природы включают гидрофобные аминокислоты (A, I, L, M, F, P, W, Y и V), гидрофильные аминокислоты (R, D, N, С, E, Q, G, Н, К, S и Т), аминокислоты с алифатической боковой цепью (G, A, V, L, I и P), аминокислоты с боковой цепью, содержащей гидроксильную группу (S, Т и Y), аминокислоты с боковой цепью, содержащей атом серы (С и M), аминокислоты с боковой цепью, содержащей карбоновую кислоту и амид (D, N, Е и Q), аминокислоты с боковой цепью, содержащей основание (R, К и H), и аминокислоты с боковой цепью, содержащей ароматическое кольцо (H, F, Y и W) (в скобках приведены однобуквенные сокращения названий аминокислот).
Сообщалось, что полипептид, имеющий аминокислотную последовательность, полученную из исходной аминокислотной последовательности путем модификации (такой как делеция, добавление и/или замещение одной или нескольких аминокислот), сохраняет биологическую активность исходного полипептида (Mark, D.F. et al, Proc. Natl. Acad. Sci. USA (1984) 81, 5662-5666; Zoller, M.J. & Smith, M. Nucleic Acids Research (1982) 10, 6487-6500; Wang, A. et al., Science 224, 1431-1433; Dalbadie-McFarland, G et al., Proc. Natl. Acad. Sci. USA (1982) 79, 6409-6413).
В качестве одного из примеров можно отметить полипептид, в котором один или несколько аминокислотных остатков добавлены, к анионообменнику SLC4, полученному из организма человека или т.п., слитый полипептид, включающий анионообменник SLC4, полученный из организма человека или т.п. Такой слитый полипептид состоит из анионообменника SLC4, полученного из организма человека или т.п., и другого, соединенного с ним полипептида. Такой слитый полипептид может быть получен путем объединения гена, кодирующего анионообменник SLC4, полученный из организма человека или т.п., в рамке считывания с геном, кодирующим другой полипептид, с последующим переносом полученной ДНК в вектор экспрессии и последующей экспрессией ДНК в клетке-хозяине. Для этого могут быть использованы методики, известные специалистам в данной области. При этом отсутствуют какие-либо ограничения, относящиеся к пептиду, подлежащему слиянию с анионообменником SLC4, полученным из организма человека или т.п.
Примеры полипептидов, подходящих для слияния с анионообменником SLC4, полученным из организма человека или т.п., включают, без ограничения, FLAG (Норр, Т.Р. et al, BioTechnology (1988) 6, 1204-1210), 6xHis, включающий шесть гистидиновых (His) остатков, 10xHis, гемагглютинин гриппа (HA), фрагмент c-myc человека, фрагмент VSV-GP, фрагмент p18HIV, Т7-tag, HSV-tag, E-tag, фрагмент антигена SV40T, lck tag, фрагмент а-тубулина, B-tag, фрагмент белка С, глютатион-S-трансферазу (GST), гемагглютинин гриппа (HA), константный участок иммуноглобулина, β-галактозидазу и мальтозо-связывающий белок (МВР).
Коммерчески доступный ген, кодирующий такой полипептид, подвергают слиянию с геном, кодирующим анионообменник SLC4, полученным из организма человека или т.п. Полученный таким образом слитый ген экспрессируют с образованием слитого полипептида.
Альтернативный способ, известный специалистам в данной области как подходящий для целей получения полипептидов, функционально эквивалентных конкретному полипептиду, представляет собой способ, в котором используется методика гибридизации (Sambrook, J et al., Molecular Cloning 2nd ed., 9.47-9.58, Cold Spring Harbor Lab. Press, 1989). Специалисты в данной области могут достаточно легко выделить ДНК, высокогомологичную данной последовательности ДНК (например, с последовательностью SEQ ID NO:1) для анионообменника SLC4, полученного из организма человека или т.п., на основе последовательности ДНК или ее части, и затем выделить полипептиды, функционально эквивалентные анионообменнику SLC4, полученному из организма человека или т.п., согласно данной ДНК.
Условия гибридизации для выделения ДНК, кодирующей полипептид, функционально эквивалентный анионообменнику SLC4, полученному из организма человека или т.п., могут быть соответствующим образом выбраны специалистами в данной области. Так, например, могут быть использованы условия гибридизации низкой жесткости. Условия гибридизации низкой жесткости включают, например, использование температуры 42°C, концентраций солей 2×SSC и 0,1% ДСН, предпочтительно температуры 50°C, концентрации солей 2×SSC и 0,1% ДСН. Более предпочтительно, используются условия высокой жесткости. Так, например, условия высокой жесткости включают температуру 65°C, концентрации солей 2×SSC и 0,1% ДСН. В тех условиях, когда температуру гибридизации снижают, могут быть получены не только ДНК с высокой гомологией, но также ДНК только лишь с низкой гомологией. И, наоборот, ожидается, что при повышении температуры гибридизации будут получены только ДНК с высокой гомологией. Однако, не только температура, но также множество других факторов (такие как концентрация солей) влияют на жесткость условий гибридизации. Специалисты в данной области могут соответствующим образом выбрать те факторы, которые определяют соответствующий уровень жесткости.
Полипептид, кодируемый ДНК, выделенной с помощью указанных методик гибридизации, может характеризоваться 70% или большей степенью гомологии, и обычно имеют высокую степень гомологии с анионообменником SLC4, полученным из организма человека или т.п., по аминокислотной последовательности. Термин «высокая гомология» относится обычно к гомологии на уровне 97% или выше, предпочтительно к гомологии на уровне 98% или выше, более предпочтительно на уровне 99% гомологии или выше. Для определения степени гомологии полипептидов может быть использован алгоритм, описанный в работе Wilbur, W.J. and Lipman, D.J., Proc. Natl. Acad. Sci. USA (1983) 80, 726-730.
Рассматриваемый полипептид может варьировать по аминокислотной последовательности, молекулярной массе, изоэлектрической точке, наличию или отсутствию сахарных цепей, по морфологии и т.п., в зависимости от клетки или клетки-хозяина, который продуцирует полипептид или, в зависимости от способа очистки, который будет описан позже. Однако, если полученный полипептид имеет функции, эквивалентные функциям анионообменника SLC4, полученного из организма человека или т.п., то в рамках настоящего изобретения может использоваться ДНК, кодирующая данный полипептид. Так, например, в том случае, когда полипептид по настоящему изобретению экспрессируют в прокариотическом организме (например, в Escherichia coli), добавляют метиониновый остаток к N-концу исходной аминокислотной последовательности полипептида. В том случае, когда полипептид экспрессируют в эукариотическом организме (например, в клетке млекопитающего), N-концевую последовательность удаляют. Указанные полипептиды могут использоваться в рамках настоящего изобретения.
В настоящем изобретении может использоваться ДНК, кодирующая анионообменник SLC4, ДНК, имеющая нуклеотидную последовательность, представленную в SEQ ID NO:1. Альтернативно, может использоваться ДНК, которая гибридизуется с ДНК, комплементраной к ДНК, имеющей нуклеотидную последовательность, представленную в SEQ ID NO:1, в условиях соответствующей жесткости и которая все еще кодирует полипептид, обладающий активностью анионообменника SLC4. Последовательность SEQ ID NO:1 относится к нуклеотидной последовательности АЕ1 человека. Кроме информации о последовательности АЕ1 человека, была зарегистрирована аналогичная информация по соответствующим последовательностям для мыши, крысы, шимпанзе, коровы, лошади, собаки, волка, курицы, данио и т.п.; для мыши - GenBank NM_011403; для крысы - GeneBank NM_012651; для шимпанзе GenBank ХМ_001151353; для коровы - GeneBank NM_181036; для лошади - GeneBank NM_001081788; для собаки - GenBank AB242566; для волка - GeneBank NM_001048031; для курицы - GenBank NM_205522, и для данио - GenBank NM_198338. Таким образом, может также использоваться АЕ1, описанный выше. Другие анионообменники SLC4 также могут использоваться, если информация об их последовательности зарегистрирована в каких-либо базах данных.
ДНК, кодирующая анионообменник SLC4, может использоваться для получения in vivo или in vitro желаемого полипептида, описанного выше. Кроме того, ДНК, кодирующая анионообменник SLC4, может использоваться при создании клетки, которая экспрессирует на высоком уровне анионообменник SLC4. ДНК, кодирующая анионообменник SLC4, может иметь любую форму, главное, чтобы она была способна кодировать анионообменник SLC4. При этом указанная ДНК может представлять собой кДНК синтезированную на основе мРНК, геномную ДНК или химически синтезированную ДНК. Следует отметить, что если ДНК способна кодировать анионообменник SLC4, то ДНК может иметь любую нуклеотидную последовательность, основанную на вырожденности генетического кода.
ДНК, кодирующая анионообменник SLC4, может быть получена согласно способам, известным специалистам в данной области. Так, например, ДНК может быть получена путем получения библиотеки кДНК из клетки, экспрессирующей анионообменник SLC4, и проведения гибридизации с использованием части последовательност