Внутрилегочное введение флуорохинолона
Иллюстрации
Показать всеПорошкообразная композиция для внутрилегочного введения содержит частицы, включающие ципрофлоксацина бетаина 3,5-гидрат и эксципиент. Частицы имеют массовый медианный аэродинамический диаметр, составляющий от примерно 1 до примерно 5 мкм, ципрофлоксацина бетаина 3,5-гидрат имеет время полужизни в легких, составляющее по меньшей мере 1,5 ч, и композиция характеризуется шероховатостью от 3 до 10. Композицию можно применять для лечения эндобронхиальной инфекции, такой как инфекция, вызываемая Pseudomonas aeruginosa, и она наиболее пригодна для лечения муковисцидоза. 5 з.п. ф-лы, 8 ил., 16 табл., 12 пр.
Реферат
Настоящая заявка притязает на приоритет предварительной заявки на патент США №61/127780, зарегистрированной 15 мая 2008 г., содержание которой полностью включено в настоящее описание в качестве ссылки.
Предпосылки создания изобретения
Один или несколько вариантов осуществления настоящего изобретения относится(ятся) к фармацевтическим композициям, которые содержат один или несколько флуорохинолонов, таких как ципрофлоксацин. Один или несколько вариантов осуществления настоящего изобретения относится(ятся) к порошкам, содержащим бетаиновое производное одного или нескольких флуорохинолонов, такое как ципрофлоксацина бетаин. Один или несколько вариантов осуществления настоящего изобретения относится(ятся) к способам получения, применения и/или введения таких фармацевтических композиций, содержащих их лекарственных форм и устройствам, системам и способам, предназначенным для внутрилегочного введения таких композиций.
Настоящее изобретение относится к композициям и способам лечения бактериальных инфекций и, прежде всего, относится к лечению муковисцидоза (CF), не связанного с муковисцидозом (не-CF) бронхоэктаза и острых осложнений хронического обструктивного заболевания легких.
Муковисцидоз представляет собой наиболее распространенное укорачивающее жизнь генетическое заболевание в Соединенных Штатах и Северной Европе, которое поражает примерно 30000 человек в Соединенных Штатах и близкое к этому количество людей в Западной Европе. Генетический дефект, вызывающий это аутосомальное рецессивное заболевание, представляет собой мутацию в гене муковисцидозного трансмембранного регулятора проводимости (CFTR), который кодирует белок хлоридного канала. Индивидуумы с CF, как правило, страдают хроническими эндобронхиальными инфекциями, синуситом и малабсорбцией, что обусловлено панкреатической недостаточностью, повышенной потерей соли при потении, обструктивным гепатобилиарным заболеванием и пониженной фертильностью. Респираторное заболевание является основной причиной заболеваемости и обусловливает 90% случаев смерти среди людей, страдающих CF. Важным прогностическим фактором выживаемости при CF является легочная функция (которую оценивают путем измерения односекундного объема воздуха при форсированном выдохе (предсказанный % FEV1)), Двулетний срок выживания для данной популяции пациентов с CF снижается в 2 раза при каждом 10%-ном уменьшении предсказанного % FEV1, а для индивидуумов, у которых FEV1 составляет менее 30% от предсказанного, выживаемость в течение 2 лет составляет менее 50% (Kerem E. и др., «Prediction of Mortality in Patients with Cystic Fibrosis», N Engi J Med 326, 1992, ее. 1187-1191). Коэффициенты потери легочной функции варьируются как между индивидуумами, так и для конкретного индивидуума с течением времени. Ретроспективный анализ изменений с течением времени продемонстрировал, что коэффициенты снижения варьируются от менее чем 2% от предсказанного % FEV1 в год до более чем 9% от предсказанного % FEV1 в год, при этом в целом коэффициент снижения выражено ассоциирован с возрастом наступления смерти.
Пациенты с CF страдают утолщением слизистой оболочки, которое, как полагают, вызывается нарушением транспорта ионов, ухудшающим защиту организма-хозяина легких, что приводит к повышению чувствительности к возникающим в раннем возрасте эндобронхиальным инфекциям, вызываемым Staphylococcus aureus, Haemophilus influenzae и Pseudomonas aeruginosa. В пубертатном возрасте у большинства индивидуумов, страдающих CF, в мокроте присутствует Р. aeruginosa. Хронические эндобактериальные инфекции, прежде всего вызываемые Р. aeruginosa, провоцируют устойчивый воспалительный ответ в дыхательных путях, который ускоряет прогрессирование обструктивного заболевания, характеризующегося диффузным бронхоэктазом; Winnie G.B. и др., «Respiratory Tract Colonization with Pseudomonas aeruginosa in Cystic Fibrosis: Correlations Between AxAi-Pseudomonas aeruginosa Antibody Levels And Pulmonary Function», Pediatr Pulmonol 10, 1991, ее. 92-100. Существенное снижение выживаемости, ассоциированное с хронической инфекцией, вызываемой Р. aeruginosa (Henry R.L. и др., «Mucoid Pseudomonas aeruginosa is a Marker of Poor Survival in Cystic Fibrosis», Pediatr Pulmonol 12(3), 1992, ее. 158-161), и выраженная ассоциация приобретения в раннем возрасте хронической инфекции, вызываемой Р. aeruginosa, и детской смертностью (Demko С.А. и др., «Gender Differences in Cystic Fibrosis: Pseudomonas aeruginosa infection», J Clin Epidemiol 48, cc. 1041-1049), позволяет предположить наличие связи между приобретением хронической эндобактериальной инфекции, вызываемой Р. aeruginosa, легочным воспалением, потерей легочной функции и, в конце концов, наступлением смерти.
Были предприняты попытки лечения вызываемых Р. aeruginosa инфекций у пациентов, страдающих CF, с использованием различных терапевтических подходов. Целью таких терапий являлось либо снижение бактериальных нагрузок в легком, либо снижение возникающего при этой инфекции воспаления. Было установлено, что такие терапии приводят к уменьшению коэффициентов снижения легочной функции у инфицированных пациентов, но при этом обладают определенными недостатками.
Исторически, стандартная терапия при лечении эндобактериальных инфекций, вызываемых Р. aeruginosa, заключалась в парентеральном введении в течение 14-21 дня так называемых «антипсевдомонадных» антибиотиков (антибиотиков, обладающих активностью в отношении штаммов Pseudomonas aeruginosa), как правило, включающих аминогликозид. Однако недостаточная способность указанных агентов эффективно проникать из кровотока в легочную ткань и секреция из дыхательных путей приводили к тому, что в области-мишени достигались лишь субтерапевтические концентрации. В результате этого повторное парентеральное введение аминогликозидов приводило к развитию устойчивых изолятов, с которыми ассоциировано повышенное производство слизи и различные вирулентные факторы. Для обеспечения адекватных концентраций лекарственного средства в области инфекции путем его парентерального введения необходимы уровни в сыворотке, которые ассоциированы с нефротоксичностью, токсичностью в отношении преддверия лабиринта и ототоксичностью («American Academy of tolaryngology. Guide for the evaluation of hearing handicap», JAMA 241(19), 1979, ее. 2055-2059); Brummett R.E., «Drug-induced ototoxicity», Drugs 19, 1980, сс.412-428).
Введение путем ингаляции антибиотиков, таких как аминогликозиды, явилось привлекательным альтернативным подходом, позволяющим обеспечивать высокие концентрации антибиотиков непосредственно в области инфекции в эндобронхиальном пространстве, минимизируя при этом системную биодоступность.
Например, TOBI®, содержащий аминогликозид тобрамицин, разрешен для осуществления ингаляционной терапии при лечении эндобронхиальных инфекций у пациентов, страдающих CF [NDA 50-753]. После получения этого разрешения TOBI® (фирма Novartis, Базель, Швейцария) стал стандартным средством для лечения пациентов, страдающих CF, организм которых хронически колонизирован Р. aeruginosa. Пациентам вводят номинальную дозу, составляющую 300 мг, с помощью стандартного струйного распылителя дважды в день. Для уменьшения возможности развития устойчивых бактериальных штаммов пациенты проходят курс лечения, состоящий из 28 дней «он-периода» (период, когда вводят лекарственное средство), за которым следует состоящий из 28 дней «офф-период» (период, когда лекарственное средство не вводят). Однако при этом из дозы, составляющей 300 мг, в легкие поступает только примерно 10% или 30 мг. Клинические опыты, проведенные с использованием TOBI®, продемонстрировали, что вводимый путем ингаляции тобрамицин обладает существенно меньшими системными побочными действиями. Введение в виде аэрозоля дозы объемом 5 мл препарата, содержащего 300 мг тобрамицина в ¼ - нормальном физиологическом растворе, с целью подавления Р. aeruginosa в эндобронхиальном пространстве пациента описано в патенте США №5508269, содержание которого полностью включено в настоящее описание в качестве ссылки.
Существует ряд ограничений, касающихся применения тобрамицина для пациентов, страдающих CF. Системное введение тобрамицина путем IV инъекции может вызывать серьезные побочные действия, включая почечную токсичность и ототоксичность. Распыляемые жидкости могут вызывать действия, связанные с препаратом и его введением, а также развитие повышенной устойчивости (т.е. повышение величины минимальной ингибирующей концентрации, MIC) P. aeruginosa в процессе лечения. Несмотря на риск ухудшения легочной функции, необходимо соблюдать режим лечения, предусматривающий терапевтические «он-периоды» продолжительностью 1 месяц и «офф-периоды» продолжительностью 1 месяц для того, чтобы избежать развития устойчивости, позволяющей чувствительным патогенам осуществлять репопуляцию. В настоящее время недостаточно изучено продолжительное воздействие вводимых путем ингаляции аминогликозидов на почечную функцию. Введение дозы, составляющей 5 мл, занимает примерно 15-20 мин, кроме того, требуется дополнительное время для зарядки и очистки распылителя. Распыление может иметь также и другие недостатки, такие как стоимость, эффективность и воспроизводимость, риск бактериального загрязнения и недостаточная мобильность (необходимость в громоздких компрессорах или баллонах со сжатым газом и источниках энергии).
Помимо вводимых путем ингаляции антибиотиков, таких как поступающие в продажу продукты с товарным знаком TOBI, обычно прописывают ряд других осуществляемых в течение длительного времени терапий с целью снижения количества разрушительных циклов обструкции, инфекции и воспаления в легком индивидуума, страдающего CF. Такие виды терапии, как интенсивный клиренс дыхательных путей, ингаляция бронходилататоров и введение муколитических средств, таких как рекомбинантная человеческая дорназа альфа, все назначают на длительный период времени, создавая тем самым предпосылку для существенного увеличения связанного с лечением бремени для индивидуумов, страдающих CF. Многие пациенты, страдающие CF, тратят более четырех часов ежедневно для осуществления терапии. Не удивительно, что выдерживание терапевтического лечения представляет собой значительную проблему для пациентов, страдающих CF, и что степень недостаточности выдерживания режима лечения может варьироваться в зависимости от конкретного лечения. Принимая во внимание то, что для лечения необходимо продолжительное время, следует признать, что любые режимы, которые позволяют существенно уменьшить время введения и увеличить удобства, связанные с введением (например, мобильность устройства и простоту применения), являются предпочтительными, они потенциально улучшают соблюдение пациентом режима лечения и улучшают результаты лечения. Кроме того, разработка альтернативных предназначенных для ингаляции препаратов, содержащих антибиотики, которые можно вводить в «офф-период» ТОВ-терапии, может явиться основой для альтернативного подхода к лечению, который не приводит к репопуляции чувствительных патогенов и потере легочной функции.
Ципрофлоксацин представляет собой синтетический фторированный карбоксихинолон с широким спектром активности. Ципрофлоксацин избирательно ингибирует синтез бактериальной дезоксирибонуклеиновой кислоты (ДНК) путем воздействия на ДНК-гиразу и топоизомеразу IV. Эти необходимые ферменты контролируют топологию ДНК и принимают участие в репликации, репарации и транскрипции ДНК. Было установлено, что Ципрофлоксацин обладает высокой бактерицидной активностью in vitro в отношении многих патогенов, вызывающих респираторные инфекции, включая Mycobacterium tuberculosis, Mycobacterium avium-M. intracellulare, Bacillus anthracis, Hemophilus influenzae, Neisseria meningitidis и Pseudomonas aeruginosa. В настоящее время Ципрофлоксацин рассматривается как один из флуорохинолонов, который обладает наибольшей, если не самой высокой, активностью в отношении Р. aeruginosa и очень сильными бактерицидными свойствами. Предназначенные для орального и внутривенного введения формы ципрофлоксацина применяли в клинических условиях для лечения инфекций дыхательных путей.
Несмотря на успех, достигнутый при применении ципрофлоксацина, существуют некоторые факторы, которые ограничивают клиническую применимость лекарственного средства для лечения легочных инфекций, к ним относятся его низкая растворимость при физиологических значениях рН, горький вкус при его нахождении в растворе и быстрый почечный клиренс. Например, для того, чтобы внутривенно ввести дозу, составляющую 500 мг, лекарственное средство необходимо развести до концентрации <2 мг/мл и осуществлять медленную инфузию, чтобы избежать осаждения в месте инъекции. Ципрофлоксацин при его внутривенном или оральном введении характеризуется также неблагоприятными фармакокинетическими профилями в нижних дыхательных путях, в том числе сравнительно коротким периодом элиминации (время полужизни составляет от 1,0 до 1,6 ч) и малой площадью под кривой зависимости концентрации от времени, которая составляет от 43 до 113 мг·ч/л.
Следует ожидать, что введение путем ингаляции ципрофлоксацина пациентам, нуждающимся в этом, такими как пациенты, страдающие CF, страдающие ХОЗЛ пациенты и страдающие антраксом (сибирская язва) пациенты, приводит к высоким концентрациям бактерицида в дыхательных путях. Ципрофлоксацин даже в субингибирующих концентрациях воздействует на вирулентность Р. aeruginosa (чувство кворума («quorum sensing»)) и потенциально может снижать встречаемость хронических инфекций дыхательных путей у пациентов, страдающих CF. Снижение бактериальной нагрузки в дыхательных путях и возможное замедление повторной инфекции может приводить к улучшению легочной функции и способствовать улучшению отдаленного прогноза. Кроме того, применение ингаляции ципрофлоксацина может позволить преодолеть возможность возникновения почечной недостаточности, которая отмечена после лечения аминогликозидами.
Однако оказалось, что эффективное внутрилегочное введение ципрофлоксацина является трудно осуществимым. Препятствием, ассоциированным с введением противоинфекционных средств, таких как Ципрофлоксацин, в легкие является возможность быстрого клиренса лекарственного средства вследствие: (а) мукоцилиарного клиренса из дыхательных путей; (б) абсорбции лекарственного средства в системный кровоток; (в) клиренса, опосредуемого легочными макрофагами. После внутритрахеального введения растворимый гидрохлорид ципрофлоксацина быстро абсорбируется из легких в системный кровоток, что характеризуется временем полужизни, составляющим ровно 0,2 ч (Wong J.P., Cherwonogroszky J.W., DiNinno V.L. и др: Liposome-encapsulated ciprifloxacin for the prevention and treatment of infectious diseases caused by intracellular pathogens, в: «Liposomes in Biomedical Applications», под ред. Florence А.Т., Gregoriadis G., изд-во Harwood Academic Press, Amsterdam, 1995, cc.105-120). Такой промежуток времени является слишком коротким для того, чтобы обеспечить эффективное лечение эндобронхиальных инфекций, вызываемых Р. aeruginosa, и это представляет собой существенное ограничение при разработке препаративной формы.
Для преодоления быстрого клиренса гидрохлорида ципрофлоксацина из легких исследователи провели изучение возможности капсулирования в носителях, обеспечивающих контролируемое высвобождение, таких как липосомы. Например, Wong с соавторами продемонстрировали на модели с использованием грызунов, что липосомы позволяют добиться существенного увеличения времени нахождения ципрофлоксацина в легких, что приводит к эффективному лечению инфекций, вызываемых Francicella tularensis. Ограничениями для введения посредством распыления ципрофлоксацина с использованием липосом являются: (а) большие промежутки времени, необходимые для введения, что обусловлено низкими уровнями лекарственной нагрузки и ограничениями на концентрации дисперсии, приемлемые для распыления (ограничение по вязкости); (б) недостаточный контроль кинетики высвобождения. В исследованиях, проведенных Wong, применяли стандартный распылитель. Такие распылители, как правило, обеспечивают скорость потока, составляющую от 0,1 до 0,2 мл/мин. При концентрации лекарственного средства, составляющей 10-40 мкг/мл, скорость потока составляла от 1 до 8 мкг/мин. Если предположить, что эффективность введения составляет примерно 10%, то в легкие можно вводить только от 0,1 до 0,8 мкг/мин. Следовательно, с практической точки зрения с использованием данной модели нецелесообразно вводить в легкие дозы, превышающие 10 мг.
В клинической практике не нашло своего развития применение полимерных носителей в качестве средств увеличения продолжительности времени пребывания гидрохлорида ципрофлоксацина. Сохраняются опасения, связанные с медленным клиренсом полимерных носителей из легких.
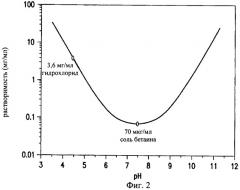
При значениях рН ниже pK1 (6,0) и выше pK2 (8,8) ципрофлоксацин имеет чистый заряд и обладает высокой растворимостью. В диапазоне значений рН от 6,0 до 8,8 соединение является цвиттерионным и практически нерастворимым (растворимость при значении рН 7 составляет 60 мкг/мл). Результаты исследований продемонстрировали, что находящийся в цвиттерионной форме ципрофлоксацина бетаин характеризуется увеличенным временем нахождения в легких (Endermann R., Labischinski H., Ladel С. и др.: Treatment of bacterial diseases of the respiratory organs, заявка на патент США 2004/0254194 A1). Однако Endermann с соавторами не описали введение ципрофлоксацина бетаина в форме, которая позволяет осуществлять легкое, эффективное и воспроизводимое введение в организм пациента.
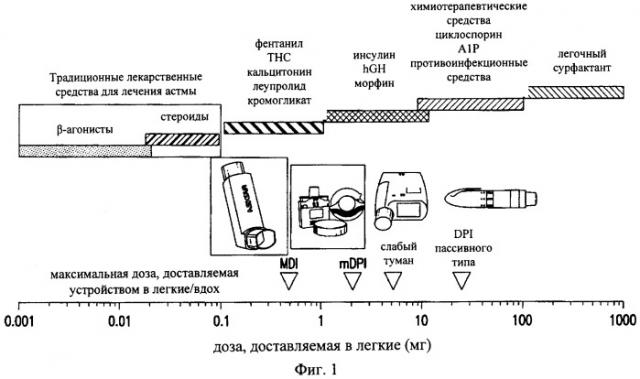
Кроме того, одним из основных препятствий, с которыми сталкиваются при осуществлении внутрилегочного введения противоинфекционных средств, является то, что в этом случае требуются величины терапевтических доз для легкого (>10 мг). На рынке средств, предназначенных для введения в виде аэрозоля, доминируют противоастматические терапевтические средства (например, бронходилататоры и кортикостероиды). Как продемонстрировано на фиг.1, противоастматические лекарственные средства обладают высокой эффективностью при введении в легкие в дозах, составляющих менее чем примерно 100 микрограммов (мкг) (см. также у Weers J., dark A., Challoner P., High dose inhaled powder delivery: challenges and techniques. B: «Respiratory Drug Delivery IX», под ред. R.N. Dalby, P.R. Byron, J. Peart, J.D. Suman, S.J. Farr, изд-bo Davis Healthcare Inti Publishing, River Grove, IL, 2004, cc.281-288).
Таким образом, существующие терапевтические методы имеют ряд недостатков. Принимая во внимание известные системы, предназначенные для введения содержащих антибиотик аэрозолей, можно считать, что сохраняется потребность в создании высокоэффективных и более удобных систем. Один или несколько вариантов осуществления настоящего изобретения позволяет удовлетворить одну или несколько из указанных потребностей.
Краткое изложение сущности изобретения
Настоящее изобретение позволяет удовлетворить указанные существующие в настоящее время потребности.
Одним из объектов изобретения является фармацевтическая композиция для внутрилегочного введения, содержащая флуорохинолон, такой как ципрофлоксацин, моксифлоксацин или левофлоксацин, которая находится в форме, пригодной для эффективного введения в легкие.
Другой объект изобретения относится к порошкообразной композиции для внутрилегочного введения, состоящей из частиц, которые содержат флуорохинолон и эксципиент. Частицы имеют массовый медианный аэродинамический диаметр, составляющий от примерно 1 до примерно 5 мкм. Флуорохинолон характеризуется временем полужизни в легких, составляющим по меньшей мере 1,5 ч.
Следующий объект изобретения относится к порошкообразной композиции для внутрилегочного введения, состоящей из частиц, которые содержат флуорохинолон и эксципиент. Частицы имеют массовый медианный аэродинамический диаметр, составляющий от примерно 1 до примерно 5 мкм, и насыпную плотность, составляющую менее чем примерно 0,6 г/см3, и шероховатость, составляющую от примерно 3 до примерно 10. Флуорохинолон характеризуется временем полужизни в легких, составляющим по меньшей мере 1,5 ч.
Еще один объект изобретения относится к композиции для внутрилегочного введения, состоящей из частиц, которые содержат флуорохинолона бетаин и эксципиент.
Еще один объект изобретения относится к композиции для внутрилегочного введения, состоящей из частиц, которые содержат флуорохинолона бетаин и эксципиент, где частицы представляют собой частицы порошка с шероховатостью, составляющей от примерно 3 до примерно 10.
Еще один объект изобретения относится к композиции для внутрилегочного введения, состоящей из частиц, которые содержат ципрофлоксацина бетаин, где ципрофлоксацина бетаин состоит практически из ципрофлоксацина бетаина 3,5-гидрохлорида (ципрофлоксацина бетаин 3,5Н2О).
Еще один объект изобретения относится к стандартной лекарственной форме для внутрилегочного введения, представляющей собой резервуар, который содержит композицию, находящуюся в порошкообразной форме, где композиция содержит флуорохинолона бетаин.
Еще один объект изобретения относится к стандартной лекарственной форме для внутрилегочного введения, представляющей собой резервуар, который содержит композицию, находящуюся в порошкообразной форме, где композиция содержит флуорохинолона бетаин. Частицы имеют массовый медианный аэродинамический диаметр, составляющий от примерно 1 до примерно 5 мкм, насыпную плотность, составляющую менее чем примерно 0,6 г/см3, и шероховатость, составляющую от примерно 3 до примерно 10.
Еще один объект изобретения относится к системе введения, которая содержит стандартную лекарственную форму, представляющую собой резервуар, который содержит композицию, находящуюся в порошкообразной форме, где композиция содержит флуорохинолона бетаин. Кроме того, система введения содержит ингалятор для сухого порошка, содержащий камеру, приспособленную для помещения в нее капсулы.
Следующий объект изобретения относится к способу изготовления частиц для внутрилегочного введения, заключающемуся в том, что приготавливают жидкий исходный продукт, содержащий флуорохинолона бетаин и эксципиент. Жидкость удаляют из исходного продукта, получая частицы, содержащие флуорохинолона бетаин и эксципиент. Образовавшиеся частицы имеют массовый медианный аэродинамический диаметр, составляющий от примерно 1 до примерно 5 мкм.
Еще один объект изобретения относится к способу изготовления частиц для внутрилегочного введения, заключающемуся в том, что приготавливают жидкий исходный продукт, содержащий флуорохинолона бетаин и эксципиент. Жидкость удаляют из исходного продукта, получая частицы, содержащие флуорохинолона бетаин и эксципиент.Образовавшиеся частицы имеют массовый медианный аэродинамический диаметр, составляющий от примерно 1 до примерно 5 мкм, насыпную плотность, составляющую менее чем примерно 0,6 г/см3, и шероховатость, составляющую от примерно 3 до примерно 10.
Следующий объект изобретения относится к способу лечения эндобронхиальной инфекции, заключающемуся в том, что пациенту, нуждающемуся в этом, вводят путем ингаляции в эффективном количестве композицию, где композиция содержит частицы, содержащие флуорохинолона бетаин и по меньшей мере один эксципиент, и где частицы имеют массовый медианный аэродинамический диаметр, составляющий от примерно 1 до примерно 5 мкм.
Еще один объект изобретения относится к способу лечения эндобронхиальной инфекции, заключающемуся в том, что пациенту, который нуждается в этом, вводят путем ингаляции в эффективном количестве композицию, где композиция содержит частицы, содержащие флуорохинолона бетаин и по меньшей мере один эксципиент, и где частицы имеют массовый медианный аэродинамический диаметр, составляющий от примерно 1 до примерно 5 мкм, насыпную плотность, составляющую менее чем примерно 0,6 г/см3, и шероховатость, составляющую от примерно 3 до примерно 10.
Еще один объект изобретения относится к способу лечения эндобронхиальной инфекции, заключающемуся в том, что пациенту, который нуждается в этом, вводят путем ингаляции в эффективном количестве композицию, где композиция содержит частицы, содержащие флуорохинолона бетаин и по меньшей мере один эксципиент, и где частицы имеют массовый медианный аэродинамический диаметр, составляющий от примерно 1 до примерно 5 мкм, и где композицию в эффективном количестве вводят посредством четырех или меньшего количества ингаляций, предпочтительно посредством трех, более предпочтительно посредством одной ингаляции.
Еще один объект изобретения относится к способу лечения эндобронхиальной инфекции, заключающемуся в том, что пациенту, который нуждается в этом, вводят путем ингаляции в эффективном количестве композицию, где композиция содержит частицы порошка, содержащие флуорохинолон и по меньшей мере один эксципиент, и где частицы имеют массовый медианный аэродинамический диаметр, составляющий от примерно 1 до примерно 5 мкм, и где флуорохинолон имеет время полужизни в легких, составляющее по меньшей мере 1,5 ч.
Еще один объект изобретения относится к способу лечения эндобронхиальной инфекции, заключающемуся в том, что пациенту, который нуждается в этом, вводят путем ингаляции в эффективном количестве композицию, где композиция содержит частицы порошка, содержащие флуорохинолон и по меньшей мере один эксципиент, и где частицы имеют массовый медианный аэродинамический диаметр, составляющий от примерно 1 до примерно 5 мкм, насыпную плотность, составляющую менее чем примерно 0,6 г/см3, и шероховатость, составляющую от примерно 3 до примерно 10, и где флуорохинолон имеет время полужизни в легких, составляющее по меньшей мере 1,5 ч.
Один или несколько вариантов осуществления настоящего изобретения относится(ятся) к порошкообразной композиции, содержащей флуорохинолона бетаин, такой как ципрофлоксацина бетаин, которую можно вносить в капсулу размера №2 (или имеющую меньший объем), и которая обеспечивает при внутрилегочном введении посредством одной ингаляции поступление в легкие дозы, составляющей по меньшей мере примерно 10 мг.
Один или несколько вариантов осуществления настоящего изобретения относится(ятся) к порошкообразной композиции, содержащей флуорохинолона бетаин, такой как ципрофлоксацина бетаин, которую можно вносить в капсулу размера №2 (или имеющую меньший объем), и которая обеспечивает при внутрилегочном введении посредством трех или четырех, или меньшего количества ингаляций поступление в легкие терапевтической дозы.
Один или несколько вариантов осуществления настоящего изобретения относится(ятся) к порошкообразной композиции, содержащей флуорохинолона бетаин, такой как ципрофлоксацина бетаин, которую можно вносить в капсулу размера №2 (или имеющую меньший объем), и которая обеспечивает при внутрилегочном введении посредством двух ингаляций поступление в легкие терапевтической дозы.
Один или несколько вариантов осуществления настоящего изобретения относится(ятся) к порошкообразной композиции, содержащей флуорохинолона бетаин, такой как ципрофлоксацина бетаин, которую можно вносить в капсулу размера №2 (или имеющую меньший объем), и которая обеспечивает при внутрилегочном введении посредством одной ингаляции поступление в легкие терапевтической дозы.
В одном или нескольких вариантах осуществления настоящего изобретения порошкообразная композиция, представляет собой частицы, содержащие в количестве от 50 до 70 мас.% кристаллический ципрофлоксацина бетаин, на который нанесено пористое покрытие из насыщенного фосфатидилхолина с длинной цепью, где частицы имеют массовый медианный диаметр, составляющий от примерно 1 до примерно 5 мкм, массовый медианный аэродинамический диаметр, составляющий от примерно 1 до примерно 5 мкм, и шероховатость (Sv), составляющую от примерно 3 до примерно 10.
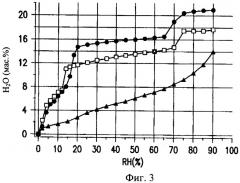
В одном или нескольких вариантах осуществления настоящего изобретения порошкообразная композиция, представляет собой частицы, содержащие кристаллический ципрофлоксацина бетаина 3,5-гидрат, который имеет остаточное содержание влаги, составляющее от 10 до 15 мас.%, и значение рН после восстановления, составляющее от 6,0 до 8,8.
В одном или нескольких вариантах осуществления настоящего изобретения порошкообразная композиция, представляет собой частицы, содержащие кристаллический ципрофлоксацина бетаина 3,5-гидрат и эксципиент, где удельная площадь поверхности частиц составляет от 8 до 20 м2/г, пористость частиц составляет от 5 до 20 см3/г, и шероховатость (Sv) составляет от 3 до 10.
В одном или нескольких вариантах осуществления настоящего изобретения порошкообразная композиция, представляет собой частицы, содержащие кристаллический ципрофлоксацина бетаина 3,5-гидрат, на которые нанесен пористый слой покрытия из эксципиента, где удельная площадь поверхности частиц составляет от 8 до 20 м2/г, пористость частиц составляет от 5 до 20 см3/г, и шероховатость (Sv) составляет от 3 до 10.
В одном или нескольких вариантах осуществления настоящего изобретения порошок, содержащий флуорохинолон, вносят в резервуар, такой как капсула, где порошок имеет насыпную плотность по данным измерений методом одноосевого сжатия, составляющую от 0,1 до 0,6 г/см3.
В одном или нескольких вариантах осуществления настоящего изобретения порошок, содержащий флуорохинолон, вносят в резервуар, такой как капсула, где порошок имеет насыпную плотность по данным измерений методом одноосевого сжатия, составляющую менее 0,6 г/см3, и более предпочтительно составляющую от 0,2 до 0,5 г/см3.
В одном или нескольких вариантах осуществления настоящего изобретения фармацевтическая композиция представляет собой порошок, содержащий в терапевтически эффективном количестве ципрофлоксацина бетаин и фармацевтически приемлемые эксципиенты, где порошок представляет собой частицы, содержащие кристаллический ципрофлоксацина бетаин в количестве, составляющем от 50 до 70 мас.%, и смесь дистеароилфосфатидилхолина и дигидрата хлорида кальция в молярном соотношении 2:1 в количестве, составляющем от 30 до 50 мас.%
В одном или нескольких вариантах осуществления настоящего изобретения стандартная лекарственная форма представляет собой контейнер, содержащий фармацевтическую композицию, которая представляет собой порошок, содержащий в терапевтически эффективном количестве ципрофлоксацина бетаин и фармацевтически приемлемые эксципиенты, где порошок представляет собой частицы, содержащие кристаллический ципрофлоксацина бетаин в количестве, составляющем от 50 до 70 мас.%, и смесь дистеароилфосфатидилхолина и дигидрата хлорида кальция в молярном соотношении 2:1 в количестве, составляющем от 30 до 50 мас.%.
В одном или нескольких вариантах осуществления настоящего изобретения система введения включает ингалятор для сухого порошка и фармацевтическую композицию, которая представляет собой порошок, содержащий в терапевтически эффективном количестве ципрофлоксацина бетаин и фармацевтически приемлемые эксципиенты, где порошок представляет собой частицы, содержащие кристаллический ципрофлоксацина бетаин в количестве, составляющем от 50 до 70 мас.%, и смесь дистеароилфосфатидилхолина и дигидрата хлорида кальция в молярном соотношении 2:1 в количестве, составляющем от 30 до 50 мас.%.
В одном или нескольких вариантах осуществления настоящего изобретения способ изготовления высушенных распылением частиц заключается в том, что суспендируют кристаллический ципрофлоксацина бетаин в жидкости, представляющей собой субмикронную эмульсию капель, стабилизированную фармацевтически приемлемыми эксципиентами, с образованием исходного продукта, и подвергают исходный продукт распылительной сушке с получением высушенных распылением частиц, где частицы содержат ципрофлоксацина бетаин, на который нанесено пористое покрытие из фармацевтически приемлемых эксципиентов, где частицы имеют массовый медианный диаметр, составляющий от 1 до 5 мкм, массовый медианный аэродинамический диаметр, составляющий от 1 до 5 мкм, и шероховатость (Sv), составляющую от 3 до 10.
В одном или нескольких вариантах осуществления настоящего изобретения способ изготовления высушенных распылением частиц заключается в том, что суспендируют кристаллический ципрофлоксацина бетаин в жидкости, представляющей собой субмикронную эмульсию капель, стабилизированную фармацевтически приемлемыми эксципиентами, с образованием исходного продукта, и подвергают исходный продукт распылительной сушке с получением высушенных распылением частиц, где частицы содержат кристаллы ципрофлоксацина бетаина 3,5-гидрата, на который нанесено пористое покрытие из фармацевтически приемлемых эксципиентов, где частицы имеют массовый медианный диаметр, составляющий от 1 до 5 мкм, массовый медианный аэродинамический диаметр, составляющий от 1 до 5 мкм, и шероховатость (Sv), составляющую от 3 до 10.
В одном или нескольких вариантах осуществления настоящего изобретения способ лечения легочных инфекций заключается в том, что пациенту, нуждающемуся в этом, вводят путем ингаляции в эффективном количестве композицию, содержащую ципрофлоксацина бетаин, где композиция находится в форме порошка, представляющего собой частицы, которые содержат ципрофлоксацина бетаин в количество, составляющем от 50 до 70 мас.%, и имеют массовый медианный диаметр, составляющий от 1 до 5 мкм, массовый медианный аэродинамический диаметр, составляющий от 1 до 5 мкм, и шероховатость (Sv), составляющую от 3 до 10.
В одном или нескольких вариантах осуществления настоящего изобретения порошки для внутрилегочного введения изготавливают путем распылительной сушки исходного продукта на основе эмульсии с помощью мобильной сушилки небольшой мощности фирмы Niro при температуре на входе от 125 до 145°С и температуре на выходе от 60 до 80°С. Получаемые в результате частицы характеризуются пластинчатой морфологией, характерной для лекарственной субстанции, и на них наносят пористый слой покрытия из эксципиентов, при этом шероховатость (Sv) частиц составляет от 3 до 10.
В одном или нескольких вариантах осуществления настоящего изобретения порошки представляющие собой частицы, которые содержат флуорохинолон, вносят в капсулы №2 из гидроксипропилметилцеллюлозы (ГПМЦ), при этом вносимая масса составляет от 20 до 60 мг.
В одном или нескольких вариантах осуществления настоящего изобретения порошки, предлагаемые в настоящем изобретении, содержат в качестве лекарственной субстанции ципрофлоксацина бетаин и обладают временем полужизни, превышающим 3 ч, что способствует повышению эффективности в отношении Р. aeruginosa.
В одном или нескольких вариантах осуществления настоящего изобретения порошки, содержащие ципрофлоксацин, позволяют осуществлять лечение инфекций, вызываемых Pseudomonas aeruginosa, у пациентов, страдающих CF, в течение месячного «офф-периода», который следует после месячного «он-периода» лечения путем ингаляции тобрамицина TOBI®.
В одном или нескольких вариантах осуществления настоящего изобретения порошки, содержащие ципрофлоксацин, позволяют осуществлять лечение инфекций у страдающих ХОЗЛ пациентов.
В одном или нескольких вариантах осуществления настоящего изобретения порошки, содержащие ципрофлоксацин, позволяют осуществлять лечение вызываемых возбудителем сибирской язвы инфекций.
В одном или нескольких вариантах осуществления настоящего изобретения полученные путем сушки распылением порошки, содержащие ципрофлоксацин, оказывают позитивное воздействие на качество жизни пациентов, страдающих CF, путем улучшения продолжительной легочной функции (FEV1), при этом они требуют небольшого времени, например, менее пяти минут, для введения с помощью портативного ингалятора.
В одном или нескольких вариантах осуществления настоящего изобретения соотношение величин AUCв мокроте/АUСв плазме, обеспечиваемое эффективным направленным введением ципрофлоксацина бетаина в легкие, превышает 50, предпочтительно превышает 100, и более предпочтительно превышает 250.
В одном или нескольких вариантах осуществления настоящего изобретения частицы, предлагаемые в настоящем изобретении, которые содержат ципрофлоксацина бетаин, не требуется смешивать с грубыми частицами носителя, представляющего собой лактозу, для обеспечения очень высокой флуидизации и диспергирования порошка.
В одном или нескольких вариантах осуществления настоящего изобретения композиция, содержащая флуорохинолона бетаин, такой как ципрофлоксацина бетаин, характеризуется эффективн