Мутантные формы стрептолизина о
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой очищенный мутантный белок стрептолизина О с последовательностью SEQ ID NO:1, где аминокислоты в положениях Р427 и W535 заменены другой аминокислотой, или с последовательностью SEQ ID NO:25. При этом гемолитическая активность мутантного белка SLO снижена по меньшей мере на 50% по сравнению с SLO дикого типа. Изобретение относится также к вакцинным композициям для профилактики инфекции, вызываемой S. pyogenes и содержащим указанный белок стрептилизина. Изобретение позволяет получать мутантные формы стрептолизина О, которые не являются токсичными, но которые все еще сохраняют способность индуцировать защиту от S. pyogenes и находят применение в вакцинных композициях для индукции защиты от S. pyogenes. 7 н. и 8 з.п. ф-лы, 26 ил., 21 табл., 8 пр.
Реферат
По настоящей заявке испрашивается приоритет заявки US61/016193, поданной 21 декабря 2007, и заявки US61/088381, поданной 13 августа 2008, полное содержимое которых включено в настоящее описание в качестве ссылки.
Область техники, к которой относится изобретение
Изобретение относится к областям иммунологии и вакцинологии.
Уровень техники изобретения
Стрептолизин О (SLO; GAS25) является одним из наиболее важных факторов вирулентности патогена человека Streptococcus pyogenes (GAS). Вследствие его способности вызывать ранний и сильный иммунный ответ у человека, он широко используется в качестве диагностического маркера инфекции GAS.
SLO принадлежит к семейству высокогомологичных тиол-активируемых цитолизинов (TACY), которые проявляют свою цитолизитическую активность посредством взаимодействия с холестеролом на клеточной мембране, самопроизвольной олигомеризации и формирования пор. Более того, их способность активировать напрямую классический путь системы комплемента путем связывания с Fc-областью человеческого IgG может приводить к прямой комплимент-опосредованной атаке на клетки-хозяева. TACY также могут взаимодействовать с иммунной защитой и функциями иммунных клеток посредством индукции цитокинов и медиаторов воспаления.
Некоторые TACY могут пассивно или активно защищать лабораторных животных. См. FEMS Lett. 182, 197-205, 2000. Однако применение этих токсинов в качестве вакцинных кандидатов было затруднено из-за их сложного паттерна вредных побочных эффектов. Следовательно, существует потребность в получении белков SLO, которые не являются токсичными.
Краткое описание чертежей
Фиг.1. Трехмерная компьютерная модель SLO. Пролины представлены как закрашенные. Pro427 окрашен в белый цвет.
Фиг.2. График, показывающий результаты гемолитического теста с использованием экстрактов E. coli, содержащих SLO дикого типа и Мутант SLO P427L.
Фиг.3. Микрофотография SDS-полиакриламидного геля, показывающая очищенный Мутант SLO P427L.
Фиг.4. График, показывающий результаты гемолитического теста с использованием очищенных SLO дикого типа и мутанта SLO P427L.
Фиг.5. Микрофотография SDS-полиакриламидного геля супернатантов E. coli лизатов. Дорожка А - E. coli отрицательный контроль; дорожка В - rSLO дикий тип немеченый; дорожка С - rSLO P427L без метки; и дорожка D - очищенный rSLO дикий тип немеченый (5 мг).
Фиг.6. График, демонстрирующий, что при одних и тех же условиях Мутант SLO P427L является в 1000 раз менее гемолитическим, чем SLO дикого типа.
Фиг.7. График, демонстрирующий влияние холестерола на гемолиз SLO дикого типа и мутантом SLO P427L.
Фиг 8. Микрофотография SDS-PAGE анализа общего количества немеченых белков в клеточных экстрактах. Фиг.8А, экспрессия SLO дикого типа и P427L не-меченных белков; Фиг.8В, экспрессия SLO P427L+W535, P427L+C530G, и P427L+C530G+W535F не-меченных белков.
Фиг.9. Микрофотография SDS-PAGE анализа общего количества His-меченных белков в клеточных экстрактах.
Фиг.10. Микрофотография SDS-PAGE анализа очищенных His-меченных белков.
Фиг.11. Микрофотография SDS-PAGE анализа очищенных немеченых белков. Фиг.11А, дорожки: А, немеченый SLO дикий тип; В, немеченый SLO P427L; маркеры молекулярного веса (116-66.2-45-35-25-18.4-14.4); черная стрелка указывает на Белок SLO, выделенный из мутантов и клонов дикого типа. Фиг 11В, дорожка А, немеченый SLO дикий тип (3 мкг), дорожка В, SLO P427L-W535F немеченый (3 мкг), маркеры молекулярного веса (116-66.2-45-35-25-18.4-14.4); черная стрелка указывает на Белок SLO, выделенный из мутантов и клонов дикого типа.
Фиг.12. Микрофотография SDS-PAGE анализа очищенного немеченого Белка SLO дикого типа. Образцы различных партий очистки дикого типа SLO были проанализированы при восстанавливающих и не восстанавливающих условиях.
Фиг.13. График, показывающий результаты гемолитического теста His-меченных мутантов SLO.
Фиг.14. График, показывающий ингибирование SLO-индуцированной гемолитической активности анти-SLO сывороткой.
Фиг.15. График, показывающий титрование ингибирования анти-SLO сывороткой SLO гемолиза.
Фиг.16. График, показывающий титрование SLO гемолитической активности.
Фиг.17. График, показывающий титрование гемолитической активности SLO дикого типа, химически детоксифицированного SLO дикого типа и мутантов SLO (P427L; P427L+W535F).
Фиг.18. График, показывающий титрование гемолитической активности SLO дикого типа и мутантов SLO (P427L; P427L+W535F).
Фиг.19. График, показывающий титрование гемолитической активности SLO дикого типа и химически детоксифицированного SLO дикого типа
Фиг.20. График, показывающий разведение антисыворотки против мутанта SLO P427L+W535F, необходимое для получения 50% снижения гемолитической активности SLO (50 нг/мл SLO).
Фиг.21. График, показывающий разведение антисыворотки против мутанта SLO P427L+W535F, необходимое для получения 50% снижения гемолитической активности SLO (100 нг/мл SLO).
Фиг.22. Кривая титрования, показывающая, что анализы ингибирования гемолиза были проведены при таких концентрациях токсина, которые позволяют 100% гемолиз.
Фиг.23. Выравнивание SLO белков. M1_SF370, SEQ ID №: 1; M12_2096, SEQ ID №:2; M12_9429, SEQ ID №:3; M1_5005, SEQ ID №:4; M2, SEQ ID №:5; M28, SEQ ID №:6; M6, SEQ ID №:7; M18, SEQ ID №:8; M5, SEQ ID №:9; M3, SEQ ID №:10; M3_SSI SEQ ID №:11; и M4, SEQ ID №:12.
Фиг.24. Выравнивание SLO дикого типа и His-меченных мутантов SLO. SLO_M1strainSF370, SEQ ID №:13; SLO WT_histagged, SEQ ID №:14; SLOmut.P427L_histagged, SEQ ID №:15; SLOmut.C530G_histagged, SEQ ID №:16; SLOmut.DeltaA248_histagged, SEQ ID №:17; SLOmut.W535F_histagged, SEQ ID №:18; и SLOmutW535F&D482N_histagged, SEQ ID №:19.
Фиг.25. График, сравнивающий снижение SLO гемолитической активности антисывороткой против SLO дикого типа и антисывороткой против мутанта SLO P427L+W535F.
Фиг.26. График, показывающий in vivo протективные свойства рекомбинантного Мутанта SLO P427L+W535F, с использованием как алюминия, так и MF59 в качестве адъювантов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение представляет мутанты стрептолизина О (SLO; GAS25), которые являются нетоксичными, но все еще сохраняют способность индуцировать защиту от S. pyogenes. Мутантные формы SLO являются применимыми, среди прочего, в вакцинных композициях для индуцирования защиты от S. pyogenes.
Мутантные белки SLO.
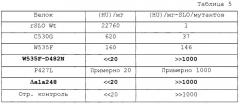
Мутантные формы SLO по изобретению имеют по меньшей мере на 50% меньшую гемолитическую активность, чем SLO дикого типа (например, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 96, 97, 98, 99, или 100%) по сравнению с SLO дикого типа, как определено при проведении гемолитического теста, но являются иммуногенными, то есть они наделяют защитой от летального инфицирования GAS в мышиной модели (например, см. Пример 7). Мутанты SLO по изобретению включают мутанты SLO P427L (SEQ ID №:20), W535F (SEQ ID №:21), C530G (SEQ ID №:22), ΔA248 (SEQ ID №:23), W535F+D482N (SEQ ID №:24), P427L+W535F (SEQ ID №:25), P427L+C530G (SEQ ID №:26), и P427L+C530G+W535F (SEQ ID №:27). Изобретение также включает His-меченные версии этих мутантов. Примеры показаны на Фиг.24.
Мутанты SLO по изобретению включают мутанты с изменениями в аминокислотной последовательности (то есть, замещение, делеция или вставка) в одной или нескольких аминокислотах P427, W535, C530, A248, и D482, пронумерованных в соответствии с последовательностью SLO дикого типа, представленной в SEQ ID №:1. Фиг.23 представляет выравнивание последовательностей GAS25 дикого типа из различных М типов.
Мутанты SLO по изобретению включают мутанты с единичными, двойными или тройными изменениями в аминокислотной последовательности («единичные мутанты», «двойные мутанты» или «тройные мутанты») в положениях P427, W535, C530, A248, и/или D482. Так, мутанты SLO могут включать следующие:
i. P427L (SEQ ID №:20), P427R, P427N, P427C, P427Q, P427E, P427G, P427H, P4271, P427L, P427K, P427M, P427F, P427A, P427S, P427T, P427W, P427Y или P427V;
ii. W535F (SEQ ID №:21), W535R, W535N, W535D, W535C, W535Q, W535E, W535G, W535I, W535L, W535K, W535M, W535A, W535P, W535S, W535T, W535Y или W535V;
iii. C530G (SEQ ID №:22), C530R, C530N, C530D, C530S, C530Q, C530E, C530A, C530H, C530I, C530L, C530K, C530M, C530F, C530P, C530T, C530W, C530Y или C530V;
iv. D482L, D482R, D482N, D482C, D482Q, D482E, D482G, D482H, D482I, D482L, D482K, D482M, D482F, D482A, D482S, D482T, D482W, D482Y или D482V;
v. A248L, A248R, A248N, A248C, A248Q, A248E, A248G, A248H, A248I, A248L, A248K, A248M, A248F, A248S, A248T, A248W, A248Y, или A248V;
vi. ΔP427; или ΔW535; или ΔC530; или ΔD482; или ΔA248 (SEQ ID №:23); и
vii. их комбинации, такие как W535F+D482N (SEQ ID №:24), P427L+W535F (SEQ ID №:25), P427L+C530G (SEQ ID №:26), и P427L+C530G+W535F (SEQ ID NO.27).
Двойные мутанты по изобретению включают P427L+W535F (SEQ ID NO25), P427L+C530G (SEQ ID №:26), P427L+A248L, P427L+D482L, W535F+C530G, W535F+A248L, W535F+D482L, C530G+A248L, и A248L+D482L. Тройные мутанты включают P427L+C530G+A248L, P427L+C530G+D482L, P427L+A248L+D482L, P427L+C530G+W535F (SEQ ID №:27), W535F+C530G+A248L, W535F+C530G+D482L, W535F+A248L+D482L, и C530G+A248L+D482L.
Мутантные белки SLO по изобретению также включают слитые полипептиды, которые включают мутантный белок SLO, как описано выше, и другой антиген GAS. Антигены GAS раскрыты, например, в WO 02/34771 и включают, но не ограничиваются, GAS39 (spy0266; gi-15674446), GAS40 (spy0269; gi-15674449), GAS42 (spy0287; gi-15674461), GAS45 (M5005_spy0249; gi-71910063), GAS57 (spy0416; gi-15674549), GAS58 (spy0430; gi-15674556), GAS84 (spy1274; gi-15675229), GAS95 (spt1733; gi-15675582), GAS117 (Spy0448; gi-15674571), GAS130 (spy0591; gi-15674677), GAS137 (spy0652; gi-15674720), GAS159 (spy1105; gi-15675088), GAS193 (spy2025; gi-15675802), GAS202 (spy1309; gi-15675258), GAS217 (spy0925; gi-15674945), GAS236 (spy1l26; gi-15675106), GAS253 (spy1524; gi-15675423), GAS277 (spy1939; gi-15675742), GAS294 (spy1173; gi-15675145), GAS309 (spy0124; gi-15674341), GAS366 (spy1525; gi-15675424), GAS372 (spy1625; gi-15675501), GAS384 (spy1874; gi-15675693), GAS389 (spy1981; gi-15675772), GAS504 (spy1751; gi-15675600), GAS509 (spy1618; gi-15675496), GAS290 (spy1959; gi-15675757), GAS511 (spy1743; gi-15675592), GAS527 (spy1204; gi-15675169), GAS529 (spy1280; gi-15675233), и GAS533 (spy1877; gi-15675696). Дополнительные антигены GAS включают, но не ограничиваются GAS68 (Spy0163; gi13621456), GAS84 (Spy1274; gi13622398), GAS88 (Spy1361; gi13622470), GAS89 (Spy1390; gi13622493), GAS98 (Spy1882; gi13622916), GAS99 (Spy1979; gi13622993), GAS102 (Spy2016, gi13623025), GAS146 (Spy0763; gi13621942), GAS195 (Spy2043; gi13623043), GAS561 (Spy1l34; gi13622269), GAS179 (Spy1718, gi13622773) и GAS681 (spy1l52; gi1362228).
Молекулы нуклеиновых кислот, кодирующие мутантные белки SLO.
Изобретение включает молекулы нуклеиновых кислот, которые кодируют мутантные белки SLO. Изобретение также включает молекулы нуклеиновых кислот включающие нуклеотидные последовательности, имеющие последовательность, по меньшей мере на 50% идентичную таким молекулам. В зависимости от конкретной последовательности, степень идентичности последовательности является предпочтительно большей, чем 50% (например, 60%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более). Идентичность нуклеотидных последовательностей предпочтительно определяется алгоритмом поиска гомологии Smith-Waterman, который реализован в программе MPSRCH (Oxford Molecular), с применением поиска родственного пропуска параметрами штрафа за открытие пропуска = 12 и штрафа за удлинение пропуска = 1.
Изобретение также предоставляет молекулы нуклеиновой кислоты, которые могут гибридизоваться с этими молекулами. Реакции гибридизации могут проводиться в условиях различной «жесткости». Условия, которые увеличивают жесткость реакции гибридизации, широко известны и опубликованы в области техники. См., например, стр. 7.52 в Sambrook et al, Molecular Cloning: A Laboratory Manual, 1989. Примеры подходящих условий включают (в порядке увеличения жесткости): температуры инкубации 25°C, 37°C, 50°C, 55°C и 68°C; концентрации буферного раствора 10X SSC, 6X SSC, 1X SSC, и 0,1X SSC (где SSC является 0,15 M NaCl и 15 мМ цитратным буфером) и их эквиваленты в других буферных системах, концентрации формамида 0%, 25%, 50%, и 75%; время инкубации от 5 минут до 24 часов; 1, 2 или несколько промывочных шагов; время инкубации Промывки 1, 2, или 15 минут; и промывочные растворы 6X SSC, 1X SSC, 0,1X SSC или деионизированная вода. Техники гибридизации и их оптимизация хорошо известны в области техники. См., например, Sambrook, 1989; Ausubel et al, eds., Short Protocols in Molecular Biology, 4th ed., 1999; Патент U.S. 5707829; Ausubel et al, eds., Current Protocols in Molecular Biology, Supplement 30, 1987.
В некоторых вариантах осуществления, молекулы нуклеиновой кислоты по изобретению гибридизуются с мишенью в условиях низкой жесткости; в других вариантах осуществления, молекулы нуклеиновой кислоты по изобретению гибридизуются в условиях средней жесткости; в предпочтительных вариантах осуществления молекулы нуклеиновой кислоты по изобретению гибридизуются в условиях высокой жесткости. Примером условий гибридизации низкой жесткости являются 50°C и 10X SSC. Примером условий гибридизации средней жесткости являются 55°C и 1X SSC. Примером условий гибридизации высокой жесткости являются 68°C и 0,1X SSC.
Получение мутантных белков SLO
Получение рекомбинантов
Вырожденность генетического кода широко известна. Так, любая молекула нуклеиновой кислоты (полинуклеотид), которая кодирует дикий тип белка SLO или мутантный белок SLO по изобретению, может быть использована для получения этого белка рекомбинантным путем. Примеры нуклеотидных последовательностей, которые кодируют SLO дикого типа, мутанты SLO P427L, W535F, C530G, ΔA248, W535F+D482N, P427L+W535F, P427L+C530G, и P427L+C530G+W535F представлены в списке последовательностей (см. также SEQ ID №:28, 29, 30, 31, 32, 33, 34, 35, и 36, соответственно). Молекулы нуклеиновых кислот, кодирующие SLO дикого типа, также могут быть выделены из соответствующих бактерий S. pyogenes, с применением стандартных методик выделения нуклеиновых кислот или могут быть синтезированы с применением методики амплификации, такой как полимеразная цепная реакция (ПЦР), или на автоматическом синтезаторе. См. Caruthers et al, Nucl. Acids Res. Symp. Ser. 215 223, 1980; Horn et al. Nucl. Acids Res. Symp. Ser. 225 232, 1980; Hunkapiller et al, Nature 310, 105-11, 1984; Grantham et al, Nucleic Acids Res. 9, r43-r74, 1981.
Молекулы кДНК могут быть получены с использованием стандартных молекулярно-биологических методов, с использованием мРНК в качестве матрицы. Молекулы кДНК могут быть, впоследствии, реплицированы с использованием стандартных молекулярно-биологических методов, хорошо известных в области техники. Методы амплификации, такие как ПЦР, могут быть использованы для получения дополнительных копий полинуклеотидов по изобретению, используя как геномную ДНК, так и кДНК в качестве матрицы.
При необходимости, полинуклеотиды могут быть сконструированы с использованием способов, общеизвестных в области техники, для изменения антиген-кодирующих последовательностей по различным причинам, включая, но не ограниваясь, изменения, которые модифицируют клонирование, процессинг и/или экспрессию полипептида или продукта мРНК. Перестановки ДНК путем случайной фрагментации и повторной сборки генных фрагментов и синтетических олигонуклеотидов на ПЦР могут быть использованы для конструирования нуклеотидных последовательностей. Например, сайт-направленный мутагенез может быть использован для вставки новых рестрикационных сайтов, изменения паттерна гликозилирования, изменения выбора кодона, продукции сплайс-вариантов, введения мутаций и так далее.
Модификации последовательности, такие как добавление последовательности метки для очистки или кодон-оптимизация, могут быть использованы для улучшения экспрессии. Например, N-концевая лидерная последовательность может быть заменена на последовательность, кодирующую белок-метку, такой как полигистидин ("HIS")или глутатион-S-трансферазу ("GST"). Такие белок-метки могут быть использованы для улучшения очистки, детекции и стабильности экспрессируемого белка. Кодоны, предпочтительные для конкретных прокариотических или эукариотических хозяев, могут быть выбраны для увеличения уровня экспрессии белка или для получения РНК транскипта, имеющего желаемые особенности, такие как время полураспада, которое является более длинным, чем таковое для транскрипта, полученного для природной последовательности. Эти способы хорошо известны в области техники и дополнительно описаны в WO05/032582.
Экспрессионные векторы
Молекулы нуклеиновой кислоты, которые кодируют мутантный белок SLO, могут быть вставлены в экспрессионный вектор, который содержит необходимые элементы для транкрипции и трансляции вставленной кодирующей последовательности. Способы, которые хорошо известны специалистам в области техники, могут быть использованы для конструирования экспрессионных векторов, содержащих кодирующие последовательности и подходящие элементы, контролирующие транскрипцию и трансляцию. Эти способы включают in vitro технологии рекомбинантных ДНК, синтетические технологии и in vitro генетическую рекомбинацию.
Клетки-хозяева
Клетки-хозяева для получения мутантных белков SLO могут быть прокариотическими или эукариотическими. E. coli являются предпочтительными клетками-хозяевами, но другие подходящие хозяева включают Lactococcus lactis, Lactococcus cremoris, Bacillus subtilis, Vibrio cholerae, Salmonella typhi, Salmonella typhimurium, Neisseria lactamica, Neisseria cinerea, Mycobacteria (например, M. tuberculosis), дрожжи, бакуловирусы, клетки млекопитающих и так далее.
Штаммы млекопитающих могут быть выбраны по их способности регулировать экспрессию вставленных последовательностей или процессировать экспрессированные полипептиды необходимым образом. Такие модификации полипептида включают, но не ограничиваются, ацетилирование, карбоксилирование, гликозилирование, фосфорилирование, липидирование и ацилирование. Пост-трансляционный процессинг, который разрезает «предпро»-форму полипептида также может быть использован для достижения корректной вставки, фолдинга и/или функции. Различные клетки-хозяева, которые имеют специфический клеточный аппарат, и характерный механизм посттрансляционной активности являются коммерчески доступными от American Type Culture Collection (ATCC; 10801 University Boulevard, Manassas, VA 20110-2209) и могут быть выбраны для обеспечения корректной модификации и процессинга чужеродного белка См. WO 01/98340.
Экспрессионные конструкции могут быть введены в клетки-хозяева посредством общепринятых методов, которые включают, но не ограничиваются, трансферрин-поликатион-опосредованный ДНК трансфер, трансфекцию очищенными или инкапсулированными нуклеиновыми кислотами, липосома-опосредованное клеточное слияние, внутриклеточную доставку ДНК-покрытых латексных шариков, слияние протопластов, вирусную транфекцию, электропорацию, методы генной пушки и DEAE- или кальций фосфат- опосредованную трансфекцию.
Клетки-хозяева, трансформированные экспрессионными векторами, могут культивироваться при условиях, подходящих для экспрессии или выделения белка из клеточной культуры. Белок, продуцируемый трансформированной клеткой, может секретироваться или содержаться внутриклеточно, в зависимости от нуклеотидной последовательности и/или использованного экспрессионного вектора. Специалисту в данной области техники понятно, что экспрессионные векторы могут быть сконструированы таким образом, чтобы содержать сигнальные последовательности, которые направляют секрецию растворимых антигенов через прокариотическую или эукариотическую мембрану.
Очистка
Сигнальные экспортные последовательности могут быть включены в рекомбинантно полученный мутантный белок SLO таким образом, что антиген может быть очищен из клеточной культуральной среды с использованием известных способов. Альтернативно, рекомбинантно полученный мутантный белок SLO по изобретению может быть выделен из сконструированных клеток-хозяев и отделен от других компонентов в клетке, таких как белки, углеводы или липиды, с использованием общепринятых в области техники способов. Такие способы включают, но не ограничиваются, гель-фильтрацию, фракционирование сульфатом аммония, ион-обменную хроматографию, аффинную хроматографию и препаративный гель-электрофорез. Препарат очищенных мутантных белков SLO является на 80% чистым, предпочтительно, препараты являются на 90%, 95% или 99% чистыми. Чистота препарата может быть определена любым способом, известным в области техники, таким как SDS-полиакриламидный гель электрофорез. Когда является приемлемым, мутантные белки SLO могут быть растворены, например, в мочевине.
Химический синтез
Мутантные белки SLO могут быть синтезированы, например, с использованием твердофазных способов. См., например, Merrifield, J. Am. Chem. Soc. 85, 2149 54, 1963; Roberge et al, Science 269, 202 04, 1995. Белковые синтезы могут быть осуществлены с использованием ручных или автоматических методов. Автоматический синтез может быть достигнут, например, с использованием Applied Biosystems 43 IA Peptide Synthesizer (Perkin Elmer). При необходимости, фрагменты мутантного белка SLO могут быть отдельно синтезированы и собраны вместе с использованием химических способов для получения полноразмерной молекулы.
Антитела
Изобретение предоставляет антитела, которые специфически связываются с мутантным белком SLO по изобретению, но которые не связываются с белком SLO дикого типа. Термин «антитела» включает интактные иммуноглобулиновые молекулы, также как и их фрагменты, которые способны связывать антиген. Они включают гибридные (химерные) молекулы антител (e.g., Winter et al, Nature 349, 293-99, 1991; U.S. Patent 4816567); F(ab')2 и F(ab) фрагменты и Fv-молекулы; не-ковалентые гетеродимеры (например, Inbar et ah, Proc. Natl. Acad. Sci. U.S.A. 69, 2659-62, 1972; Ehrlich et al., Biochem 19, 4091-96, 1980); одноцепочечные Fv-молекулы (sFv) (например, Huston et al., Proc. Natl. Acad. Sci. U.S.A. 85, 5897-83, 1988); димерные и тримерные фрагменты конструкций антител; минитела (например, Pack et al., Biochem 31, 1579- 84, 1992; Cumber et al, J. Immunology 149B, 120-26, 1992); гуманизированные молекулы антител (например, Riechmann et al., Nature 332, 323-27, 1988; Verhoeyan et al., Science 239, 1534-36, 1988; и U.K. патентная публикация GB 2276169, опубликованная 21 сентября 1994); и любые функциональные фрагменты, полученные из таких молекул, также как и антитела, полученные посредством нетрадиционных способов, таких как фаговый дисплей. Предпочтительно, антитела являются моноклональными антителами. Способы получения моноклональных антител широко известны в области техники.
Обычно требуется по меньшей мере 6, 7, 8, 10 или 12 последовательных аминокислот для формирования эпитопа. Однако, эпитопы, которые содержат непоследовательные аминокислоты могут требовать несколько, например, 15, 25, или 50 аминокислот. Различные иммунологические методы (например, Вестерн-блоты, ELISA, радио-иммунологические методы, иммуногистохимические методы, иммунопреципитации, или другие иммунохимические методы, известные в области техники) могут быть использованы для идентификации антител, обладающих желаемой специфичностью. Различные протоколы для конкурентного связывания или иммунорадиометрические методы хорошо известны в области техники. Такие иммунологические методы обычно включают измерение формирования комплекса между иммуногеном и антителами, которые специфически связываются с иммуногеном. Препарат антител, которые специфически связываются с мутантным белком SLO, обычно обеспечивают сигнал детекции по меньшей мере в 5-, 10-, или 20-раз выше, чем сигнал детекции с другими белками, когда используется в иммунохимическом анализе и не дает детектируемого сигнала при контакте с белком SLO дикого типа. Предпочтительно, антитела не детектируют других белков в иммунохимическом анализе и могут иммунопреципитировать с определенным антигеном из раствора.
Получение антител
Мутантный белок SLO или не-SLO полипептидные антигены (описанные выше) могут быть использованы для иммунизации млекопитающего, такого как мышь, крыса, кролик, морская свинка, обезьяна или человек, для получения поликлональных антител. При необходимости, антиген может быть конъюгирован с белком-переносчиком, таким как бычий сывороточный альбумин, тироглобулин и гемоцианин лимфы улитки. В зависимости от вида иммунизируемого животного, различные адъюванты могут быть использованы для усиления иммунологического ответа. Такие адъюванты включают, но не ограничиваются, адъювант Фрейнда, минеральные гели (например, гидроксид алюминия), и поверхностно-активные вещества (например, лизолектин, плюроновые полиолы, полианионы, пептиды, масляные эмульсии, гемоцианин лимфы улитки и динитрофенол). Среди адъювантов, используемых у людей, BCG (bacilli Calmette-Guerin) и Corynebacterium parvum являются особенно применимыми.
Моноклональные антитела, которые специфически связываются с антигеном, могут быть получены с использованием любого метода, который обусловливает продукцию антительных молекул стабильными клеточными линиями в культуре. Эти методы включают, но не ограничиваются, гибридомные методы, человеческие В-клеточные гибридомные методы и EBV гибридомный метод. Kohler et al., Nature 256, 495 497, 1985; Kozbor et al., J. Immunol. Methods 81, 31 42, 1985; Cote et al., Proc. Natl. Acad. ScL 80, 2026 2030, 1983; Cole et al., MoI. Cell Biol. 62, 109 120, 1984).
В дополнение, могут быть использованы методы, разработанные для продукции «химерных антител», соединения генов мышиных антител с генами антител человека для получения молекулы с подходящей антигенной специфичностью и биологической активностью (Morrison et al., Proc. Natl. Acad. ScI 81, 6851 6855, 1984; Neuberger et ah, Nature 312, 604 608, 1984; Takeda et ah, Nature 314, 452 454, 1985). Моноклональные и другие антитела могут быть «гуманизированы» для предохранения пациента от возникновения иммунного ответа против антитела, когда оно применяется терапевтически. Такие антитела могут быть достаточно схожи в последовательности с антителами человека для использования напрямую в терапии или могут нуждаться в изменении нескольких ключевых остатков. Различия в последовательности между антителами родентов и последовательностями человека могут быть минимизированы путем замещения остатков, которые отличаются от таковых в человеческой последовательности сайт-направленным мутагенезом индивидуальных остатков или заменой полностью комплементарных определяющих областей.
Альтернативно, гуманизированные антитела могут быть получены с использованием рекомбинантных способов, как описано выше. Антитела, которые специфично связываются с конкретным антигеном, который может содержать сайты связывания антигена, которые являются как частично, так и полностью гуманизированными, как раскрыто в US 5565332.
Альтернативно, методы, описанные для получения одноцепочечных антител, могут быть адаптированы с использованием способов, известных в области техники, для получения одноцепочечных антител, которые специфически связываются с конкретным антигеном. Антитела со сходной специфичностью, но с отличной идиотипической композицией, могут быть генерированы путем перестановок в цепочке из случайных комбинаторных иммуноглобулиновых библиотек (chain shuffling from random combinatorial immunoglobin libraries) (Burton, Proc. Natl. Acad. ScI 88, 11120 23, 1991).
Одноцепочечные антитела также могут быть сконструированы с использованием способа амплификации ДНК, такого как ПЦР, с использованием гибридомной кДНК в качестве матрицы (Thirion et al., 1996, Eur. J. Cancer Prev. 5, 507-11). Одноцепочечные антитела могут быть моно- или биспецифичными, и могут быть бивалентными или тетравалентными. Конструирование тетравалентных, биспецифических одноцепочечных антител описывается в, например, Coloma & Morrison, Nat. Biotechnol. 15, 159-63, 1997. Конструирование бивалентных, биспецифических одноцепочечных антител описывается в Mallender & Voss, J. Biol. Chem. 269, 199-206, 1994.
Нуклеотидная последовательность, кодирующая одноцепочечные антитела может быть сконструирована с использованием ручного или автоматического нуклеотидного синтеза, клонирована в экспрессионную конструкцию, используя стандартные способы рекомбинантной ДНК, и введена в клетку для экспрессии кодирующей последовательности, как описано выше. Альтернативно, одноцепочечные антитела могут быть получены непосредственно с использованием, например, технологии нитевидного бактериофага (filamentous phage technology) (Verhaar et al., Int. J. Cancer 61, 497-501, 1995; Nicholls et al., J. Immunol. Meth. 165, 81-91, 1993).
Антитела, которые специфично связываются с определенным антигеном также могут быть получены путем индуцирования in vivo продукции в популяции лимфоцитов или путем скрининга иммуноглобулиновых библиотек или панелей высокоспецифичных реагентов, как описано в литературе (Orlandi et al., Proc. Natl. Acad. Sci. 86, 3833 3837, 1989; Winter et al., Nature 349, 293 299, 1991).
Химерные антитела могут быть сконструированы как описано в WO 93/03151. Также могут быть получены связывающие белки, которые являются производными иммуноглобулинов и которые являются мультивалентными и мультиспецифичными, такие как «диатела», описанные в WO 94/13804.
Антитела могут быть очищены способами, хорошо известными в области техники. Например, антитела могут быть аффинно очищены путем пропускания через колонку, к которой пришит соответственный антиген. Связавшиеся антитела далее могут быть элюированы в колонки с использованием буфера с более высокой концентрацией соли.
Фармацевтические композиции
Изобретение также предоставляет композиции для применения в лекарственных средствах (например, таких как иммуногенные композиции или вакцины). Композиции по изобретению находят применение для профилактики и/или лечения заболеваний, вызванных инфицированием S. Pyogenes, и включают по меньшей мере один активный ингредиент, который может быть полипептидом, молекулой нуклеиновой кислоты или антителом. Указанной заболевание может быть, например, бактериемией, менингитом, послеродовой горячкой, скарлатиной, рожистым воспалением, фарингитом, импетиго, некротизирующим фасцитом, миозитом или синдромом токсического шока.
Композиции, содержащие мутантные белки SLO, являются предпочтительными иммуногенными композициями, и являются наиболее предпочтительно композициями вакцин. рН таких композиций предпочтительно лежит между 6 и 8, предпочтительно около 7. рН может поддерживаться с помощью буферного раствора. Композиция может быть стерильной и/или апирогенной. Композиция может быть изотонической по отношению к человеческому организму.
Вакцины по изобретению могут быть использованы как в профилактических, так и в терапевтических целях, но обычно являются профилактическими. Соответственно, изобретение включает способ для терапевтического или профилактического лечения инфекции Streptococcus pyogenes. Животные предпочтительно являются млекопитающими, наиболее предпочтительно людьми. Способы предусматривают введение животному терапевтического или профилактического количества иммуногенной композиции по изобретению.
Некоторые композиции по изобретению включают полипептидный мутантный белок SLO, как описано в настоящем описании. Другие композиции по изобретению включают молекулы нуклеиновой кислоты, которые кодируют мутантный белок(ки) SLO и, необязательно, другие антигены, которые могут быть включены в композицию (см. ниже). См., например, Robinson & Torres (1997) Seminars in Immunology 9:271-283; Donnelly et al. (1997) Ann. Rev Immunol 15:617-648; Scott- Taylor & Dalgleish (2000) Expert Opin Investig Drugs 9:471-480; Apostolopoulos & Plebanski (2000) Curr Opin MoI Ther 2:441-447; Ilan (1999) Curr Opin MoI Ther 1:116- 120; Dubensky et al. (2000) MoI Med 6:723-732; Robinson & Pertmer (2000) Adv Virus Res 55:1-74; Donnelly et al. (2000) Am J Respir Crit Care Med 162(4 Pt 2):S190-193; Davis (1999) Mt. Sinai J. Med. 66:84-90. Обычно молекула нуклеиновой кислоты является молекулой ДНК, например, в виде плазмиды.
В некоторых вариантах осуществления, композиции по изобретению могут включать один или несколько дополнительных активных средств. Такие средства включают, но не ограничиваются, (a) другой мутантный белок SLO по изобретению, (б) полипептидный антиген, который находит применение в педиатрической вакцине, (в) полипептидный антиген, который находит применение в вакцине для пожилых людей или людей с иммунодефицитом, (г) молекулу нуклеиновой кислоты, кодирующую пп.(а)-(в), и антитела, которые специфически связываются с пп.(а)-(в)
Дополнительные антигены
Композиции по изобретению могут быть введены в сочетании с одним или несколькими дополнительными антигенами для использования в терапевтических или профилактических способах по настоящему изобретению. Подходящие антигены включают перечисленные ниже. Дополнительно, композиции по настоящему изобретению могут быть использованы для лечения или профилактики инфекций, вызванных любым из перечисленных ниже патогенов. В дополнение к комбинации с антигенами, описанными ниже, композиции по изобретению могут также быть скомбинированы с адъювантом, как описано в настоящем описании.
Антигены для использования по изобретению включают, но не ограничиваются, один или несколько из следующих антигенов, описанных ниже, или антигенов, полученных из одного или нескольких патогенов, описанных ниже:
A. Бактериальные антигены
Бактериальные антигены, подходящие для применения по изобретению, включают белки, полисахариды, липополисахариды и внешне-мембранные везикулы, которые могут быть выделены, очищены или получены из бактерий. В дополнение, бактериальные антигены могут включать бактериальные лизаты и инактивированные бактериальные смеси. Бактериальные антигены могут быть получены путем рекомбинантной экспрессии. Бактериальные антигены предпочтительно содержат эпитопы, которые экспонированы на поверхности бактерий в течение по меньшей мере одной стадии их клеточного цикла. Бактериальные антигены предпочтительно являются консервативными среди множества серотипов. Бактериальные антигены содержат антигены, полученные из одной или нескольких бактерий, перечисленных ниже, так же, как и определенные примеры антигенов, обозначенные ниже.
Neisseria Meningitidis: Meningitidis антигены включают белки (такие, как обозначены в ссылках 1-7), сахариды (включая полисахариды, олигосахариды или липополисахариды), или внешне-мембранные везикулы (ссылки 8,9,10,11), очищенные или выделенные из серогрупп N. Meningitidis, таких как A, C, W135, Y, и/или B. Антигенные белки Meningitidis могут быть выбраны из адгезионных белков, автотранспортеров, токсинов, белков захвата Fe, и белков, ассоциированных с мембранной (предпочтительно, интегральных белков внешней клеточной мембраны).
Streptococcus pneumoniae: Антигены Streptococcus pneumoniae могут включать сахариды (включая полисахариды и олигосахариды) и/или белки из Streptococcus pneumoniae. Сахаридные антигены могут быть выбраны из серотипов 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F и 33F. Белковые антигены могут быть выбраны из белков, обозначенных в WO 98/18931, WO 98/18930, US Patent No. 6699703, US Patent No. 6800744, WO 97/43303 и WO 97/37026. Белки Streptococcus pneumoniae могут быть выбраны из семейства Poly Histidine Triad family (PhtX), семейства Choline Binding Protein family (CbpX), усеченных CbpX, семейства LytX, усеченных LytX, усеченный CbpX- усеченный LytX химерных белков, пневмолизина (Ply), PspA, PsaA, Sp128, Sp10l, Sp130, Sp125 или Sp133.
Streptococcus pyogenes (стрептококк группы A): Антигены стрептококка группы A могут включать белки, определенные в WO 02/34771 или WO 2005/032582 (включая, но не ограничиваясь, GAS39 (spy0266; gi-15674446), GAS40 (spy0269; gi-15674449), GAS42 (spy0287; gi-15674461), GAS45 (M5005_spy0249; gi-71910063), GAS57 (spy0416; gi-15674549), GAS58 (spy0430; gi-15674556), GAS84 (spy1274; gi-15675229), GAS95 (sptl733; gi-15675582), GAS117 (spy0448; gi-15674571), GAS130 (spy0591; gi-15674677), GAS137 (spy0652; gi-15674720), GAS159 (spy11O5; gi-15675088), GAS193 (spy2025; gi-15675802), GAS202 (spy1309; gi-15675258), GAS217 (spy0925; gi-15674945), GAS236 (spy1126; gi-15675106), GAS253 (spy1524; gi-15675423), GAS277 (spy1939; gi-15675742), GAS294 (spy1 l73; gi-15675145), GAS309 (spy0124; gi-15674341), GAS366 (spy1525; gi-15675424), GAS372 (spy1625; gi-15675501), GAS384 (spy1874; gi-15675693), GAS389 (spy1981; gi-15675772), GAS504 (spy1751; gi-15675600), GAS509 (spy1618; gi-15675496), GAS290 (spy1959; gi-15675757), GAS511 (sρyl743; gi-15675592), GAS527 (spy1204; gi-15675169), GAS529 (spy1280; gi-15675233), и GAS533 (spy1877; gi-15675696)), соединения фрагментов белков GAS M (включая описанные в WO 02/094851 и Dale, Vaccine (1999) 17: 193-200, и Dale, Vaccine 14(10): 944-948), белки, связывающие фибронектин (Sfbl), стрептококковый гем-ассоциированный белок (Shp), и стрептолизин S (SagA). Дополнительные антигены GAS включают GAS68 (Spy0163; gi13621456), GAS84 (Spy1274; gi13622398), GAS88 (Spy1361; gi13622470), GAS89 (Spy1390; gi13622493), GAS98 (Spy1882; gi13622916), GAS99 (Spy1979; gi13622993), GAS102 (Spy2016, gi13623025), GAS146 (Spy0763; gi13621942), GAS195 (Spy2043; gi13623043), GAS561 (Spy1l34; gi13622269), GAS 179 (Spy1718, gi13622773) и GAS681 (spy1l52; gi1362228).
Moraxella catarrhalis: Moraxella включают антигены, обозначенные в WO 02/18595 и WO 99/58562, антигены белков внешней мембраны (HMW-OMP), C-антиген, и/или LPS.
Bordetella pertussis: Pertussis антигены включают петуссис гелотоксин (PT) и филаментный гемагглютинин (FHA) из B. pertussis, необязательно также в комбинации с пертактином и/или антигенами агглютиногенов 2 и 3.
Staphylococcus aureus: Антигены Staphylococcus aureus включают капсульные полисахариды S. aureus 5 и 8 типов, необязательно коньгированные с нетоксическим рекомбинантным эндотоксином А Pseudomonas aeruginosa, такие как Staph VAX™, или антигены, производные поверхностных белков, инвизинов (лейкодипин, киназы, гиалуронидазы), поверхностных факторов, которые ингибируют захват фагоцитами (капсула, Протеин A), каротиноидов, продукции каталазы, Протеина А, коагулазы, фактора свертывания крови и/или токсинов, повреждающих мембрану (необязательно детоксифицированных), которые лизируют мембраны эукариотических клеток (гемолизины, лейкотоксин, лейкоцидин).
Staphylococcus epidermis: S. epidermidis антигены включают слизь-ассоциированный антиген (SAA).
Clostridium tetani (столбняк): Антигены столбняка включают столбнячный анатоксин (TT), предпочтительно использующийся в качестве белка-носителя в соединении/коньюгате с композициями по настоящему изобретению.
Cornynebacterium diphtheriae (дифтерия): Антигены дифтерии включают дифтерийный анатоксин, предпочтительно детоксифицированный, такой как CRM197. Дополнительно антигены, имеющие свойство модулировать, ингибировать или ассоциированные с ADP рибозилированием предлагаются для комбинирования/совместного введения/коньюгирования с композициями по настоящему изобретению. Дифтерийные анатоксины могут быть использованы в качестве белков-носителей.
Haemophilus influenzae B (Hib): Hib антигены включают Hib сахаридный антиген.
Pseudomonas aeruginosa: Антигены Pseudomonas включают эндотоксин А, Wzz протеин, P. aeruginosa LPS, более конкретно -LPS, выделенный из PAOl (серотип О5), и/или белки внешней мембраны, включая белки внешней мембраны F (Outer Membrane Proteins F (OprF) (Infect Immun. 2001 May; 69(5): 3510-3515).
Legionella pneumophila: Бактериальные антигены могут быть получены из Legionella pneumophila.
Streptococcus agalactiae (стрептококк группы В): Антигены стрептококка группы В включаю