Заманиха и воспаление
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, а именно к композиции для лечения или профилактики воспаления. Описано применение первичной композиции, содержащей суспензию плодов заманихи в молоке или содержащем молочный белок носителе, не содержащей нерастворимые волокна, для получения продукта для лечения или профилактики воспаления. Вышеописанная композиция эффективна для лечения или профилактики воспаления. 13 з.п. ф-лы, 13 ил., 2 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение, в общем, относится к области воспаления. В частности, настоящее изобретение касается применения природных соединений для получения продукта для лечения воспаления. Например, оказалось, что экстракт дерезы обладает противовоспалительными свойствами.
Уровень техники
Воспаление представляет собой сложную биологическую реакцию тканей на вредные раздражители, как-то патогены, поврежденные клетки или раздражающие вещества. В общем, это защитная попытка организма устранить вредоносные раздражители, а также запустить процесс заживления ткани. Однако недостаточная регуляция воспаления может вызывать некоторые болезни независимо от возраста субъекта.
Старение связано с нарушением регуляции иммунной системы типа заметного снижения клеточного иммунитета наряду с возрастанием дисфункции гуморального иммунитета (напр., снижением ответа на вакцины). Более того, старение зачастую связано с состоянием слабо выраженного воспаления. В частности, поэтому многие пожилые субъекты подвергаются повышенному риску инфекционных и неинфекционных заболеваний, способствующих заболеваемости и смертности.
Дереза известна своей множественной пользой для здоровья по разнообразию питательных веществ (напр., зеаксантин, витамины и полисахариды Lycium barbarum).
Тем не менее, в этой области все еще остается потребность в наличии доступных природных соединений, обладающих противовоспалительными свойствами.
Например, такие пищевые добавки, как n-3 PUFA (полиненасыщенные жирные кислоты), снижают функции воспалительных клеток, а также уменьшают клеточный иммунитет (напр., пролиферацию лимфоцитов и активность клеток NK), что может давать отрицательные эффекты в отношении защитных сил организма.
Поэтому целью настоящего изобретения является получение альтернативного природного соединения, обладающего противовоспалительными свойствами и не вызывающего отрицательных эффектов в отношении иммунной защиты у субъекта.
Раскрытие изобретения
Авторы настоящего изобретения неожиданно обнаружили, что экстракт дерезы обладает противовоспалительными свойствами. Поэтому цель настоящего изобретения достигается посредством применения экстракта дерезы для получения продукта для лечения и/или профилактики воспаления. К тому же оказалось, что иммунный ответ сохраняется.
Соответственно, одно из воплощений настоящего изобретения заключается в применении первичной композиции, включающей ягоды дерезы или их части и необязательно носитель, содержащий молоко или молочный белок, для получения продукта для лечения и/или профилактики воспаления.
Продукт может предназначаться для перорального или топического применения.
Молоко или молочный белок может иметь животное или растительное происхождение либо представлять собой их смесь. Предпочтительно молоко представляет собой коровье молоко, молоко ламы, буйвола, козье молоко, овечье молоко, растительное молоко, в частности соевое молоко, либо их смесь. Под молочным белком понимается белковая фракция, получаемая из одного или нескольких типов молока, перечисленных выше.
Предпочтительно первичная композиция является смешивающейся композицией.
Предпочтительно первичная композиция, особенно если она включает содержащий молоко или молочный белок носитель, обладает профилем основных активных компонентов, близким к целым ягодам дерезы, обладает хорошей стабильностью, смешиваемостью и/или диспергируемостью в водных системах.
Более того, первичная композиция, особенно если она включает содержащий молоко или молочный белок носитель, имеет повышенную питательную ценность в виде лучшей биодоступности и устойчивости. Она имеет приятный вкус и цвет. Ее можно использовать непосредственно либо в виде концентрированного или высушенного порошка для некоторых применений в потребляемых ежедневно пищевых продуктах или других пищевых применений.
Все эти особенности достигаются, если первичная композиция получается способом, в котором основные липофильные и/или гидрофильные биоактивные компоненты ягод дерезы переходят в первичную композицию, который включает стадии:
i) смешивания и измельчения материала дерезы в молоке или содержащей молочный белок жидкой среде; ii) необязательно отделения нерастворимых волокон для получения водной суспензии; iii) необязательно пастеризации полученной суспензии; iv) необязательно добавления синтетических или природных биоактивных компонентов во время обработки;, и v) также необязательно высушивания суспензии для получения порошка.
Соответственно, в одном воплощении настоящего изобретения первичная композиция получается способом, включающим стадии: i) смешивания и измельчения материала дерезы в молоке или содержащей молочный белок жидкой среде; ii) необязательно отделения нерастворимых волокон для получения водной суспензии; iii) необязательно пастеризации полученной суспензии; iv) необязательно добавления синтетических или природных биоактивных компонентов во время обработки; и v) также необязательно высушивания суспензии для получения порошка.
Главное преимущество этого способа состоит в том, что он является естественным, экономным и способствует улучшению доставки многих питательных веществ в виде комбинации стабилизированных водо- и жирорастворимых соединений в их природной композиции, свободной от остатков органических растворителей.
В следующем аспекте изобретения предусмотрен способ повышения смешиваемости или диспергируемости в водных системах, устойчивости и биодоступности биоактивных соединений материала дерезы с помощью описанного выше способа, в частности, использования молока или молочных белков, соевого молока или молочных продуктов из растений для экстрагирования и доставки многих питательных веществ - функциональных ингредиентов ягод дерезы.
Первичная композиция, как описано выше, может применяться для доставки многих питательных веществ - функциональных ингредиентов ягод дерезы с улучшенной биодоступностью, смешиваемостью и стабильностью.
Термин "биоактивное соединение" служит для обозначения молекул или компонентов, проявляющих биологическую активность или лечебное воздействие при пероральном или топическом применении.
Дереза может использоваться, напр., в виде плодов и других частей растения. Плоды могут использоваться в виде свежего, концентрированного или высушенного материала, например высушенного на воздухе или лиофилизованного материала. Однако предпочтительно используются сушеные зрелые плоды.
В предпочтительном воплощении настоящего изобретения первичная композиция содержит, по меньшей мере, часть основных липофильных и/или гидрофильных биоактивных компонентов ягод дерезы.
Основные липофильные и/или гидрофильные биоактивные компоненты предпочтительно выбираются из группы, состоящей из липидов, алкалоидов, белков, углеводов, гликопротеидов, каротиноидов, полифенольных соединений типа флавоноидов, витаминов, минералов или их смесей.
Каротиноиды можно выбирать из группы, состоящей из каротинов и ксантофиллов типа ликопена, каротина, фитофлуена, фитоена, кантаксантина, бета-криптоксантина, капсантина, лютеина, зеаксантина либо в виде их жирнокислотных эфиров или смесей.
Гликопротеиды предпочтительно выбираются из группы, состоящей из арабиногалактановых белков, в частности полисахарида Lycium barbarum, и макромолекул, которые выявляются реагентом Ярива на бета-глюкозил.
Флавоноиды предпочтительно выбираются из группы, состоящей из флавонов типа апигенина, лютеолина или диосметина, флавонолов типа кверцетина, мирицетина, кемпферола, флаванонов, антоцианидинов типа пеларгонидина, мальвидина или изофлавонов типа генистеина, даидзеина либо их смесей.
Первичная композиция настоящего изобретения может содержать, по меньшей мере, основные биоактивные компоненты ягод дерезы или их частей, исключая нерастворимые волокна, в содержащем молоко или молочный белок носителе. Молочный носитель может иметь вид снятого молока или цельного молока животного или растительного происхождения (напр., соевого молока, сока или кокосового молока и т.п.). В более предпочтительном воплощении используется коровье молоко или соевое молоко в зависимости от того, какая нужна первичная композиция. Содержащий молочный белок носитель может представлять собой любую пищевую жидкость, содержащую, к примеру, молочные белки типа казеинов или белки молочной сыворотки.
Необязательно в жидкую среду можно добавлять растительное масло.
Материал дерезы можно смешивать и измельчать в содержащем молоко или молочный белок носителе при соотношении от 1:1 до 1:1000, предпочтительно от 1:5 до 1:50. Операция смешивания и измельчения может проводиться при температуре от 1 до 95°С, предпочтительно от 20 до 80°С и более предпочтительно от 40 до 80°С. Затем можно хотя бы частично удалить нерастворимые волокна для получения водной суспензии.
Это можно сделать любым удобным способом. Образовавшуюся первичную композицию далее можно пастеризовать и/или высушить в порошок известными. методами. Полученная первичная композиция также может находиться в жидком виде или в виде геля.
Таким образом, настоящим изобретением предусмотрена первичная композиция, обладающая профилем существенных питательных веществ, близким к целым плодам, обладающая хорошей стабильностью, смешиваемостью и биодоступностью. Эти композиции могут сильно диспергироваться в водных системах, если выбрана порошковая форма. В таком случае порошок диспергируется, к примеру, в холодной или горячей воде. Его с тем же успехом можно добавлять в молоко.
Композиция может дополнительно содержать один или несколько эмульгаторов, стабилизаторов, антиоксидантов и других добавок. Предпочтительно применяются эмульгаторы, совместимые с продуктами питания, как-то фосфолипиды, к примеру лецитин, полиоксиэтиленсорбитанмоно- или тристеарат, монолаурат, монопальмитат, моно- или триолеат, моно- или диглицериды.
Также могут применяться любые типы стабилизаторов, известные как применимые в пищевых продуктах, косметике или фармацевтических препаратах.
Могут применяться любые типы антиоксидантов, известные как применимые в пищевых продуктах, косметике или фармацевтических препаратах.
Также могут применяться и вспомогательные вещества, ароматизаторы, красители, известные как применимые в пищевых продуктах, косметике или фармацевтических препаратах.
Эмульгаторы, стабилизаторы, антиоксиданты и вспомогательные вещества могут добавляться в соответствии с окончательным предназначением первичной композиции.
Композиция может дополнительно содержать синтетические или природные биоактивные ингредиенты, как-то аминокислоты, жирные кислоты, витамины, минералы, каротиноиды, полифенолы и т.п., которые можно добавлять предпочтительно путем сухого или мокрого смешивания с данной композицией перед пастеризацией и/или высушиванием.
Продукт, полученный при помощи настоящего изобретения, может представлять собой добавку к рациону, добавку в качестве или в составе медикамента либо добавку в качестве или в составе крема.
В предпочтительном воплощении настоящего изобретения продукт предназначается для и/или применяется на людях или комнатных животных.
Продукт может вводиться субъектам любого возраста, в частности младенцам, детям, подросткам, взрослым и/или пожилым. Однако польза от ягод дерезы как будто особенно хорошо подходит для взрослых и пожилых.
В соответствии с предпочтительным воплощением настоящего изобретения продукт, полученный при помощи настоящего изобретения, предназначается для потребления человеком в составе или в качестве пищевого продукта. Пищевой продукт может потребляться энтерально, что для настоящего изобретения означает прием внутрь (перорально), либо парентерально.
Соответственно, первичная композиция может служить добавкой в пищевой продукт для приема внутрь типа алиментарной композиции, пищевой добавкой, кормом для комнатных животных, косметическим препаратом или фармацевтическим препаратом. Первичная композиция также может служить добавкой в продукт для топического применения типа косметики или фармацевтических препаратов.
Соответственно, продукт, полученный при помощи настоящего изобретения, может представлять собой полную алиментарную смесь, молочный продукт, охлажденный или устойчивый при хранении напиток, продукт для кормящих матерей, жидкий напиток, суп, добавку к рациону, пищевой заменитель, питательный батончик, кондитерское изделие, молочный или кисломолочный продукт, йогурт, молочный порошок, продукт для энтерального питания, смесь для грудных детей, продукт питания для грудных детей, пюре, крупяной продукт или сброженный крупяной продукт, мороженое, конфеты, сладости, печенье, торт/пирожное, шоколад, капучино, кофе, кулинарный продукт типа майонеза, томатную пасту или приправу к салату, корм или напиток для комнатных животных. В предпочтительном воплощении вышеописанная первичная композиция добавляется в пищевую композицию для потребления человеком. Первичную композицию, которая предпочтительно имеет вид порошка, можно диспергировать в вышеприведенных пищевых продуктах или напитках в таком количестве, чтобы суточный прием биоактивных питательных веществ был таким, как описано выше, который можно выбрать в зависимости от требуемого эффекта и ткани-мишени. Количество первичной композиции или пищевой композиции, которое индивидуум должен принимать для достижения положительного эффекта, также будет зависеть от его размера, его типа и возраста.
Если продукт представляет собой пищевую добавку для приема внутрь, она может находиться в капсулах, желатиновых капсулах, мягких капсулах, таблетках, таблетках с сахарным покрытием, пилюлях, пастах или пастилках, жвачках либо питьевых растворах или эмульсиях, сиропе или геле. Доза первичной композиции может варьироваться специалистами в зависимости от предназначения, но обычно она составляет от 0,1 до 100% вес. первичной композиции. Такая добавка может включать и подсластитель, стабилизатор, антиоксидант, вспомогательное вещество, ароматизатор и/или краситель. Добавка для косметических целей может дополнительно включать соединение, активное в отношении кожи.
В другом воплощении, если продукт настоящего изобретения представляет собой фармацевтическую композицию, то он может применяться для профилактического или терапевтического лечения.
При терапевтическом применении композиции вводятся в количестве, достаточном для того, чтобы, по меньшей мере, частично излечить или остановить симптомы болезни и ее осложнения. Адекватное для этой цели количество определяется как "терапевтически эффективная доза". Эффективное для этой цели количество зависит от ряда факторов, известных специалистам в этой области, таких как тяжесть заболевания, вес и общее состояние пациента. При профилактическом применении композиции по изобретению вводятся пациенту, подверженному риску или иным образом рискующему заболеть определенным заболеванием, в количестве, достаточном для того, чтобы, по меньшей мере, частично уменьшить риск возникновения болезни. Такое количество определяется как "профилактически эффективная доза". Опять же точное количество зависит от ряда специфических для пациента факторов, таких как состояние здоровья и вес пациента.
Соединения по изобретению, если они вводятся в виде фармацевтической композиции, предпочтительно вводятся с фармацевтически приемлемым носителем, причем природа носителя зависит от способа применения, к примеру, энтерального, перорального и топического (включая глазное) способа применения. Требуемая лекарственная форма может быть изготовлена с использованием целого ряда наполнителей, включая, к примеру, фармацевтические сорта маннитола, лактозы, крахмала, стеарата магния, натриевого сахарина, целлюлозы, карбоната магния.
Подразумевается, что специалист будет в состоянии на основе собственных знаний выбрать надлежащие компоненты и галенову форму для доставки активного соединения в нужную ткань, напр. кожу, толстую кишку, желудок, глаза, почки или печень, принимая во внимание способ применения.
Изобретение также касается косметической композиции, включающей первичную композицию, описанную выше. Она может входить в состав, к примеру, лосьонов, шампуней, кремов, солнцезащитных кремов, кремов после загара, кремов и/или мазей против старения. Такая композиция, которая может применяться топически, дополнительно содержит жир или масло, которое может применяться в косметике, например, приведенное в работе CTFA, Cosmetic Ingredients Handbook, Washington. Также можно добавлять и другие косметически активные ингредиенты. Композиция дополнительно содержит структурообразующее вещество и эмульгатор. Также в композицию можно добавлять и другие наполнители, красители, душистые вещества или глушители. Следует иметь в виду, что данные косметические продукты должны содержать смесь из различных ингредиентов, известных специалистам, обеспечивающих быстрое проникновение данного вещества в кожу и предотвращающих их разложение во время хранения.
Следует иметь в виду, что идея настоящего изобретения также может применяться в качестве вспомогательной терапии, способствующей уже применяющемуся лечению. Поскольку соединения настоящего изобретения легко вводятся вместе с пищевым материалом, то можно использовать специальное клиническое питание, содержащее большое количество данных веществ.
Введение комнатному животному или человеку продуктов, пищевой добавки, косметической или фармацевтической композиции, как описано выше, приводит к улучшению здоровья, в частности, по меньшей мере, частично уменьшает воспаление.
Воспаление, которое можно лечить с применением продукта, полученного при помощи настоящего изобретения, можно выбрать из группы, состоящей из острого воспаления, как-то сепсиса, инфекций, ожогов, и хронического воспаления, как-то хронического воспаления кишечника, болезни Крона, язвенного колита, некротизирующего энтероколита, воспаления кожи типа вызванного УФ или химического воспаления кожи, экземы, реактивного воспаления кожи, псориаза, витилиго, угрей, воспалительного синдрома кишечника, воспаления печени, алкогольного цирроза, аллергии, атопии, воспаления костей, ревматоидного артрита, системной волчанки, синдрома Гужеро-Шегрена, синдрома Рейтера, полиомиелита, дерматомиозита, тиреоидита, базедовой болезни, болезни Хашимото, диабета I типа, болезни Аддисона, аутоиммунного гепатита, целиакии, болезни Бирмера, множественного склероза, миастении, энцефаломиелита, воспаления глаз, связанного с ожирением воспаления, возрастного слабовыраженного воспаления, синдрома Блау, болезни Альцгеймера, сердечно-сосудистых заболеваний, атеросклероза, метаболического синдрома, гингивита и пародонтоза.
Авторы настоящего изобретения исследовали молекулярный механизм противовоспалительного эффекта первичной композиции настоящего изобретения. Не стремясь придерживаться какой-либо теории, авторы изобретения полагают, что она подавляет обусловленную LPS продукцию провоспалительных цитокинов макрофагами (фиг.1) и вызванную TNF-α или LPS активацию пути NF-кВ (фиг.2) в клетках кишечного эпителия человека. В доклинических исследованиях добавление в рацион первичной композиции настоящего изобретения проявляло сильные противовоспалительные свойства на модели острого воспаления кишечника у мышей (фиг.3-10). Кроме того, первичная композиция настоящего изобретения также уменьшала экспрессию провоспалительных цитокинов типа TNF-α в печени старых мышей (фиг.11). Более того, добавление в рацион первичной композиции настоящего изобретения повышало специфичные к антигену гуморальные и клеточные иммунные ответы у старых мышей (фиг.12 и 13 соответственно). Таким образом, первичная композиция настоящего изобретения оказалась полезной тем, что она уменьшает воспалительное состояние. В то же время первичная композиция настоящего изобретения еще и способна поддерживать иммунную систему.
Следовательно, продукт, полученный при помощи настоящего изобретения, можно использовать для уменьшения воспалительного состояния и одновременно усиления иммунной системы.
Поэтому первичная композиция настоящего изобретения обладает потенциалом для восстановления нарушенных иммунных и воспалительных реакций до состояния гомеостаза. Посредством такого двойного эффекта первичная композиция настоящего изобретения, напр., пригодна для применения в продуктах питания для пожилых, в клинике и для комнатных животных.
В частности, первичная композиция настоящего изобретения полезна тем, что она поддерживает иммунную функцию при старении и в то же время уменьшает возрастное состояние слабовыраженного воспаления.
К тому же первичная композиция настоящего изобретения может применяться в клинических продуктах для контролирования острого или хронического воспаления.
Так, в одном воплощении настоящего изобретения продукт, полученный при помощи настоящего изобретения, применяется для исправления нарушений иммунитета. Он также может применяться для повышения специфичного к антигену гуморального иммунитета и/или для повышения клеточного иммунитета.
Кроме того, первичная композиция и/или продукт настоящего изобретения может применяться для лечения или профилактики нарушений, связанных с окислительным стрессом. Авторы изобретения показали, что применение первичной композиции и/или продукта настоящего изобретения может вызвать сильное возрастание таких антиокислительных генов, как GPX-1, CAT1 и SOD2 (фиг.9). Следовательно, первичная композиция и/или продукт настоящего изобретения может обеспечить защиту от окислительного стресса, вызванного, к примеру, такими свободными радикалами, как анион супероксида •O2 -, перекись водорода Н2О2, гидроксильный радикал •ОН, органический гидропероксид ROOH, алкоксирадикалы RO•, пероксирадикалы ROO•, гипохлористая кислота HOCl, пероксинитрил OONO- и/или NO•.
Специалистам должно быть ясно, что любые положения, описанные в настоящем изобретении, можно свободно комбинировать, не выходя за рамки настоящего изобретения, как оно изложено в первоначальном виде.
Другие преимущества и особенности настоящего изобретения станут ясными из нижеследующих примеров и фигур.
Краткое описание фигур
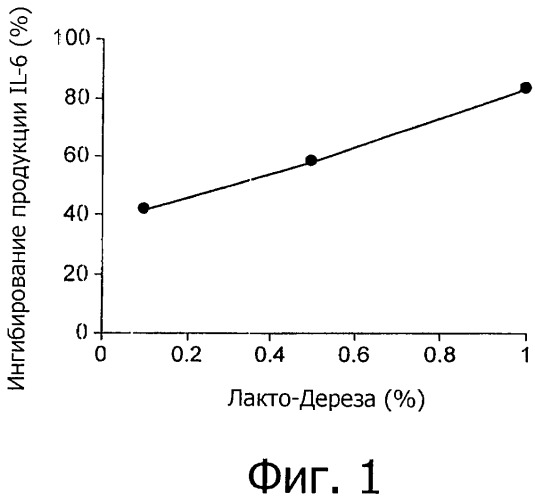
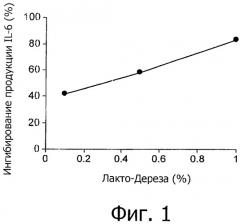
На фиг.1 представлено ингибирование LWB опосредованной LPS продукции IL-6 в линии клеток макрофагов мыши (клеток RAW).
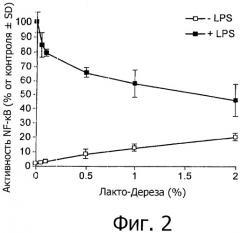
На фиг.2 представлено ингибирование LWB опосредованной LPS активации NF-кВ в линии клеток кишечного эпителия человека (клеток НТ-29, устойчиво трансфицированных геном-репортером NF-кВ).
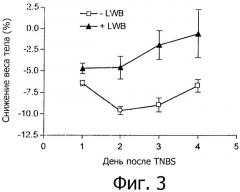
На фиг.3 представлено снижение веса тела после введения TNBS. Среднее±SEM.
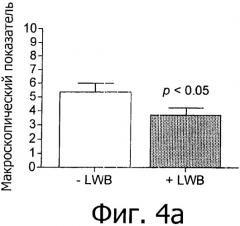
На фиг.4 представлена оценка макроскопического показателя. Справа: среднее±SEM; слева: индивидуальные значения и медиана.
На фиг.5 представлена оценка гистологического показателя. Справа: среднее±SEM; слева: индивидуальные значения и медиана.
На фиг.6 представлено отношение СОХ-2 к контрольному белку (актину). Справа: среднее±SEM; слева: индивидуальные значения и медиана.
На фиг.7 представлена экспрессия pSTAT3. Справа: среднее±SEM; слева: индивидуальные значения и медиана.
На фиг.8 представлена экспрессия таких провоспалительных генов, как TNF-α, IL-6 и IL-1β, и таких белков, как КС, на модели острого воспаления кишечника у мышей без добавления и с добавлением LWB.
На фиг.9 представлена экспрессия таких антиокислительных генов, как GPX-1, САТ1 и SOD2, на модели острого воспаления кишечника у мышей без добавления и с добавлением LWB.
На фиг.10 представлена антиокислительная способность. Справа: среднее±SEM; слева: индивидуальные значения и медиана.
На фиг.11 представлена экспрессия гена, кодирующего TNF-α, в печени старых мышей, получавших LWB, по сравнению с тем, что наблюдалось в печени нормальных старых мышей (H2O) и взрослых мышей (CTRL).
На фиг.12 представлен специфичный к антигену (KLH) антительный ответ у старых мышей.
На фиг.13 представлен клеточный иммунный ответ - гиперчувствительность замедленного типа (DTH) у старых мышей.
Осуществление изобретения
Пример 1
Получение первичной композиции, содержащей ягоды дерезы и молоко (LWB. Lacto-Wolfberry, т.е. Лакто-Дереза)
В емкость на 1 л вносили сушеные плоды дерезы (40 г) и цельное молоко (300 г). Смесь отстаивали 10 минут и обрабатывали гомогенизатором Polytron (Dispersing and Mixing Technology by KINEMATICA, РТ3000) при 26000 об/мин в течение 15 мин в атмосфере азота. Во время обработки политроном смесь поддерживали при температуре 80-85°С при помощи водяной бани, а затем охлаждали до комнатной температуры. Затем полученную смесь центрифугировали при 2000g в течение 10 минут. Отбрасывали твердый осадок. Жидкую фазу (306 г оранжево-желтого молока) лиофилизировали. Наконец, высушенный продукт размалывали, получая 54 г оранжево-желтого порошка, который проявлял очень хорошую диспергируемость в воде и лучшую стабильность зеаксантина по сравнению с порошком ягод дерезы.
Пример 2
Реактивы
Порошок Лакто-Дереза (LWB) из пробной серии N°WB03A1506H, полученной в NRC (Nestle Research Center; Lausanne), как описано выше, и экстракт дерезы в порошке (серия N°WB03A1506H) были предоставлены J. Wang (FS, Lipids & Bioactives). Липополисахарид (LPS) из Е. coli серотипа 055:В5 приобретали у фирмы Sigma (St. Louis, МО). Женское молоко (НМ) брали у различных здоровых доноров через 20 дней после родов с разрешения комитета по этике. Гемоцианин моллюска блюдечко (KLH) приобретали у фирмы Sigma.
Культура клеток
Клетки моноцитов/макрофагов мыши линии RAW 264.7 (TIB-71 из АТСС, Manassas, Virginia, США) содержали в модифицированной Дюльбекко среде Игла (DMEM, Amimed, Bioconcept, Allschwill, Швейцария) с добавлением 10% инактивированной нагреванием телячьей сыворотки (FCS, Amimed) и 1% пенициллина/стрептомицина (Invitrogen, Paisley, UK) при 37°С в воздушном инкубаторе с 5% CO2. Клетки субкультивировали с помощью трипсина/EDTA (Sigma, St. Louis, МО, США). Клетки аденокарциномы толстой кишки человека линии НТ-29 клона 34 (т.е. клетки НТ-29, устойчиво трансфицированные геном-репортером NF-кВ), содержали в среде DMEM с высоким уровнем глюкозы (4,5 г/л) (Bioconcept, Allschwill, Швейцария), содержащей 1% L-глутамина с добавлением 10% инактивированной нагреванием (1 час при 56°С) FCS, 1% пенициллина/стрептомицина (Sigma, St. Louis, МО), 500 мкг/мл G418 (Invitrogen) и 100 мкг/мл Normocin (Invivogen), при 37°С в воздушном инкубаторе с 5% CO2. Культуральную среду меняли через каждые 2 дня до тех пор, пока клетки не достигали конфлюентности в -90%. Клетки субкультивировали с помощью трипсина/EDTA (Sigma).
Измерение опосредованной LPS экспрессии IL-6
Клетки RAW 264.7 высеивали при 104 клеток на лунку в плоскодонные 96-луночные планшеты (Nunc, Rosklide, Дания) в нормальной культуральной среде при 37°С в воздушном инкубаторе с 5% CO2. После 3 дней культивирования (клетки достигали конфлюентности в ~ 80%) клетки стимулировали или не стимулировали с помощью 0,5 мкг/мл LPS Е. coli (055:В5, Sigma) в отсутствие или в присутствии образцов LWB (конечная концентрация 0,1-1%) в течение 24 часов в нормальной среде. После этого выделяли супернатанты клеточных культур и использовали их для измерения продукции IL-6. Содержание интерлейкина-6 (IL-6) в супернатантах клеточных культур определяли методом ELISA (Murine IL-6 Eli-pair, Diaclone, Besancon, Франция) согласно инструкциям производителя.
Активность NF-кВ
Клетки НТ-29 клона 34 высеивали при 104 клеток на лунку в плоскодонные 96-луночные планшеты (Nunc) в обычной культуральной среде. После 3-4 дней культивирования (клетки достигали конфлюентности в ~ 80%) клетки промывали фосфатно-солевым буфером (PBS) (Sigma), а затем стимулировали или не стимулировали с помощью LPS (10 нг/мл+5% женского молока) или рекомбинантного TNF-α (10 нг/мл; R&D Systems, Oxon, England) в отсутствие или в присутствии образцов LWB в течение 24 часов в среде DMEM, содержащей 1% пенициллина/стрептомицина. После этого выделяли супернатанты клеточных культур и хранили при +4°С в течение ночи до анализа активности NF-кВ. После активации NF-кВ клетки НТ-29 клона 34 выделяют щелочную фосфатазу (SEAP) в супернатант культуры. Выделение SEAP измеряли флуоресцентным методом (Phospha-Light™ System) согласно инструкциям производителя (Applied Biosystems, Bedford, США). Вкратце, супернатанты клеточных культур инкубировали с реакционным буфером из системы Phospha-Light™ в течение 20 мин в белом плоскодонном 96-луночном полипропиленовом планшете (Greiner) и измеряли люминесценцию на спектрометре Spectrafluor Plus (Tecan 8634, Hombrechtikon, Швейцария). Результаты выражали в относительных единицах люминесценции (RLU).
Модель индуцированного TNBS колита
Модель индуцированного TNBS колита - это модель острого воспаления, которое вызывается химическим препаратом TNBS (тринитробензолсульфоновая кислота) в дозе 150 мг/кг. По 10 мышей на группу получали рацион, содержащий 1% LWB (50 мг), в течение 7 дней перед индуцированием колита и вплоть до забоя. С 1-го по 4-й день после введения TNBS мышам давали по 50 мг LWB гаважем, чтобы компенсировать уменьшение приема корма в связи с острым воспалением кишечника. Для каждого животного определяли снижение веса тела, макроскопический и гистологический показатель, экспрессию COX-2, pSTAT3, провоспалительных и антиокислительных генов и антиокислительную способность. Макроскопический и гистологический показатель вычисляли по критериям начисления баллов согласно Wallace (Wallace et al, 1989) и Ameho (Ameho et al, 1997). COX-2, индуцибельная форма циклооксигеназы - это белок в 72 кДа, который отвечает за индуцибельный биосинтез простагландинов в условиях острого воспаления. Stat3 является ключевой сигнальной молекулой для многих цитокинов, в частности для таких провоспалительных цитокинов, как IL-6.
Схема опытов по оценке иммуномодуляции у старых мышей
Свободных от специфических патогенов самцов мышей C57BL/6J (4-недельного возраста) приобретали у фирмы Charles River Laboratories Inc. (Франция). Мыши содержались в стандартных условиях (12-часовой цикл освещения/темноты, температура 22°С, влажность 56%) и получали воду и полусинтетический корм Kliba 3434 ad libitum. Вплоть до 5-месячного возраста держали по 5 мышей на клетку, а затем переводили в индивидуальные клетки. Все условия и обращение с животными были одобрены комитетами по этике Nestle и государства с согласия Федерального ветеринарного надзора Швейцарии. В 21-месячном возрасте мышей случайным образом разбивали на 2 группы по 10 животных. Контрольные мыши без добавления LWB (H2O, n=10 на возрастную группу) и мыши с добавлением LWB получали полусинтетический корм (AIN-93). LWB давали в виде 0,5% (w/v) раствора в питьевой воде, который готовили свежим и меняли через каждый день. Во время испытания (44 дня) всем мышам давали пить и есть ad libitum. Такая же схема опытов выполнялась дважды, а также выполнялась на 8-месячных мышах (n=8 на группу). Для исследования Т-клеточного гуморального ответа in vivo (выработки специфичных к антигену антител) на 15-й день испытания старых мышей иммунизировали подкожным введением (100 мкл) инертного антигена - гемоцианина моллюска блюдечко (KLH, Sigma) в дозе 100 мкг в 1% растворе квасцов (Brenntag Biosector, Frederikssund, Дания). В качестве меры клеточного иммунитета in vivo использовали реакцию DTH (гиперчувствительность замедленного типа). Способность к выработке реакции DTH определяли по измерениям толщины ушей (опухания ушей), сделанным до и через 24 часа вплоть до 8 дней после провокационной пробы. Вкратце, через 7 дней после иммунизации мышей с помощью KLH (т.е. на 22 день испытания) вызывали реакцию DTH повторным введением антигена KLH (10 мкл при 0,5 мкг/мл) в правое ухо каждой мыши. В левое ухо вводили только носитель (физраствор=PBS), и оно служило внутренним контролем для каждого животного. Через 24 часа после провокационной пробы и в последующие 7 дней измеряли и не подвергавшиеся пробе (левые), и подвергавшиеся пробе (правые) уши. Реакцию DTH (KLH-PBS) выражали по величине опухания уха, т.е. изменению толщины уха по следующей формуле: Δ толщины уха = [толщина подвергавшегося пробе уха (правого, KLH) - толщина не подвергавшегося пробе уха (левого, PBS)], где Д толщины уха = [толщина уха после пробы - толщина уха до пробы]. Брали пробы крови в день 0, 15, 29 из хвостовой вены и в день 44 посредством пункции сердца. Мышей забивали на 44-й день испытания. При вскрытии извлекали печень, и кусочек ее немедленно замораживали в жидком азоте. Образцы хранили при -80°С до дальнейшего анализа.
Измерение уровня специфичных к KLH антител типа IgG2a
Содержание специфичных к KLH антител типа IgG2a в сыворотке определяли методом ELISA. Вкратце, лунки планшета покрывали KLH (50 мкл на лунку при 100 нг/мл) и инкубировали при 37°С в течение 3 часов. Свободные места связывания блокировали буфером для ELISA в течение 1 часа при 37°С. Затем вносили образцы и инкубировали при +4°С в течение ночи. Связавшиеся антитела подвергали реакции 1 час при 37°С со встряхиванием с конъюгированными с биотином козьими антителами против IgG2a мыши (специфичным к γ2а-цепи) фирмы Southern Biotechnologies (Birmingham, США). Планшеты просчитывали при 450 нм после добавления субстрата пероксидазы - ТМВ фирмы KPL. Уровень антител типа IgG2a против KLH выражали в виде средних значений OD450 нм.
Экспрессия генов
Образцы печени переносили в 1 мл лизирующего буфера для РНК (Macherey-Nagel, Duren, Германия) и гомогенизировали с помощью Ribolyzer (Hybaid, Waltham, MA, США) при следующих параметрах настройки: мощность 6 на 20 секунд. Экстракцию РНК проводили с помощью коммерчески доступного набора (NucleoSpin RNA II Kit; Macherey-Nagel, Duren, Германия). Количественное определение РНК осуществляли с помощью набора Ribogreen RNA Quantitation Kit (Molecular Probes; Eugene, Oregon, США), а качество РНК проверяли с помощью набора Agilent RNA 6000 Nano LabChip Kit (Agilent Technologies, Palo Alto, США). Тотальный препарат РНК (2 мкг) подвергали обратной транскрипции с помощью обратной транскриптазы Multiscribe согласно инструкциям производителя (Applied Biosystems; Rokreutz, Швейцария). Сделанные на заказ матрицы низкой плотности (LDA) с 48 зондами TaqMan (несущая способность: 8 образцов на карточку в технике одного повтора) приобретали у фирмы Applied Biosystems (Foster City, США) и использовали согласно инструкциям производителя. Экспрессию генов вычисляли методом относительного представления ΔΔCt с помощью программы SDS 2.2.2 (Applied Biosystems). Полученные значения циклового порога (Ct) выводились в MS Excel (Microsoft, США) для дальнейшего анализа. Вкратце, сначала вычисляли значение ΔCt (т.е. значение Ct искомого гена - значение Ct "хозяйственного" гена GAPDH), а затем определяли относительную экспрессию мРНК по следующей формуле: 2-ΔCt×106.
Общий статистический анализ
Данные анализировали при помощи ±SEM или SD и t-критерия Стьюдента (непарного) либо двустороннего критерия ANOVA, когда нужно. Значимыми считались значения вероятности менее 5%.
Результаты
A) Опыты in vitro, показывающие противовоспалительные свойства Лакто-Дерезы
Раствор Лакто-Дерезы (LWB) ингибировал in vitro опосредованное LPS выделение провоспалительного цитокина IL-6 клетками линии макрофагов мыши (фиг.1) и опосредованную LPS активацию NF-кВ в клетках кишечного эпителия человека (фиг.2).
B) Опыты in vivo, показывающие противовоспалительные и повышающие иммунитет эффекты Лакто-Дерезы
а. Патологическое острое воспаление
При добавлении в рацион LWB проявлялись сильные противовоспалительные свойства на модели острого воспаления кишечника у мышей. Прием внутрь 1% LWB приводил к уменьшению снижения веса тела (фиг.3), макроскопических и гистологических повреждений (фиг.4 и 5), значительному снижению уровня экспрессии СОХ-2 и pSTAT3 (фиг.6 и 7). Кроме того, снижалась экспрессия таких провоспалительных генов, как TNF-α, IL-6 и IL-1β, и таких белков, как КС в толстой кишке по сравнению с контрольной группой (фиг.8). Параллельно этому LWB вызывал сильное повышение таких антиокислительных генов, как GPX-1, CAT1 и SOD2 (фиг.9) в толстой кишке и повышал антиокислительную защиту в плазме крови (фиг.10).
b. Физиологическое возрастное слабовыраженное воспаление
Добавление в рацион LWB (0,5% в питьевой воде) вызывало снижение экспрессии связанных с воспалением генов в печени старых мышей до уровня, наблюдавшегося у взрослых мышей (фиг.11, на примере гена, кодирующего TNF-α).
с. Усиление иммунитета у старых мышей
Добавление в рацион LWB (0,5% в питьевой воде) приводило к улучшению как гуморального (фиг.12), так и клеточного иммунитета (фиг.13) у старых мышей.
1. Применение пе