Композиция и способ лечения опухолей
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к апоптотическим факторам, и может быть использовано в медицине. Получают композицию, включающую ингибитор TNF-подавляющей активности Core 1 митохондриального дыхательного комплекса III в опухолевой клетке на основе нуклеиновой кислоты; член суперсемейства фактора некроза опухоли (TNF) и носитель. Изобретение позволяет повысить чувствительность опухолевой клетки к апоптотической активности члена суперсемейства фактора некроза опухоли. 3 н. и 13 з.п. ф-лы, 5 ил., 9 пр.
Реферат
Область изобретения
Опухолью называют аномальное разрастание ткани, которое может носить злокачественный или доброкачественный характер. Доброкачественные опухоли характеризуются только локальным ростом, тогда как злокачественная опухоль распространяется на другие ткани.
Рак относится к генетическим заболеваниям. Способность противостоять апоптозу является отличительной чертой раковых клеток. Известно, что многие генетические нарушения обеспечивают устойчивость раковых клеток к программируемой гибели клеток (апоптозу). Ферменты, называемые каспазами, осуществляют процесс разрушения клетки в ходе апоптоза. Инициаторные каспазы расщепляют неактивные формы предшественников каспаз-эффекторов, тем самым активируя их. Затем активированные каспазы-эффекторы начинают разрушать белки внутри клетки. В обычной ткани скорость апоптоза уравновешивается скоростью клеточного роста в ткани, и это регулирует рост ткани. В случае нарушения процесса апоптоза в клетке она может продолжать делиться, что приводит к неконтролируемому росту тканей.
Лиганд, индуцирующий апоптоз, связанный с фактором некроза опухоли (TRAIL), является перспективным терапевтическим реагентом для лечения опухолей. TRAIL входит в суперсемейство факторов некроза опухоли (TNF), включающее мощные индукторы апоптоза TNF и лиганд Fas (FasL). TRAIL представляет особый интерес не только потому, что он индуцирует быстрый апоптоз в самых разнообразных опухолях человека и линиях раковых клеток, но и потому, что он проявляет незначительную токсичность для обычных клеток и тканей.
Экспрессия TRAIL обычно осуществляется многими тканями организма, однако его можно вводить и экзогенно в ходе лечения опухоли. Введение растворимой активной формы TRAIL мышам с солидными опухолями индуцировало апоптоз, подавляло распространение опухоли и улучшало выживаемость. Имеются также свидетельства того, что комбинированное лечение с использованием TRAIL и различных химиотерапевтических композиций может еще более усилить регрессию опухоли.
TRAIL связывается с рецепторами смерти DR4 и DR5 на клетках опухоли и линиях раковых клеток и быстро и специфично вызывает апоптоз. В зависимости от типа клеток связывание TRAIL с рецептором смерти индуцирует либо и внешний, и внутренний каналы апоптоза, либо только один из этих каналов. В обоих каналах при связывании TRAIL с его рецептором формируется сайт связывания для адапторного белка FADD (Fas-связанный белок с доменом смерти), который захватывает и активирует инициаторную каспазу 8. В некоторых клетках каспаза 8 активирует внешний канал апоптоза, напрямую вызывая активирование каспаз-эффекторов 3, 6, и 7, что достаточно для индуцирования апоптоза. TRAIL может также индуцировать апоптоз по внутреннему каналу, где активация каспазы 8 инициирует апоптоз с участием митохондрий и образованием апоптосомы. Каспаза 8 расщепляет ингибирующий Bcl-2 белок, который содержит домен BH3 (Bid), вызывая транслокацию укороченного Bid из цитоплазмы во внешнюю мембрану митохондрии и индуцируя олигомеризацию Bax и Bak. Поры, образованные Bax (Bcl-2-связанный X белок) и Bak (Bcl-2-антагонист/киллер 1), приводят к потере поляризации митохондриальной мембраны и выбросу цитохрома c, вызывая метаболический отказ клеточных митохондрий. Затем цитохром с в цитоплазме взаимодействует с каспазой 9, с тем чтобы последовательно активировать каспазы-эффекторы 3, 6 и 7.
В то же время лечение с использованием соединений из суперсемейства TNF имеет определенные ограничения, связанные с тем, что различные клетки опухоли устойчивы по отношению к апоптозу, вызванному соединениями суперсемейства TNF, в том числе TRAIL. В настоящем изобретении рассматриваются такие ограничения.
Опубликованные результаты
Известно, что определенные молекулы, присутствующие в организме, могут подавлять активность соединений из суперсемейства TNF (такие вещества в дальнейшем называются супрессорами TNF). Например, сообщалось о том, что клеточный FLICE-ингибирующий белок (c-FLIPs), Bax ингибитор 1 и Bcl-XL подавляют апоптотическую активность TRAIL. Burns, T.F. and W.S. El-Deiry, J. Biol. Chem., 276: 37879-37886 (2001). Сообщалось также, что гены AKT и MIRSA тоже подавляют апоптотическую активность TRAIL. См., например, Aza-Blanc et al., Molecular Cell, 12: 627-637 (2003).
Кроме того, известно, что биологические молекулы, ингибирующие активность супрессора TNF, служат сенсибилизаторами клетки таким образом, чтобы повысить апоптотическую активность TRAIL. Например, показано, что введение миРНК, ориентированной на гены AKT и MIRSA в клетке, сенсибилизирует клетку по отношению к апоптотической активности TRAIL. См., например, Aza-Blanc et al., Molecular Cell, 12: 627-637 (2003).
Настоящее изобретение относится к созданию средств, функция которых также заключается в повышении апоптотической активности TRAIL.
Краткое описание изобретения
Настоящее изобретение относится к композиции, включающей: (A) ингибитор, который ингибирует активность белка комплекса III, например Core 1, и (B) носитель.
Кроме того, изобретение относится к способу получения композиции, включающей ингибитор, ингибирующий активность белка комплекса III, например Core 1, и носитель, включающий смешивание указанного ингибитора с указанным носителем.
В другом аспекте изобретение относится к способу получения композиции, в которую входят: ингибитор, ингибирующий активность белка комплекса III, например Core 1, носитель, а также член суперсемейства фактора некроза опухоли, включающий смешивание указанного ингибитора, указанного носителя и указанного члена суперсемейства.
Еще один аспект настоящего изобретения относится к способу проведения анализа с целью определить, является ли то или иное соединение ингибитором TNF-подавляющей активности белка комплекса III, например Core 1, включающий сравнение жизнеспособности клеток, экспрессирующих белок комплекса III, которые выращивали в присутствии члена суперсемейства TNF и приводили в контакт с указанным соединением, с жизнеспособностью клеток той же клеточной линии (также экспрессирующих указанный белок комплекса III), которые выращивали в отсутствие члена суперсемейства TNF и приводили в контакт с указанным соединением.
Следующий аспект настоящего изобретения относится к способу проведения анализа с целью определить, является ли то или иное соединение ингибитором TNF-подавляющей активности белка комплекса III, например Core 1, включающий приведение вещества в контакт с клетками, экспрессирующими указанный белок и которые выращивали в присутствии члена суперсемейства TNF, в течение заранее заданного промежутка времени; приведение вещества в контакт с клетками той же самой клеточной линии, которые экспрессируют белок и которые выращивали в отсутствие члена суперсемейства TNF, в течение такого же заранее заданного промежутка времени; и сравнение жизнеспособности этих клеток.
Еще один аспект настоящего изобретения относится к способу проведения анализа с целью определить, является ли то или иное соединение ингибитором активности белка комплекса III, например Core 1, включающий выращивание клеток, экспрессирующих белок из клеточной линии в присутствии члена суперсемейства TNF; выращивание клеток, экспрессирующих белок из той же клеточной линии в отсутствие члена суперсемейства TNF; приведение вещества в контакт с этими клетками; сравнение жизнеспособности клеток после заранее заданного промежутка времени.
Еще один дополнительный аспект настоящего изобретения относится к способу проведения анализа с целью определить, является ли то или иное соединение ингибитором TNF-подавляющей активности белка комплекса III, например Core 1, включающий сравнение жизнеспособности клеток, экспрессирующих указанный белок и которые приводили в контакт с членом суперсемейства TNF и этого соединения, с жизнеспособностью клеток той же клеточной линии, экспрессирующих указанный белок комплекса III и приводили в контакт с этим соединением, но в отсутствие члена суперсемейства TNF.
Другой дополнительный аспект настоящего изобретения относится к способу проведения анализа с целью определить, является ли то или иное соединение ингибитором TNF-подавляющей активности белка комплекса III, например Core 1, включающий приведение экспрессирующих белок клеток из клеточной линии в контакт с членом суперсемейства TNF и указанным соединением; приведение экспрессирующих белок клеток из той же клеточной линии в контакт с указанным соединением, но в отсутствие члена суперсемейства TNF; и сравнение жизнеспособности клеток.
Описание фигур
На фигуре 1A приводится схема, описывающая метод скрининга библиотеки кДНК для выявления генов, которые определяют резистентность к апоптозу, индуцированному TRAIL. На схематической диаграмме приводится генетический скрининг библиотеки мышиной кДНК E14 для выявления резистентности к апоптозу, индуцированному TRAIL. кДНК из клеток, устойчивых к TRAIL, были выделены, секвенированы и проверены.
На фигуре 1B приводится частичная аминокислотная последовательность мышиной кДНК UQCRC1 (Core 1) в сравнении с полной последовательностью человеческой кДНК UQCRC1. Обе содержат последовательность митохондриальной локализации (MLS).
На фигуре 1C приводится график, демонстрирующий уровень сверхэкспрессии Core 1 в различных опухолевых тканях (из базы данных Ascenta).
Фигура 2A представляет собой гистограмму, отражающую жизнеспособность (что определяется процентом клеток, являющихся Annexin V-отрицательными) клеток HCT116, экспрессирующих доминантный отрицательный FADD (dnFADD), зеленый флуоресцентный белок (GFP) или частичный Core 1; эти клетки были обработаны TRAIL в концентрации 10 нг/мл или 50 нг/мл либо не приводились в контакт с TRAIL (0 нг/мл).
Фигура 2B представляет собой гистограмму, отражающую жизнеспособность (что определяется процентом поляризованных митохондрий в клетках) клеток HCT116, экспрессирующих доминантный отрицательный FADD (dnFADD), зеленый флуоресцентный белок (GFP) или частичный Core 1, которые были обработаны TRAIL в концентрации 10 нг/мл или 50 нг/мл либо не приводились в контакт с TRAIL (0 нг/мл).
На фигуре 2C представлен вестерн-блоттинг, проведенный на цитоплазматических и митохондриальных фракциях, которые были приготовлены из стабильных клеточных линий, экспрессирующих желтый флуоресцентный белок (YFP) или полную последовательность человеческого Core 1 (FL), с использованием антител к Core 1, COX 1 (митохондриальный маркер) и SOD1 (цитоплазматический маркер).
На фигуре 2D представлена гистограмма, отражающая жизнеспособность (что определяется процентом клеток, являющихся Annexin V-отрицательными) клеток HCT116, экспрессирующих желтый флуоресцентный белок (YFP) или полную последовательность человеческого Core 1, которые были обработаны TRAIL в концентрации 10 нг/мл или 50 нг/мл либо не приводились в контакт с TRAIL (0 нг/мл).
На фигуре 3A представлен вестерн-блоттинг, проведенный на фракциях из стабильных клеточных линий HCT116, экспрессирующих желтый флуоресцентный белок (YFP) или полную последовательность человеческого Core 1 (FL), которые либо были обработаны 200 нг/мг TRAIL в течение 24 часов, либо не приводились в контакт с TRAIL, с использованием антител к каспазе 8, каспазе 9, каспазе 3 и тубулину (пятна снимались и повторно анализировались с использованием антител к тубулину в качестве контроля загрузки).
Фигура 3B представляет собой гистограмму, отражающую количество цитохрома с, присутствующего в клетках, экспрессирующих либо желтый флуоресцентный белок (YFP), либо Core 1, которые были обработаны 100 нг/мл TRAIL или не приводились в контакт с TRAIL (0 нг/мл). Количество цитохрома с в лизатах определялось иммуноферментным анализом ELISA.
Фигура 3С представляет собой гистограмму, отражающую жизнеспособность клеток, экспрессирующих желтый флуоресцентный белок (YFP) или Core 1, которые либо не подвергались обработке, либо были обработаны TRAIL (100 нг/мл) или FasL (16 нг/мл). Жизнеспособность клеток определялась по титру Cell Titer Blue.
Фигура 3D представляет собой гистограмму, отражающую жизнеспособность клеток, экспрессирующих желтый флуоресцентный белок (YFP) или полную последовательность человеческого Core 1, которые либо не подвергались обработке, либо были обработаны 200 нМ камптотецина, 10 нМ таксотера или DMSO. Жизнеспособность клеток определялась по титру Cell Titer Blue.
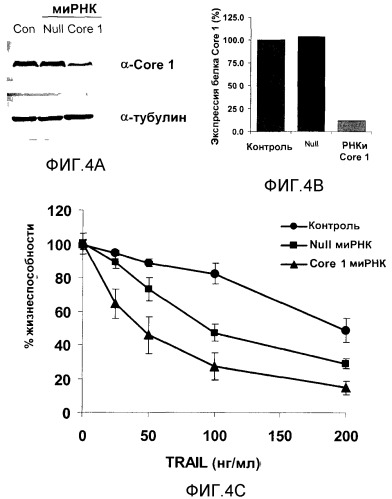
На фигуре 4A представлен вестерн-блоттинг, проведенный на фракциях из клеток HCT116 дикого типа, которые инкубировали только с липофектамином (контрольные клетки), 3,75 нМ Null миРНК или Core 1 миРНК в течение 72 часов, с использованием антител к Core 1 и тубулину (пятна снимали и повторно анализировали с использованием антител к тубулину в качестве контроля загрузки).
Фигура 4B представляет собой гистограмму, отражающую уровень экспрессии Core 1 в каждой из клеток, которые были описаны выше, на фигуре 4A.
На фигуре 4C приведена гистограмма, описывающая жизнеспособность клеток, которые ранее были обработаны только липофектамином, Null миРНК или Core 1 миРНК с последующей обработкой возрастающими концентрациями TRAIL.
На фигуре 5A приведена нуклеотидная последовательность человеческой кДНК UQCRC1 (SEQ ID NO: 1).
На фигуре 5B приведена аминокислотная последовательность человеческого Core 1 (SEQ ID NO: 2).
Подробное описание изобретения
Настоящее изобретение описывает применение ингибитора, который ингибирует TNF-подавляющую активность белка, относящегося к митохондриальному дыхательному комплексу III. Для простоты такой белок в настоящем документе называется белком комплекса III. Изобретение применимо к белку в той форме, в которой он связан с комплексом III, а также к белку, находящемуся в той форме, в которой он не связан с комплексом III, например, в выделенной форме. В одном из вариантов осуществления настоящего изобретения белком комплекса III является Core 1.
В состав настоящего изобретения входит фармацевтически эффективное количество ингибитора, который ингибирует TNF-подавляющую активность белка комплекса III, например Core 1. По сути, любое соединение, способное ингибировать TNF-подавляющую активность белка комплекса III, например Core 1, может использоваться для практического применения настоящего изобретения. Примеры соединений, которые могут использоваться для практического применения настоящего изобретения, включают: антисмысловую нуклеиновую кислоту, которая ингибирует экспрессию гена, кодирующего белок комплекса III, например Core 1; нуклеиновую кислоту, кодирующую антисмысловую нуклеиновую кислоту, которая ингибирует экспрессию гена белка комплекса III, например Core 1; миРНК, которая ингибирует экспрессию гена, кодирующего белок комплекса III, например Core 1; нуклеиновую кислоту, которая кодирует такую миРНК; антитело, которое способно связываться с белком комплекса III, например Core 1, и снижать его активность; нуклеиновую кислоту, кодирующую антитело, которое способно связываться с белком комплекса III, например, Core 1, и снижать его TNF-подавляющую активность; рибозим, который способен снижать уровень экспрессии белка комплекса III, например Core 1; нуклеиновую кислоту, кодирующую рибозим, который способен снижать уровень экспрессии белка комплекса III, например Core 1; соединение с малыми молекулами, которое способно снижать TNF-подавляющую активность белка комплекса III, например Core 1.
Ингибитор присутствует в композиции в концентрации, достаточной для снижения TNF-подавляющей активности белка комплекса III, например Core 1. Она может определяться рядовыми специалистами в данной области с учетом возможных колебаний эффективных концентраций в зависимости от конкретного используемого ингибитора, а также количеств и природы других компонентов композиции. В рамках общих рекомендаций предполагается, что в большинстве приложений будет использоваться ингибитор в количествах примерно от 0,01% до 15% от веса композиции. В некоторых вариантах осуществления ингибитор присутствует в количествах приблизительно от 0,01% до 10% от веса композиции, либо примерно от 0,1% до 5% от веса композиции.
В вариантах осуществления, где в качестве ингибитора используется антисмысловая нуклеиновая кислота, она гибридизуется по крайней мере с частью дезоксирибонуклеиновой кислоты (ДНК), кодирующей белок комплекса III, например Core 1, с тем чтобы за счет этого ингибировать экспрессию белка. Антисмысловой нуклеиновой кислотой может быть также кислота, которая снижает экспрессию гена, кодирующего белок комплекса III, например Core 1, за счет ингибирования сплайсинга его первичного транскрипта. Антисмысловая нуклеиновая кислота может содержать ДНК или рибонуклеиновую кислоту (РНК), либо обе кислоты. Антисмысловая последовательность любой длины достаточна для практического применения настоящего изобретения, при условии что она способна ингибировать экспрессию белка комплекса III, например Core 1. Предпочтительная антисмысловая последовательность имеет длину по меньшей мере 20 нуклеотидов. В предпочтительных вариантах осуществления антисмысловой нуклеиновой кислотой является олигонуклеотид.
Антисмысловая нуклеиновая кислота может быть получена синтетическим путем, например посредством экспрессии всей или части нуклеиновой кислоты, кодирующей белок комплекса III, например Core 1, в противоположной ориентации, как описано в European Patent № 140308. Последовательность нуклеиновой кислоты, кодирующей Core 1, приводится на фигуре 5A. Приготовление и использование синтетических антисмысловых нуклеиновых кислот в общей форме описано в International Application Publication WO 92/15680.
Антисмысловая нуклеиновая кислота может быть химически модифицирована, к примеру для улучшения стабильности и/или селективности. Например, одна из таких модификаций предусматривает замену свободного кислорода в фосфодиэфирной связи на сульфогруппу с образованием фосфоротиоатной связующей цепочки. Фосфоротиоатные антисмысловые нуклеиновые кислоты растворимы в воде, являются полианионами и устойчивы по отношению к эндогенным нуклеазам. Кроме того, можно синтезировать антисмысловые нуклеиновые кислоты с фосфорамидитными и полиамидными (пептидными) связями. Такие нуклеиновые кислоты обычно очень устойчивы к распаду в присутствии нуклеазы. Кроме того, химические группы могут добавляться к 2'-углероду сахара и 5-углероду (C-5) пиримидинов для увеличения стабильности антисмысловой нуклеиновой кислоты и способствования связыванию антисмысловой нуклеиновой кислоты с целевым сайтом. Модификации могут включать 2'-деокси, O-пентокси, O-пропокси, O-метокси, фтор, метоксиэтоксифосфоротиоаты, модифицированные основания, а также другие модификации, известные рядовым специалистам в данной области.
Антисмысловая нуклеиновая кислота присутствует в составе композиции в концентрации, достаточной для ингибирования экспрессии нуклеиновой кислоты, кодирующей белок комплекса III, например Core 1.
В тех вариантах осуществления, где нуклеиновая кислота, кодирующая антисмысловую нуклеиновую кислоту, используется в качестве ингибитора, такая нуклеиновая кислота относится к кислотам, кодирующим антисмысловую нуклеиновую кислоту описанного выше типа. Эта нуклеиновая кислота присутствует в составе композиции в концентрации, достаточной для экспрессии такого количества антисмысловой нуклеиновой кислоты, которое будет обеспечивать эффективное ингибирование экспрессии белка комплекса III, например Core 1.
В тех вариантах осуществления, где миРНК (малая интерферирующая РНК) используется в качестве ингибитора, такая миРНК гибридизуется с частью мРНК, кодирующей белок комплекса III, например Core 1, и способна включаться в индуцированный РНК сайленсинг-комплекс (RISC), который идентифицирует мРНК и ингибирует ее экспрессию. миРНК присутствует в составе композиции в концентрации, достаточной для ингибирования экспрессии нуклеиновой кислоты, кодирующей белок.
В еще одном варианте осуществления настоящего изобретения нуклеиновая кислота, кодирующая вышеуказанную миРНК, может использоваться в качестве ингибитора.
В тех вариантах осуществления, где в качестве ингибитора используется антитело, такое антитело связывается с Core 1 и ингибирует его TNF-подавляющую активность. Это антитело может быть, например, моноклональным или поликлональным, химерным, фрагментом Fab, фрагментом Fv, либо продуктом библиотеки экспрессии Fab или Fv.
Поликлональные антитела могут быть получены из антигенного фрагмента белка комплекса III, например Core 1, или полного белка. Моноклональные антитела могут быть получены, например, с помощью метода, изложенного в Mishell, B. B., et al., Selected Methods in Cellular Immunology, (W.H. Freeman, ed.) San Francisco (1980). Моноклональные антитела по настоящему изобретению могут быть «гуманизированы», чтобы исключить формирование иммунного ответа реципиента на антитела. «Гуманизированным антителом» называют такое антитело, в котором участки, определяющие комплементарность (CDR) и/или другие части каркасных доменов легкой и/или тяжелой вариабельной цепи взяты из не принадлежащего человеку иммуноглобулина, а остальные части молекулы взяты из одного или нескольких иммуноглобулинов человека. К гуманизированным также относятся антитела, для которых характерна гуманизированная тяжелая цепь, связанная с немодифицированной легкой цепью донора или акцептора либо с химерной легкой цепью, или наоборот. Гуманизация антител может проводиться с помощью известных специалистам методов (см., например, G.E. Mark and E.A. Padlan, "Chapter 4. Humanization of Monoclonal Antibodies", The Handbook of Experimental Pharmacology Vol. 113, Springer-Verlag, New York, 1994). Для экспрессии гуманизированных антител могут использоваться трансгенные животные.
Антитело может быть одноцепочечным. Известные специалистам методики получения одноцепочечных антител могут быть адаптированы для получения одноцепочечных антител к белку комплекса III, например Core 1.
Антитело присутствует в составе композиции в концентрации, достаточной для ингибирования активности белка комплекса III, например Core 1.
В тех вариантах осуществления, где нуклеиновая кислота, кодирующая антитело, используется в качестве ингибитора, такая нуклеиновая кислота относится к кислотам, кодирующим антитело, которое связывается с белком комплекса III, например Core 1, и ингибирующим его активность. Нуклеиновая кислота присутствует в составе композиции в концентрации, достаточной для экспрессии такого количества антитела, которое оказывается эффективным для ингибирования активности белка.
В тех вариантах осуществления, где в качестве ингибитора используется рибозим (энзим рибонуклеиновой кислоты), таким рибозимом является тот рибозим, который содержит каталитический домен и домен, связывающий субстрат. Домен, связывающий субстрат, гибридизуется по крайней мере с частью мРНК, которая кодирует белок комплекса III, например Core 1. Каталитическим доменом называют домен, который способен расщеплять мРНК.
В предпочтительных вариантах осуществления настоящего изобретения образующийся рибозим имеет молоточковый мотив. Другие формы имеют шпилечный мотив, мотивы вируса гепатита-дельта, интрона группы I или РНК РНКазы Р (в связи со вспомогательной последовательностью РНК) либо мотив РНК Neurospora VS. Молоточковые мотивы описаны в работе Rossi et al., Aids Research and Human Retroviruses, 8: 183 (1992). Шпилечные мотивы описаны в работе Hampel and Tritz Biochemistry, 28: 4929 (1989), и Hampel et al., Nucleic Acids Res., 18: 299 (1990). Мотив вируса гепатита-дельта описан в работе Perrotta and Been, Biochemistry, 31: 16 (1992); мотив РНКазы Р описан в работе Guerrier-Takada et al., Cell, 35: 849 (1983); мотив рибозима РНК Neurospora VS описан в работе Collins (Saville and Collins, Cell, 61: 685-696 (1990); Saville and Collins, Proc. Natl. Acad. Sci. USA, 88: 8826-8830 (1991); Collins and Olive, Biochemistry, 32, 2795-2799 (1993); мотив интрона группы I описан в Cech et al., US Patent № 4987071.
Одним из примеров метода получения рибозима является химический синтез олигодезоксирибонуклеотида с каталитическим доменом рибозима (-20 нуклеотидов) с боковыми последовательностями, которые после транскрипции гибридизуются с целевой мРНК Core 1. Амплификация олигодезоксирибонуклеотида проводится с использованием связывающих субстрат последовательностей в качестве праймеров. Амплифицированный продукт клонируется в эукариотический вектор экспрессии. Рибозим по настоящему изобретению может экспрессироваться в клетках эукариотов из соответствующего вектора ДНК. При желании активность рибозима может усиливаться посредством его выделения из первичного транскрипта вторым рибозимом (Ohkawa et al., Nucleic Acids Symp. Ser., 27: 15-6 (1992); Taira et al., Nucleic Acids Res., 19: 5125-30 (1991); Ventura et al., Nucleic Acids Res., 21, 3249-55 (1993).
Рибозим присутствует в составе композиции в концентрации, достаточной для ингибирования экспрессии нуклеиновой кислоты, кодирующей белок комплекса III, например Core 1.
В вариантах осуществления, в которых нуклеиновая кислота, кодирующая рибозим, используется в качестве ингибитора, такая нуклеиновая кислота относится к кислотам, кодирующим рибозим, который способен гибридизоваться с мРНК, кодирующей белок комплекса III, например Core 1, и расщеплять ее. Нуклеиновая кислота присутствует в составе композиции в концентрации, достаточной для получения рибозима в количестве, ингибирующем экспрессию белка. Количество может определяться рядовыми специалистами в данной области.
В вариантах осуществления, где используется соединение с малыми молекулами, ингибирующее активность белка комплекса III, например Core 1, таким соединением является соединение, которое сенсибилизирует клетки по отношению к апоптозу, индуцированному TRAIL, посредством ингибирования функции митохондриального комплекса III, например за счет ингибирования активности вышеуказанного белка. Соединение с малыми молекулами присутствует в композиции в концентрации, достаточной для ингибирования активности белка комплекса III, например Core 1, или для усиления эффекта воздействия TRAIL на клетки опухоли независимо от активности белка комплекса III в этих клетках.
В вариантах осуществления, в которых используется нуклеиновая кислота, кодирующая соединения с малыми молекулами, такая нуклеиновая кислота относится к тем кислотам, которые кодируют соединение с малыми молекулами, ингибирующим TNF-подавляющую активность белка комплекса III, например Core 1. Нуклеиновая кислота присутствует в составе композиции в концентрации, достаточной для получения вышеуказанного соединения в количестве, ингибирующем активность белка. Это может определяться рядовыми специалистами в данной области.
В вышеприведенных вариантах осуществления, которые предусматривают использование нуклеиновой кислоты, кодирующей антисмысловую нуклеиновую кислоту или белок, например антитело, рибозим или соединение с малыми молекулами, применяемую для ингибирования TNF-подавляющей активности белка комплекса III, например Core 1, такая нуклеиновая кислота может также содержать одну или несколько регуляторных областей, которые регулируют экспрессию кодирующей части нуклеиновой кислоты. Выбор соответствующей регуляторной области или областей представляет собой стандартную процедуру и не превышает уровня знаний рядовых специалистов в данной области. Регуляторные области включают промоторы, энхансеры, супрессоры и т.д.
К промоторам, которые могут использоваться в настоящем изобретении, относятся конститутивные промоторы и регулятивные (индуцируемые) промоторы. Примеры промоторов, применяемых на практике в настоящем изобретении: убиквитарные промоторы (например HPRT, виментин, актин, тубулин); промоторы промежуточного филамента (например десмин, нейрофиламенты, кератин, GFAP); терапевтические генные промоторы (например, MDR типа, CFTR, фактор VIII), а также тканеспецифические промоторы (например актиновый промотор в клетках гладкой мускулатуры или промоторы Flt и Flk, активные в эндотелиальных клетках).
К тканеспецифическим промоторам относятся транскрипционные контрольные области, которые проявляют специфичность по отношению к тканям, например: контрольная область гена эластазы I, проявляющая активность в ацинарных клетках поджелудочной железы (Swift et al., 1984, Cell 38:639-646; Ornitz et al., 1986, Cold Spring Harbor Symp. Quant. Biol., 50:399-409; MacDonald, 1987, Hepatology 7:425-515); контрольная область гена инсулина, проявляющая активность в бета-клетках поджелудочной железы (Hanahan, 1985, Nature 315:115-122); контрольная область гена иммуноглобулина, которая проявляет активность в лимфоидных клетках (Grosschedl et al., 1984, Cell 38:647-658; Adames et al., 1985, Nature 318:533-538; Alexander et al., 1987, Mol. Cell. Biol., 7:1436-1444); контрольная область опухоли молочной железы мышей, проявляющая активность в тестикулярных клетках, клетках грудной железы, лимфоидных и тучных клетках (Leder et al., 1986, Cell 45:485-495); контрольная область гена альбумина, которая проявляет активность в печени (Pinkert et al., 1987, Genes and Devel. 1:268-276); контрольная область гена альфа-фетопротеина, проявляющая активность в печени (Krumlauf et al., 1985, Mol. Cell. Biol., 5:1639-1648; Hammer et al., 1987, Science 235:53-58); контрольная область гена альфа-1-антитрипсина, которая проявляет активность в печени (Kelsey et al., 1987, Genes and Devel., 1:161-171); контрольная область гена бета-глобина, которая проявляет активность в миелоидных клетках (Mogram et al., 1985, Nature 315:338-340; Kollias et al., 1986, Cell 46:89-94); контрольная область гена основного белка миелина, которая проявляет активность в клетках олигодендроцитов мозга (Readhead et al., 1987, Cell 48:703-712); контрольная область гена легкой цепи миозина-2, проявляющая активность в скелетной мускулатуре (Sani, 1985, Nature 314:283-286), а также контрольная область гена гонадотропин-высвобождающего гормона, которая проявляет активность в гипоталамусе (Mason et al., 1986, Science 234:1372-1378).
К другим промоторам, которые могут использоваться в практических применениях по настоящему изобретению, относятся, например, промоторы, которые преимущественно активируются в делящихся клетках, промоторы, реагирующие на стимул (например рецептор стероидных гормонов, рецептор ретиноевой кислоты), тетрациклин-регулируемые транскрипционные модуляторы, предранний промотор цитомегаловируса, промоторы ретровирусного LTR, металлотионеина, SV-40, E1a и MLP. Тетрациклин-регулируемые транскрипционные модуляторы и промоторы CMV описаны в International Application Publication № WO 96/01313 и US Patent № 5168062 и 5385839.
В одном из вариантов осуществления настоящего изобретения в состав композиции входит вектор, который, в свою очередь, включает описанную выше нуклеиновую кислоту. Вектор представляет собой средство для переноса нуклеиновой кислоты в клетку. Термин «вектор» включает как вирусные, так и невирусные средства введения нуклеиновой кислоты в клетку. К невирусным векторам относятся, например, плазмиды, липосомы, электрически заряженные липиды (цитофектины), комплексы ДНК-белок и биополимеры. К вирусным векторам относятся, например, ретровирус, аденосателлитный вирус, векторы чумы, бакуловируса, осповакцины, симплекса герпеса, Эпштейна-Барра и аденовируса. Кроме нуклеиновой кислоты вектор может также содержать один или несколько селектируемых маркеров, которые применяются для выбора, измерения и мониторинга результатов переноса нуклеиновой кислоты (ткани, в которые осуществляется перенос, продолжительность экспрессии и т.д.).
Что касается использования вирусного вектора, он может быть дефектным по отношению к репликации, то есть неспособным к автономной репликации в целевых клетках. В общем случае в геноме дефектных по отношению к репликации вирусных векторов отсутствует по крайней мере одна область, которая необходима для репликации вируса в инфицированной клетке. Эти области можно либо удалить (полностью или частично), либо сделать нефункциональными с помощью любой методики, известной специалистам в данной области. К таким методикам относятся полное удаление, замена (другими последовательностями, в частности за счет введенной нуклеиновой кислоты), частичное удаление либо добавление одного или нескольких оснований к важной (для репликации) области. Такие методики могут осуществляться in vitro (на изолированной ДНК), или in situ, с использованием методик манипуляций с генами или за счет обработки мутагенными агентами. Предпочтительно, вирус, дефектный по отношению к репликации, сохраняет последовательности своего генома, которые необходимы для инкапсулирования вирусных частиц.
Что касается использования ретровирусов, то они интегрируют вирусы, которые инфицируют делящиеся клетки. Геном ретровируса включает две LTR, последовательность инкапсуляции и три кодирующие области (gag, pol и env). Структура рекомбинантных ретровирусных векторов описана, например, в European Patent № 453242 и 178220 и в Bernstein et al., Genet. Eng., 7: 235 (1985) and McCormick, BioTechnology, 3: 689 (1985). В рекомбинантных ретровирусных векторах гены gag, pol и env обычно удаляются, полностью или частично, и заменяются представляющей интерес последовательностью гетерологичной нуклеиновой кислоты. Такие векторы могут конструироваться из различных видов ретровируса, например, MoMuLV («вирус мышиного лейкоза Молони»), MSV («вирус мышиной саркомы Молони»), HaSV («вирус саркомы Харви»), SNV («вирус некроза селезенки»); RSV («вирус саркомы Рауса») и вирус Фрейнда. Системы векторов лентивируса могут также использоваться в практическом применении настоящего изобретения. Лентивирусный геном представляет собой полиаденилированную РНК с позитивным геномом с 9000-10000 пар оснований, содержащую три структурных гена с организацией от 5' до 3' (gag, pol, env), характерной для всех ретровирусов. Подробный обзор лентивирусных систем см. в Fields Virology, Second Edition, Volume 2, Chapter 55, "Lentiviruses," pp. 1571-1589, Raven Press, New York, 1990.
Как правило, для того чтобы построить рекомбинантные ретровирусы, содержащие нуклеиновую кислоту по настоящему изобретению, конструируется плазмида, которая содержит LTR, инкапсулирующую и кодирующую последовательности. Данная конструкция используется для трансфицирования линии клеток с дефектом упаковки, которая способна передавать ретровирусные функции, недостающие в плазмиде. Соответственно, линии клеток с дефектом упаковки обычно могут экспрессировать гены gag, pol и env. Такие линии клеток с дефектом упаковки описаны ранее, в частности, линия клеток PA317 (US 4861719); линия клеток PsiCRIP (International Application Publication № WO 90/02806) и линия клеток GP+envAm-12 (International Application Publication № WO 89/07150). Кроме того, рекомбинантные ретровирусные векторы могут содержать модификации внутри LTR для подавления транскрипционной активности, а также экстенсивных инкапсулирующих последовательностей, которые могут включать часть гена gag (Bender et al., J. Virol. 61 (1987) 1639). Рекомбинантные ретровирусные векторы очищают с помощью стандартных методик, известных рядовым специалистам в данной области.
Что касается использования аденоассоциированных вирусов (AAV), то они представляют собой ДНК-вирусы сравнительно небольшого размера, способные стабильным и сайт-специфичным образом интегрироваться в геном клеток, которые они инфицируют. Они могут инфицировать широкий спектр клеток, не индуцируя никаких эффектов клеточного роста, морфологии или дифференциации, и, по-видимому, не связаны с патологиями человека. Геном AAV был клонирован, секвенирован и охарактеризован. Он включает примерно 4700 оснований и содержит инвертированную терминальную повторяющуюся область (ITR) примерно из 145 оснований на обоих концах, которая служит в качестве исходной для репликации вируса. Остальная часть генома делится на две важные области, выполняющие функции инкапсуляции: левая часть генома, которая содержит ген rep, задействованный в репликации вируса и экспрессии генов вируса, и правая часть генома, которая содержит ген сар, кодирующий капсидные протеины вируса.
Использование векторов, полученных из AAV для передачи генов in vitro и in vivo, было описано ранее (см. International Application Publication № WO 91/18088 и WO 93/09239; US Patent №№ 4797368 и 5139941, и European Patent № 488528). В этих публикациях описаны различные конструкции из AAV, в которых гены rep и (или) cap удалены и заменены представляющим интерес геном, а также использование этих конструкций для передачи представляющих интерес генов in vitro (в культивированные клетки) или in vivo (непосредственно в организм). Используемый в настоящем изобретении дефектный по отношению к репликации рекомбинантный AAV может готовиться посредством котрансфицирования плазмиды, которая содержит представляющую интерес последовательность нуклеиновой кислоты, ограниченную двумя инвертированными терминальными повторяющимися областями (ITR) AAV, а также плазмиды, несущей гены инкапсуляции AAV (гены rep и cap), в линию клеток, инфицированных человеческим вирусом-помощником (например, аденовирусом). Полученные AAV рекомбинанты затем очищаются с помощью стандартных методик.
В предпоч