Способ получения нанокристаллического кремнийзамещенного гидроксиапатита
Иллюстрации
Показать всеИзобретение относится к технологии получения неорганических материалов, которые могут быть использованы для производства медицинских материалов, стимулирующих восстановление дефектов костной ткани, в том числе в стоматологии. Способ получения монофазового нанокристаллического кремнийзамещенного гидроксиапатита включает синтез кремнийсодержащего гидроксиапатита методом осаждения из водного раствора реагентов, содержащих ортофосфорную кислоту, гидроксид кальция и тетраэтилортосиликат при рН не менее 9 и молярном отношении Са/Р в диапазоне от 2,0 до 2,5, отстаивание для завершения процесса фазообразования, выделение осадка, высушивание и термообработку осадка, при этом синтез ведут путем приливания 10-20%-ного раствора ортофосфорной кислоты со скоростью 0,2-0,8 мл/мин на литр водного раствора композиции гидроксид кальция /тетраэтилортосиликат, приготовленной с использованием 0,08-0,16%-ного водного раствора гидроксида кальция и расчетного количества тетраэтилортосиликата для получения готового продукта со степенью замещения кремнием х, равным 1-2, и молярным отношением Са/(Р+Si), близким к 1,67, а термообработку ведут при температуре не ниже 300°С, но не более 400°С. Изобретение позволяет получать стехиометрический монофазный продукт фаз со средним размером кристаллов 9,95-12,53 нм, удельной поверхностью 108,97-132,58 м2/г и повышенной биоактивностью, при нагревании которого не образуются побочные фазы. 4 ил., 2 табл., 8 пр.
Реферат
Изобретение относится к технологии получения неорганических материалов, а именно к способу получения нанокристаллического кремнийзамещенного гидроксиапатита, который может быть использован для производства медицинских материалов, стимулирующих восстановление дефектов костной ткани, в том числе в стоматологии.
В последние годы в медицинской практике с целью замены, восстановления или реставрации поврежденных костей и суставов в качестве биосовместимых имплантатов весьма эффективно используются кальций-фосфатные материалы.
Ограниченные источники аутогенных материалов, а также риски, связанные с использованием аллогенных или ксеногенных материалов, сделали актуальным широкое применение в стоматологической и ортопедической практике синтетических костнопластических материалов. Решающим фактором при выборе подобных синтетических материалов является то, что они должны быть максимально биосовместимыми и биологически активными материалами, способными к полноценной интеграции в естественный процесс ремоделирования костной ткани.
Одним из наиболее востребованных костнопластических синтетических материалов кальций-фосфатного состава, среди разработанных в течение последних 30-40 лет, является гидроксиапатит (далее ГАП), который соответствует химической формуле Са10(РО4)6(ОН)2.
Гидроксиапатит можно считать кристаллохимическим аналогом минеральной составляющей тканей скелета животных и людей и в связи с этим он успешно служит базовым компонентом синтетических материалов для ортопедии и стоматологии. Поэтому синтетический ГАП является наиболее биосовместимым ортофосфатом кальция, который, как сообщается, часто готовят по керамической технологии и в качестве костнозамещающего материала применяют в поризованной, гранулированной, плазменно-напыленной и компактированной формах [1]. Однако гидроксиапатитовая керамика не очень хорошо растворяется в организме и не резорбирует в течение разумного периода времени [2]. Предлагаемое время для идеально полной резорбции этих материалов составляет от 1 месяца до 3 лет, в течение которых они будут замещены на новые кости. Поэтому повышение скорости интеграции с костной тканью и биоактивности материалов на основе гидроксилапатита является важной задачей.
Одним из путей решения этой проблемы является синтез наноразмерного гидроксиапатита с последующей термической обработкой ниже температуры спекания. Поэтому для получения наноразмерного ГАП сегодня наибольшее распространение получили методы, основанные на осаждении гидроксиапатита из щелочных водных растворов реагентов, содержащих в стехиометрическом соотношении ионы кальция и фосфат-ионы. Подобный метод, в частности, изложен в патенте РФ №2342938 [3].
Вместе с тем, последние результаты клинической апробации препаратов медицинского назначения, приготовленных с использованием ГАП, отвечающего формуле Са10(РO4)6(ОН)2, показывают, что такой материал, наряду с явными преимуществами обладает рядом недостатков: недостаточной скоростью биорезорбции in vivo и остеоиндукцией, т.е. слабым стимулирующим воздействием на рост новой костной ткани.
Перспективным направлением повышения резорбируемости и остеоиндукции кальций-фосфатных материалов является химическое модифицирование гидроксиапатита, прежде всего, путем получения кремний- или силикатзамещенного гидроксиапатита, далее Si-ГАП. Установлено, что гидроксиапатит, модифицированный силикат-анионами, способствует улучшенной пролиферации остеобластов и росту внеклеточного матрикса, ускоренной минерализации костной ткани [4-5]. Кремнийзамещенные гидроксиапатиты чаще всего описываются формулой:
Ca10(PO4)6-x(SiO4)x(OH)2-x, где х - коэффициент или степень замещения кремния.
Известен способ получения кремнийзамещенного гидроксиапатита путем осаждения из водного раствора реагентов [6], где в качестве источника ионов кальция и фосфат-ионов использовали гидроксид кальция - Са(ОН)2 и ортофосфорную кислоту - Н3РО4. Реакцию между ними проводили при комнатной температуре, а рН поддерживали на уровне 10,5 за счет добавления гидроксида аммония. Кремний в состав ГАП вводили с использованием тетраацетата кремния - Si (СН3СОО)4. Материал был приготовлен по стехиометрии ГАП при условии, что кремний замещает позиции фосфора в кристаллической решетке, а молярное отношение Са/(Р+Si) равно 1,67. Осадок ГАП термообрабатывали при 1200°С в течение 2 часов в атмосфере воздуха. Недостатком этого способа, с одной стороны, является невысокая степень замещения кремния x≤1, что соответствует содержанию кремния в материале 0,8-1,5 мас.%, а с другой - появление примесных фаз, например оксида кальция или трикальцийфосфата после термообработки при использовании более высоких степеней замещения, например, при х>1.
Известен также способ получения кремнийзамещенного гидроксиапатита, согласно которому готовили порошки методом осаждения из водных растворов, используя соотношение Са/(Р+Si), равное 1,67 [7]. Порошки содержали карбонат. После прокаливания были получены апатиты свободные от карбонатов. Используя химическую формулу
Ca10(PO4)6-x(SiO4)x(OH)2-x, где 0≤х≤2
для прокаленных декальцинированных продуктов, авторы способа сообщают, что поведение порошков кремнийсодержащего гидроксиапатита с х>1 очень отличается от композиций с х≤1. Если при коэффициенте замещения на силикат-ионы х≤1 после прокаливания был получен Si-ГАП, свободный от карбонатов, то у порошков с коэффициентом замещения х>1 при нагреве выше 700°С одновременно появилось две фазы: гидроксиапатит и α-трикальцийфосфат, что, как и в вышеуказанном способе [6], является существенным недостатком.
Наиболее близким по технической сущности и достигаемому результату является способ, описанный в патенте US 20100173009 A1 [8].
Указанный способ включает синтез Si-ГАП методом осаждения при рН не менее 9 из водного раствора реагентов, содержащих ортофосфорную кислоту, гидроксид кальция и тетраэтилортосиликат (далее ТЭОС). Причем реагенты вводятся в реакционную смесь при условии обеспечения молярного отношения Са/Р в диапазоне от 2,05 до 2,55, содержания атомов кремния в диапазоне от 2,9 до 6 мас.% и молярного отношения Са/(Р+Si) в диапазоне от 1,50 до 1,66. Раствор ортофосфорной кислоты помещают в капельную воронку и добавляют по каплям в композицию гидроксид кальция/ТЭОС, в течение примерно 60-120 минут. Реакционную смесь перемешивают в течение 2 часов, а затем оставляют для старения около 24 часов. Вся реакция проходит при комнатной температуре. Затем суспензию отфильтровывают с помощью воронки Бюхнера с использованием фильтровальной бумаги и вакуумного насоса. После удаления фильтрата мокрый фильтр-корж помещают в сушильный шкаф и сушат при 90°С в течение 2 дней. После чего высушенный фильтр-корж извлекают, измельчают в мелкий порошок с использованием ступки и пестика, а затем помещают в камерную печь и нагревают в атмосфере воздуха до максимальных температур от 400°С до 900°С в течение одного часа. Скорость нагрева 2,5°С/мин, скорость охлаждения 10°С/мин.
Этот способ позволяет получать поликристаллический чистый или монофазовый кремнийзамещенный гидроксиапатит, состоящий из частиц размером 0,05-5 мкм (или 50-5000 нм соответственно), обладающий относительно высокой скоростью растворения и способностью извлекать достаточные количества кремния в раствор.
Указывается, что преимуществом кремнийзамещенного гидроксиапатита этого изобретения является более высокая растворимость по сравнению с керамическим кремнийзамещенным гидроксиапатитом и обычным немодифицированным гидроксиапатитом, а также более высокий выход кремния при контакте с раствором. Также отмечается, что при выдерживании кремнийзамещенного гидроксиапатита в физиологическом растворе концентрация ионов кальция остается неизменной или увеличивается. Это выгодно отличает его от гидроксиапатитов с низким уровнем замещения кремния, для которых содержание кальция в физиологическом растворе снижается в тот же период времени.
Сообщается, что удельная поверхность порошка кремнийзамещенного гидроксиапатита, получаемого с помощью данного способа составляет от 10 до 90 м2/г, что существенно превышает удельную поверхность порошка обычного гидроксиапатита после нагревания образцов при той же температуре. Например, после нагрева при 900°С удельная поверхность порошка кремнийзамещенного гидроксиапатита, полученного с помощью данного способа, составляет 27 м2/г, а удельная поверхность соответствующего порошка незамещенного гидроксиапатита составляет 13 м2/г.
В то же время в описании указывается, что использование молярного отношения Са/(Р+Si)=1,667 и выше может после нагрева при 900°С приводить к появлению двух фаз: фазы Si - ГАП и 2-й нежелательной фазы - СаО. Кроме того, отмечается, что такой кремнийзамещенный гидроксиапатит может быть представлен формулой:
Ca10-δ(PO4)6-x(SiO4)x(OH)2-x, где δ представляет дефицит кальция, поскольку молярное отношение Са/(Р+Si) имеет значение меньше чем 1,667.
Таким образом, основными недостатками данного технического решения является недостаточная биоактивность полученного продукта, т.е. недостаточно высокая скорость растворения в физиологических средах, невозможность получения стабильного монофазового кремнийсодержащего гидроксиапатита с коэффициентом замещения х в диапазоне от 1 до 2 при молярном отношении реагентов Са/(Р+Si)=1,67, и, как следствие, нестехиометричность такого продукта из-за дефицита катионов кальция. А, как известно, недостаток кальция в костных тканях человека и животных может приводить к более серьезным проблемам, чем дефицит кремния. Также следует иметь в виду, что у кремнийсодержащих гидроксиапатитов, отвечающих формуле Ca10(PO4)6-x(SiO4)x(OH)2-x, нарушается принцип электронейтральности. Это, в свою очередь, является основной причиной нестабильности подобных соединений и объясняет их склонность к деструкции с выделением побочных примесных фаз, особенно при нагревании.
Задачей изобретения является создание способа получения монофазового нанокристаллического кремнийзамещенного гидроксиапатита с повышенной биоактивностью и со степенью замещения кремния х=1-2, при молярном отношении Са/(Р+Si), близком к 1,67.
Технический результат:
- получение стехиометричного монофазового Si-ГАП со средним размером кристаллов 9,95-12,53 нм, удельной поверхностью 108,97-132,58 м2/г, что обеспечивает повышенную биоактивность готового продукта;
- получение стабильного монофазового продукта формулы Ca10(PO4)6-x(SiO4)x(OH)2-x, где 1≤х≤2, при нагревании которого не образуются побочные фазы.
Для решения поставленной задачи получения стабильного монофазового нанокристаллического кремнийзамещенного гидроксиапатита со степенью замещения кремния х=1-2, что соответствует содержанию кремния до 6 мас.%, при молярном отношении Са/(Р+Si), близком к 1,67, предложен способ получения Si-ГАП, включающий синтез путем осаждения из водного раствора реагентов, содержащих ортофосфорную кислоту, гидроксид кальция и тетраэтилортосиликат при рН не менее 9 и молярном отношении Са/Р в диапазоне от 2,0 до 2,5, отстаивание для завершения процесса фазообразования, выделение осадка, высушивание и термообработку осадка, причем синтез ведут путем приливания 10-20%-ного раствора ортофосфорной кислоты со скоростью 0,2-0,8 мл/мин на литр водного раствора композиции гидроксид кальция/тетраэтилортосиликат, приготовленной с использованием 0,08-0,16%-ного водного раствора гидроксида кальция и расчетного количества тетраэтилортосиликата для получения готового продукта со степенью замещения кремнием х=1-2 и молярным отношением Са/(Р+Si), равным 1,67, а термообработку ведут при температуре не ниже 300°С, но не более 400°С.
Способ включает следующие новые признаки:
- скорость приливания 10-20%-ного раствора ортофосфорной кислоты составляет 0,2;
- 0,8 мл/мин на литр водного раствора композиции, приготовленной с использованием 0,08;
- 0,16%-ного водного раствора гидроксида кальция и расчетного количества тетраэтилортосиликата для получения готового продукта;
- термообработку осадка ведут при температуре не ниже 300°С, но не более 400°С, т.к. термообработка ниже 300°С приводит к снижению биоактивности готового продукта, а выше 400°С - нецелесообразно из-за дополнительных энергозатрат.
Использование водного раствора гидроксида кальция с концентрацией менее 0,08 мас.% нецелесообразно по экономическим причинам из-за крайне низкого выхода готового продукта.
Получение и использование истинного водного раствора гидроксида кальция с концентрацией более 0,16 мас.% нецелесообразно из-за низкой растворимости гидроксида кальция.
Скорость приливания 10-20%-ного раствора ортофосфорной кислоты менее 0,2 л/мин на литр водного раствора композиции гидроксида кальция и тетраэтилортосиликата нецелесообразно из-за крайне низкого выхода готового продукта.
Скорость приливания 10-20%-ного раствора ортофосфорной кислоты более 0,8 л/мин на литр водного раствора композиции гидроксида кальция и тетраэтилортосиликата приводит к возможности получения нестабильного нестехиометричного кремнийзамещенного гидроксиапатита Ca10-δ(PO4)6-x(SiO4)x(OH)2-x с нарушенным принципом электронейтральности, который далее при нагревании может разлагаться с образованием трехкальциевого фосфата - Са3(РO4)2, гидроксида кальция - Са(ОН)2 или оксида кальция - СаО.
Теоретическое обоснование предложенного изобретения заключается в следующем. Кремнийзамещенные гидроксиапатиты могут быть представлены формулой - Са10(РO4)6-x(SiO4)x(OH)2-x, где х - коэффициент или степень замещения кремния. При этом наличие до 5-6 мас.% кремния в составе костной ткани является принципиально важным для формирования полноценной естественной кости с требуемыми строением и функционалом. Для обеспечения необходимого содержания кремния и кальция в синтетическом кремнийзамещенном гидроксиапатите коэффициент замещения кремнием в синтезируемом продукте должен быть в пределах х=1-2, а молярное отношение Са/(Р+Si) близким к 1,67.
Однако, если природный гидроксиапатит, отвечающий этим характеристикам, успешно формируется в костях человека и животных, то получение подобного монофазового и стабильного синтетического Si-ГАП, как следует из данных зарубежных и отечественных авторов, до сих пор остается нерешенной технической проблемой. Формально для синтеза кремнийзамещенного ГАП данного состава в щелочной раствор с рН более 9 (как источник групп ОН-) должны быть внесены или присутствовать в требуемом соотношении свободные ионы кальция, фосфат-ионы и силикат-ионы. Однако силикат-ионы, в отличие от ионов Са2+ и РО4 3-, имеют особое химическое поведение в водных растворах, а именно высокую склонность к полимеризации с образованием олигомеров и далее частиц коллоидного кремнезема. Причем скорость полимеризации при прочих равных параметрах возрастает по мере увеличения концентрации ионов SiO4 4- и снижения щелочности среды.
В предлагаемом способе, как и в прототипе, источником силикат-ионов является тетраэтилортосиликат (ТЭОС), который добавляют в раствор гидроксида кальция. В результате щелочного гидролиза ТЭОС в реакционную смесь поступают свободные силикат-ионы по реакции:
( C 2 H 5 O ) 4 S i + 4 O H − → S i O 4 4 − + 4 C 2 H 5 O H ( 1 )
Далее свободные ионы SiO4 4- сразу вступают в реакцию с избытком ионов Са2+ с образованием малорастворимого силиката кальция по реакции:
2 C a 2 + + S i O 4 4 − → C a 2 S i O 4 ↓ , ( 2 )
и тем самым уходят из реакционного объема.
Затем в реакционную смесь начинают с заданной скоростью дозировать раствор ортофосфорной кислоты. В этот период происходит формирование промежуточного продукта - аморфного фосфата кальция Са3(РO4)2, который затем трансформируется в термодинамически наиболее устойчивое и самое малорастворимое соединение в системе СаО-Р2O5-Н2O - гидроксиапатит (ГАП). Поскольку Ca2SiO4 является наиболее растворимым соединением в этом ряду, то по мере формирования новой фазы Са3(РO4)2 и далее ГАП, силикат кальция начинает растворяться с высвобождением в объем раствора ионов SiO4 4-. Эти силикат ионы встраиваются в кристаллическую решетку новообразующейся фазы с образованием кремнийзамещенного гидроксиапатита.
3 C a 2 + + 2 P O 4 3 − → C a 3 ( P O 4 ) 2 ( 3 )
C a 2 S i O 4 ↔ 2 C a 2 + + S i O 4 4 − ( 4 )
3 C a 3 ( P O 4 ) 2 + C a 2 + + x S i O 4 4 − + ( 2 − x ) O H − → C a 10 ( P O 4 ) 6 − x ( S i O 4 ) x ( O H ) 2 − x ↓ + x P O 4 3 − ( 5 )
При получении стехиометричного монофазового Si-ГАП со степенью замещения х=1-2 (до 6 мас.% Si) с учетом вышерассмотренного химизма принципиально важно вести процесс синтеза на всех этапах таким образом, чтобы максимально синхронизировать скорости протекания сопряженных процессов (3)-(5). Если часть ионов SiO4 4- после деструкции Ca2SiO4 не успевает встраиваться в структуру ГАП, то происходит быстрая их полимеризация с образованием олигомеров и наночастиц коллоидного кремнезема. Эта часть заполимеризованного кремния уже не может участвовать в изоморфном замещении фосфора, а осаждается на твердых частицах суспензии гидроксида кальция или на поверхности уже образовавшихся кристаллитов незамещенного ГАП. В результате наряду с фазой кремнийзамещенного гидроксиапатита возникают побочные продукты, например нестабильный нестехиометричный гидроксиапатит Ca10-δ(PO4)6-x(SiO4)x(OH)2-x, с нарушенным принципом электронейтральности, который далее может разлагаться с образованием трехкальциевого фосфата - Са3(РO4)2, гидроксида кальция - Са(ОН)2 или оксида кальция - СаО.
Предложенный способ характеризуют следующие фигуры:
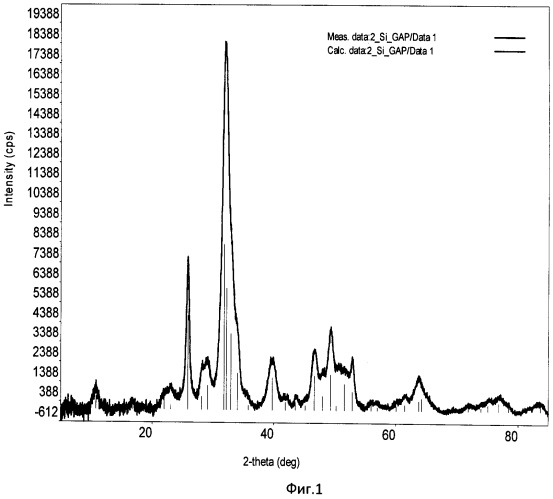
Фиг.1. Дифрактограмма РФА образца Si-ГАП при степени замещения кремнием х=2;
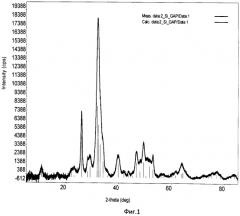
Фиг.2. Дифрактограмма РФА образца Si-ГАП при степени замещения кремнием х=1;
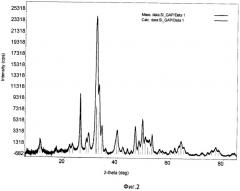
Фиг.3. ИК-спектр образца Si-ГАП при х=2;
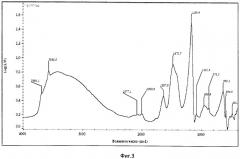
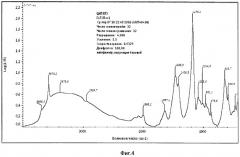
Фиг.4. ИК-спектр образца Si-ГАП при х=1.
Рентгенографические исследования проводили на дифрактометре Rigaku Ultima IV (Япония) с детектором D/teX Ultra. Съемку проводили в режиме на отражение (геометрия Брегга-Брентано) с использованием Cu Kа-излучения (длина волны Х=1.54178 Ǻ). Параметры работы генератора: ускоряющее напряжение 40 кВ, ток трубки 250 мА. Съемку проводили в кварцевых кюветах. Для закрепления порошковых образцов не использовали растворители. Параметры съемки интервал углов 2θ=5-85°, шаг по 20θ 0.02°, скорость регистрации спектров 37 мин. Качественный анализ полученных рентгенограмм и профильный анализ спектров, определение значений параметров решетки проводили с помощью программы PDXL Qualitative Analysis при использовании баз данных ICDD (PDF 2008).
Качественный анализ Si-ГАП на наличие карбонат-ионов в тех или иных позициях кристаллической структуры был проведен при помощи ИК-спектроскопии на ИК-Фурье спектрометре Nicolet 6700 (Thermo Electron Corporation, США) с детектором МСТ-А∗ (50 мкм).
ИК-спектры поглощения образцов регистрировали в диапазоне 400-4000 см-1 со следующими параметрами: число сканов пробы 32; число сканов 32; разрешение 4,000; усиление 8,0; скорость зеркала 0,6329; диафрагма 100,00. Анализ полученных ИК-спектров, определение значений волновых чисел проводили с помощью программного комплекса OMNIC (версия 7.3) при использовании автофильтра, базовой коррекции.
Описание способа поясняется примерами.
Пример 1
Синтез кремнийзамещенного гидроксиапатита с молярным отношением Са/(Р+Si) - 1,67 и степенью замещения на кремний х=2 (около 5,8 мас.% Si или 19 мас.% силикат-иона) в случае, когда концентрация водного раствора гидроксида кальция - 0,08 мас.%, а концентрация водного раствора ортофосфорной кислоты - 20 мас.%.
Навеску гидроксида кальция массой 0,8 г при комнатной температуре добавляли к 1000 мл дистиллированной воды, перемешивали с помощью магнитной мешалки в течение 10-15 минут и оставляли на 6 часов до полного растворения гидроксида кальция. После чего к 1000 мл 0,08%-ного водного раствора гидроксида кальция при непрерывном перемешивании добавляли 0,44 мл ТЭОС (0,42 г, ω=99%) и раствор интенсивно перемешивали с помощью электрической мешалки еще в течение 5-10 минут.
1,72 мл ортофосфорной кислоты (1,96 г 20% конц. Н3РO4) помещали в делительную воронку и добавляли по каплям в водный раствор, содержащий композицию гидроксид кальция/ТЭОС, со скоростью 0,6 мл/мин. После добавления всего объема раствора ортофосфорной кислоты проверяли рН смеси реагентов и рН оставался более 10, в связи с высоким молярным соотношением Са/Р используемых реагентов. Реакционную смесь перемешивали в течение 30 минут, а затем оставляли для старения около 24 часов. Вся реакция проходила при комнатной температуре.
Образовавшийся коллоидный раствор отфильтровывали с помощью воронки Бюхнера, с использованием фильтровальной бумаги и вакуумного насоса. Затем осадок с фильтра количественно переносили в фарфоровую чашку и сушили при 90°С в сушильном шкафу до постоянной массы. После этого Si-ГАП измельчали в мелкий порошок с использованием ступки и пестика и помещали в муфельную печь, где его термообрабатывали при 300°С в течение 2 часов, скорость нагрева 10°С/мин. Дифрактограмма РФА образца Si-ГАП, полученного при степени замещения кремнием х=2, представлена на фиг.1, ИК-спектр образца Si-ГАП при х=2 представлен на фиг.3.
Пример 2
Синтез кремнийзамещенного гидроксиапатита с молярным отношением Са/(Р+Si) - 1,67 и степенью замещения на кремний х=2 (около 5,8 мас.% Si или 19 мас.% силикат-ионов) в случае, когда концентрация водного раствора гидроксида кальция - 0,16 мас.%, а концентрация водного раствора ортофосфорной кислоты - 10 мас.%.
Навеску гидроксида кальция массой 1,6 г при комнатной температуре добавляли к 1000 мл дистиллированной воды, перемешивали с помощью магнитной мешалки в течение 10-15 минут и оставляли на 6 часов до полного растворения гидроксида кальция. После чего к 1000 мл 0,16%-ного водного раствора гидроксида кальция при непрерывном перемешивании добавляли 0,88 мл ТЭОС (0,84 г, ω=99%) и водный раствор интенсивно перемешивали с помощью электрической мешалки еще в течение 5-10 минут.
7,4 мл ортофосфорной кислоты (7,84 г 10% конц. Н3РО4) помещали в делительную воронку и добавляли по каплям в водный раствор, содержащий композицию гидроксид кальция/ТЭОС, со скоростью 0,6 мл/мин. После добавления всего объема раствора ортофосфорной кислоты проверяли рН смеси реагентов и рН оставался более 10, в связи с высоким молярным соотношением Са/Р используемых реагентов. Реакционную смесь перемешивали в течение 30 минут, а затем оставляли для старения около 24 часов. Вся реакция проходила при комнатной температуре.
Образовавшийся коллоидный раствор отфильтровывали с помощью воронки Бюхнера, с использованием фильтровальной бумаги и вакуумного насоса. Затем осадок с фильтра количественно переносили в фарфоровую чашку и сушили при 90°С в сушильном шкафу до постоянной массы. После этого Si-ГАП измельчали в мелкий порошок с использованием ступки и пестика и помещали в муфельную печь, где его термообрабатывали при 350°С в течение 2 часов, скорость нагрева 10°С/ мин.
Пример 3
Синтез кремнийзамещенного гидроксиапатита с молярным отношением Са/(Р+Si) - 1,67 и степенью замещения на кремний х=2 (около 5,8 мас.% Si или 19 мас.% силикат-ионов) в случае, когда концентрация водного раствора гидроксида кальция - 0,16 мас.%, а скорость подачи 10%-ного водного раствора ортофосфорной кислоты в реакционную смесь - 0,8 мл/мин.
Навеску гидроксида кальция массой 1,6 г при комнатной температуре добавляли к 1000 мл дистиллированной воды, перемешивали с помощью магнитной мешалки в течение 10-15 минут и оставляли на 6 часов до полного растворения гидроксида кальция. После чего к 1000 мл 0,16%-ного водного раствора гидроксида кальция при непрерывном перемешивании добавляли 0,88 мл ТЭОС (0,84 г, ω=99%) и водный раствор интенсивно перемешивали с помощью электрической мешалки еще в течение 5-10 минут.
7,4 мл ортофосфорной кислоты (7,84 г 10% конц. Н3РО4) помещали в делительную воронку и добавляли по каплям в водный раствор, содержащий композицию гидроксид кальция/ТЭОС, со скоростью 0,8 мл/мин. После добавления всего объема раствора ортофосфорной кислоты проверяли рН смеси реагентов и рН оставался более 10, в связи с высоким молярным соотношением Са/Р используемых реагентов. Реакционную смесь перемешивали в течение 30 минут, а затем оставляли для старения около 24 часов. Вся реакция проходила при комнатной температуре.
Образовавшийся коллоидный раствор отфильтровывали с помощью воронки Бюхнера, с использованием фильтровальной бумаги и вакуумного насоса. Затем осадок с фильтра количественно переносили в фарфоровую чашку и сушили при 90°С в сушильном шкафу до постоянной массы. После этого Si-ГАП измельчали в мелкий порошок с использованием ступки и пестика и помещали в муфельную печь, где его термообрабатывали при 300°С в течение 2 часов, скорость нагрева 10°С/мин.
Пример 4
Синтез кремнийзамещенного гидроксиапатита с молярным отношением Са/(Р+Si) - 1,67 и степенью замещения на кремний х=2 (около 5,8 мас.% Si или 19 мас.% силикат-ионов) в случае, когда концентрация водного раствора гидроксида кальция - 0,16 мас.%, а скорость подачи 10%-ного водного раствора ортофосфорной кислоты в реакционную смесь - 0,2 мл/мин.
Навеску гидроксида кальция массой 1,6 г при комнатной температуре добавляли к 1000 мл дистиллированной воды, перемешивали с помощью магнитной мешалки в течение 10-15 минут и оставляли на 6 часов до полного растворения гидроксида кальция. После чего к 1000 мл 0,16%-ного водного раствора гидроксида кальция при непрерывном перемешивании добавили 0,88 мл ТЭОС (0,84 г, ω=99%) и водный раствор интенсивно перемешивали с помощью электрической мешалки еще в течение 5-10 минут.
Затем 7,4 мл ортофосфорной кислоты (7,84 г 10% конц. Н3РО4) помещали в делительную воронку и добавляли по каплям в водный раствор, содержащий композицию гидроксид кальция/ТЭОС, со скоростью 0,2 мл/мин. После добавления всего объема раствора ортофосфорной кислоты проверяли рН смеси реагентов и рН оставался более 10, в связи с высоким молярным соотношением Са/Р используемых реагентов. Реакционную смесь перемешивали в течение 30 минут, а затем оставляли для старения около 24 часов. Вся реакция проходила при комнатной температуре.
Образовавшийся коллоидный раствор отфильтровывали с помощью воронки Бюхнера, с использованием фильтровальной бумаги и вакуумного насоса. Затем осадок с фильтра количественно переносили в фарфоровую чашку и сушили при 90°С в сушильном шкафу до постоянной массы. После этого Si-ГАП измельчали в мелкий порошок с использованием ступки и пестика и помещали в муфельную печь, где его термообрабатывали при 370°С в течение 2 часов, скорость нагрева 10°С/мин.
Пример 5
Синтез кремнийзамещенного гидроксиапатита с молярным отношением Са/(Р+Si) - 1,67 и степенью замещения на кремний х=2 (около 5,8 мас.% Si или 19 мас.% силикат-ионов) в случае, когда концентрация водного раствора гидроксида кальция - 0,16 мас.%, а скорость подачи 10%-ного водного раствора ортофосфорной кислоты - 1,0 мл/мин.
Навеску гидроксида кальция массой 1,6 г при комнатной температуре добавляли к 1000 мл дистиллированной воды, перемешивали с помощью магнитной мешалки в течение 10-15 минут и оставляли на 6 часов до полного растворения гидроксида кальция. После чего к 1000 мл 0,16%-ного водного раствора гидроксида кальция при непрерывном перемешивании добавили 0,88 мл ТЭОС (0,84 г, ω=99%) и водный раствор интенсивно перемешивали с помощью электрической мешалки еще в течение 5-10 минут.
Затем 7,4 мл ортофосфорной кислоты (7,84 г 10% конц. Н3РО4) помещали в делительную воронку и добавляли по каплям в водный раствор, содержащий композицию гидроксид кальция/ТЭОС, со скоростью 1,0 мл/мин. После добавления всего объема раствора ортофосфорной кислоты проверяли рН смеси реагентов и рН оставался более 10, в связи с высоким молярным соотношением Са/Р используемых реагентов. Реакционную смесь перемешивали в течение 30 минут, а затем оставляли для старения около 24 часов. Вся реакция проходила при комнатной температуре.
Образовавшийся коллоидный раствор отфильтровывали с помощью воронки Бюхнера, с использованием фильтровальной бумаги и вакуумного насоса. Затем осадок с фильтра количественно переносили в фарфоровую чашку и сушили при 90°С в сушильном шкафу до постоянной массы. После этого Si-ГАП измельчали в мелкий порошок с использованием ступки и пестика и помещали в муфельную печь, где его термообрабатывали при 300°С.
Из таблицы 1 видно, что повышение скорости добавления ортофосфорной кислоты приводит к появлению второй фазы.
Пример 6
Синтез кремнийзамещенного гидроксиапатита с молярным отношением Са/(Р+Si) - 1,67 и степенью замещения на кремний х=1 (около 2,85 мас.% Si или 9,35 мас.% силикат-ионов) при концентрации водного раствора гидроксида кальция - 0,16 мас.% и скорости подачи 10%-ного водного раствора ортофосфорной кислоты в реакционную смесь - 0,6 мл/мин.
Навеску гидроксида кальция массой 1,6 г при комнатной температуре добавляли к 1000 мл дистиллированной воды, перемешивали с помощью магнитной мешалки в течение 10-15 минут и оставляли на 6 часов до полного растворения гидроксида кальция. После чего к 1000 мл 0,16%-ного водного раствора гидроксида кальция при непрерывном перемешивании добавили 0,44 мл ТЭОС (0,42 г, ω=99%) и водный раствор интенсивно перемешивали с помощью электрической мешалки еще в течение 5-10 минут.
Затем 9,3 мл ортофосфорной кислоты (9,80 г 10% конц. Н3РО4) помещали в делительную воронку и добавляли по каплям в водный раствор, содержащий композицию гидроксид кальция/ТЭОС, со скоростью 0,6 мл/мин. После добавления всего объема раствора ортофосфорной кислоты проверяли рН смеси реагентов и рН оставался более 10, в связи с высоким молярным соотношением Са/Р используемых реагентов. Реакционную смесь перемешивали в течение 30 минут, а затем оставляли для старения около 24 часов. Вся реакция проходила при комнатной температуре.
Образовавшийся коллоидный раствор отфильтровывали с помощью воронки Бюхнера, с использованием фильтровальной бумаги и вакуумного насоса. Затем осадок с фильтра количественно переносили в фарфоровую чашку и сушили при 90°С в сушильном шкафу до постоянной массы. После этого Si-ГАП измельчали в мелкий порошок с использованием ступки и пестика и помещали в муфельную печь, где его термообрабатывали при 300°С в течение 2 часов, скорость нагрева 10°С/мин.
Дифрактограмма РФА образца Si-ГАП, полученного при степени замещения кремнием х=1 представлена на фиг.2, а ИК-спектр образца Si-ГАП при х=1 на фиг.4.
Пример 7
Синтез кремнийзамещенного гидроксиапатита с молярным отношением Са/(Р+Si) - 1,67 и степенью замещения на кремний х=2 (около 5,8 мас.% Si или 19 мас.% силикат-иона) в случае, когда концентрация водного раствора гидроксида кальция - 0,08 мас.%, а концентрация водного раствора ортофосфорной кислоты - 20 мас.%.
Навеску гидроксида кальция массой 0,8 г при комнатной температуре добавляли к 1000 мл дистиллированной воды, перемешивали с помощью магнитной мешалки в течение 10-15 минут и оставляли на 6 часов до полного растворения гидроксида кальция. После чего к 1000 мл 0,08%-ного водного раствора гидроксида кальция при непрерывном перемешивании добавляли 0,44 мл ТЭОС (0,42 г, ω=99%) и раствор интенсивно перемешивали с помощью электрической мешалки еще в течение 5-10 минут.
1,72 мл ортофосфорной кислоты (1,96 г 20% конц. Н3РО4) помещали в делительную воронку и добавляли по каплям в водный раствор, содержащий композицию гидроксид кальция/ТЭОС, со скоростью 0,6 мл/мин. После добавления всего объема раствора ортофосфорной кислоты проверяли рН смеси реагентов и рН оставался более 10, в связи с высоким молярным соотношением Са/Р используемых реагентов. Реакционную смесь перемешивали в течение 30 минут, а затем оставляли для старения около 24 часов. Вся реакция проходила при комнатной температуре.
Образовавшийся коллоидный раствор отфильтровывали с помощью воронки Бюхнера, с использованием фильтровальной бумаги и вакуумного насоса. Затем осадок с фильтра количественно переносили в фарфоровую чашку и сушили при 90°С в сушильном шкафу до постоянной массы. После этого Si-ГАП измельчали в мелкий порошок с использованием ступки и пестика и помещали в муфельную печь, где его термообрабатывали при 250°С в течение 2 часов, скорость нагрева 10°С/мин.
Из таблицы 2 видно, что выход кремния после выдерживания в SBF-растворе, несмотря на высокое содержание кремния в образце, равное 5,8 мас.%, примерно соответствует выходу кремния для образца по примеру 6, где содержание кремния в два раза ниже. А по сравнению с оптимальными составами по примерам 1-4, с таким же содержанием кремния в образце, выход кремния в SBF-раствор в полтора раза ниже, что является подтверждением снижения биоактивности в результате термоотбработки при температуре ниже 300°С.
Пример 8
Синтез немодифицированного гидроксиапатита по патенту РФ №2342938.
В связи с тем, что ряд характеристик немодифицированного наногидроксиапатита не был указан в описании данного изобретения их определяли опытным путем. Нанокристаллический гидроксилапатит был получен с помощью «мокрого синтеза» добавлением 20%-ного водного раствора ортофосфорной кислоты (Н3РО4) в насыщенный раствор гидроксида кальция Са(ОН)2 со скоростью 1 мл/мин. Уравнение реакции можно представить следующим образом:
10Са(ОН)2+6Н3РО4=Са10(РO4)6(ОН)2↓+18Н2O
Конечное значение рН доводилось до величины 10,2. Реакционная смесь отстаивалась в течение 24 часа для завершения протекающих процессов кристаллизации. Синтезированная 2%-ная водная суспензия высушивалась в сушильном шкафу при 95°С, затем полученные порошки термообрабатывали в муфельной печи при 350°С в течение 2 часов для дегидратации кристаллов ГАП и его кристаллизации.
Пример 9 (по прототипу)
Синтез кремнийзамещенного гидроксиапатита по патенту US 20100173009 A1.