Способ получения производных бис(5-алкил-2-фурил)(2-азидофенил)метанов
Иллюстрации
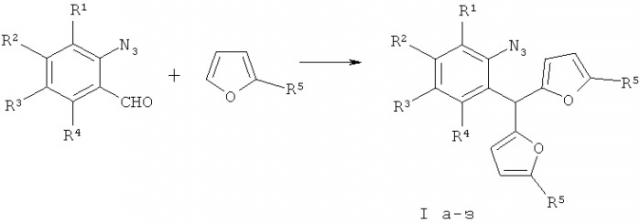
Показать всеИзобретение относится к области органической химии, конкретно к способу получения производных бис(5-алкил-2-фурил)(2-азидофенил)-метанов общей формулы I, которые могут найти применение в качестве исходных соединений в синтезе индолов, перспективных биологически активных веществ. Способ заключается в том, что смесь доступных 2-азидобензальдегидов и 2-алкилфуранов обрабатывают кислотами в различных растворителях:
1 R2 R3 R4 R5 Ia Н Н Н Н Me Iб Н Н Н Н Et Iв Н Н Н Н t-Bu Iг Н Н Br Н Me Iд Н OMe OMe Н Me Iе OMe Н NO2 Н Me Iж Br Н ОМе ОМе Me Iз NO2 Н Me Н Me
Способ позволяет получать соединения формулы I с высоким выходом. 2 табл., 5 пр.
Реферат
Изобретение относится к области органической химии - синтезу производных бис(5-алкил-2-фурил)(2-азидофенил)метанов. Производные фурана, содержащие азидогруппу используют в синтезе различных гетероциклов, например, фуроиндолов [Tanaka A., Yakushijin K., Yoshma S., . Heterocycl. Chem., 1977, Vol.14, 975-979], фуроизохинолинов [Ito K., Yakushijin K., Yoshina S., Tanaka A., Yamamoto K., J. Heterocycl. Chem., 1978, Vol.15, 301-305], фуробензазепинов [Yakushijin K., Yoshina S., Heterocycles, 1977 Vol.6, 721-725], которые являются привлекательными объектами для биологического скрининга.
Изобретение относится к разработке способа получения производных бис(5-алкил-2-фурил)(2-азидофенил)метанов общей формулы I,
| Индекс | R1 | R2 | R3 | R4 | R5 |
| Ia | Н | Н | Н | Н | Me |
| Iб | Н | Н | Н | Н | Et |
| Iв | Н | Н | Н | Н | t-Bu |
| Iг | Н | Н | Br | Н | Me |
| Iд | Н | OMe | OMe | Н | Me |
| Iе | OMe | Н | NO2 | Н | Me |
| Iж | Br | Н | OMe | OMe | Me |
| Iз | NO2 | Н | Me | Н | Me |
которые представляют интерес в синтезе индолов [Yakushijin K., Tsuruta Т., Furukawa H., Chem. Pharm. Bull., 1982, Vol.30, 140-151].
Одним из способов получения ароматических азидов является реакция диазотирования анилинов и последующая обработка солей диазония азидом натрия. Реакцию диазотирования проводят обработкой аминов азотистой кислотой, которую генерируют путем взаимодействия нитрита натрия с минеральной кислотой, как правило, соляной. Таким методом были получены ближайшие ароматические аналоги бис(5-алкил-2-фурил)(2-аминофенил)метанов 2-азидотрифенилметаны [Carde R.N., Jones G., McKinley W.H, Price C, J. Chem. Soc., Perkin Trans. 1, 1978, 1211-1218; Alajarin M., Bonillo В., Ortin M.-M., Sanchez-Andrada P., Vidal A., Orenes R.-A., Org. Biomol. Chem., 2010, 4690-4700]. Попытка получения бис(5-алкил-2-фурил)(2-азидофенил)метанов данным способом оказалась безуспешной, поскольку в кислых условиях реакции диазотирования бис(5-алкил-2-фурил)(2-аминофенил)метаны подвергаются осмолению [Jones G., McKinley W.H., J. Chem. Soc., Perkin Trans. 1, 1979, 599-602]. Позднее было показано, что проведение реакции диазотирования в более мягких условиях (ацетонитрил, изоамилнитрит и триметилсилил хлорид) также не позволяет зафиксировать диазосоединения. В этих условиях генерируемая диазогруппа вступает во взаимодействие с одним из фурановых циклов, приводящее к образованию циннолинов [Abaev V.Т., Gutnov A.V., Butin A.V., Zavodnik V.Е., Tetrahedron, 2000, Vol 56, 8933-8937]. В литературе имеется единственное сообщение о синтезе 2-азидобензилфурана. В этом синтезе также использовалась последовательность реакции диазотирования и обработка образующегося диазосоединения азидом натрия. Это превращение удалось осуществить, поскольку в фурановом ядре содержался электроноакцепторный заместитель [Yakushijin K., Tsuruta Т., Furukawa H., Chem. Pharm. Bull., 1982, Vol.30, 140-151].
Задача изобретения - разработка способа получения производных бис(5-алкил-2-фурил)(2-азидофенил)метанов I, представляющих интерес в качестве исходных соединений в синтезе индолов, перспективных для поиска биологически активных веществ.
Техническим результатом является создание нового эффективного способа получения производных бис(5-алкил-2-фурил)(2-азидофенил)метанов, позволяющего получать конечные продукты с высоким выходом и вводить любые заместители в ароматическое ядро.
В основе заявляемого метода лежит описанная ранее конденсация о-замещенных бензальдегидов и 2-алкилфуранов, катализируемая кислотами [Абаев В.Т., Гутнов А.В., Бутан А.В., ХГС, 1998, 529-532; Abaev V.Т., Gutnov A.V., Butin A.V., Zavodnik V.Е., Tetrahedron, 2000, Vol.56, 8933-8937; Циунчик Ф.А., Абаев В.Т., Бутан А.В. ХГС, 2005, 1796-1799; Abaev V.Т., Dmitriev A.S., Gutnov A.V., Podelyakin S.A., Butin A.V. J. Heterocycl. Chem., 2006, Vol.43, 1195-1204].
Технический результат достигается в результате обработки кислотами смеси доступных 2-азидобензальдегидов [Stokes В.J., Liu В., Driver Т.G., J. Am. Chem. Soc., 2011, 4702-4705] и 2-алкилфуранов в различных растворителях.
| Индекс | R1 | R2 | R3 | R4 | R5 |
| Ia | Н | Н | Н | Н | Me |
| Iб | Н | Н | Н | Н | Et |
| Iв | Н | Н | Н | Н | t-Bu |
| Iг | Н | Н | Br | Н | Me |
| Iд | Н | OMe | OMe | Н | Me |
| Iе | OMe | Н | NO2 | Н | Me |
| Iж | Br | Н | ОМе | ОМе | Me |
| Iз | NO2 | Н | Me | Н | Me |
Температуры плавления, данные элементного анализа и спектральные характеристики бис(5-алкил-2-фурил)(2-азидофенил)метанов 1б-з приведены в таблице 1.
Полученный технический результат открывает путь к ранее недоступным бис(5-алкил-2-фурил)(2-азидофенил)метанам I и позволяет вводить в ароматическое ядро указанных соединений как донорные, так и акцепторные заместители.
Таким образом, совокупность существенных признаков, изложенных в формуле изобретения, позволяет достичь желаемого технического результата.
Примеры осуществления заявляемого способа получения бис(5-метил-2-фурил)(2-азидофенил)метана 1а.
Пример 1. Смесь 2.94 г (20 ммоль) 2-азидобензальдегида, 4.51 мл (50 ммоль) сильвана, 1.5 мл CF3COOH и 30 мл (ЭДСЬ перемешивают при комнатной температуре в течение 24 часов (контроль ТСХ). Затем реакционную смесь выливают в 200 мл холодной воды, нейтрализуют NaHCO3, экстрагируют CH2Cl2 (3×20 мл), объединенные органические фракции сушат Na2SO4, упаривают при пониженном давлении. Остаток разделяют методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - дихлорметан: гексан (1:9). Перекристаллизовывают из изопропанола. Выход 78% (4.57 г).
ТПЛ.=61-62°С.
Найдено для C17H15N3O2, %: С, 69.67; Н 5.24; N 14.24.
Вычислено: С, 69.61; Н 5.15; N 14.33.
Спектр 1Н ЯМР (CDCl3), (δ, м. д. и КССВ, J, Гц): 2.26 (с, 6Н, Me), 5.70 (с, 1Н, СН), 5.84 (д,.7=3.2 Гц, 2Н, HFur), 5.89 (д, J=3.2 Гц, 2Н, HFur), 7.07-7.13 (м, 1Н, HAr), 7.15-7.21 (м, 2Н, HAr), 7.28-7.34 (м, 1Н, HAr).
Спектр 13С ЯМР (CDCl3), (δ, м. д.): 13.8 (2С), 39.0, 106.2 (2С), 108.6 (2С), 118.3, 124.9, 128.5, 130.0, 131.2, 137.8, 151.7 (2С), 152.2 (2С).
Пример 2.
Смесь 2.94 г (20 ммоль) 2-азидобензальдегида, 4.51 мл (50 ммоль) сильвана, 1.5 мл CF3COOH и 30 мл бензола перемешивают при комнатной температуре в течение 0.5 часа (контроль ТСХ). Затем реакционную смесь выливают в 200 мл холодной воды, нейтрализуют NaHCO3, экстрагируют бензолом (3×20 мл), объединенные органические фракции сушат Na2SO4, упаривают при пониженном давлении. Остаток разделяют методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - дихлорметан: гексан (1:9). Перекристаллизовывают из изопропанола. Выход 80% (4.69 г).
Пример 3.
Смесь 2.94 г (20 ммоль) 2-азидобензальдегида, 4.51 мл (50 ммоль) сильвана, 1.5 мл (CH3)3SiCl и 30 мл бензола перемешивают при комнатной температуре в течение 1 часа (контроль ТСХ). Затем реакционную смесь выливают в 200 мл холодной воды, нейтрализуют NaHCO3, экстрагируют бензолом (3×20 мл), объединенные органические фракции сушат Na2SO4, упаривают при пониженном давлении. Остаток разделяют методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - дихлорметан: гексан (1:9). Перекристаллизовывают из изопропанола. Выход 75% (4.40 г).
Пример 4.
Смесь 2.94 г (20 ммоль) 2-азидобензальдегида, 4.51 мл (50 ммоль) сильвана 1.5 мл силилового эфира полифосфорной кислоты (СПОК) [Циунчик Ф.А., Абаев В.Т., Бутин А.В. ХГС, 2005, 1796-1799] и 30 мл бензола перемешивают при комнатной температуре в течение 24 часов (контроль ТСХ). Затем реакционную смесь выливают в 200 мл холодной воды, нейтрализуют NaHCO3, экстрагируют бензолом (3×20 мл), объединенные органические фракции сушат Na2SO4, упаривают при пониженном давлении. Остаток разделяют методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - дихлорметан: гексан (1:9). Перекристаллизовывают из изопропанола. Выход 81% (4.75 г).
Пример 5.
Смесь 2.94 г (20 ммоль) 2-азидобензальдегида, 4.51 мл (50 ммоль) сильвана, 0.2 мл HClO4 и 20 мл 1,4-диоксана перемешивают при комнатной температуре в течение 5 часов (контроль ТСХ). Затем реакционную смесь выливают в 200 мл холодной воды, нейтрализуют NaHCO3, экстрагируют бензолом (3×20 мл), объединенные органические фракции сушат Na3SO4, упаривают при пониженном давлении. Остаток разделяют методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - дихлорметан: гексан (1:9). Перекристаллизовывают из изопропанола. Выход 82% (4.81 г).
В таблице 2 приведены данные о влиянии условий проведения реакции на выход бис(5-метил-2-фурил)(2-азидофенил)метана (примеры 1-5).
Как видно из таблицы 2, результат, а именно получение бис(5-метил-2-фурил)(2-азидофенил)метана Ia, может быть достигнут при использовании различных кислот и растворителей. При этом варьирование этих компонентов реакционной смеси существенным образом не сказывается на выходе конечного продукта.
| Таблица 2 | ||||
| Влияние реакционных условий на выход бис(5-метил-2-фурил)(2-азидофенил)метана Ia | ||||
| Пример | Растворитель | Кислота | Время реакции, ч | Выход, % |
| 1 | CH2Cl2 | CF3COOH | 24 | 78 |
| 2 | Бензол | CF3COOH | 1 | 80 |
| 3 | Бензол | (СН3)3SiCl | 1 | 75 |
| 4 | Бензол | СПФК | 24 | 81 |
| 5 | 1,4-диоксан | HClO4 | 5 | 82 |
Как в примере 5 получен ряд производных бис(5-алкил-2-фурил)(2-азидофенил)метанов Ia-з с выходами 71-92%.
Способ получения производных бис(5-алкил-2-фурил)(2-азидофенил)метанов общей формулы I,
| Индекс | R1 | R2 | R3 | R4 | R5 |
| Ia | Н | Н | Н | Н | Me |
| Iб | Н | Н | Н | Н | Et |
| Iв | Н | Н | Н | Н | t-Bu |
| Iг | Н | Н | Br | Н | Me |
| Iд | Н | OMe | OMe | Н | Me |
| Iе | OMe | Н | NO2 | Н | Me |
| Iж | Br | Н | ОМе | ОМе | Me |
| Iз | NO2 | Н | Me | Н | Me |