Фильтрация в переменном тангенциальном потоке
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии. Предложен способ концентрирования забуференного водного раствора иммуноглобулина в тангенциальном потоке, где значения трансмембранного давления и величину поперечного потока выбирают в зависимости от текущей концентрации иммуноглобулина в растворе, а также способ получения иммуноглобулина с использованием способа концентрирования по изобретению. Данное изобретение обеспечивает низкий уровень образования агрегатов при выделении иммуноглобулинов. 2 н. и 12 з.п. ф-лы, 15 ил., 2 табл., 5 пр.
Реферат
Настоящее изобретение относится к области концентрирования белков, а более конкретно - к применению фильтрации в тангенциальном потоке (ФТП) для концентрирования иммуноглобулина.
Предпосылки к созданию изобретения
Белки, а в особенности иммуноглобулины, играют важную роль в арсенале современной медицины. Экспрессионные системы для выработки рекомбинантных полипептидов хорошо известны в соответствующей области и описаны, например, в Marino, M.H., Biopharm. 2 (1989) 18-33; Goeddel, D.V., и др. Methods Enzymol. 185 (1990) 3-7; Wurm, F., и Bernard, A., Curr. Opin. Biotechnol. 10 (1999) 156-159. Полипептиды для фармацевтических применений преимущественно вырабатывают в клетках млекопитающих, таких как клетки яичников китайского хомячка (СНО), гибридомные клетки NS0, клетки мышиной миеломы Sp2/0, иммортализованные клетки почек африканской зеленой мартышки (COS), человеческих эмбриональных клетках почек (НЕК), клетках почек детеныша хомячка (ВНК), клетки линии PER.C6® и им подобные.
Для применений на людях всякое фармацевтическое вещество должно удовлетворять определенным критериям. Для обеспечения безопасности биофармацевтических средств для людей должны быть устранены, например, нуклеиновые кислоты, вирусы и белки клеток-хозяев, которые могут причинить тяжкий вред. Для удовлетворения нормативным требованиям, вслед за процессом изготовления должны следовать одна или несколько стадий очистки. В выборе подходящего способа очистки играют важную роль, среди прочего, чистота, производительность и выход.
Технология производства и выделения иммуноглобулинов весьма сложна вследствие их физических и химических свойств, таких как молекулярная масса и устройство доменов, включая вторичные модификации. Например, концентрированные растворы необходимы не только для лекарственных препаратов, но и для промежуточных веществ в технологии производства и выделения (ТПВ), дабы иметь дело с низкими объемами для обеспечения практичности манипуляций, применения и хранения. Более того, для обеспечения удобного и быстрого осуществления соответствующих методик желательны низкие времена концентрирования. В этой связи несовершенные методики ФТП, в особенности после конечных стадий очистки, могут привести к устойчивым повреждениям, затрагивающим даже лекарственный продукт. Корреляция между сдвиговым напряжением и агрегацией в процессах концентрирования в тангенциальном потоке для промежуточных растворов моноклональных антител (mAb) была исследована в Ahrer, К., и др. (J. Membr. Sci. 274 (2006) 108-115). Было прослежено влияние времени концентрирования и выбранных величин потока и давления на производительность процесса и особенности агрегации (см., например, Dosmar, M., и др., Bioprocess Int. 3 (2005) 40-50; Luo, R. и др., Bioprocess Int. 4 (2006) 44-46).
Mahler, H.-C., и др. (Eur. J. Pharmaceut. Biopharmaceut. 59 (2005) 407-417) сообщали о стимуляции и анализе агрегации в жидком препарате антитела иммуноглобулина IgG1, полученного с помощью различных способов перемешивания. В Патенте США US 6,252,055 сообщают о концентрированном препарате моноклонального антитела. Способ изготовления концентрированного препарата антитела описан в заявке на патент США US 2006/0182740. Комбинированный способ, включающий последовательность ультрафильтрации, диафильтрации и второй стадии ультрафильтрации, описан в заявке на патент США US 2006/0051347. В Европейском патенте ЕР 0907378 описан способ концентрирования препарата антитела с помощью ультрафильтрации в поперечном потоке при постоянной скорости рециркуляции 250 мл/мин. Способы фильтрации в тангенциальном потоке и соответствующей установки описаны в заявке на патент США US 2004/0167320. В международной заявке на изобретение WO 97/45140 описан концентрированный раствор антитела.
Краткое описание изобретения
Объектом настоящего изобретения является способ концентрирования растворов, содержащих рекомбинантно полученные иммуноглобулины.
Более подробно, в одном из вариантов осуществления настоящего изобретения его объектом является способ концентрирования раствора иммуноглобулина посредством фильтрации в тангенциальном потоке, в котором задаваемые трансмембранное давление и величина поперечного потока изменяются в пределах:
а) трансмембранное давление от 1,4 бар до 1,6 бар и поперечный поток от 75 мл/мин до 90 мл/мин в диапазоне концентраций до 30 мг иммуноглобулина на миллилитр концентрируемого раствора,
б) трансмембранное давление от 0,8 бар до 0,9 бар и поперечный поток от 140 мл/мин до 160 мл/мин в диапазоне концентраций от 15 мг/мл до 55 мг/мл и
в) трансмембранное давление от 0,8 бар до 0,9 бар и поперечный поток от 120 мл/мин до 140 мл/мин в диапазоне концентраций свыше 45 мг/мл.
В одном из вариантов осуществления настоящего изобретения диапазон концентраций на стадии в) составляет от 50 мг/мл до 275 мг/мл. В предпочтительном варианте осуществления настоящего изобретения диапазон концентраций на стадии в) составляет от 50 мг/мл до 180 мг/мл. В более предпочтительном варианте осуществления настоящего изобретения диапазон концентраций на стадии в) составляет от 50 мг/мл до 130 мг/мл. В другом варианте осуществления настоящего изобретения трансмембранное давление и величина поперечного потока составляют 1,5 бар и 80 мл/мин на стадии а), 0,85 бар и 150 мл/мин на стадии б) и/или 0,85 бар и 130 мл/мин на стадии в). В другом варианте осуществления настоящего изобретения раствор иммуноглобулина является забуференным водным раствором иммуноглобулина.
Еще в одном варианте осуществления настоящего изобретения его объектом является способ получения гетерологичного иммуноглобулина, включающий следующие стадии в нижеприведенной последовательности:
а) получение рекомбинантной клетки млекопитающего, содержащей одну или несколько нуклеиновых кислот, кодирующих гетерологичный иммуноглобулин,
б) культивирование клеток со стадии а) в условиях, подходящих для экспрессии гетерологичного иммуноглобулина,
в) выделение гетерологичного иммуноглобулина из рекомбинантной клетки млекопитающего или из культуральной среды,
г) концентрирование получаемого забуференного водного раствора, содержащего гетерологичный иммуноглобулин, с помощью фильтрации в тангенциальном потоке с переменными трансмембранным давлением и величиной поперечного потока.
В одном из вариантов осуществления настоящего изобретения стадия г) данного способа включает концентрирование получаемого забуференного водного раствора с помощью фильтрации в тангенциальном потоке с переменными трансмембранным давлением и величиной поперечного потока при
1) трансмембранном давлении от 1,4 бар до 1,6 бар и величине поперечного потока от 75 мл/мин до 90 мл/мин в диапазоне концентраций до 30 мг иммуноглобулина на миллилитр концентрируемого раствора,
2) трансмембранном давлении от 0,8 бар до 0,9 бар и величине поперечного потока от 140 мл/мин до 160 мл/мин в диапазоне концентраций от 15 мг/мл до 55 мг/мл и
3) трансмембранном давлении от 0,8 бар до 0,9 бар и величине поперечного потока от 120 мл/мин до 140 мл/мин в диапазоне концентраций свыше 45 мг/мл.
В другом варианте осуществления настоящего изобретения способ включает следующую стадию до стадии г) или после стадии г):
д) очистку забуференного водного раствора, содержащего гетерологичный иммуноглобулин.
В другом варианте осуществления настоящего изобретения гетерологичный иммуноглобулин является целым иммуноглобулином, или фрагментом иммуноглобулина, или конъюгатом иммуноглобулина. В одном из вариантов осуществления настоящего изобретения клетка млекопитающего является клеткой СНО, клеткой ВНК, клеткой NS0, клеткой Sp2/0, клеткой COS, клеткой НЕК или клеткой линии PER.C6®.
Подробное описание изобретения
Объектом настоящего изобретения является способ концентрирования раствором иммуноглобулинов до концентрации более 100 мг/мл. Было неожиданно обнаружено, что с помощью способа согласно настоящему изобретению это может быть достигнуто при низком уровне образования агрегатов и за короткое время.
Термины «фильтрация в тангенциальном потоке» или «ФТП», употребляемые при описании настоящего изобретения взаимозаменяемо, означают процесс фильтрации, в котором содержащий полипептид раствор, подвергаемый концентрированию, протекает вдоль, т.е. касательно (тангенциально), поверхности фильтрующей мембраны. Фильтрующая мембрана характеризуется размером пор с некоторой верхней пороговой величиной. В одном из вариантов осуществления настоящего изобретения пороговая величина находится в пределах от 20 кДа до 50 кДа, предпочтительно 30 кДа. Этот способ фильтрации является вариантом ультрафильтрации. Термин «поперечный поток» означает поток подвергаемого концентрированию раствора, касательный к мембране (поток концентрата). Термины «поток» или «поток пермеата», которые могут употребляться при описании настоящего изобретения взаимозаменяемо, означают поток жидкости через мембрану, т.е. через поры мембраны. Таким образом, он означает объемную скорость потока пермеата через мембрану. Поток обычно измеряется в терминах объема, проходящего через единицу поверхности мембраны за единицу времени, в литрах на квадратный метр в час (ЛМЧ). В одном из вариантов осуществления настоящего изобретения поперечный поток отличается тем, что составляет миллилитры в минуту для площади мембраны 0,02 м. В другом варианте осуществления настоящего изобретения величина поперечного потока принимает отдельные значения 240 л/м2/ч, 450 л/м2/ч и 390 л/м2/ч. Раствор пермеата содержит растворитель подвергаемого концентрированию раствора, равно как и молекулы с молекулярной массой ниже пороговой величины для используемой мембраны, но не гетерологичный иммуноглобулин. Термины «трансмембранное давление» или «ТМД», которые могут употребляться в при описании настоящего изобретения взаимозаменяемо, означают давление, прилагаемое для продавливания растворителя и компонентов, меньших, чем пороговая величина фильтрующей мембраны, сквозь поры фильтрующей мембраны. Трансмембранное давление является средним из давлений на входе, на выходе и в растворе пермеата и может быть рассчитано по формуле
Термин «иммуноглобулин» относится к белку, содержащему один или несколько полипептидов, кодируемых преимущественно иммуноглобулиновыми генами. Известные гены иммуноглобулинов включают различные гены константной области, равно как и множество генов вариабельной области иммуноглобулина. Иммуноглобулины могут существовать в разнообразных форматах, включая, например, Fv, Fab и F(ab)2, равно как и одиночные цепи (scFv) или димеры антитела (например, Huston, J.S., и др., Proc. Natl. Acad. Sci. USA 85 (1988) 5879-5883; Bird, R.E., и др., Science 242 (1988) 423-426; для общих сведений. Hood и др.. Immunology (Иммунология), Benjamin N.Y., 2-е издание (1984); а также Hunkapiller, Т. и Hood, L., Nature 323 (1986) 15-16).
Термин «целый иммуноглобулин» означает иммуноглобулин, содержащий два так называемых полипептида легкой иммуноглобулиновой цепи (легкая цепь) и два так называемых полипептида тяжелой иммуноглобулиновой цепи (тяжелая цепь). Каждый из полипептидов тяжелой и легкой иммуноглобулиновой цепи целого иммуноглобулина содержит вариабельный домен (вариабельную область) (как правило, N-концевую часть полипептидной цепи), включающую области связывания, способные взаимодействовать с антигеном. Каждый из полипептидов тяжелой и легкой иммуноглобулиновой цепи целого иммуноглобулина также содержит константную область (как правило, С-концевую часть полипептидной цепи). Константная область тяжелой цепи опосредует связывание антитела с 1) клетками, несущими рецептор Fc-гамма (FcγR), такими как фагоцитарные клетки, или 2) с клетками, несущими неонатальный рецептор Fc (FcRn), также известный как рецептор Брамбелла. Она также опосредует связывание с некоторыми факторами, включая факторы классической системы комплемента, такими как компонент комплемента (C1q). Переменная область легкой или тяжелой цепи иммуноглобулина включает, в свою очередь, различные участки, т.е. четыре каркасных участка (FR) и три сверхизменчивых участка (CDR).
Термин «фрагмент иммуноглобулина» означает полипептид, содержащий хотя бы один домен переменной области, домен СН1, шарнирную область, домен СН2, домен СН3, домен СН4 тяжелой цепи, переменный домен или домен CL легкой цепи. Сюда также включены их производные и варианты. Например, может присутствовать переменный домен, из которого удалены одна или несколько аминокислот или аминокислотных областей.
Термин «иммуноглобулиновый конъюгат» означает полипептид, содержащий хотя бы один домен тяжелой или легкой цепи иммуноглобулина, конъюгированный через пептидную связь с другим полипептидом. Это другой полипептид является неиммуноглобулиновым пептидом, таким как гормон, или рецептор роста, или антифьюзогенный пептид, или фактор комплемента, или им подобные.
Общие методы хроматографии и их применение известны специалисту в соответствующей области. См., например, Chromatography (Хроматография), 5-е издание, часть A: Fundamentals and Techniques (Основы и методы), под ред. Heftmann, E., Elsevier Science Publishing Company, New York, (1992); Advanced Chromatographic and Electromigration Methods in Biosciences (Продвинутые хроматографические и электромиграционные методы в биологических науках), под ред. Deyl, Z., Elsevier Science BV, Amsterdam, The Netherlands, (1998); Chromatography Today (Хроматография сегодня), Poole, С.F., и Poole, S. K.., Elsevier Science Publishing Company, New York, (1991); Scopes, Protein Purification: Principles and Practice (Очистка белков: принципы и практика) (1982); под ред. Sambrook, J., и др., Molecular Cloning: A Laboratory Manual (Молекулярное клонирование: лабораторное руководство), 2-е издание, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989; или Current Protocols in Molecular Biology (Современные методики в молекулярной биологии), под ред. Ausubel, F. М., и др., John Wiley & Sons, Inc., New York.
Для очистки полученных рекомбинантным образом гетерологичных иммуноглобулинов часто используют сочетание различны стадий колоночной хроматографии. Как правило, за аффинной хроматографией на А-белке следует одна или две дополнительные стадии разделения. Конечная стадия очистки является так называемой «стадией наведения блеска» для удаления следовых примесей и загрязнителей, таких как агрегированные иммуноглобулины, остаточные белки клетки-хозяина (БКХ), ДНК (нуклеиновые кислоты клетки хозяина), вирусы или эндотоксины. Для этой «стадии наведения блеска» часто используют анионит в проточном режиме.
Хорошо разработаны и широко применяются различные способы выделения и очистки белков, такие как аффинная хроматография с микробными белками (например, аффинная хроматография на А-белке или G-белке), ионообменная хроматография (например, катионообменная (карбоксиметильные смолы), анионообменная (аминоэтильные смолы) и в смешанном режиме обмена), тиофильная адсорбционная хроматография (например, с бета-меркаптоэтанолом и другими SH-лигандами), гидрофобная хроматография или адсорбционная хроматография с ароматическими группами (например, с фенилсефарозой, аза-аренофильными смолами или м-аминофенилбороновой кислотой), металл-хелатная аффинная хроматография (например, с носителем со сродством к Ni(II)- и Cu(II)), эксклюзионная хроматография и электрофоретические методы (такие как гель-электрофорез, капиллярный электрофорез) (Vijayalakshmi, M.A., Appl. Biochem. Biotech. 75 (1998) 93-102).
Термин «гетерологичный иммуноглобулин» означает иммуноглобулин, не вырабатываемый в естественных условиях клеткой млекопитающего. Иммуноглобулин, получаемый согласно способу по настоящему изобретению, получают рекомбинантным образом. Подобные способы широко известны в соответствующей области и состоят в экспрессии белка в эукариотических клетках с последующим высвобождением и выделением гетерологичного иммуноглобулина и, как правило, очисткой до фармацевтически приемлемой чистоты. Для выработки, т.е. экспрессии, иммуноглобулина кодирующая легкую цепь нуклеиновая кислота и кодирующая тяжелую цепь нуклеиновая кислота вводятся обе в экспрессионную кассету с помощью стандартных способов. Нуклеиновые кислоты, кодирующие легкую и тяжелую цепи, легко выделяются и секвенируются с помощью общепринятых способов. В качестве источника таких нуклеиновых кислот могут быть использованы клетки гибридомы. Экспрессионные кассеты могут быть введены в экспрессионную плазмиду (плазмиды), которыми затем трансфицируют клетки-хозяева, не вырабатывающие без этого иммуноглобулины. Экспрессию осуществляют в подходящих прокариотических или эукариотических клетках-хозяевах и выделяют иммуноглобулин из клеток после лизиса или из надосадочной жидкости клеточной культуры.
Термин «раствор иммуноглобулина», как он употребляется в настоящей заявке, означает забуференный водный раствор, содержащий целый иммуноглобулин, фрагмент иммуноглобулина или конъюгат иммуноглобулина. Этот раствор может быть, например, надосадочной жидкостью клеточной культуры или элюатом после колоночной хроматографии, или раствором иммуноглобулина после «наведения блеска».
Термины «гетерологичная ДНК» или «гетерологичный полипептид» относятся к молекуле ДНК или полипептиду, или к популяции молекул ДНК или популяции полипептидов, которые не существуют в естественных условиях внутри данной клетки-хозяина. Молекулы ДНК, гетерологичные по отношению к данной клетке-хозяину, могут содержать ДНК, производные от наличествующих в используемых клетках-хозяевах (т.е. эндогенные ДНК), если эти молекулы ДНК клетки-хозяина скомбинированы с не принадлежащими клетке-хозяину молекулами ДНК (т.е. экзогенными ДНК). Например, молекула ДНК, содержащая принадлежащий молекуле ДНК, не относящейся к клетке-хозяину участок, кодирующий полипептид, действующим образом связанный с участком молекулы ДНК клетки-хозяина, содержащим промотор, рассматривается как гетерологичная молекула ДНК. И наоборот, гетерологичная молекула ДНК может содержать эндогенный структурный ген, действующим образом связанный с экзогенным промотором. Пептид или полипептид, кодируемый не принадлежащей клетке-хозяину молекулой ДНК, является «гетерологичным» пептидом или полипептидом.
Выражение «в условиях, подходящих для экспрессии гетерологичного иммуноглобулина» означает условия, используемые для культивирования клеток млекопитающего, экспрессирующих иммуноглобулин и являющихся известными или легко устанавливаемыми специалистом в соответствующей области. Специалисту в соответствующей области должно быть также известно, что эти условия могут варьироваться в зависимости от типа культивируемой клетки млекопитающего и типа экспрессируемого иммуноглобулина. Как правило, клетки млекопитающего культивируют при температуре от 20°С до 40°С и в течение периода времени, достаточного для обеспечения эффективной выработки белка иммуноглобулина, например от 4 до 28 суток.
Термин «рекомбинантная клетка млекопитающего» относится к клетке, в которую может быть введена/трансфицирована или уже введена нуклеиновая кислота, кодирующая гетерологичный полипептид. Термин «клетка» включает клетки, используемые для экспрессии нуклеиновых кислот. В одном из вариантов осуществления настоящего изобретения клетка млекопитающего является клеткой СНО (например, СНО K1, CHO DG44), или клеткой ВНК, или клеткой NS0, или клеткой SP2/0, или клеткой НЕК 293, или модифицированной генетическим материалом вируса Эпштейна-Барр клеткой НЕК 293 EBNA, или клеткой линии PER.C6®, или клеткой COS. В предпочтительном варианте осуществления настоящего изобретения клетка млекопитающего является клеткой СНО, или клеткой ВНК, или клеткой НЕК, или клеткой SP2/0, или клеткой линии PER.C6®. Выражение «клетка», как оно употребляется в контексте, включает как саму рассматриваемую клетку, так и ее потомство. Таким образом, термин «рекомбинантная клетка» включает как первично трансфицированную ячейку, так и культуры, включающие развившиеся из них клетки-потомки вне зависимости от числа переносов генетического материала. Следует также понимать, что не все потомство должно быть в точности идентично по содержанию ДНК вследствие направленных или произвольных мутаций. Сюда включены такие варианты потомства, которые характеризуются той же функцией или биологической активностью, что и изначально преобразованные клетки.
Термин «забуференный», как он употребляется в настоящей заявке, означает раствор, в котором изменения рН вследствие добавления или высвобождения кислотных или основных веществ выравниваются с помощью буферного вещества. Может быть задействовано любое буферное вещество, приводящее к такому эффекту. В одном из вариантов осуществления настоящего изобретения используют фармацевтически приемлемые буферные вещества, такие как, например, фосфорная кислота или ее соли, уксусная кислота или ее соли, лимонная кислота или ее соли, морфолин или его соли, 2-(N-морфолино)этансульфокислота или ее соли, гистидин или его соли, глицин или его соли или трис(гидроскиметил)аминометан (Трис) или его соли. В предпочтительном варианте осуществления настоящего изобретения буферным веществом является фосфорная кислота или ее соли, уксусная кислота или ее соли, или лимонная кислота или ее соли, или гистидин или его соли. Буферный раствор может необязательно содержать дополнительную соль, такую как хлорид натрия, и/или сульфат натрия, и/или хлорид калия, и/или сульфат калия, и/или цитрат натрия, и/или цитрат калия. В одном из вариантов осуществления настоящего изобретения величина рН забуференного водного раствора находится в пределах от рН 3,0 до рН 10,0, предпочтительно от рН 3,0 до рН 7,0, более предпочтительно от рН 4,0 до рН 6,0 и наиболее предпочтительно - от рН 4,5 до рН 5,5.
Как было недавно неожиданно обнаружено, способ фильтрации в тангенциальном потоке (ФТП) согласно настоящему изобретению, в котором трансмембранное давление и величина поперечного потока изменяются в продолжение процесса фильтрации и подстраиваются, исходя из текущей концентрации иммуноглобулина в подвергаемом концентрированию растворе, позволяет получить за короткое время раствор иммуноглобулина с низким уровнем образования агрегатов. Иначе говоря, было неожиданно обнаружено, что образование агрегатов при фильтрации в тангенциальном потоке остается на низком уровне, если применяется способ ФТП согласно настоящему изобретению, т.е. способ, в котором в течение процесса фильтрации трансмембранное давление изменяется и подбирается в соответствии с текущей концентрацией раствора антитела. Способ согласно настоящему изобретению является переменным способом в отличие от известных в соответствующей области постоянных способов, т.е. способов, в которых трансмембранное давление выбирается до процесса фильтрации и поддерживается постоянным в течение всего процесса фильтрации в тангенциальном потоке.
Объектом настоящего изобретения является способ концентрирования раствора иммуноглобулина с помощью фильтрации в тангенциальном потоке, в котором задаваемые трансмембранное давление и поперечный поток переменны и изменяются в течение процесса фильтрации в зависимости от концентрации иммуноглобулина в концентрируемом растворе следующим образом:
а) трансмембранное давление от 1,4 бар до 1,6 бар и поперечный поток от 75 мл/мин до 90 мл/мин прилагают в диапазоне концентраций до 30 мг иммуноглобулина на миллилитр подвергаемого концентрированию раствора,
б) трансмембранное давление от 0,8 бар до 0,9 бар и поперечный поток от 140 мл/мин до 160 мл/мин прилагают в диапазоне концентраций от 15 мг/мл до 55 мг/мл и
в) трансмембранное давление от 0,8 бар до 0,9 бар и поперечный поток от 120 мл/мин до 140 мл/мин прилагают в диапазоне концентраций свыше 45 мг/мл.
Существует корреляция между сдвиговым напряжением в ФТП и образованием агрегатов. Для расчета величины данного эффекта вызванное потоком сдвиговое напряжение τw на поверхности используемой мембраны рассчитывают по следующей формуле:
, где dH является ,
базирующейся на сведениях из Gerhart, и др. (Fundamentals of Fluid Mechanics (Основы гидромеханики), Addison-Wesley Publishing Company (1993)) и Cheryan, и др. (Ultrafiltration and Microfiltration Handbook (Справочник по ультрафильтрации и микрофильтрации), 2-е издание CRC Press LLC (1998)). В данной формуле dH является гидравлическим диаметром, а - шириной, b - высотой, и L - длиной канала потока. Далее, Δp=pi-po, где pi обозначает приложенное давление на входе, а po является давлением на выходе. В одном из примеров используют мембрану Hydrosart™ (Sartocon Slice 200 Hydrosart™ компании Sartorius AG, Göttingen, Germany), состоящую из регенерированной целлюлозы с номинальным верхним порогом молекулярной массы 30 кДа и площадью мембраны 0,02 м2. Для используемой мембранной кассеты был рассчитан гидравлический диаметр, равный 1,08 мм. Сначала мембрану использовали в стандартном способе ФТП, т.е. без изменения трансмембранного давления и величины поперечного потока в ходе процесса концентрирования. Были проанализированы три постоянных метода с предварительно заданным постоянным Δp и предварительно заданным постоянным трансмембранным давлением (ТМД) 0,6 бар.
| Таблица 1 | |
| Обзор приложенных разностей давления и соответствующего сдвигового напряжения | |
| Δp [бар] | τw [Па] |
| 1,2 | 216 |
| 1,8 | 324 |
| 3,0 | 541 |
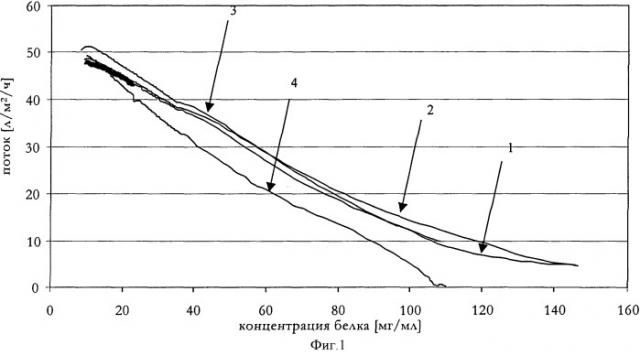
При рассмотрении величины потока в зависимости от растущей концентрации белка не наблюдается существенных изменений для кривых, полученных для процессов с различными величинами Δр. Однако для режима с разностью давлений 3 бар наблюдалась более низкая конечная концентрация вследствие высокого давления на входе. По сравнению с режимом концентрирования при более низком постоянном поперечном потоке (ПП; 90 мл/мин) и более низкой средней величине Δp (около 0,9 бар), более высокие величины Δp в диапазоне 1,2-1,8 бар приводят к улучшенной производительности по потоку в зависимости от времени и более высокой конечной концентрации (во всех случаях ТМД составляло 0,6 бар).
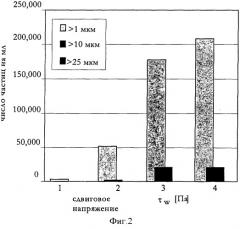
Сравнение данных по мутности, исследованию методом затенения (LO) и динамическому светорассеянию (ДРС) до и после процесса концентрирования показывает, что при увеличенном сдвиговом напряжении наблюдается усиление образования агрегатов (Фигура 2).
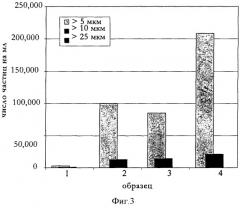
Был разработан способ ФТП с общей длительностью процесса, сравнимой с режимом высокого входного давления (Δp=3 бар), вызывающим напряжения, основанный на экспериментах по отслеживанию трансмембранного давления (ТМД) и поперечного потока (ПП) (см., например, Luo, R., и др., Bioprocess Int. 4 (2006) 44-54). Способ согласно настоящему изобретению был разработан с целью улучшения производительности по потоку в продолжение времени при пониженном уровне образования агрегатов иммуноглобулина, т.е. с целью достичь сочетания низкого уровня образования агрегатов с малым суммарным временем концентрирования. В процессе разработки способа согласно настоящему изобретению осуществляли отслеживание ТМД и ПП в зависимости от превалирующей концентрации иммуноглобулина в подвергаемом концентрированию растворе иммуноглобулина. Был найден способ с ТМД и ПП, подобранными в зависимости от наилучшего профиля по потоку при данной концентрации. Избегая связанных с высоким входным давлением недостатков (см., например, Dosmar, M., и др., Bioprocess Int. 3 (2005) 40-50), способ согласно настоящему изобретению приводит к низкому содержанию агрегатов по данным измерений мутности и исследований методом светотени и ДРС (см. фигуры 3 и 4). Кроме того, с помощью способа согласно настоящему изобретению достигается более высокая конечная концентрация.
В способе согласно настоящему изобретению трансмембранное давление и величина поперечного потока варьируются в зависимости от текущей концентрации концентрируемого раствора иммуноглобулина. В одном из вариантов осуществления настоящего изобретения способ согласно настоящему изобретению является способом фильтрации в тангенциальном потоке с регулируемыми параметрами, где текущая концентрация иммуноглобулина в подвергаемом концентрированию растворе определяет прилагаемое трансмембранное давление и поперечный поток. Таким образом, трансмембранное давление и величина поперечного потока подстраиваются в зависимости от текущей концентрации иммуноглобулина с целью снижения прилагаемых напряжений и в связи с этим снижения уровня образования агрегированных молекул иммуноглобулина и достижения малого общего времени концентрирования.
В способе согласно настоящему изобретению определяют три диапазона концентраций. Первый диапазон текущих концентраций подвергаемого концентрированию раствора составляет от 0 мг/мл до 30 мг/мл, второй диапазон текущих концентраций составляет от 15 мг/мл до 55 мг/мл, а третий диапазон текущих концентраций составляет от 45 мг/мл до 180 мг/мл. Как можно заметить, эти диапазоны концентраций пересекаются. Как было обнаружено, в пересечениях диапазонов концентраций, от 15 мг/мл до 30 мг/мл и от 45 мг/мл до 55 мг/мл, в способе согласно настоящему изобретению могут применяться разные величины трансмембранного давления и поперечного потока. В этих пересекающихся диапазонах концентраций могут применяться без заметного влияния на уровень образования агрегатов или длительность процесса любые из двух настроек ТМД и ПП.
Таким образом, в одном из вариантов осуществления способа согласно настоящему изобретению условия от а) к б) и от б) к в) могут быть изменены при любом значении концентрации, принадлежащем пересечениям диапазонов концентраций.
В одном из вариантов осуществления настоящего изобретения диапазон концентраций на стадии в) составляет от 50 мг/мл до 275 мг/мл. В другом варианте осуществления настоящего изобретения трансмембранное давление и поперечный поток составляют 1,5 бар и 80 мл/мин на стадии а), 0,85 бар и 150 мл/мин на стадии б), и/или 0,85 бар и 130 мл/мин на стадии в). В другом варианте осуществления настоящего изобретения раствор иммуноглобулина является забуференным водным раствором иммуноглобулина. В одном из вариантов осуществления настоящего изобретения диапазон концентраций составляет на стадии а) от 5 до 25 мг/мл, на стадии б) от 25 до 50 мг/мл, а на стадии в) от 50 до 140 мг/мл.
В еще одном варианте осуществления настоящего изобретения его объектом является способ получения гетерологичного иммуноглобулина, включающий следующие шаги в представленной последовательности:
а) получение рекомбинантной клетки млекопитающего, содержащей одну или несколько нуклеиновых кислот, кодирующих гетерологичный иммуноглобулин,
б) культивирование клетки млекопитающего в условиях, подходящих для экспрессии гетерологичного иммуноглобулина,
в) выделение гетерологичного иммуноглобулина из рекомбинантной клетки млекопитающего или из культуральной среды, являющейся забуференным водным раствором,
г) концентрирование получаемого забуференного водного раствора, содержащего гетерологичный иммуноглобулин, с помощью фильтрации в тангенциальном потоке с переменными трансмембранным давлением и величиной поперечного потока, зависящими от концентрации иммуноглобулина.
В одном из вариантов осуществления способа получения согласно настоящему изобретению шаг г) включает концентрирование получаемого забуференного водного раствора с помощью фильтрации в тангенциальном потоке с переменными трансмембранным давлением и величиной поперечного потока, зависящими от концентрации иммуноглобулина, при
1) трансмембранном давлении от 1,4 бар до 1,6 бар и поперечном потоке от 75 мл/мин до 90 мл/мин в диапазоне концентраций до 30 мг иммуноглобулина на миллилитр концентрируемого раствора,
2) трансмембранном давлении от 0,8 бар до 0,9 бар и поперечном потоке от 140 мл/мин до 160 мл/мин в диапазоне концентраций от 15 мг/мл до 55 мг/мл и
3) трансмембранном давлении от 0,8 бар до 0,9 бар и поперечном потоке от 120 мл/мин до 140 мл/мин в диапазоне концентраций свыше 45 мг/мл.
В другом варианте осуществления настоящего изобретения способ включает осуществление следующего шага прежде, т.е. до, или после шага г):
д) очистку забуференного водного раствора, содержащего гетерологичный иммуноглобулин.
Очистка на шаге д) может быть осуществлена с помощью различных способов и методик, таких как хроматографическая стадия, или сочетание различных или сходных хроматографических стадий, или осаждение, или высаливание, или ультрафильтрация, или диафильтрация, или лиофилизация, или смена буфера, или сочетания перечисленного, или подобное перечисленному.
В еще одном варианте осуществления настоящего изобретения гетерологичный иммуноглобулин является целым иммуноглобулином, или фрагментом иммуноглобулина, или конъюгатом иммуноглобулина. В одном из вариантов осуществления настоящего изобретения клетка млекопитающего является клеткой СНО, клеткой ВНК, клеткой NS0, клеткой Sp2/0, клеткой COS, клеткой НЕК или клеткой линии PER.C6®. В предпочтительном варианте осуществления настоящего изобретения клетка млекопитающего является клеткой СНО, или клеткой ВНК, или клеткой НЕК, или клеткой Sp2/0, или клеткой линии PER.C6®.
Нижеприведенные примеры и фигуры представлены с целью облегчения понимания настоящего изобретения, истинный объем которого изложен далее в формуле изобретения. Следует понимать, что в изложенные методики могут быть внесены модификации без отхода от духа настоящего изобретения.
Противоинтерлейкиновое антитело анти-IL-IR (см., например, международную заявку на изобретение WO 2005/023872) и анти-Р-селектиновое антитело (см., например, международную заявку на изобретение WO 2005/100402) были доступны в достаточных количествах в наших лабораториях во время осуществления изобретения, вследствие чего примерами для настоящего изобретения послужили два упомянутых иммуноглобулина. Сходным образом, настоящее изобретение в целом осуществимо с любым иммуноглобулином. Это проиллюстрированное описание приводится лишь в качестве примера, но не в качестве ограничивающего настоящее изобретение.
Описание фигур
Фигура 1: Зависимость потока от концентрации белка в растворе антитела анти-IL-IR перед промыванием мембраны для режимов с различными постоянными Δp и для способа концентрирования с постоянным ПП 90 мл/мин. 1: способ с постоянными параметрами, Δp=1,2 бар, 2: способ с постоянными параметрами, Δp=1,8 бар, 3: способ с постоянными параметрами, Δp=3,0 бар, 4: способ с постоянными параметрами, ПП=90 мл/мин
Фигура 2: Число частиц до и после концентрирования раствора антитела анти-IL-IR с помощью способа с постоянными параметрами. 1: до концентрирования, 2: τw=216, 3: τw=324, 4: τw=541.
Фигура 3: Сопоставление числа частиц в растворе антитела анти-IL-IR до и после концентрирования различными способами. 1: до концентрирования, 2: способ с переменными параметрами согласно настоящему изобретению, 3: способ с постоянными параметрами, ПП=90 мл/мин, 4: τw=541.
Фигура 4: Зависимость потока от концентрации белка в растворе антитела анти-IL-IR. 1: способ с постоянными параметрами, ПП=90 мл/мин, 2: τw=541, 3: способ с переменными параметрами согласно настоящему изобретению.
Фигура 5: Зависимость трансмембранного потока от трансмембранного давления для раствора антитела анти-IL-IR при концентрации белка 5,3 мг/мл для величин поперечного потока 50 мл/мин (сплошные кружочки), 80 мл/мин (сплошные треугольники) и 130 мл/мин (сплошные квадраты).
Фигура 6: Зависимость трансмембранного потока от трансмембранного давления для раствора антитела анти-IL-IR при концентрации белка 45 мг/мл для величин поперечного потока 80 мл/мин (сплошные кружочки), 130 мл/мин (сплошные треугольники) и 150 мл/мин (сплошные квадраты).
Фигура 7: Зависимость трансмембранного потока от трансмембранного давления для раствора антитела анти-IL-IR при концентрации белка 90 мг/мл для величин поперечного потока 50 мл/мин (сплошные кружочки), 80 мл/мин (сплошные треугольники) и 130 мл/мин (сплошные квадраты).
Фигура 8: Зависимость трансмембранного потока от трансмембранного давления для раствора антитела анти-IL-IR при концентрации белка 180 мг/мл 50 мл/мин (сплошные кружочки), 80 мл/мин (сплошные треугольники) и 130 мл/мин (сплошные квадраты).
Фигура 9: Гранулометрический анализ частиц концентрата раствора антитела анти-IL-IR в цитратном буфере, полученного различными способами. 1: до концентрирования, 2: способ с переменными параметрами согласно нас