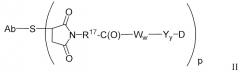Антитела против tenb2, сконструированные с цистеином, и конъюгаты антитело - лекарственное средство
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Предложено антитело, специфичное к TENB2, содержащее легкую и тяжелую цепи. Тяжелая цепь содержит замену на свободный (реакционноспособный) цистеин А121С, что соответствует А114С (нумерация по Кабату) или А118С (нумерация по Eu). Предложены варианты конъюгата для лечения рака предстательной железы, содержащего антитело, ковалентно связанное с ауристатином, в том числе посредством линкера. Описаны: фармацевтическая композиция для лечения рака предстательной железы, использующая в качестве активного начала антитело или его конъюгат; изделие для лечения рака предстательной железы на основе такой композиции. Предложены: способ определения белка TENB2 в образце - на основе антитела, а также анализ для выявления клеток рака предстательной железы у млекопитающего и способ ингибирования клеточной пролиферации - на основе конъюгата антитела и ауристатина. Описан способ получения конъюгата антитела (Аb) и ауристатина (D) с формулой Ab-(L-D)p, где р равно от 1 до 4, а L - линкер. Использование изобретения обеспечивает конъюгаты с повышенной стабильностью в сыворотке по сравнению с такими же конъюгатами без замены А121С в антителе, что может найти применение в медицине. 9 н. и 24 з.п. ф-лы, 18 ил., 2 табл., 4 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данное изобретение относится, главным образом, к антителам, сконструированным с реакционноспособными цистеиновыми остатками, и конкретнее к антителам, имеющим терапевтическое или диагностическое применение. Антитела, сконструированные с цистеином, могут быть конъюгированы с химиотерапевтическими лекарственными средствами, токсинами, аффинными лигандами, такими как биотин, и метками детекции, такими как флюорофоры. Изобретение также относится к способам использования антител и соединений конъюгата антитело-лекарственное средство для in vitro, in situ, и in vivo диагностики или обработки клеток млекопитающих, или связанных патологических состояний.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Терапия антителами была разработана для направленного лечения пациентов, страдающих злокачественными новообразованиями, иммунологическими или ангиогенными нарушениями. Трансмембранные, или имеющие другое расположение, опухолеассоциированные полипептиды специфически экспрессируемые на поверхности раковых клеток по сравнению с нормальной, нераковой клеткой (клетками), были определены в качестве клеточных мишеней для диагностики или лечения рака с помощью антител. Определение таких опухолеассоциированных полипептидов поверхностных антигенов, то есть опухолеассоциированных антигенов (ТАА), делает возможным специфическое нацеливание на раковые клетки для разрушения посредством терапии, основанной на антителах.
Применение конъюгатов антитело-лекарственное средство (ADC), то есть иммуноконъюгатов, для местной доставки цитотоксических или цитостатических средств, т.е. лекарственных средств для уничтожения или ингибирования опухолевых клеток при лечении злокачественного новообразования (Lambert, J. (2005) Curr. Opinion in Pharmacology 5: 543-549; Wu et al (2005) Nature Biotechnology 23(9): 1137-1146; Payne, G. (2003) Cancer Cell 3: 207-212; Syrigos and Epenetos (1999) Anticancer Research 19: 605-614; Niculescu-Duvaz and Springer (1997) Adv. Drug Del. Rev. 26: 151-172; US 4975278) делает возможной направленную доставку лекарственной молекулы к опухоли, и внутриклеточное накопление там, где системное введение этих неконъюгированных лекарственных средств для уничтожения опухолевых клеток также может привести к недопустимым уровням токсичности как для нормальных клеток, так и для опухолевых клеток, подлежащих уничтожению (Baldwin et al (1986) Lancet pp. (Mar. 15, 1986): 603-05; Thorpe, (1985) «Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review» in Monoclonal Antibodies '84: Biological And Clinical Applications, A. Pinchera et al (ed.s), pp. 475-506). Меры по улучшению терапевтического индекса, а именно максимальной эффективности и минимальной токсичности ADC, сфокусированы на селективности поликлональных (Rowland et al (1986) Cancer Immunol. Immunother., 21: 183-87) и моноклональных антител (mAb), а также лекарство-связывающих и лекарство-высвобождающих свойствах (Lambert, J. (2005) Curr. Opinion in Pharmacology 5: 543-549). Лекарственные молекулы, используемые в конъюгатах антитело-лекарственное средство, включают бактериальные токсины белковой природы, такие как дифтерийный токсин, белковые токсины растений, такие как рицин, малые молекулы, такие как ауристатины, гелданамицин (Mandler et al (2000) J. of the Nat. Cancer Inst. 92(19): 1573-1581; Mandler et al (2000) Bioorganic & Med. Chem. Letters 10: 1025-1028; Mandler et al (2002) Bioconjugate Chem. 13: 786-791), майтанзиноиды (EP 1391213; Liu et al (1996) Proc. Natl. Acad. Sci. USA 93: 8618-8623), калихемицин (Lode et al (1998) Cancer Res. 58: 2928; Hinman et al (1993) Cancer Res. 53: 3336-3342), дауномицин, доксорубицин, метотрексат и виндезин (Rowland et al. (1986), выше). Лекарственные молекулы могут действовать на цитотоксические и цитостатические механизмы, включая связывание тубулина, связывание ДНК, или ингибирование топоизомеразы. Некоторые цитотоксические лекарственные средства имеют тенденцию быть неактивными или менее активными при конъюгировании с большими антителами или лигандами белковых рецепторов.
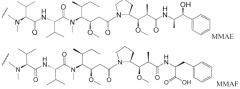
Пептиды ауристатина, ауристатин E (AE) и монометилауристатин (MMAE), синтетические аналоги доластатина (WO 02/088172), в качестве лекарственных молекул были конъюгированы с: (i) химерными моноклональными антителами cBR96 (специфичны к Льюис Y на карциномах); (ii) cAC10, которое специфично к CD30 на гематологических злокачественных новообразованиях (Klussman, et al (2004), Bioconjugate Chemistry 15(4): 765-773; Doronina et al (2003) Nature Biotechnology 21(7): 778-784; Francisco et al (2003) Blood 102(4): 1458-1465; US 2004/0018194); (iii) антителами против CD20, такими как ритуксан (WO 04/032828), для лечения CD-20-экспрессирующих злокачественных новообразований и иммунных нарушений; (iv) антителом 2Н9 против EphB2R для лечения рака ободочной и прямой кишки (Mao et al (2004) Cancer Research 64(3): 781-788); (v) антителом к Е-селектину (Bhaskar et al (2003) Cancer Res. 63: 6387-6394); (vi) трастузумабом (HERCEPTIN®, US 2005/0238649), и (vi) антителами против CD30 (WO 03/043583). Варианты ауристатина Е раскрыты в US 5767237 и US 6124431. Монометилауристатин Е, конъюгированный с моноклональными антителами, раскрыт у Senter et al, Proceedings of the American Association for Cancer Research, том 45, номер реферата 623, представлен 28 марта 2004. Ауристатиновые аналоги MMAE и MMAF были конъюгированы с различными антителами (US 2005/0238649).
Обычные способы присоединения лекарственной молекулы к антителу, т.е. связывание посредством ковалентных связей, как правило, приводят к образованию гетерогенной смеси молекул, в которой молекулы лекарственного средства присоединены к целому ряду участков на антителе. Например, цитотоксические лекарственные средства, обычно, конъюгируют с антителами посредством многочисленных остатков лизина антитела, образуя гетерогенную смесь конъюгата антитело-лекарственное средство. В зависимости от условий реакции, гетерогенная смесь обычно содержит распределение антител с прикрепленными лекарственными молекулами от 0 до 8, или более. Кроме того, в пределах каждой подгруппы конъюгатов с конкретным целочисленным соотношением молекул лекарственного средства к антителу, существует потенциально гетерогенная смесь, в которой молекула лекарственного средства присоединена к различным участкам на антителе. Аналитические и препаративные методы могут быть недостаточными для разделения и характеристики видов молекул конъюгатов антитело-лекарственное средство в составе гетерогенной смеси, полученной в результате реакции конъюгирования. Антитела представляют собой крупные, сложные и структурно разнообразные биомолекулы, часто со множеством реакционноспособных функциональных групп. Их способность реагировать с линкерными реагентами и промежуточными соединениями лекарственное средство-линкер зависит от таких факторов, как рН, концентрация, концентрация соли, и вспомогательных растворителей. Более того, многостадийный процесс конъюгирования может быть невоспроизводимым в результате сложности контролирования условий реакции и характеристик взаимодействующих веществ и промежуточных соединений.
Тиолы цистеина являются реакционноспособными при нейтральном значении рН, в отличие от большинства аминов, которые присоединяют протон, и менее нуклеофильны при значении рН, близком к 7. Поскольку свободные тиоловые (меркаптаны, сульфгидрил) группы являются относительно реакционноспособными, белки с цистеиновыми остатками часто находятся в их окисленной форме в качестве дисульфид-связанных олигомеров, или имеют внутренние мостиковые дисульфидные группы. Внеклеточные белки, как правило, не имеют свободных тиолов (Garman, 1997, Non-Radioactive Labelling: A Practical Approach, Academic Press, London, page 55). Тиоловые группы цистеина антитела, как правило, более реакционноспособны, т.е. более нуклеофильны, по отношению к электрофильным реагентам конъюгирования, чем аминные или карбоксильные группы антитела. Остатки цистеина были введены в белки с использованием методов генной инженерии для образования ковалентных присоединений к лигандам или для образования новых внутримолекулярных дисульфидных связей (Better et al (1994) J. Biol. Chem. 13: 9644-9650; Bernhard et al (1994) Bioconjugate Chem. 5: 126-132; Greenwood et al (1994) Therapeutic Immunology 1: 247-255; Tu et al (1999) Proc. Natl. Acad. Sci USA 96: 4862-4867; Kanno et al (2000) J. of Biotechnology, 76: 207-214; Chmura et al (2001) Proc. Nat. Acad. Sci. USA 98(15): 8480-8484; US 6248564). Тем не менее, конструирование тиоловых групп цистеина посредством мутаций различных аминокислотных остатков белка в аминокислоты цистеина, является потенциально проблематичным, в частности, в случае непарных (свободный Cys) остатков, или тех, которые являются относительно доступными для взаимодействия или окисления. В концентрированных растворах белка, либо в периплазме E.coli, культуральных супернатантах, или частично, или полностью очищенном белке, непарные остатки Cys на поверхности белка могут образовывать пары и окисляться с образованием внутримолекулярных дисульфидов, и, следовательно, белковых димеров или мультимеров. Образование дисульфидных димеров делает новый Cys нереакционноспособным для конъюгирования с лекарственным средством, лигандом или другой меткой. Более того, если белок посредством окисления образует межмолекулярную дисульфидную связь между вновь сконструированным Cys и существующим остатком Cys, тиоловые группы обоих Cys становятся недоступны для участия и взаимодействия активных центров. Кроме того, белок может стать неактивным или неспецифическим в результате неправильного сворачивания или потери третичной структуры (Zhang et al (2002) Anal. Biochem. 311:1-9).
Антитела конструировали с цистеином в виде FAB-фрагментов антител (тиоFab) и экспрессировали в виде полноразмерных, моноклональных IgG (тиоMab) антител (US 2007/0092940, содержание которого включено в настоящий документ посредством ссылки). Антитела ТиоFab и ТиоMab конъюгировали посредством линкеров с вновь введенными тиолами цистеина с использованием тиол-реактивных линкерных реагентов и лекарство-связывающих реагентов, для получения конъюгатов антитело-лекарственное средство (Тио ADC).
TENB2 представляет собой опухолеассоциированный полипептидный антиген (также известный как PR1), и белок TENB2 содержит 2 фоллистатин-подобных домена и консервативный EGF-подобный домен. Ген, кодирующий данный белок, впервые был охарактеризован из библиотеки кДНК человеческого мозга (см. Uchida, et al. (1999) Biochem. Biophys. Res. Commun. 266:593-602), и позднее был выделен из библиотеки кДНК мозга эмбриона человека (см. Horie, et al. (2000) Genomics 67: 146-152). См. также, например, Online Mendelian Inheritance in Man, номер 605734; Unigene Cluster Hs.22791; LocusLink 23671; и другие соответствующие сайты. TENB2 называли PR1, томорегулин, TR, ген гиперпластического полипоза 1, HPP1 и TMEFF2. Последовательность его нуклеиновой кислоты может быть идентифицирована по номерам ATCC AF264150, AB004064, AB017269 и AF179274; и его аминокислотная последовательность может быть идентифицирована по номерам ATCC AAF91397, BAA90820, BAA87897 и AAD55776. Ген TENB2 в базе данных UniGene Cluster имеет идентификационный номер hs.22791, в базе данных Locuslink имеет идентификационный номер 23671, и в базе данных OMIM имеет идентификационный номер 605734.
Ген также связан с некоторыми злокачественными состояниями. Young et al (2001) Proc. Nat'l Acad. Sci. USA 98: 265-270 описали экспрессию в колоректальных полипах. Glynne-Jones et al (2001) Int. J. Cancer 94:178-184 описали его в качестве маркера рака простаты.
В результате его сверхэкспрессии в некоторых опухолях человека, полипептид TENB2 и нуклеиновая кислота, кодирующая этот полипептид, являются объектами для количественного и качественного сравнения между образцами различных тканей млекопитающих. Уникальные профили экспрессии полипептида TENB2, и нуклеиновой кислоты, кодирующей этот полипептид, можно использовать для диагностики и терапевтического лечения некоторых типов злокачественных опухолей млекопитающих.
Недавно были раскрыты некоторые антитела против TENB2, включая антитело # 19 против TMEFF2, и показано, что они могут быть интернализированными и пригодными для лечения пролиферативных состояний предстательной железы, включая например, доброкачественную гиперплазию предстательной железы и рак предстательной железы (PCT/US03/07209; US Ser. № 10/383447, поданной 7 Марта 2003; Vinay et al., «Antibodies Against Cancer Antigen TMEFF2 and Uses Thereof», содержания которых включены путем ссылки).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном аспекте, изобретение включает антитело против TENB2, сконструированное с цистеином, содержащее одну или несколько свободных аминокислот цистеина и последовательность, выбранную из последовательностей SEQ ID NO:8-23. Антитело против TENB2, сконструированное с цистеином, может связывать полипептид TENB2. Опухолеассоциированные антигены (TAA), такие как полипептиды TENB2, могут быть получены для использования при создании антител, сконструированных с цистеином, используя методы и информацию, которые хорошо известны и описаны в уровне техники, например, в PCT/US03/07209. Антитело против TENB2, сконструированное с цистеином, может быть получено способом, включающим замену одного или нескольких аминокислотных остатков в родительском антителе против TENB2 на цистеин.
Один или несколько свободных аминокислотных остатков цистеина в антителе против TENB2, сконструированном с цистеином, расположены в легкой цепи или в тяжелой цепи.
В одном аспекте, изобретение включает способ определения наличия белка TENB2 в образце, в котором подозревают наличие указанного белка, включающий воздействие на указанный образец антителом против TENB2, сконструированным с цистеином, и определение связывания указанного антитела с указанным белком TENB2 в указанном образце, где связывание антитела с указанным белком указывает на наличие указанного белка в указанном образце.
Антитела против TENB2, сконструированные с цистеином, можно использовать в качестве "голых" антител (неконъюгированных с лекарственным средством или молекулой-меткой), или в качестве конъюгатов антитело-лекарственное средство (ADC). Антитело против TENB2, сконструированное с цистеином, может быть ковалентно связано с молекулой лекарственного средства ауристатин, в результате чего образуется конъюгат антитело-лекарственное средство. Конъюгат антитело-лекарственное средство может содержать антитело (Ab) против TENB2, сконструированное с цистеином, и молекулу (D) лекарственного средства ауристатин, где антитело против TENB2, сконструированное с цистеином, связано с (D) посредством одной или нескольких аминокислот цистеина с помощью линкерной молекулы (L); соединение имеет формулу I:
где p равно 1, 2, 3 или 4. Молекулы лекарственного средства ауристатин включают MMAE и MMAF.
Аспектом изобретения является способ обнаружения раковых клеток, включающий: (a) воздействие на клетки соединением конъюгата антитело-лекарственное средство; и (b) определение степени связывания соединения конъюгата антитело-лекарственное средство с клетками.
Аспектом изобретения является фармацевтическая композиция, содержащая конъюгат антитело-лекарственное средство, и фармацевтически приемлемый разбавитель, носитель или наполнитель.
Аспектом изобретения является способ ингибирования клеточной пролиферации, включающий обработку опухолевых клеток млекопитающего в среде клеточной культуры соединением конъюгата антитело-лекарственное средство, в результате чего ингибируется пролиферация опухолевых клеток.
Аспектом изобретения является способ лечения рака, включающий введение пациенту фармацевтической композиции. Пациент может применять химиотерапевтическое средство в комбинации с соединением конъюгата антитело-лекарственное средство.
Аспектом изобретения является изделие, содержащее фармацевтическую композицию, контейнер; и листовку-вкладыш в упаковке, или этикетку, в которой указано, что соединение можно использовать для лечения злокачественного новообразования, характеризующегося сверхэкспрессией полипептида TENB2.
Аспектом изобретения является способ получения соединения конъюгата антитело-лекарственное средство формулы I, включающий стадии: (a) взаимодействия сконструированных цистеиновых групп антитела, сконструированного с цистеином, с линкерным реагентом с образованием промежуточного соединения антитело-линкер Ab-L; и (b) взаимодействия Ab-L с активированной молекулой D лекарственного средства; в результате чего образуется конъюгат антитело-лекарственное средство; или включающий стадии: (c) взаимодействия нуклеофильной группы молекулы лекарственного средства с линкерным агентом с образованием промежуточного соединения лекарственное средство-линкер D-L; и (d) взаимодействия D-L с сконструированной цистеиновой группой антитела, сконструированного с цистеином; в результате чего образуется конъюгат антитело-лекарственное средство.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 представлена последовательность тяжелой цепи: SEQ ID NO:1, и последовательность легкой цепи: SEQ ID NO:2 гуманизированного антитела против TENB2, hu TMEFF2#19.
На фиг.2 представлена последовательность тяжелой цепи: SEQ ID NO:3, и последовательность легкой цепи: SEQ ID NO:2 гуманизированного антитела против TENB2, сконструированного с цистеином, A121C thio hu TMEFF2#19. Сигнальная последовательность не включена в последовательную нумерацию антитела против TENB2.
На фиг.3 представлено выравнивание последовательностей легкой цепи гуманизированного трастузумаба (HuTMAb-LC, SEQ ID NO:4) и легкой цепи hu TMEFF2#19 (SEQ ID NO:5). Нумерация придерживается последовательной нумерации.
На фиг.4 представлено выравнивание последовательностей тяжелой цепи гуманизированного трастузумаба (HuTMAb-HC, SEQ ID NO:6) и тяжелой цепи hu TMEFF2#19 (SEQ ID NO:7). Нумерация придерживается последовательной нумерации.
На фиг.5 изображены конъюгаты антитела против TENB2, сконструированного с цистеином, и лекарственного средства (ADC), где молекула лекарственного средства прикреплена к сконструированной цистеиновой группе в: легкой цепи (LC-ADC); тяжелой цепи (HC-ADC); и в Fc-области (Fc-ADC).
На фиг.6 изображены стадии: (i) восстановления дисульфидных аддуктов цистеина и внутрицепочечных и межцепочечных дисульфидов в антителе против TENB2, сконструированном с цистеином (ТиоMab); (ii) частичного окисления, т.е. переокисления, для повторного формирования межцепочечных и внутрицепочечных дисульфидов; и (iii) конъюгирования переокисленного антитела с промежуточным соединением лекарственное средство-линкер, с образованием конъюгата антитела против TENB2, сконструированного с цистеином, и лекарственного средства (ADC).
На фиг.7 представлена экспрессия TENB2 в раковой и нормальной тканях человека: анализ с олигонуклеотидным микрочипом проводили на РНК, выделенной из 4841 образца тканей человека. Каждый квадратик на графике определяет интенсивность сигнала (среднее отклонение имеет шкалу до 100) TENB2 для образца обозначенной ткани. Зеленые квадратики означают нормальную ткань, красные квадратики означают опухоль, и голубые квадратики отображают ткани других поврежденных тканей.
На фиг.8 представлена экспрессия TENB2 в опухолях предстательной железы человека: верхняя и нижняя панели представляют собой модели эксплантов предстательной железы человека, стабильную клеточную линию среды PC3TENB2 с контрольным вектором и опухолью предстательной железы, соответственно.
На фиг.9 изображена интернализация моноклонального антитела TENB2 (Mab) в клеточной линии среды PC3TENB2 и опухоли LuCaP 70.
На фиг.10 представлены результаты анализа FACS клеток среды PC3 TENB2, после обработки с помощью тио- или стандартного ADC против TENB2.
На фиг.11 представлен анализ клеточного уничтожения на клетках среды PC3 TENB2 с использованием стандартного анти-TENB2 и тио-анти-TENB2 ADC.
На фиг.12 представлен анализ эффективности на клетках среды PC3 TKNB2 с использованием анти-TENB2 и тио-анти-TENB2 ADC (конъюгированный с vc-MMAE или MC-MMAF).
На фиг.13 изображен вестерн-блоттинг с различными эксплантами опухолевой ткани LuCaP, с использованием гуманизированного Ab против TENB2 (hu TMEFF2#19).
На фиг.14 представлены экспериментальные исследования ксенотрансплантов с использованием моделей рака предстательной железы человека LuCaP 70, 77 и 96.1.
На фиг.15 представлена оценка фармакокинетики у крыс, с использованием тио-анти-TENB2 и стандартного ADC.
На фиг.16 представлена оценка безопасности анти-TENB2-vc-MMAE в сравнении с MC-MMAF у крыс.
На фиг.17 представлена оценка безопасности анти-TENB2-vc-MMAE в сравнении с анти-TENB2-MC-MMAF у человекообразных обезьян.
На фиг.18 представлена оценка безопасности тио-анти-TENB2-vc-MMAE в сравнении с анти-TENB2-vc-MMAE у крыс.
ПОДРОБНОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Будет предоставлена подробная информация для некоторых вариантов осуществления данного изобретения, примеры которых проиллюстрированы сопутствующими структурами и формулами. Несмотря на то, что изобретение будет описано в отношении перечисленных вариантов осуществления, будет понятно, что они не предназначены для ограничения изобретения. С другой стороны, изобретение имеет целью охватить все альтернативы, модификации и эквиваленты, которые могут быть включены в объем изобретения, как определено формулой изобретения.
Специалисту в данной области техники известны многие способы и материалы, схожие или эквивалентные описанным в настоящем документе, которые можно использовать при практическом применении настоящего изобретения. Настоящее изобретение никоим образом не ограничено описанными методами и материалами.
ОПРЕДЕЛЕНИЯ
Если не определено иначе, технические и научные термины, используемые в настоящем документе, имеют то же значение, как обычно используемые специалистом в данной области, к которой относится изобретение, и находятся в соответствии с: Singleton et al (1994) Dictionary of Microbiology and Molecular Biology, 2nd Ed., J. Wiley & Sons, New York, NY; and Janeway, C, Travers, P., Walport, M., Shlomchik (2001) Immunobiology, 5th Ed., Garland Publishing, New York.
Термин «антитело» в настоящем документе используется в самом широком смысле и, в частности, охватывает моноклональные антитела, поликлональные антитела, димеры, мультимеры, мультиспецифические антитела (например, биспецифические антитела), и фрагменты антител, при условии, что они проявляют желаемую биологическую активность (Miller et al (2003) Jour. of Immunology 170:4854-4861). Антитела могут быть мышиными или крысиными, человеческими, гуманизированными, химерными или полученными от других биологических видов. Антитело представляет собой белок, который способен распознавать и связывать специфический антиген (Janeway, C., Travers, P., Walport, M., Shlomchik (2001) Immuno Biology, 5th Ed., Garland Publishing, New York). Антиген-мишень, обычно, имеет множество участков связывания, также называемых эпитопами, распознаваемых CDR многочисленных антител. Каждое антитело, которое специфически связывает различные эпитопы, имеет различное строение. Таким образом, один антиген может иметь более чем одно соответствующее антитело. Антитело включает полноразмерную молекулу иммуноглобулина или иммунологически активную часть молекулы полноразмерного иммуноглобулина, а именно, молекулу, которая содержит антигенсвязывающий сайт, который иммуноспецифически связывает антиген-мишень, представляющий интерес, или его часть, такие мишени включают, но не ограничиваются ими, раковые клетки или клетки, которые продуцируют аутоиммунные антитела, ассоциированные с аутоиммунным заболеванием. Иммуноглобулин, раскрытый в настоящем документе, может быть молекулой иммуноглобулина любого типа (например, IgG, IgE, IgM, IgD, и IgA), класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2), или подкласса. Иммуноглобулины могут быть получены от любых биологических видов, таких как человек, мышь или крыса, или кролик. Структуру и свойства различных классов антител см., например, в Basic and Clinical Immunology, издание 8, Daniel P. Stites, Abba I. Terr and Tristram G. Parslow (eds.), Appleton & Lange, Norwalk, CT, 1994, страница 71 и Глава 6.
«Фрагменты антител» содержат часть полноразмерного антитела, как правило, его антигенсвязывающую или вариабельную область. Примеры фрагментов антител включают фрагменты Fab, Fab', F(ab')2 и Fv; димерные антитела; линейные антитела; миниантитела (US 5641870, Example 2; Zapata et al (1995) Protein Eng. 8(10): 1057-1062); Olafsen et al (2004) Protein Eng. Design & Sel. 17(4): 315-323), фрагменты, продуцируемые библиотекой экспрессируемых Fab, антиидиотипические антитела (анти-Id), CDR (определяющие комплементарнось области), и эпитопсвязывающие фрагменты любого из вышеперечисленного, которые иммуноспецифически связывают антигены раковых клеток, антигены вирусов или микробные антигены, молекулы одноцепочечных антител; и мультиспецифические антитела, образованные фрагментами антител.
Используемый в настоящем документе термин «моноклональное антитело» относится к антителу, полученному из популяции антител, по существу, гомогенных, т.е., конкретные антитела, образующие популяцию, являются идентичными, за исключением возможных природных мутаций, которые могут присутствовать в незначительном количестве. Моноклональные антитела являются высокоспецифичными, будучи направленными против одного единственного антигенного сайта. Более того, в отличие от препаратов поликлональных антител, которые включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. В дополнение к их специфичности, моноклональные антитела являются предпочтительными в силу того, что они могут быть синтезированы без контаминации другими антителами. Определение «моноклональное» обозначает характер антитела, как полученного из по существу гомогенной популяции антител, и не должно рассматриваться, как требующее получение антитела каким-либо конкретным способом. Например, моноклональные антитела, используемые в соответствии с настоящим изобретением, могут быть получены посредством гибридомной технологии, впервые описанной Kohler и соавторами (1975) Nature 256:495, или могут быто получены с помощью методов рекомбинантных ДНК (см., например: US 4816567; US 5807715). При использовании гибридомного метода мышь или другое подходящее животное-хозяин, такое как хомячок, иммунизируют, как описано выше, для выявления лимфоцитов, которые продуцируют или способны к продукции антител, которые будут специфически связывать белок, используемый для иммунизации. Альтернативно, лимфоциты могут быть иммунизированы in vitro. После иммунизации лимфоциты выделяют и затем объединяют с клеточной линией миеломы, используя подходящее средство, вызывающее слияние клеток, например, полиэтиленгликоль, для образования клетки гибридомы (Goding, (1986) Monoclonal Antibodies: Principles and Practice, pp.59-103 Academic Press). Моноклональные антитела также могут быть выделены из фаговых библиотек антител с использованием технологий, описанных у Clackson и соавторов (1991) Nature, 352: 624-628; Marks et al (1991) J. Mol. Biol., 222: 581-597.
ДНК, которая кодирует антитело, может быть модифицирована с целью продукции полипептидов химерных или слитых антител, например, путем использования последовательностей константных доменов (CH и CL) тяжелой цепи и легкой цепи человека вместо гомологичных последовательностей мыши (US 4816567; и Morrison, et al., Proc. Natl Acad. Sci. USA, 81: 6851 (1984)), или посредством слияния кодирующей последовательности иммуноглобулина с полной или частичной, кодирующей последовательностью полипептида неиммуноглобулинового происхождения (гетерологичный полипептид). Последовательности полипептида неиммуноглобулинового происхождения можно использовать вместо константных доменов антитела, или их можно использовать вместо вариабельных доменов одного антигенсвязывающего сайта антитела, для создания химерного двухвалентного антитела, содержащего один антигенсвязывающий сайт, имеющий специфичность к одному антигену, и другой антигенсвязывающий сайт, имеющий специфичность к другому антигену.
«Нативные антитела» представляют собой обычно гетеротетрамерные гликопротеины, размером около 150000 дальтон, состоящие из двух идентичных дегких (L) цепей и двух идентичных тяжелых (Н) цепей. Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, тогда как количество дисульфидных связей различается между тяжелыми цепями различных изотипов иммуноглобулина. Каждая тяжелая и легкая цепь также имеет расположенные на равном расстоянии друг от друга межцепочечные дисульфидные мостики. Каждая тяжелая цепь имеет на одном конце вариабельный домен (VH), за которым следует ряд константных доменов. Каждая легкая цепь имеет вариабельный домен на одном конце (VL) и константный домен на другом конце. Константный домен легкой цепи связан с первым константным доменом тяжелой цепи, и вариабельный домен легкой цепи связан с вариабельным доменом тяжелой цепи. Полагают, что специфические аминокислотные остатки образуют сопряжение между вариабельными доменами легкой цепи и тяжелой цепи.
Моноклональные антитела в этом документе в частности включают «химерные» антитела, в которых часть тяжелой и/или легкой цепи является идентичной с или гомологичной к соответствующим последовательностям антител, полученным от определенных биологических видов или принадлежащих к определенному классу или подклассу антител, в то время как оставшаяся часть цепи (цепей) является идентичной или гомологичной соответствующим последовательностям в антителах, полученных от других биологических видов или принадлежащих другому классу или подклассу антител, а также фрагментов таких антител, при условии, что они проявляют необходимую биологическую активность (US 4816567; и Morrison et al (1984) Proc. Natl. Acad. Sci. USA, 81: 6851-6855). В настоящем документе представляющие интерес химерные антитела включают «приматизированные» антитела, содержащие антигенсвязывающие последовательности вариабельных доменов, полученные от приматов, не принадлежащих к человеческому роду (например, старосветская мартышка, человекообразная обезьяна, и др.), и последовательности константной области человека.
«Гуманизированные» формы отличных от человеческих (например, грызунов) антител представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из нечеловеческого антитела. Преимущественно, гуманизированные антитела представляют собой иммуноглобулины человека (реципиентное антитело), в котором остатки из гипервариабельной области реципиента заменены на остатки из гипервариабельной области биологического вида, отличного от человека, (донорное антитело), например, мыши, крысы, кролика или примата, не относящегося к человеческому роду, имеющего требуемую антительную специфичность, аффинность и потенциал. В ряде случаев, остатки каркасной области (FR) иммуноглобулина человека заменены соответствующими, отличными от человеческих, остатками. Кроме того, гуманизированные антитела могут содержать остатки, которые не обнаружены в реципиентном антителе или в донорном антителе. Эти модификации осуществлены для дополнительного совершенствования функциональной активности антител. В общем, гуманизированные антитела будут содержать по существу все, по меньшей мере, из одного, а обычно, двух вариабельных доменов, в которых все, или в основном все, из гипервариабельных петель соответствуют таковым нечеловеческого иммуноглобулина, и все, или в основном все, FR являются таковыми из последовательности человеческого иммуноглобулина. Гуманизированное антитело также необязательно будет содержать, по меньшей мере, часть константной области иммуноглобулина (Fc), обычно, иммуноглобулина человека. Фрагмент Fc содержит карбоксиконцевые части обеих Н-цепей, удерживаемых вместе дисульфидами. Эффекторные функции антител определены последовательностями в области Fc, которая также частично распознается рецепторами Fc (FcR), обнаруженными в некоторых типах клеток (Jones et al (1986) Nature 321: 522-525; Riechmann et al (1988) Nature 332: 323-329; Presta, (1992) Curr. Op. Struct. Biol. 2: 593-596; Verhoeyen et al (1988) Science, 239: 1534-1536; Sims et al (1993) J. Immunol. 151: 2296; Chothia et al (1987) J. Mol. Biol., 196: 901). В других способах используют определенную каркасную область, полученную из консенсусной последовательности всех легких или тяжелых цепей антител человека определенной подгруппы (Carter et al (1992) Proc. Natl. Acad. Sci. USA, 89: 4285; Presta et al (1993) J. Immunol. 151: 2623).
«Антитело человека» представляет собой такое антитело, которое имеет аминокислотную последовательность, соответствующую той, что принадлежит антителу, продуцируемому у человека, и/или было создано с использованием любой технологии для получения антител человека, как раскрыто в настоящем документе. Это определение антитела человека в частности включает гуманизированные антитела, содержащие антигенсвязывающего остатки нечеловеческого происхождения. Существуют трансгенные животные (например, мыши), которые способны в условиях иммунизации продуцировать полный набор антител человека при отсутствии продуцирования эндогенного иммуноглобулина. Например, было описано, что гомозиготная делеция гена области присоединения тяжелой цепи антитела (JH) В химерной и зародышевой линии мутантых мышей приводит к полному ингибированию продукции эндогенных антител. Перенос элемента гена иммуноглобулина зародышевой линии человека в такую зародышевую линию мутантной мыши приведет к продуцированию антител человека после антигенной стимуляции (Jakobovits et al (1993) Proc. Natl. Acad. Sci. USA, 90: 2551; Jakobovits et al (1993) Nature, 362: 255-258; Bruggemann et al (1993) Year in Immuno. 7: 33; US 5545806; US 5569825; US 5591669; US 5545807; и WO 97/17852).
Антитело со «зрелой аффинностью» имеет одно или несколько изменений в одной или нескольких своих CDR, что приводит к повышению аффинности антитела к антигену по сравнению с антителом, которое не обладает таким изменением (изменениями). Предпочтительные антитела со зрелой аффинностью будут иметь наномолярные или даже пикомолярные аффинности с антигеном-мишенью. Антитела со зрелой аффинностью продуцируют высокую аффинность посредством перестановки VH и VL доменов (Marks et al (1992) Bio/Technology 10: 779-783), или неспецифического мутагенеза остатков CDR и/или каркасной области (Barbas et al (1994) Proc Nat. Acad. Sci, USA 91: 3809-3813; Schicr et al (1995) Gene 169: 147-155; Yelton et al (1995) J. Immunol. 155: 1994-2004; Jackson et al (1995) J. Immunol. 154(7): 3310-9; и Hawkins et al (1992) J. Mol. Biol. 226: 889-896).
«Интактное антитело» в настоящем документе означает такое антитело, которое содержит домены VL и VH, а также константный домен легкой цепи (CL) и константные домены тяжелой цепи CH1, CH2 и CH3. Константные домены могут быть константными доменами с нативными последовательностями (например, константные домены с нативными последовательностями человека), или аминокислотные последовательности их вариантов. Интактное антитело может иметь одну или несколько «эффекторных функций», которые относятся к тем биологическим активностям, связанным с константной областью Fc антитела (нативная последовательность области Fc или аминокислотная последовательность варианта области Fc). Примеры эффекторных функций антитела включают связывание C1q; комплементзависимую цитотоксичность; связывание рецептора Fc; антителозависимую клеточноопосредованную цитотоксичность (ADCC); фагоцитоз; и даун-регуляцию рецепторов клеточной поверхности, таких как рецептор В-клетки и BCR.
Термин «вариант аминокислотной последовательности» относится к полипептидам, имеющим аминокислотные последовательности, которые до некоторой степени отличаются от нативной последовательности полипептида. Обычно, варианты аминокислотных последовательностей будут обладать, по меньшей мере, приблизительно 70% идентичной последовательностью с, по меньшей мере, одним рецепторсвязывающим доменом нативной последовательности полипептида или с, по меньшей мере, одним лигандсвязывающим доменом нативного рецептора, предпочтительно, они будут, по меньшей мере, на приблизительно 80%, более предпочтительно, по меньшей мере, на приблизительно 90% гомологичны с последовательностями рецептор- или лигандсвязывающих доменов. Варианты аминокислотных последовательностей имеют замены, делеции и/или вставки в некоторых положениях внутри аминокислотной последовательности нативной аминокислотной последовательности. Аминокислоты обозначаются посредством общепринятых обозначений, с ипользованием однобуквенного и трехбуквенного кодов.
«Идентичность последовательности» определяется как процентное содержание остатков в варианте аминокислотной последовательности, которые являются идентичными после выравнивания последовательностей и введения пропусков, при необходимости, для достижения максимального процента идентичности последовательности. В уровне техники хорошо известны методы и компьютерные программы для выравнивания последовательностей. Одной такой программой является «Align 2», разработанная компанией Genentech, Inc., которая была зарегистрирована ведомством по охране авторских прав Соединенных Штатов, Вашингтон (округ Колумбия) 20559, 10 Декабря 1991, и чей код встречается в PCT/US03/07209.
«Антителозависимая клеточноопосредованная цитотоксичность» и «ADCC» относятся к клеточноопосредованной реакции, при которой неспецифические цитотоксические клетки, экспрессирующие рецепторы Fc (FcR) (например, натуральные клетки-киллеры (NK), нейтрофилы и макрофаги) распознают связанное антитело с клеткой-мишенью и впоследствии вызывают лизис