Способ выявления мутации с.-53-2а>g в гене престина (slc26a5), вызывающей развитие несиндромальной аутосомно-рецессивной глухоты
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой способ выявления мутации c.-53-2A>G в гене SLC26A5, сопровождающийся развитием несиндромальной аутосомно-рецессивной глухоты. Способ включает выделение ДНК из лимфоцитов периферической крови методом фенольно-хлороформной экстракции. Проводят полимеразную цепную реакцию с возможностью проведения анализа флуоресценции по конечной точке. Амплифицируют одновременно два участка гена SLC26A5 в смеси двух пар последовательностей олигонуклеотидов с флуоресцентной меткой: CACCACAAAGAAGAGATG, TCAGCATGATCCATAGTAC, FAM-agtgtCacTagGggaaaa-BHQ-1, VIC-agtgtCacCagGggaaaa-BHQ-2, фланкирующих область с возможным содержанием мутации c.-53-2A>G в гене SLC26A5. Предложенное изобретение позволяет получить точный, объективный клинический диагноз наследственной аутосомно-рецессивной потери слуха. 1 ил., 2 табл., 2 пр.
Реферат
Изобретение относится к медицине, а именно к медицинской генетике и оториноларингологии, может быть использовано для диагностики врожденной наследственной глухоты у человека.
Общепопуляционная частота врожденной тугоухости и глухоты составляет 1 на 650-1000 новорожденных детей (Chaleshtori et. al., 2007). По прогнозам ВОЗ к 2020 году более 30% всей популяции земного шара будут иметь нарушения слуха. Данный прогноз указывает на отсутствие в перспективе снижения числа инвалидов по слуху в абсолютном и долевом выражении, как в Российской Федерации, так и в других странах, свидетельствуя о масштабе медицинской проблемы и ее социальной значимости, обусловленной влиянием нарушений слуха у детей на их речевое развитие, формирование интеллекта и личности ребенка. В вопросах этиологии и патогенеза заболевания остается много неясных аспектов, но считается, что примерно половина всех случаев врожденной глухоты имеет наследственное происхождение. Как следствие, правильное консультирование семей таких пациентов практически невозможно без применения ДНК-диагностики. Наследственная глухота относится к тем заболеваниям, в которых анамнестические и клинические данные представляют довольно скудный материал для постановки правильного диагноза с определением этиологии заболевания. Вместе с тем, своевременная и точная диагностика этого наследственного дефекта позволит наиболее качественно и в самые ранние сроки начинать реабилитационные мероприятия для обеспечения полноценной социальной адаптации лиц с наследственными дефектами слуха.
Преимущества предлагаемой разработки перед существующими аналогами заключаются в оптимальности разрабатываемых подходов ДНК-диагностики заболеваний, основанных на выявлении существующего своеобразия генофонда народов Волго-Уральского региона.
Согласно литературным данным, большинство случаев генетически детерминированной потери слуха наследуется по аутосомно-рецессивному типу (Hulser et al., 1997; Kammen-Jolly et al., 2000; Petit et al., 2001; Denoyelle F. et al., 1997; Piatto V.B. et al., 2003; Petersen at al., 2006; Alvarez et al., 2009; Vivero et al., 2010). Однако выраженная генетическая гетерогенность заболевания, а также большая ассортативность браков между глухими и слабослышащими зачастую не позволяет точно выяснить механизм наследования дефекта звуковосприятия, а также приводит к повышению случаев болезни, среди потомков пробанда. Наиболее частая форма наследственной глухоты - несиндромальная сенсоневральная тугоухость/глухота (HCHT) (Hulser et al., 1997; Kammen-Jolly et al., 2000; Lefebvre et al., 2000; Friedman et al., 2000; Petit et al., 2001; Gabriel et al., 2001; Dong et al., 2001; Houseman et al., 2001; Lerer et al., 2001; Nadjmabadi et al.; 2002, Mehl et. al, 2002, Nance, 2003; Cryns et. al., 2004; Morton et. al., 2006; Chalestori et. al., 2007; Batissoco et al, 2010; Bhalla et al., 2011). Среди всех идентифицированных генов, вовлеченных в функционирование системы звуковосприятия, наиболее значимыми являются гены белков-коннексинов 26 (GJB2), 30 (GJB6), 31 (GJB3), и гены митохондриальной ДНК 12SrRNA и tRNASER(UCN), вклад которых в развитие несиндромальных и некоторых синдромальных форм, по данным различных авторов, достигает 20-80% в различных этнических группах (Friedman et al., 2000; Petit et al., 2001; Cryns et. al., 2004; Smith et al., 2005; Petersen et. al., 2006). Однако у довольно большого числа семей, которые обращаются к врачу-генетику по поводу определения риска врожденных наследственных форм потери слуха у потомства, при проведении молекулярного исследования генов коннексинов и генов митохондриальной ДНК, не удается выявить генетический дефект, приводящий к потере слуха. По данным различных авторов, процент семей с невыявленными генетическими дефектами, приводящими к наследственным формам потери слуха, в зависимости от этноса, составляет, в среднем, около 40- 80% (Маркова с соавт., 2005; Hilgert et al., 2009; Таварткиладзе с соавт., 2010; Барашков с соавт., 2009; Preciado et al., 2010; Green et al., 2010; Близнец с соавт., 2012).
Известен способ детекции мутации c.-53-2A>G в гене престина (SLC26A5) посредством денатурирующей высокоэффективной жидкостной хроматографии (Albert S., Blons Н., Jonard L. et. al. SLC26A4 gene is frequently involved in nonsyndromic hearing impairment with enlarged vestibular aqueduct in Caucasian populations // European Journal of Human Genetics. 2006. №14, P. 773-779). Однако денатурирующая высокоэффективная жидкостная хроматография - достаточно дорогостоящий и сложный метод, который требует последующего ресеквенирования, и к тому же при данном методе довольно затруднительно выявлять однонуклеотидные замены, находящиеся в гомозиготном состоянии, поскольку в таких образцах затруднено образование гетеродимеров - показателей наличия мутации в образце.
Глубокое ресеквенирование - анализ, широко применяемый для детекции любых изменений нуклеотидной последовательности, был разработан Фредериком Сенгером в 1977 году и в настоящее время, после завершения проекта «Геном человека», широко используется для ресеквенирования нуклеотидной последовательности ДНК человека (Sanger F. Determination of nucleotide sequences in DNA // Biosci Rep.-2004. - V. 24(4-5). - P.237-253). Существенными недостатками этого метода являются его трудоемкость и необходимость дорогостоящего оборудования и реактивов, а также определенное количество времени (около 2 суток).
Прототипом изобретения является работа Teek с соавторами (Teek R, Oitmaa Е, Kruustuk К, et al. Splice variant IVS2-2A>G in the SLC26A5 (Prestin) gene in five Estonian families with hearing loss // Int J Pediatr Otorhinolaryngol. - 2009 -V.73(l). - P. 103-107). Основным недостатком ближайшего аналога являются его трудоемкость и необходимость в использовании дорогостоящего оборудования и реактивов.
Техническим результатом изобретения является упрощение способа и повышение точности определения мутации c.-53-2A>G в гене престина (SLC26A5) и сокращение времени исследования (до 2-х суток) посредством разработки аллельспецифической ПЦР в реальном времени с анализом флуоресцентной детекции в конечной точке амплификации у больных наследственной несиндромальной глухотой и у гетерозиготных носителей данной мутации. Преимуществом ПЦР с флуоресцентной детекцией является отсутствие необходимости проведения этапов рестрикции и электрофореза, что сводит риск контаминации и резко сокращает время и трудоемкость проведения анализа. Интерпретация результатов проводится с помощью программных средств реал-тайм амплификатора (Allelic Discrimination) в автоматическом режиме.
Указанный технический результат достигается тем, что в способе, включающем выделение ДНК из лимфоцитов периферической крови методом фенольно-хлороформной экстракции, проведение полимеразной цепной реакции в реальном времени с флуоресцентной детекцией, амплификацию фрагментов ДНК, содержащих мутацию c.-53-2A>G в гене престина (SLC26A5), амплифицируют в смеси двух пар последовательностей олигонуклеотидов, помеченных различными флуоресцентными красителями:
SLC26A5-IVS2-2-FJ, CACCACAAAGAAGAGATG,
SLC26A5-IVS2-2-RJ,TCAGCATGATCCATAGTAC,
SLC26A5-IVS2-2-FAM, FAM-agtgtCacTagGggaaaa-BHQ-l,
SLC26A5-IVS2-2-VIC,VIC-agtgtCacCagGggaaaa-BHQ-2,
(длина фрагмента 174 п.н.), фланкирующих область с возможным содержанием мутации c.-53-2A>G.
Способ осуществляется следующим образом.
ДНК выделяют из лимфоцитов периферической крови. В качестве консерванта используют раствор следующего состава: 0,48% лимонной кислоты, 1,32% цитрата натрия, 1,47% глюкозы. При заборе крови к 1 мл консерванта добавляют 4 мл венозной крови и хорошо перемешивают.
Для получения ДНК необходимой степени чистоты и достаточного молекулярного веса используется метод выделения ДНК из крови фенольно-хлороформной экстракцией, описанный Метью (Mathew С.С.The isolation of high molecular weight eucariotic DNA. // Methods in Molecular Biology /Ed. Walker J.M.Y.L.: Human Press. 1984. -V.2. - P.31-34).
1. Кровь в пробирке с консервантом тщательно перемешивается и переливается в центрифужный стакан объемом 50 мл, туда же добавляем 30 мл охлажденного лизирующего буфера, содержащего 320 мМ сахарозы, 1% раствор тритона Х-100, 5 мМ MgCl2, 10 мМ трис НСl (рН7,6).
2. Смесь центрифугируется 20 мин при 4000 об/мин.
3. Надосадочную жидкость сливают, к получившемуся осадку приливают 0,4 мл 10% SDS и протеиназу К (концентрация 10 мг/мл).
Смесь для лизиса оставляют на 16 часов в термостате при температуре 37°С.
Экстракцию ДНК осуществляют в следующем порядке:
4. К лизату добавляют 0,5 мл фенола, насыщенного 1М трис НСl до рН 7,8.
5. Смесь встряхивают на шейкере и центрифугируют 10 мин при 6000 об/мин.
6. Отбирают водную фазу, содержащую ДНК и неденатурированные белки.
7. Отобранную фазу обрабатывают смесью фенол-хлороформа (1:1), а затем хлороформом.
8. Препараты осаждают двумя объемами охлажденного этанола 96%.
9. Образовавшийся осадок ДНК растворяют в 1,5 мл деионизированной Н2О; раствор хранят при -20°С.
В дальнейшем полученную ДНК используют в качестве матрицы для полимеразной цепной реакции в реальном времени (ПЦР) для амплификации нужного фрагмента кодирующего региона гена SLC26A5. Подготовку образцов для ПЦР проводят в ламинарном боксе, с использованием специального комплекта пипеток и наконечников с аэрозольными фильтрами.
- Образцы ДНК перед проведением ПЦР полностью размораживаются при комнатной температуре. После размораживания тщательно перемешивается содержимое пробирок на вортексе с последующим центрифугированием.
- Измеряется концентрация образцов ДНК на спектрофотометре.
- Образцы ДНК разводятся деионизованной водой до оптимальной концентрации, необходимой для проведения реал-тайм ПЦР (30 нг/мкл).
Основные компоненты реакции:
1. Смесь для ПЦР (670 мМ Tris-HCl (рН 8,8); 0,1% Tween-20, 2 мМ dNTPs, 10 мМ специфичных праймеров, 5 мМ специфичных зондов).
2. Tag-полимераза
- Для ПЦР-анализа одного образца в амплификационную пробирку вносятся следующие компоненты реакции (таблица 1):
| Таблица 1 | |
| Компоненты реакционной смеси | |
| Деионизованная вода | 6,8 мкл |
| Смесь для ПЦР | 2,0 мкл |
| Tag-полимераза | 0,2 мкл |
| Исследуемый образец (30 нг ДНК /мкл) | 1,0 мкл |
| Суммарный объем | 10 мкл |
- Для ПЦР-анализа нескольких образцов следует подготовить реакционную смесь на необходимое количество проб. Для этого в отдельной стерильной пробирке смешать следующие компоненты ПЦР: деионизованную воду, смесь для ПЦР и Tag-полимеразу.
- Все компоненты перемешиваются на микроцентрифуге-вортексе, затем реакционную смесь разливают по амплификационным пробиркам или плашкам по 2 мкл в лунку или в пробирку.
- Вносят ДНК (1,0 мкл) в лунки плашки или в пробирки с учетом отрицательных контролей.
- Тщательно закрывают плашку или пробирки и ставят в реал-тайм ПЦР амплификатор.
Специфические последовательности олигонуклеотидных праймеров для детекции мутации c.-53-2A>G в гене SLC26A5 и их оптимальные концентрации в реакционной смеси, зонд, размер амплифицируемого фрагмента и температурный режим ПЦР указан в таблице 2.
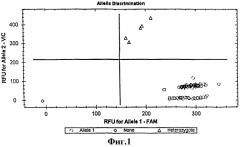
Детекцию результатов проводят на амплификаторах с возможностью проведения анализа флуоресценции по конечной точке - «Rotor-Gene» 3000/6000 («Corbet Research», Австралия); «iQCycler», «iQ5», «CFX96» («BioRad», США), ABI 7300/7500/7900 («Applied Biosystems», США). Время исследования составляет 2 дня. После прохождения ПЦР следует провести анализ кривых флуоресценции по отдельным лункам в окне «Расчет» раздела «Анализ данных» и анализ распределения генотипов в окне «Аллельная дискриминация» согласно протоколу используемого прибора. О наличии того или иного аллеля исследуемого локуса следует судить по росту флуоресценции соответствующих красителей FAM и VIC.
На фиг. 1 представлена структура вкладки «Аллельная дискриминация», а также представлено распределение генотипов по исследуемому локусу: значком Δ представлен генотип, содержащий мутацию c.-53-2A>G в гене SLC26A5 в гетерозиготном состоянии; значок о обозначает генотип без мутации, значок обозначает отрицательный контроль.
В качестве конкретных примеров обследовано в целом 204 больных с наследственными формами потери слуха, состоящих на учете в Республиканском сурдологическом центре Республиканской детской клинической больницы г.Уфы, членов их семей, а также здоровых доноров, проживающих в Волго-Уральском регионе.
Критерием включения в исследование был диагноз «Наследственная сенсоневральная тугоухость/глухота» (G11 по МКБ-10), установленный на основании клинических, лабораторно-инструментальных и молекулярно-генетических методов исследований в соответствии с современными диагностическими критериями, предлагаемыми Институтом глухоты и коммуникативных расстройств (г.Омаха, США) и рекомендованных в 2003 г. Европейской рабочей группой по наследственным нарушениям слуха GENDEAF (Stephens et al., 2001; Mazzoli et al., 2003). Диагноз глухоты или тугоухости устанавливался на основе данных тональной пороговой аудиометрии (аудиометр «GSI-61», Grason Stadler Instruments, USA), акустической импедансометрии (импедансометр «Zodiac 901», Дания) и регистрации отоакустической эмиссии (система «ILO 92», Otodynamics Ltd., Великобритания). В ходе исследования уточнялись данные об этнической принадлежности больных путем опроса и выяснения национальной принадлежности родителей до третьего поколения. Особое внимание уделялось установлению места рождения пробандов, их родителей и прародителей; выявлению кровнородственных браков в семьях обследованных пациентов. Согласно первичному анализу данных и исходя из диагностических критериев НСНТ, из общего числа случаев изолированной тугоухости/глухоты, были выделены несиндромальные сенсоневральные нарушения слуха с отягощенным по нарушенному звуковосприятию семейным анамнезом. Таким образом, в исследование вошли 204 семьи пациентов с НСНТ и 245 здоровых доноров из трех этнических групп (русские (82 человека), татары (80 человек) и башкиры (83 человека)) из Волго-Уральского региона.
Молекулярно-генетический анализ частоты мутации c.-53-2A>G в гене SLC26A5 проводился у больных, страдающих сенсоневральной тугоухостью третьей и четвертой степени и глухотой, предположительно наследственной этиологии.
На первом этапе исследований был проведен скрининг мутации с-53-2A>G в гене престина (SLC26A5) у 204 неродственных пациентов из Республики Башкортостан. У 8 пациентов (7 неродственных) данная мутация была выявлена в гетерозиготном состоянии, что составляет 3,4% всех обследованных семей с НСНТ. По этнической принадлежности пациенты с мутацией c.-53-2A>G распределились следующим образом: 6 русских и 1 татарин. У пяти пациентов с НСНТ русской этнической принадлежности мутация c.-53-2A>G (IVS2-2A>G) в гене SLC26A5 сочеталась с мутациями c.35delG (p.Glyl2fs) и p.Met34Thr в гене GJB2. У трех пациентов мутация c.35delG была идентифицирована в гомозиготном состоянии и у одного - в гетерозиготном. Мутация p.Met34Thr в гене GJB2 была выявлена у пациентки с НСНТ в гетерозиготном состоянии. У пациента татарской этнической принадлежности мутация c.-53-2A>G в гене SLC26A5 была выявлена с компаунд гетерозиготным состоянием мутаций c.235delC (p.Leu79fs) и c.314_327dell4 (p.K105fs) в гене GJB2. Таким образом, учитывая высокую частоту ассортативных браков между глухими индивидами (до 45%), достаточно легко объяснить сегрегацию мутантных аллелей в генах GJB2 и SLC26A5 среди больных из Республики Башкортостан. На основании этого анализа больным с мутациями c.35delG, c.235delC и c.314_327dell4 в гене GJB2 и c.-53-2A>G в гене SLC26A5 был поставлен диагноз - несиндромальная аутосомно-рецессивная потеря слуха. Следовательно, общий вклад идентифицированной у пациентов с НСНТ мутации c.-53-2A>G в гене SLC26A4 составил 1,7%. Далее были проанализированы здоровые доноры из популяционных выборок русских, татар и башкир - наиболее многочисленных этносов, живущих в Волго-Уральском регионе. Мутация c.-53-2A>G в гене SLC26A5 была идентифицирована в гетерозиготном состоянии у 3 русских и 1 татарина. Частота гетерозиготного носительства у русских составила 3,6% (3/80) и 1,25% (1/80) - у татар.
Таким образом, учитывая существование выраженных межпопуляционных различий в частоте и спектре мутаций гена SLC26A4, анализ генетической гетерогенности при несиндромальной аутосомно-рецессивной глухоте и тугоухости в отдельных регионах и этнических группах является актуальной проблемой медицинской генетики, необходимым условием при разработке оптимальных для данного региона подходов ДНК-диагностики наследственных форм потери слуха.
Пример 1. Больной Н.Е., 1991 год рождения, город Салават, Республика Башкортостан. Диагноз нейросенсорной двухсторонней глухоты установлен в 1991 году. В настоящее время пациент использует слуховой аппарат. Со стороны родителей и ближайших родственников - наследственность не отягощена. Нарушений слуха у родных пациента не выявлено. При молекулярно-генетическом тестировании у больного и его родителей было взято по 8 мл венозной крови с последующим выделением ДНК и проведена реал-тайм ПЦР с флуоресцентной детекцией мутации с-53-2A>G в гене SLC26A5 в реакционной смеси, содержащей 1,0 мкг геномной ДНК, соответствующее кол-во буфера, содержащего смесь для ПЦР (670 мМ Tris-HCl (рН 8,8); 0,1% Tween-20, 2 мМ dNTPs, 10 мМ специфичных праймеров, 5 мМ специфичных зондов, и Tag-полимеразу. Затем провели амплификацию ДНК в амплификаторе «CFX96» («BioRad», США) с возможностью проведения анализа флуоресценции по конечной точке согласно программе: начальная денатурация: 94°С - 2:00, 40 циклов амплификации: денатурация 95°С - 0:10, отжиг 58/60°С - 1:00. Исследование ДНК больного выявило гетерозиготное носительство с.-53-2A>G в гене SLC26A4. У пациента также была выявлена мутация c.35delG в гене GJB2. Вполне вероятно, что подобное сочетание мутаций могло привести к нарушению процесса звуковосприятия у данного пациента. Время исследования составило 2 дня.
Пример 2. Пациентка А.А., 1947 год рождения, город Учалы, Республика Башкортостан. Слух нормальный, беременность 8 недель. Со стороны мужа наследственность отягощена по врожденной глухоте. Также выявлены нарушения слуха у сына сестры пациентки. Больной был проведен амниоцентез и взята ворсина хориона. Также у супругов взяли по 8 мл венозной крови с последующим выделением ДНК и постановкой реакции реал-тайм ПЦР с флуоресцентной детекцией мутации c.-53-2A>G в гене SLC26A5. Затем провели амплификацию ДНК в амплификаторе «CFX96» («BioRad», США) с возможностью проведения анализа флуоресценции по конечной точке согласно программе: начальная денатурация: 94°С - 2:00, 40 циклов амплификации: денатурация 95°С - 0:10, отжиг 58/60°С - 1:00. Исследование ДНК больной выявило гетерозиготное носительство c.-53-2A>G в гене SLC26A5 у самой пациентки. При исследовании ДНК ворсины хориона была обнаружена мутация c.-53-2A>G в гене SLC26A5 в гомозиготном состоянии, что может свидетельствовать о повреждении звуковосприятия у плода.
В заключение необходимо отметить, что в связи с интенсивным накоплением знаний об основных этиологических, патогенетических механизмах на молекулярно-генетическом уровне, существенно расширяются возможности проведения дополнительных методов исследования, среди которых особенно актуальными становятся методы ДНК-диагностики. Поскольку они позволяют выяснить первопричину болезни, открытие патогенетических механизмов которого в дальнейшем значительно облегчает терапию заболевания. Полученные в ходе данного исследования результаты позволяют оценивать вероятность появления врожденной глухоты у детей из семей с отягощенной наследственностью. Установление с помощью молекулярно-генетических методов необратимого наследственного повреждения слуха с самого рождения позволяет правильно организовывать процесс реабилитации ребенка с повреждениями процесса звуковосприятия и снижать экономические затраты на проведение дорогостоящих диагностических процедур.
Способ выявления мутации c.-53-2A>G в гене SLC26A5, сопровождающийся развитием несиндромальной аутосомно-рецессивной глухоты, включающий выделение ДНК из лимфоцитов периферической крови методом фенольно-хлороформной экстракции, проведение полимеразной цепной реакции с возможностью проведения анализа флуоресценции по конечной точке, отличающийся тем, что амплифицируют одновременно два участка гена SLC26A5 в смеси двух пар последовательностей олигонуклеотидов с флуоресцентной меткой:SLC26A5-IVS2-2-FJ, CACCACAAAGAAGAGATG,SLC26A5-IVS2-2-RJ, TCAGCATGATCCATAGTAC,SLC26A5-IVS2-2-FAM, FAM-agtgtCacTagGggaaaa-BHQ-1,SLC26A5-IVS2-2-VIC, VIC-agtgtCacCagGggaaaa-BHQ-2,фланкирующих область с возможным содержанием мутации c.-53-2A>G в гене SLC26A5.