Cпособ мытья посуды
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и касается способа мытья посуды. Охарактеризованный способ заключается в обеспечении композиции для мытья посуды и посуды, нуждающейся в очистке, приведении указанной посуды в контакт с указанной композицией для мытья посуды при условиях, эффективно обеспечивающих очистку указанной посуды, где указанная композиция для мытья посуды содержит модифицированный субтилизин, где указанный модифицированный субтилизин, по меньшей мере, на 70% гомологичен последовательности AQSVPWGISRVQAPAAHNRGLTGSGVKVAVLDTGISTHPDLNIRGGASFVPGEPSTQDGNGHGTHVAGTIAALNNSIGVLGVAPNAELYAVKVLGASGSGSVSSIAQGLEWAGNNGMHVANLSLGSPSPSATLEQAVNSATSRGVLVVAASGNSGAGSISYPARYANAMAVGATDQNNNRASFSQYGAGLDIVAPGVNVQSTYPGSTYASLNGTSMATPHVAGAAALVKQKNPSWSNVQIRNHLKNTATSLGSTNLYGSGLVNAEAATR и содержит (i) замену G116V и, по меньшей мере, одну дополнительную мутацию или (ii) замену S126R. Представленное изобретение позволяет удалять белковые загрязнения на посуде с высокой эффективностью, является безопасным для потребителей и окружающей среды. 5 з.п. ф-лы, 2 табл., 2 ил., 6 пр.
Реферат
Настоящая заявка заявляет приоритет в отношении находящейся на рассмотрении временной патентной заявки США с регистрационным номером 60/831732.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение предлагает композиции протеаз, особенно хорошо подходящие для мытья посуды.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Обычно традиционные композиции для мытья посуды коммунального и промышленного назначения основаны на комбинации высокощелочных детергентов и хлорсодержащего отбеливателя для мытья и санитарной обработки посуды. Системы такого рода как правило эффективны для удаления отбеливающихся пятен. Однако они могут оказаться недостаточными для удаления загрязнений, содержащих белки, зачастую присутствующих на домашней посуде, посуде в больницах, кафетериях, на предприятиях общественного питания и т.д. Кроме того, композиции, содержащие высокощелочные детергенты и хлор, не считаются безопасными для потребителей и окружающей среды.
Предпринимались различные попытки производства композиций для мытья посуды, эффективных для удаления белковых загрязнений. Обычно эти композиции включают протеазы, активные в щелочных условиях (например, при pH не менее 9,5). Однако подобные композиции имеют значительные недостатки, так как затруднительно разработать рецептуру их получения в виде жидкости или геля, которые потребители обычно предпочитают в качестве моющих средств. Кроме того, щелочные композиции для мытья посуды часто рассматриваются как вещества, вызывающие раздражение.
Было предпринято несколько попыток получения композиций для мытья посуды с пониженным pH (например, pH ниже 9,5). Эти композиции безопасны для потребителей и окружающей среды и могут быть разработаны в форме жидкости или геля. Однако современные композиции для мытья посуды с пониженным pH оказались очень неэффективными при удалении белковых загрязнений, даже при введении в композиции для мытья посуды высоких концентраций ферментов (например, протеаз).
Следовательно, в данной области сохраняется потребность в композициях для мытья посуды, удаляющих белковые загрязнения на посуде с высокой эффективностью. Кроме того, сохраняется потребность в композициях для мытья посуды, которые более безопасны для потребителей и окружающей среды и находятся в форме, экономичной и легкой в использовании.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение предоставляет мутантные протеазы, проявляющие улучшенные свойства для применения в составе средств для мытья посуды. В некоторых предпочтительных вариантах осуществления, мутантные протеазы имеют не менее 70% гомологии с аминокислотной последовательностью сериновой протеазы PB92, имеющей следующую аминокислотную последовательность: H2N-AQSVPWGISRVQAPAAHNRGLTGSGVKVAVLDTGISTHPDLNIRGGASFVPGEPSTQDGNGHGTHVAGTIAALNNSIGVLGVAPNAELYAVKVLGASGSGSVSSIAQGLEWAGNNGMHVANLSLGSPSPSATLEQAVNSATSRGVLVVAASGNSGAGSISYPARYANAMAVGATDQNNNRASFSQYGAGLDIVAPGVNVQSTYPGSTYASLNGTSMATPHVAGAAALVKQKNPSWSNVQIRNHLKNTATSLGSTNLYGSGLVNAEAATR-COOH (SEQ ID №2). В дальнейших вариантах осуществления, мутантные протеазы имеют, по меньшей мере, 75%, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 95% или, по меньшей мере, 99% гомологию с SEQ ID №2. В каждом предпочтительном варианте осуществления, приведенном в данном тексте, мутантные протеазы снабжены улучшенными моющими характеристиками и/или повышенной стабильностью по сравнению с протеазой PB92 дикого типа.
В некоторых предпочтительных вариантах осуществления, настоящее изобретение предоставляет варианты протеаз с улучшенными моющими характеристиками, по сравнению с исходной протеазой. В некоторых особенно предпочтительных вариантах осуществления, ферменты включают таковые, обозначенные как 049, 045, 046, 047/048, 050, 051/052, 053, 054, 055/056, 057, 058, 059 и 060, имеющие замены, описанные в Таблице 1 данного текста. В дополнительных вариантах осуществления, настоящее изобретение предоставляет эти ферменты с дополнительными мутациями (например, заменами, вставками и/или делециями).
В некоторых особенно предпочтительных вариантах осуществления, настоящее изобретение предоставляет фермент, обозначенный как 049, имеющий нижеследующую аминокислотную последовательность:
AQSVPWGISR VQAPAAHNRG LTGSGVKVAV LDTGISTHPD LNIRGGASFV PGEPSTQDGN GHGTHVAGTI AALNNSIGVL GVAPNAELYA VKVLGASGSG SVSSIAQGLE WAGNNVMHVA NLSLGLQAPS ATLEQAVNSA TSRGVLVVAA SGNSGAGSIS YPARYANAMA VGATDQNNNR ASFSQYGAGL DIVAPGVNVQ STYPGSTYAS LNGTSMATPH VAGAAALVKQ KNPSWSNVQI RNHLKNTATS LGSTNLYGSG LVNAEAATR (SEQ ID №3).
Настоящее изобретение также предоставляет новые ферментативные моющие средства, содержащие протеолитические ферменты, среди которых содержится, по меньшей мере, одна мутантная протеаза, приведенная в данном тексте.
В дополнительных вариантах осуществления, настоящее изобретение предоставляет композиции средств для мытья посуды, включающие модифицированный субтилизин, где указанный субтилизин содержит, по меньшей мере, одну замену в последовательности, приведенную в SEQ ID №2, где каждое положение соответствует положению аминокислотной последовательности субтилизина BPN', и где замены выбраны из следующих положений: G118, S128, P129, S130 и S166.
В некоторых вариантах осуществления, модифицированный субтилизин содержит замены, сделанные в следующих положениях: G118, S128, P129 и S130. В некоторых предпочтительных вариантах осуществления, модифицированный субтилизин содержит мутацию G118V и, по меньшей мере, одну дополнительную мутацию. В некоторых особо предпочтительных вариантах осуществления, дополнительные мутации выбраны из группы, состоящей из S128F, S128L, S128N, S128R, S128V, P129E, P129L, P129M, P129N, P129L, P129Q, P129S, S130A, S130K, S130P, S130T, S130V и S166D. В еще более предпочтительных вариантах осуществления, модифицированный субтилизин содержит замены, сделанные в следующих положениях: S128, P129 и S130. В дополнительных предпочтительных вариантах осуществления, замены выбраны из группы, состоящей из S128C, S128R, P129Q, P129R, S130D и S130G. В некоторых особо предпочтительных вариантах осуществления, аминокислотная последовательность указанного модифицированного субтилизина приведенна в SEQ ID №3.
Настоящее изобретение также предоставляет варианты осуществления, включающие композиции для мытья посуды, содержащие модифицированный субтилизин, где указанный субтилизин содержит, по меньшей мере, одну замену в последовательности SEQ ID №2, где каждое положение соответствует положению аминокислотной последовательности субтилизина BPN', и где замена представляет собой S130T. Настоящее изобретение также предоставляет выделенную нуклеиновую кислоту, кодирующую модифицированный субтилизин, где указанный субтилизин содержит, по меньшей мере, две замены в последовательности, приведенной в SEQ ID №2, где каждое положение соответствует положению аминокислотной последовательности субтилизина BPN', и где замены выбраны из следующих положений: G118, S128, P129, S130 и S166. В некоторых вариантах осуществления, нуклеиновая кислота кодирует модифицированные субтилизины, содержащие замены, сделанные в следующих положениях: Gl18, S128, P129 и S130. В некоторых предпочтительных вариантах осуществления, нуклеиновая кислота кодирует модифицированные субтилизины, содержащие мутацию G118V и, по меньшей мере, одну дополнительную мутацию. В некоторых особо предпочтительных вариантах осуществления, нуклеиновая кислота далее содержит дополнительные мутации, выбранные из группы, состоящей из S128F, S128L, S128N, S128R, S128V, P129E, P129L, P129M, P129N, P129L, P129Q, P129S, S130A, S130K, S130P, S130T, S130V и S166D. В даже более предпочтительных вариантах осуществления, нуклеиновая кислота кодирует модифицированный субтилизин, содержащий замены, сделанные в следующих положениях: S128, P129 и S130. В некоторых дополнительных предпочтительных вариантах осуществления, нуклеиновая кислота содержит замены, выбранные из группы, состоящей из S128C, S128R, P129Q, P129R, S130D и S130G.
В некоторых особо предпочтительных вариантах осуществления, аминокислотная последовательность модифицированного субтилизина представляет собой последовательность, приведенную в SEQ ID №3. В некоторых дополнительных вариантах осуществления, настоящее изобретение предоставляет выделенную нуклеиновую кислоту, кодирующую аминокислотную последовательность, приведенную в SEQ ID №3.
В дополнительных вариантах осуществления, настоящее изобретение предоставляет векторы, содержащие, по меньшей мере, одну выделенную нуклеиновую кислоту, описанную выше. В дальнейших вариантах осуществления настоящее изобретение предоставляет векторы, содержащие, по меньшей мере, одну выделенную нуклеиновую кислоту, последовательность которой приведена выше. В дополнительных вариантах осуществления настоящее изобретение предоставляет клетки-хозяева, содержащие, по меньшей мере, один вектор, описанный выше.
Настоящее изобретение также предоставляет способы мытья посуды, включая этапы: обеспечение, по меньшей мере, одного модифицированного субтилизина, как описано выше, и посуды, нуждающейся в очистке; и приведение посуды в контакт, по меньшей мере, с одним модифицированным субтилизином в условиях, эффективных для обеспечения очистки посуды.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
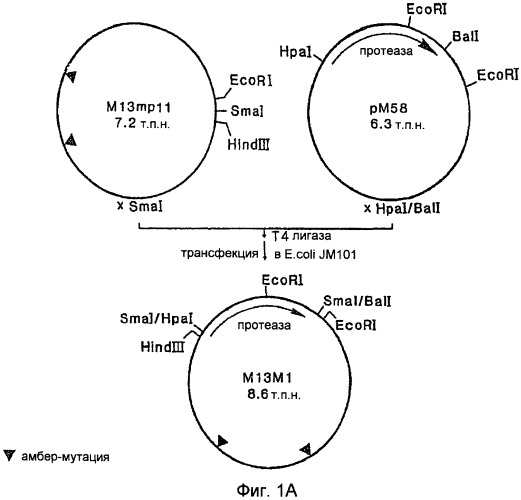
На Фигуре 1А показано конструирование мутантного вектора, содержащего ген протеазы PB92.
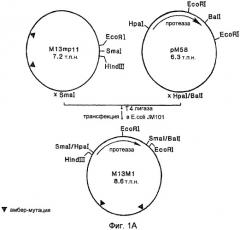
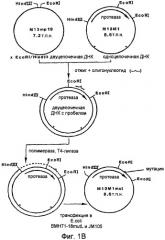
На Фигуре 1В представлено схематическое изображение процедуры введения мутации, применяемой в некоторых вариантах осуществления настоящего изобретения.
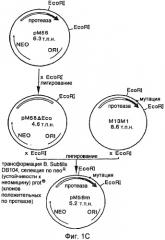
На Фигуре 1С показано конструирование экспрессионного вектора, содержащего мутантный ген протеазы PB92.
На фигуре 2 приведена нуклеотидная последовательность гена протеазы PB92 (SEQ ID № 1) и аминокислотная последовательность (SEQ ID №2) кодируемых пре-белка, про-белка и зрелого белка.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение предоставляет способы и композиции, содержащие, по меньшей мере, одну мутантную протеазу для применения при мытье посуды.
Если не указано иное, практическое применение настоящего изобретения подразумевает традиционные методики, обычно используемые в молекулярной биологии, микробиологии, очистке белков, белковой инженерии, секвенировании белков и ДНК, областях рекомбинантных ДНК и применении и разработке промышленных ферментов, которые все включены в круг компетентности в данной области техники. Все патенты, патентные заявки, статьи и публикации, упоминаемые в данном тексте как ранее, так и далее по тексту, настоящим безоговорочно введены в данный текст ссылкой.
Кроме того, приведенные в тексте рубрики не являются ограничением различных аспектов или вариантов осуществления изобретения, которые могут быть получены исходя из описания в целом. Следовательно, термины, чье определение приводится непосредственно ниже, полностью определены исходя из описания в целом. Тем не менее, с целью облегчения понимания изобретения, определения ряда терминов приводятся ниже.
Если в данном тексте не указано иное, все технические и научные термины, использованные здесь, имеют то же значение, что обычно подразумевается специалистами в области, к которой относится изобретение. Например, Singleton and Sainsbury, Dictionary of Microbiology and Molecular Biology, 2d Ed., John Wiley and Sons, NY (1994) и Hale and Markham, The Harper Collins Dictionary of Biology, Harper Perennial, NY (1991) обеспечили специалистов в данной области общими словарями многих терминов, применяемых в описании изобретения. Хотя любые методы и материалы, схожие либо эквивалентные описанным здесь, находят применение в практическом использовании настоящего изобретения, предпочтительными методами и материалами являются описанные в данном тексте. Соответственно, термины, определяемые непосредственно ниже, наиболее полно описаны исходя из определения в целом. Также, при использовании в данном тексте, формы единственного числа включают множественное число, если контекст в явном виде не указывает на иное. Если не указано иное, нуклеиновые кислоты пишутся слева направо в ориентации от 5' конца к 3' концу; аминокислотные последовательности пишутся слева направо в ориентации от амино- к карбокси-концу, соответственно. Должно быть понятно, что это изобретение не ограничено частными методиками, протоколами и описанными реагентами, так как они могут варьироваться в зависимости от контекста, при котором их применяет специалист в данной области.
Подразумевается, что каждое наибольшее численное ограничение, данное в этом описании, включает все меньшие численные пределы так же, как если бы данные меньшие численные ограничения были введены в текст в явном виде. Каждое наименьшее численное ограничение, данное в этом описании, включает все большие численные пределы так же, как если бы данные большие численные ограничения были введены в текст в явном виде. Каждый числовой интервал, данный в этом описании, будет включать все более узкие числовые интервалы, попадающие внутрь этого более широкого числового интервала так же, как если бы данные более узкие числовые интервалы были введены в текст в явном виде.
При использовании в данном тексте, термин "совместимый" обозначает, что моющие средства композиции не снижают ферментативную активность протеолитического(их) фермента(ов), предусмотренных данным текстом, до такой степени, что протеаза(ы) становится не достаточно эффективна(ы) при нормальных условиях использования. В качестве примеров далее в тексте приведены конкретные моющие вещества композиции.
При использовании в данном тексте, "эффективное количество фермента" относится к количеству фермента, необходимому для достижения ферментативной активности, требуемой при специализированном применении. Подобные эффективные количества легко устанавливаются специалистом в данной области и основаны на многих факторах, таких как применяемый конкретный вариант фермента, область применения в очистке, конкретный состав моющей композиции и требуется ли жидкая или твердая (например, гранулярная) композиция, и тому подобных факторов.
При использовании в данном тексте, термин "имеющий улучшенные свойства", применяемый в связи с термином "мутантный протеолитический фермент", относится к протеолитическим ферментам с улучшенным действием и/или повышенной стабильностью при той же силе действия, по сравнению с соответствующей протеазой дикого типа.
В некоторых особенно предпочтительных вариантах осуществления, улучшенные свойства выбраны из группы, состоящей из усиленного моющего действия и повышенной стабильности, равно как и комбинации усиленного моющего действия и повышенной стабильности.
При использовании в данном тексте, фраза "стабильность моющего средства" относится к стабильности композиции детергента. В некоторых вариантах осуществления, стабильность оценивается во время использования детергента, тогда как в других вариантах осуществления данный термин относится к стабильности композиции детергента во время хранения.
Термин "повышенная стабильность" применяется для обозначения лучшей стабильности мутантных(ой) протеаз(ы) в композиции во время хранения и/или лучшей стабильности в мыльной пене. В предпочтительных вариантах осуществления, мутантные(ая) протеазы(а) проявляют повышенную стабильность в мягких моющих средствах во время хранения и/или повышенную стабильность в мыльной пене, что включает устойчивость к окислительным агентам, комплексообразующим соединениям, саморазрушению, поверхностно-активным веществам и высокой щелочи, по сравнению с соответствующим ферментом дикого типа.
При использовании в данном тексте, фраза "устойчивость к протеолизу" относится к способности белка (например, фермента) противостоять протеолизу. Не подразумевается, что термин ограничен применением конкретной протеазы для оценки стабильности белка.
При использовании в данном тексте, "устойчивость к окислению" относится к способности белка функционировать в окислительных условиях. В частности, термин относится к способности белка функционировать в присутствии различных концентраций H2O2, перкислоты и других окислителей. Стабильность при различных окисляющих условиях может быть измерена либо традиционными методиками, известными специалистам в данной области, и/или способами, описанными в данном тексте. Индивидуальные изменения устойчивости к окислению подтверждаются, по меньшей мере, примерно 5% или более повышением или снижением (в большинстве вариантов осуществления, предпочтительно повышением) времени полужизни ферментативной активности, по сравнению с ферментативной активностью в отсутствие окислительных соединений.
При использовании в данном тексте, "pH стабильность" относится к способности белка функционировать при конкретном pH. Как правило, большинство ферментов имеют определенный интервал pH, при котором они работают. В дополнение к ферментам, которые функционируют при средних значениях pH (то есть pH около 7), существуют ферменты, способные работать в условиях очень высоких либо очень низких значений pH. Стабильность при различных значениях pH может быть измерена либо традиционными методиками, известными специалистам в данной области, и/или способами, описанными в данном тексте. Индивидуальные изменения в pH стабильности подтверждаются, по меньшей мере, примерно 5% или большим повышением или снижением (в большинстве вариантов осуществления, предпочтительно повышение) времени полужизни ферментативной активности, по сравнению с ферментативной активностью при оптимальном для данного фермента pH. Однако не предполагается, что настоящее изобретение ограничено каким-либо уровнем pH стабильности или интервалом pH.
При использовании в данном тексте, "термостабильность" относится к способности белка функционировать при конкретной температуре. Как правило, большинство ферментов имеют определенный интервал температур, при которых они работают. В дополнение к ферментам, которые функционируют при средних значениях температур (например, комнатной температуре), существуют ферменты, способные работать при очень высоких либо очень низких температурах. Термостабильность может быть измерена с помощью любой известной методики либо способами, описанными в данном тексте. Индивидуальные изменения термостабильности подтверждаются, по меньшей мере, примерно 5% или большим повышением или снижением (в большинстве вариантов осуществления, предпочтительно повышением) времени полужизни каталитической активности мутантного белка при воздействии данной температуры. Однако не предполагается, что настоящее изобретение ограничено каким-либо уровнем термостабильности или интервалом температур.
При использовании в данном тексте, термин "химическая стойкость" относится к устойчивости белка (например, фермента) к химическим реагентам, которые могут отрицательно влиять на его активность. В некоторых вариантах осуществления, подобные химические реагенты включают, но не ограничены ими, перекись водорода, перкислоту, анионные детергенты, катионные детергенты, неионные детергенты, хелатирующие агенты и им подобные. Однако не предполагается, что настоящее изобретение ограничено каким-либо конкретным уровнем химической стойкости либо интервалом химической стойкости.
При использовании в данном тексте, термины "очищенный" и "выделенный" относятся к удалению загрязнений из образца. Например, представляющий интерес фермент очищается удалением загрязняющих белков и других соединений в растворе или препарате, которые не являются ферментом, представляющим интерес. В некоторых вариантах осуществления, представляющие интерес рекомбинантные ферменты экспрессируются в бактериальных или грибных клетках-хозяевах, и эти представляющие интерес рекомбинантные ферменты очищаются удалением других компонентов клетки-хозяина; таким образом, в образце повышается процентное содержание полипептида представляющего интерес рекомбинантного фермента.
При использовании в данном тексте, "представляющий интерес белок" относится к белку (например, к ферменту или "представляющему интерес ферменту"), который анализируется, идентифицируется и/или модифицируется. В настоящем изобретении находят применение как природные, так и рекомбинантные (например, мутантные) белки.
При использовании в данном тексте, термин "белок" относится к любому соединению, включающему в себя аминокислоты и определенному как белок специалистами в данной области. Термины "белок", "пептид" и "полипептид" в данном тексте используются как взаимозаменяемые. В случае, когда пептид является частью белка, специалисты в данной области поймут использование термина по контексту.
При использовании в данном тексте, функционально и/или структурно схожие белки рассматриваются как "родственные белки". В некоторых вариантах осуществления, эти белки происходят из разных родов и/или видов, включая различия между классами организмов (например, бактериальный белок и белок грибов). В некоторых вариантах осуществления, эти белки происходят из разных родов и/или видов, включая различия между классами организмов (например, бактериальный фермент и фермент грибов). В дополнительных вариантах осуществления, родственные белки получены из одного и того же вида. В действительности, не предполагается, что настоящее изобретение ограничено родственными белками из какого-либо конкретного источника(ов). Кроме того, термин "родственные белки" охватывает гомологи по третичной структуре и гомологи по первичной последовательности (например, ферменты настоящего изобретения). В дальнейших вариантах осуществления, термин охватывает белки, которые иммунологически являются перекрестно реагирующими антигенами. При использовании в данном тексте, термин "производное" относится к белку, который получен из белка путем добавления (то есть, вставки) одной или более аминокислот к какому-либо или обоим C- и N-концам, замены в одной или более аминокислот в одном или нескольких положениях аминокислотной последовательности, и/или делеции одной или более аминокислот с какого-либо или обоих C- и N-концов, либо в одном или нескольких положениях аминокислотной последовательности, и/или вставки одной или более аминокислот в одном или нескольких положениях аминокислотной последовательности. Получение производного белка предпочтительно осуществляется путем модификации последовательности ДНК, которая кодирует природный белок, трансформации данной последовательности ДНК в подходящий организм-хозяин и экспрессии модифицированной последовательности ДНК для образования производного белка.
Родственные (и производные) белки составляют "вариантные белки". В некоторых предпочтительных вариантах осуществления, вариантные белки отличаются от родительского белка и других вариантов на малое количество аминокислотных остатков. Число отличающихся аминокислотных остатков может составлять один или более, предпочтительно 1, 2, 3, 4, 5, 10, 15, 20, 30, 40, 50 или более аминокислотных остатков. В некоторых предпочтительных вариантах осуществления, число отличающихся аминокислотных остатков между вариантами составляет от 1 до 10. В некоторых особо предпочтительных вариантах осуществления, аминокислотные последовательности родственных белков и особенно вариантных белков идентичны, по меньшей мере, на примерно 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98% или 99%. Дополнительно, при использовании в данном тексте, родственный белок или вариантный белок относится к белку, который отличается от другого родственного белка или родительского белка по числу выдающихся областей. Например, в некоторых вариантах осуществления, вариантные белки имеют 1, 2, 3, 4, 5 или 10 соответствующих выдающихся областей, которые отличаются от родительского белка.
В данной области техники известно несколько способов, пригодных для получения вариантов протеолитических ферментов настоящего изобретения, включая, но не ограничиваясь ими, насыщающий мутагенез, сканирующий мутагенез, инсерционный мутагенез, неспецифический мутагенез, сайт-специфический мутагенез и направленную эволюцию, равно как и различные иные подходы из области рекомбинантных ДНК.
При использовании в данном тексте, термин "экспрессионный вектор" относится к конструкции ДНК, содержащей последовательность ДНК, которая функционально связана с подходящей регуляторной последовательностью, способной обеспечить экспрессию ДНК в подходящем организме-хозяине. Подобные регуляторные последовательности включают промотор для обеспечения транскрипции, дополнительную последовательность оператора для контроля такой транскрипции, последовательность, кодирующую соответствующие сайты связывания рибосомы на мРНК и последовательности, контролирующие окончание транскрипции и трансляции. Вектор может представлять собой плазмиду, фаговую частицу или просто потенциальную геномную вставку. Будучи трансформирован в подходящий организм-хозяин, вектор может реплицироваться и функционировать независимо от генома хозяина либо, в некоторых случаях, может интегрироваться в геном. В данном описании, термины "плазмида", "экспрессионная плазмида" и "вектор" часто используются как взаимозаменяемые, так как в настоящее время плазмида является наиболее распространенной формой вектора. Однако подразумевается, что изобретение включает иные формы экспрессионных векторов, которые несут те же функции и которые уже известны либо станут известны в данной области техники.
В некоторых предпочтительных вариантах осуществления, ген протеазы лигируется с соответствующей экспрессионной плазмидой. Затем клонированный ген протеазы используется для трансформации или трансфекции клеток-хозяев с целью экспрессии гена протеазы. Данная плазмида может реплицироваться в организме-хозяине в случае, если она содержит хорошо известные элементы, необходимые для репликации плазмиды, либо плазмида может быть спроектирована для интеграции в хромосому хозяина. Для эффективной экспрессии гена имеются необходимые элементы (например, промотор, функционально связанный с представляющим интерес геном). В некоторых вариантах осуществления, эти необходимые элементы снабжены промотором, гомологичным промотору гена, при условии, что он распознается (то есть транскрибируется клеткой-хозяином), и терминатором транскрипции, который является либо экзогенным, либо снабжен эндогенной терминаторной областью гена протеазы. В некоторых вариантах осуществления, также включен ген селекции, такой как ген устойчивости к антибиотику, который обеспечивает непрерывное поддержание роста в культуре клеток-хозяев, несущих плазмиду, в среде с антибиотиком.
Следующий кассетный метод мутагенеза может применяться для облегчения конструирования вариантов протеаз настоящего изобретения, хотя другие способы также могут использоваться.
Во-первых, как описано в данном тексте, природный ген, кодирующий протеазу, получен и секвенирован полностью либо частично. Затем последовательность сканируется в поиске точек, в которые требуется ввести мутацию (делецию, вставку или замену) одной или более аминокислот в кодируемой протеазе. Последовательности, примыкающие к этой точке, анализируются на предмет наличия сайтов рестрикции, чтобы провести замену короткого участка гена на последовательность из пула (набора) олигонуклеотидов, при экспрессии это приведет к образованию различных мутантов. Подобные рестрикционные сайты предпочтительно должны быть уникальными в гене протеазы, что облегчит процедуру замены сегмента. Однако может применяться и какой-либо удобный сайт рестрикции, который не слишком часто встречается на протяжении последовательности гена, что при рестрикции приведет к образованию нескольких фрагментов, которые затем могут быть собраны в правильной последовательности. Если на удобном расстоянии от выбранной точки (от 10 до 15 нуклеотидов) нет сайтов рестрикции, подобные сайты получаются заменой нуклеотидов в гене таким образом, что не нарушается рамка считывания и не заменяется кодируемая аминокислота в конечной конструкции. Мутация гена с целью изменения его последовательности до соответствия требуемой последовательности осуществляется методом удлинения затравки с помощью системы фага М13 согласно распространенным методикам. Задача определения местоположения подходящих примыкающих областей и анализа изменений, требуемых для получения последовательностей двух удобных сайтов рестрикции, выполняется рутинно с применением знаний о вырожденности генетического кода, рестрикционной карты гена и большого количества различных ферментов рестрикции. Обратите внимание, что если доступен удобный сайт рестрикции в примыкающей области, то вышеописанный метод может потребоваться только при работе с примыкающими областями, которые подобный сайт не содержат.
Как только клонирована природная и/или синтетическая ДНК, сайты рестрикции, примыкающие к положениям, которые будут мутированы, разрезаются узнающими эти сайты ферментами рестрикции, и в ген лигируется ряд олигонуклеотидных кассет с концами, комплементарными полученным в исходной ДНК гена. Процедура мутагенеза упрощается при использовании этого метода, так как все олигонуклеотиды могут быть синтезированы с одинаковыми сайтами рестрикции, и не требуется синтетических линкеров для создания сайтов рестрикции.
При использовании в данном описании, термин "соответствующий" относится к остатку на пронумерованном положении в белке или пептиде или остатку, который аналогичен, гомологичен или эквивалентен пронумерованному остатку в белке или пептиде.
При использовании в данном тексте, термин "соответствующая область", как правило, относится к аналогичному положению на протяжении последовательности родственных белков или родительского белка.
Термины "кодирующая молекула нуклеиновой кислоты", "кодирующая последовательность нуклеиновой кислоты", "кодирующая последовательность ДНК" и "кодирующая ДНК" относятся к порядку или последовательности дезоксирибонуклеотидов на протяжении цепи дезоксирибонуклеиновой кислоты. Порядок этих дезоксирибонуклеотидов определяет порядок аминокислот на протяжении полипептидной (белковой) цепи. Таким образом, последовательность ДНК кодирует аминокислотную последовательность.
При использовании в данном тексте, термин "аналогичная последовательность" относится к последовательности внутри белка, обеспечивающей схожую функцию, третичную структуру и/или содержащую консервативные остатки, что и представляющий интерес белок (то есть обычно исходный представляющий интерес белок). Например, область антигенной детерминанты, которая содержит структуры альфа-спирали или бета-слоя, при замене аминокислот в аналогичной последовательности предпочтительно сохранит ту же специфическую структуру. Термин также относится к нуклеотидным последовательностям, как и к аминокислотным последовательностям. В некоторых вариантах осуществления, аналогичные последовательности разработаны таким образом, что замена аминокислот приводит к образованию варианта фермента с той же или улучшенной функцией. В некоторых предпочтительных вариантах осуществления, третичная структура и/или консервативные остатки аминокислот в представляющем интерес белке расположены внутри или около представляющего интерес сегмента или фрагмента. Таким образом, в случае если сегмент или фрагмент содержит, например, структуры альфа-спирали или бета-слоя, при замене аминокислот предпочтительно сохранится данная специфическая структура.
При использовании в данном тексте, термин "гомологичный белок" относится к белку (например, протеазе), который обладает схожей активностью и/или структурой с представляющим интерес белком (например, протеазой из другого источника). Не подразумевается, что гомологи обязательно родственны в эволюционном смысле. Таким образом, предполагается, что термин охватывает одинаковые или схожие ферменты (то есть на основе структуры и функции), полученные из различных видов. В некоторых предпочтительных вариантах осуществления, целесообразно идентифицировать гомолог, имеющий четвертичную, третичную и/или первичную структуры, схожие с таковыми представляющего интерес белка, так как замена сегмента или фрагмента в представляющем интерес белке на аналогичный сегмент гомолога снизит разрушающее воздействие замены. В некоторых вариантах осуществления, гомологичные белки вызывали схожий иммунологический ответ с представляющим интерес белком.
При использовании в данном тексте, термин "гомологичные гены" относится, по меньшей мере, к двум генам из разных видов, чьи гены соответствуют друг другу и которые являются идентичными либо очень схожими. Термин охватывает гены, которые разделены видообразованием (то есть развитием нового вида) (например, ортологичные гены), равно как и гены, которые были разделены генетической дупликацией (например, паралогичные гены). Эти гены кодируют "гомологичные белки".
При использовании в данном тексте, термины "ортолог" и "ортологичные гены" относятся к генам разных видов, которые эволюционировали из общего предкового гена (то есть гомологичные гены) при видообразовании. Обычно ортологи сохраняют ту же функцию в ходе эволюции. Идентификация ортологов находит применение в достоверном прогнозировании функции гена в новых секвенированных геномах.
При использовании в данном тексте, термины "паралог" и "паралогичные гены" относятся к генам, которые образовались путем дупликации (удвоения) внутри генома. В то время как ортологи сохраняют свою функцию в ходе эволюции, паралоги приобретают новые функции, даже если некоторые функции часто взаимосвязаны с исходной. Примеры паралогичных генов включают, но не ограничены ими, гены, кодирующие трипсин, химотрипсин, эластазу и тромбин, которые все являются сериновыми протеазами и сосуществуют в одних и тех же видах организмов.
При использовании в данном тексте, белки "дикого типа" и "природные" представляют собой белки, встречающиеся в природе. Термины "последовательность дикого типа" и "ген дикого типа" в данном тексте употребляются как взаимозаменяемые для обозначения последовательности, встречающейся в природе или содержащейся в клетке-хозяине в природе. В некоторых вариантах осуществления, последовательность дикого типа обозначает представляющую интерес последовательность, представляющую собой исходный материал для проекта белковой инженерии. Гены, кодирующие природные белки, могут быть получены традиционными методами, известными специалистам в данной области. Данные методы, как правило, включают синтез меченых проб на основе предполагаемых последовательностей областей, кодирующих представляющий интерес белок, приготовление геномных библиотек из организмов, экспрессирующих данный белок, и скрининг библиотек в поисках представляющего интерес гена с помощью гибридизации с пробами. Затем положительные по результатам гибридизации клоны картируются и секвенируются.
Термин "рекомбинантная молекула ДНК", при использовании в данном тексте, относится к молекуле ДНК, которая содержит сегменты ДНК, соединенные вместе с помощью методик молекулярной биологии.
Термин "рекомбинантный олигонуклеотид" относится к олигонуклеотиду, созданному при помощи молекулярно-биологических манипуляций, включая, но не ограничиваясь этим, лигирование двух или более олигонуклеотидных последовательностей, полученных при расщеплении ферментами рестрикции полинуклеотидной последовательности, синтез олигонуклеотидов (например, синтез праймеров или олигонуклеотидов) и тому подобное.
Степень гомологии между последовательностями может быть определена с применением любого подходящего метода, известного в данной области (см., к примеру, Smith and Waterman, Adv. Appl. Math., 2:482 [1981]; Needleman and Wunsch, J. Mol. Biol., 48:443 [1970]; Pearson and Lipman, Proc. Natl. Acad. Sci. USA 85:2444 [1988]; такие программы, как GAP, BESTFIT, FASTA и TFASTA в Wisconsin Genetics Software Package (Genetics Computer Group, Madison, WI); и Devereux et al., Nucl. Acid Res., 12:387-395 [1984]).
Например, PILEUP является полезной программой для определения уровня гомологии последовательностей. PILEUP создает множественное выравнивание последовательностей из группы родственных последовательностей, используя прогрессивные парные выравнивания. Эта программа также может построить график направляющего дерева, показывающий группирование взаимосвязей, применяемое для получения выравнивания. PILEUP использует упрощенную версию прогрессивного способа выравнивания представленного авторами Feng и Doolittle (Feng and Doolittle, J. Mol. Evol., 35:351-360 [1987]). Этот способ похож на способ, описанный авторами Higgins