Комбинации конъюгата анти-her2-антитело-лекарственное средство и химиотерапевтических средств и способы применения
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к онкологии, и может быть использована для лечения гиперпролиферативных нарушений. Для этого вводят терапевтическую комбинацию в виде комбинированной композиции или поочередно млекопитающему. Терапевтическая комбинация содержит трастузумаб-MCC-DM1 и химиотерапевтическое средство, выбранное из GDC-0941 и GNE-390. Фармацевтическая композиция для лечения гиперпролиферативного нарушения содержит трастузумаб-MCC-DM1 и химиотерапевтическое средство, выбранное из GDC-0941 и GNE-390. Группа изобретений обеспечивает синергический эффект при введении терапевтической комбинации: конъюгата антитело-лекарственное средство трастузумаба-MCC-DM1 и химиотерапевтических средств: GDC-0941 и GNE-390. 2 н. и 14 з.п. ф-лы, 40 ил., 5 пр., 21 табл.
Реферат
Релевантные заявки
По данной непредварительной заявке, поданной согласно 37 CFR § 1.53(b) испрашивается приоритет согласно 35 USC § 119(e) предварительной заявки на патент США № 61/037410, поданной 18 марта 2008 г., которая полностью включена в данный документ посредством ссылки.
Область техники, к которой относится изобретение
Изобретение главным образом относится к фармацевтическим комбинациям соединений, обладающим активностью в отношении гиперпролиферативных нарушений, таких как злокачественная опухоль. Также изобретение относится к способам применения комбинаций соединений для диагностики или лечения клеток млекопитающих в условиях in vitro, in situ и in vivo, или ассоциированных патологических состояний.
Уровень техники
HER2 (ErbB2) рецептор тирозинкиназы является членом семейства рецепторов эпидермальных факторов роста (EGFR) трансмембранных рецепторов. Сверхэкспрессию HER2 отмечают примерно в 20% злокачественных опухолей молочной железы человека, и она ассоциируется с агрессивным ростом и неблагоприятным прогнозом для пациенток с данными опухолями (Slamon et al., 1987, Science, 235:177-182).
Трастузумаб (номер по CAS 180288-69-1, ГЕРЦЕПТИН®, huMAb4D5-8, rhuMAb HER2, Genentech) представляет собой вариант рекомбинантного, полученного из ДНК гуманизированного, IgG1 каппа, моноклонального антитела мышиного антитела к HER2, которое избирательно связывается с высокой аффинностью в клеточном тесте (Kd=5 нМ) с внеклеточным доменом белка рецептора 2 человеческого эпидермального фактора роста, HER2 (ErbB2) (патент США № 5677171; патент США № 5821337; патент США № 6054297; патент США № 6165464; патент США № 6339142; патент США № 6407213; патент США № 6639055; патент США № 6719971; патент США № 6800738; патент США № 7074404; Coussens et al., 1985, Science, 230:1132-1139; Slamon et al., 1989, Science, 244:707-712; Slamon et al., 2001, New Engl. J. Med., 344:783-792). Трастузумаб содержит человеческие каркасные области с определяющими комплементарность областями мышиного антитела (4D5), которое связывается с HER2. Трастузумаб связывается с антигеном HER2 и таким образом ингибирует рост опухолевых клеток. В тестах в условиях in vitro и на животных было показано, что трастузумаб ингибирует пролиферацию человеческих опухолевых клеток со сверхэкспрессией HER2 (Hudziak et al., 1989, Mol. Cell Biol., 9:1165-1172; Lewis et al., 1993, Cancer Immunol. Immunother: 37:255-63; Baselga et al., 1998, Cancer Res., 58:2825-2831). Трастузумаб является медиатором антителозависимой клеточной цитотоксичности, ADCC (Lewis et al., 1993, Cancer Immunol. Immunother., 37(4):255-263; Hotaling et al., 1996, [abstract]. Proc. Annual Meeting Am. Assoc. Cancer Res., 37:471; Pegram M.D. et al., 1997, [abstract]. Proc. Annual Meeting Am. Assoc. Cancer Res., 38:602; Sliwkowski M. et al., 1999, Seminars in Oncology, 26(4), Suppl. 12:60-70; Yarden Y. and Sliwkowski M., 2001, Nature Reviews: Molecular Cell Biology, Macmillan Magazines, Ltd., Vol. 2:127-137).
Герцептин® был разрешен к применению в 1998 для лечения пациенток с метастатическими злокачественными опухолями молочной железы со сверхэкспрессией ErbB2 (Baselga et al., 1996, J. Clin. Oncol., 14:737-744), которые до этого получали интенсивную противоопухолевую терапию, и с того времени его применили на более чем 300000 пациентках (Slamon D.J. et al., N. Engl. J. Med., 2001, 344:783-92; Vogel C.L. et al., J. Clin. Oncol., 2002, 20:719-26; Marty M. et al., J. Clin. Oncol., 2005, 23:4265-74; Romond E.H. et al., Т N. Engl. J. Med., 2005, 353:1673-84; Piccart-Gebhart M.J. et al., N. Engl. J. Med., 2005, 353:1659-72; Slamon D. et al., [abstract]. Breast Cancer Res. Treat., 2006, 100 (Suppl. 1):52). В 2006 г. FDA разрешила герцептин® (трастузумаб, Genentech Inc.) к применению в качестве составного компонента в схеме лечения, содержащей доксорубицин, циклофосфамид и паклитаксел, для адъювантного лечения пациенток с HER2-положительной, метастатической злокачественной опухолью молочной железы. Несмотря на то, что герцептин®, разработанный для пациенток с HER2-положительными опухолями, обеспечивал более высокий терапевтический эффект по сравнению с одной химиотерапией, в конечном итоге у всех пациенток с HER2-положительной метастатической злокачественной опухолью молочной железы (MBC) имело место прогрессирование заболевания на доступных лекарственных средствах. Оставались возможности для улучшения эффективности в лечении пациенток с МВС. Несмотря на различные механизмы действия трастузумаба, у ряда пациенток, подвергшихся лечению трастузумабом, не было ответа на лечение или ответ был остановлен после положительного периода лечения. Некоторые HER2+ (HER2-положительные) опухоли не отвечали на лечение герцептином® и у большинства пациенток, у которых наблюдали ответ опухолей, в конечном итоге имело место прогрессирование заболевания. В клинике имеется существенная потребность в разработке дополнительных, направленных на HER2 противоопухолевых средств для лечения пациентов с опухолями, сверхэкспрессирующими HER2, или с другими заболеваниями, ассоциированными с экспрессией HER2, которые не отвечают или слабо отвечают на лечение герцептином®.
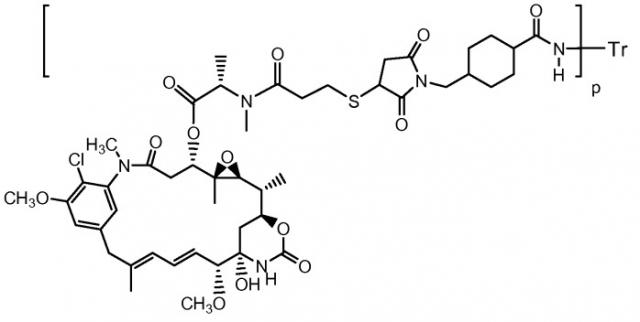
Альтернативным подходом для антитело-направленной терапии является применение антител для доставки цитотоксических лекарственных средств специфически в антиген-экспрессирующие опухолевые клетки. Майтансиноиды, производные антимитотического средства майтансина, связываются с микротрубочками аналогично лекарственным средствам на основе алкалоидов барвинка (Issell B.F. et al., 1978, Cancer Treat. Rev., 5:199-207; Cabanillas F. et al., 1979, Cancer Treat. Rep., 63:507-509). Конъюгаты антитело-лекарственное средство (ADC), состоящие из майтансиноида DM1, связанного с трастузумабом, проявляют высокую противоопухолевую активность на HER2-экспрессирующих чувствительных к трастузумабу и резистентных к трастузумабу линиях опухолевых клеток и на моделях ксенотрансплантатов злокачественной опухоли молочной железы человека. Эффективность конъюгата майтансиноидов, связанных с мышиным антителом против HER2, ТА.1 через линкер МСС, в 200 раз выше по сравнению с соответствующим конъюгатом с дисульфидным линкером (Chari et al., 1992, Cancer Res., 127-133). Конъюгаты антитело-лекарственное средство (ADC), состоящие из майтансиноида, DM1, связанного с трастузумабом, проявляют высокую противоопухолевую активность на чувствительных к трастузумабу и резистентных к трастузумабу линиях опухолевых клеток и на моделях ксенотрансплантатов злокачественной опухоли молочной железы человека. В настоящее время конъюгат трастузумаб-MCC-DM1 (T-DM1) проходит фазу II клинических испытаний у пациентов, которые устойчивы к лечению препаратами, направленными на HER2 (Beeram et al., 2007, «A phase I study of trastuzumab-MCC-DM1 (T-DM1), a first-in-class HER2 antibody-drug conjugate (ADC) in patients (pts) with HER2+ metastatic breast cancer (BC)», American Society of Clinical Oncology 43rd:June 02 (Abs 1042; Krop et al., European Cancer Conference ECCO, Poster 2118, September 23-27, 2007, Barcelona; патент США № 7097840; заявка на патент США № 2005/0276812; заявка на патент США № 2005/0166993).
Комбинированная терапия, в которой используют два или несколько лекарственных средств по определенной схеме или в определенной форме введения, как правило, имеет одну или несколько целей: (i) снижение частоты возникновения приобретенной резистентности объединением лекарственных средств с минимальной перекрестной резистентностью, (ii) снижение дозировок лекарственных средств, которые не являются токсичными, и имеют аналогичный терапевтический профиль для достижения эффективности с проявлением меньших побочных эффектов, т.е. увеличением терапевтического индекса, (iii) сенсибилизация клеток к воздействию одного лекарственного средства через действие другого лекарственного средства, посредством изменения стадии клеточного цикла или способности к росту и (iv) достижение повышенной эффективности при использовании аддитивного действия или несколько чем аддитивного действия, эффектов в биологической активности двух лекарственных средств (Pegram M. et al., 1999, Oncogene, 18:2241-2251; Konecny G. et al., 2001, Breast Cancer Res. and Treatment, 67:223-233; Pegram M. et al., 2004, J. Nat. Cancer Inst., 96(10):739-749; Fitzgarald et al., 2006, Nature Chem. Biol., 2(9):458-466; Borisy et al., 2003, Proc. Natl. Acad. Sci., 100(13):7977-7982).
Аддитивность Леве (Chou T.C. and Talalay P., 1977, J. Biol. Chem., 252:6438-6442; Chou T.C. and Talalay P., 1984, Adv. Enzyme Regul., 22:27-55; Berenbaum M.C., 1989, Pharmacol. Rev., 41:93-141) и независимость/синергия Блисса (Bliss C.I., 1956, Bacteriol. Rev., 20:243-258; Greco et al., 1995, Pharmacol. Rev., 47:331-385) являются методами, применяемыми для расчета предполагаемого взаимоотношения доза-эффект при комбинированной терапии по сравнению с монотерапией, основанные на таких параметрах, как IC50, доза лекарственного средства, необходимая для ингибирования 50% мишени и равная Ki в наиболее простом случае.
Сообщалось о применении антител-ингибиторов димеризации HER2 и ингибиторов EGFR для комбинированной терапии рака (заявка на патент США № 2007/0020261). Трастузумаб-MCC-DM1 (T-DM1) и пертузумаб по отдельности проявили эффективность на пациентках с MBC, и было показано, что комбинация пертузумаба и трастузумаба является активной у пациенток с HER-положительными MBC (Baselga J. et al., «A Phase II trial of trastuzumab and pertuzumab in patients with HER2-positive metastatic breast cancer that had progressed during trastuzumab therapy: full response data», European Society of Medical Oncology, Stockholm, Sweden, September 12-16, 2008).
Сущность изобретения
Изобретение главным образом относится к конъюгату анти-HER2-антитело-лекарственное средство, трастузумабу-МСС-DM1, который вводят в комбинации с одним или несколькими химиотерапевтическими средствами, для подавления роста опухолевых клеток. Некоторые комбинации трастузумаба-МСС-DM1 и химиотерапевтического средства проявляют синергическое действие в подавлении роста опухолевых клеток в условиях in vitro и in vivo. Комбинации и способы по изобретению могут быть пригодными при лечении гиперпролиферативных нарушений, таких как злокачественная опухоль. Комбинации могут ингибировать рост опухолей у млекопитающих и могут быть пригодными для лечения людей со злокачественными опухолями.
В одном аспекте изобретение относится к способу лечения гиперпролиферативного нарушения, включающему введение терапевтической комбинации в виде комбинированной композиции или поочередно млекопитающему, в котором терапевтическая комбинация содержит терапевтически эффективное количество трастузумаба-МСС-DM1 и терапевтически эффективное количество химиотерапевтического средства, выбранного из антитела-ингибитора димеризации HER2, антитела к VEGF, 5-FU, карбоплатина, лапатиниба, ABT-869, доцетаксела, GDC-0941 и GNE-390.
Терапевтически эффективное количество трастузумаба-МСС-DM1 и терапевтически эффективное количество химиотерапевтического средства можно вводить в виде комбинированной композиции или поочередно.
Также изобретение относится к способам применения композиций для диагностики или лечения клеток млекопитающих, организмов в условиях in vitro, in situ и in vivo, или ассоциированных патологических состояний.
Также изобретение относится к способам, в которых введение терапевтической комбинации приводит к синергическому эффекту.
Еще один аспект изобретения относится к фармацевтическим композициям, содержащим трастузумаб-МСС-DM1, химиотерапевтическое средство, выбранное из антитела-ингибитора димеризации HER2, антитела к VEGF, 5-FU, карбоплатина, лапатиниба, ABT-869, доцетаксела, GDC-0941 и GNE-390; и один или несколько фармацевтически приемлемых носителей, регуляторов сыпучести, разбавителей или наполнителей.
Еще один аспект изобретения относится к способам лечения гиперпролиферативного заболевания или нарушения, включающим введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективных количеств трастузумаба-МСС-DM1 и химиотерапевтического средства. Трастузумаб-МСС-DM1 и химиотерапевтическое средство можно формулировать совместно для введения в комбинации в виде фармацевтической композиции или их можно вводить поочередно (чередующиеся, последовательные введения) в виде терапевтической комбинации. В одном варианте осуществления T-DM1 вводят инфузией, и химиотерапевтическое средство вводят перорально.
Еще один аспект изобретения относится к способам прогноза эффективных лекарственных комбинаций в отношении эффективности в условиях in vivo, где комбинации содержат трастузумаб-МСС-DM1 и противоопухолевое, широко применяемое химиотерапевтическое средство. Данные по эффективности, полученные в опытах по оценке пролиферации клеток в условиях in vitro и на опухолевых ксенотрансплантатах в условиях in vivo, подвергают качественному и количественному анализу. Методы количественного анализа могут быть основаны на принципе медианного эффекта Chou&Talalay и изоболограммах, с помощью которых определяют значение комбинационного индекса (CI) для установления синергизма, антагонизма или аддитивного эффекта, или они могут быть основаны на независимости отклонения Блисса.
Еще один аспект изобретения относится к способу применения терапевтической комбинации по изобретению для лечения у млекопитающего заболевания или состояния, такого как злокачественная опухоль, включающего заболевание, которое модулируется HER2 или KDR9 (рецептором 1 VEGF).
Еще один аспект изобретения относится к применению терапевтической комбинации по изобретению в производстве лекарственного средства для лечения у млекопитающего заболевания или состояния, такого как злокачественная опухоль, включающего заболевание, которое модулируется HER2 или KDR9 (рецептором 1 VEGF).
Еще один аспект изобретения относится к изделиям или наборам, содержащим трастузумаб-МСС-DM1, химиотерапевтическое средство, контейнер и необязательно вкладыш в упаковке или этикетку, с описанием лечения.
Еще один аспект изобретения относится к способу определения соединений для применения в комбинации для лечения злокачественной опухоли, включающему: (а) введение терапевтической комбинации трастузумаба-МСС-DM1 и химиотерапевтического средства, выбранного из антитела-ингибитора димеризации HER2, антитела к VEGF, 5-FU, карбоплатина, лапатиниба, ABT-869, доцетаксела, GDC-0941 и GNE-390 в опухолевую клеточную линию в условиях in vitro и (b) определение синергического или не синергического эффекта.
Дополнительные преимущества и новые признаки данного изобретения будут частично приведены в последующем описании, и частично станут понятными специалистам в данной области при ознакомлении с последующей заявкой или изучены при практическом применении изобретения. Преимущества изобретения могут быть реализованы и достигнуты посредством инструментального исполнения, комбинаций, композиций и способов, заявленных в прилагаемой формуле изобретения.
Краткое описание фигур
На фиг.1 приведен график зависимости жизнеспособности клеток SK-BR-3 в условиях in vitro на 3 сутки от кратных концентраций IC50 трастузумаба, трастузумаба-МСС-DM1 (T-DM1) и комбинации трастузумаба и T-DM1.
На фиг.2 приведен график зависимости жизнеспособности клеток BT-474 EEI в условиях in vitro на 3 сутки от кратных концентраций IC50 трастузумаба, трастузумаба-МСС-DM1 (T-DM1) и комбинации трастузумаба и T-DM1.
На фиг.3 приведен график зависимости жизнеспособности клеток MDA-MB-175 в условиях in vitro на 5 сутки от кратных концентраций IC50 пертузумаба, трастузумаба-МСС-DM1 (T-DM1) и комбинации пертузумаба и T-DM1.
На фиг.3а приведен график зависимости жизнеспособности клеток MDA-MB-175 в условиях in vitro на 5 сутки от кратных концентраций IC50 пертузумаба, трастузумаба-МСС-DM1 (T-DM1) и комбинации пертузумаба и T-DM1.
На фиг.4 приведен график зависимости жизнеспособности клеток BT-474 в условиях in vitro на 5 сутки от различных фиксированных концентраций пертузумаба в комбинации с концентрацией ответной реакции трастузумаба-МСС-DM1 (T-DM1) и различных концентраций одного T-DM1.
На фиг.5 приведен график зависимости жизнеспособности клеток BT-474 в условиях in vitro на 5 сутки от различных фиксированных концентраций трастузумаба-МСС-DM1 (T-DM1) в комбинации с концентрацией ответной реакции пертузумаба и различных концентраций одного пертузумаба.
На фиг.6 приведен график зависимости жизнеспособности клеток ВТ-474 в условиях in vitro на 5 сутки от кратных концентраций IC50 пертузумаба, трастузумаба-МСС-DM1 (T-DM1) и комбинации пертузумаба и T-DM1.
На фиг.7 приведен график зависимости жизнеспособности клеток SK-BR-3 в условиях in vitro на 3 сутки от различных концентраций T-DM1 в комбинации с фиксированными концентрациями лапатиниба (4,5 нМ; 14 нМ; 41 нМ; 123 нМ) и различных концентраций одного T-DM1 (0-1000 нг/мл).
На фиг.7а приведен график зависимости жизнеспособности клеток SK-BR-3 в условиях in vitro на 3 сутки от кратных концентраций IC50 T-DM1, лапатиниба и комбинаций с соотношением фиксированных концентраций T-DM1 и лапатиниба.
На фиг.8а приведен график зависимости жизнеспособности клеток BT-474 в условиях in vitro на 3 сутки от кратных концентраций IC50 T-DM1, лапатиниба и комбинаций с соотношением фиксированных концентраций T-DM1 и лапатиниба.
На фиг.8 приведен график зависимости жизнеспособности клеток BT-474 в условиях in vitro на 3 сутки от различных концентраций T-DM1 в комбинации с фиксированными концентрациями лапатиниба (1,5 нМ; 4,5 нМ; 14 нМ; 41 нМ; 123 нМ) и различных концентраций одного T-DM1 (0-1000 нг/мл).
На фиг.9 приведен график зависимости жизнеспособности клеток BT-474-EEI в условиях in vitro на 3 сутки от различных концентраций T-DM1 в комбинации с фиксированными концентрациями лапатиниба (14 нМ; 41 нМ; 123 нМ; 370 нМ; 1111 нМ) и различных концентраций одного T-DM1 (0-1000 нг/мл).
На фиг.10 приведен график изменения среднего объема опухолей в течение времени в условиях in vivo для опухолей KPL-4, имплантированных в жировую подушку молочной железы иммунодефицитных мышей SCID (3 миллиона клеток в матригеле на мышь) после введения: (1) буфера ADC; (2) пертузумаба в дозе 15 мг/кг; (3) T-DM1 в дозе 0,3 мг/кг; (4) T-DM1 в дозе 1 мг/кг; (5) T-DM1 в дозе 3 мг/кг, (6) пертузумаба в дозе 15 мг/кг + T-DM1 в дозе 0,3 мг/кг; (7) пертузумаба в дозе 15 мг/кг + T-DM1 в дозе 1 мг/кг; (8) пертузумаба в дозе 15 мг/кг + T-DM1 в дозе 3 мг/кг. Буфер ADC и T-DM1 вводили один раз на 0 сутки. Претузумаб вводили на 0; 7 и 14 сутки.
На фиг.11 приведен график изменения среднего объема опухолей в течение времени в условиях in vivo для опухолей KPL-4, имплантированных в жировую подушку молочной железы иммунодефицитных мышей SCID (3 миллиона клеток в матригеле на мышь) после введения: (1) буфера ADC; (2) 5-FU в дозе 100 мг/кг; (3) пертузумаба в дозе 40 мг/кг, первая доза пертузумаба (группы 5, 7 и 9) была 2× нагрузочной дозой; (4) B20-4.1 в дозе 5 мг/кг; (5) T-DM1 в дозе 5 мг/кг; (6) 5-FU в дозе 100 мг/кг + T-DM1 в дозе 5 мг/кг; (7) пертузумаба в дозе 40 мг/кг + T-DM1 в дозе 5 мг/кг; (8) B20-4.1 в дозе 5 мг/кг + T-DM1 в дозе 5 мг/кг; (9) B20-4.1 в дозе 5 мг/кг + пертузумаб в дозе 40 мг/кг. Буфер ADC и T-DM1 вводили внутривенно один раз на 0 сутки. Претузумаб вводили на 0; 7 и 14 сутки (один раз в неделю ×4). 5FU вводили на 0; 7 14 и 21 сутки (один раз в неделю ×3). В20-4.1 вводили на 0; 3; 7; 10; 14; 17; 21 и 24 сутки (2×/неделю ×8 в целом).
На фиг.12 приведен график изменения среднего объема опухолей в течение времени в условиях in vivo для трансгенных опухолей молочной железы MMTV-Her2 Fo5, имплантированных в жировую подушку молочной железы мышей CRL nu/nu, после введения: (1) растворителя (буфера ADC); (2) B20-4.1 в дозе 5 мг/кг; (3) T-DM1 в дозе 3 мг/кг; (4) T-DM1 в дозе 5 мг/кг; (5) T-DM1 в дозе 10 мг/кг; (6) B20-4.1 в дозе 5 мг/кг + T-DM1 в дозе 3 мг/кг; (7) B20-4.1 в дозе 5 мг/кг + T-DM1 в дозе 5 мг/кг; (8) B20-4.1 в дозе 5 мг/кг + T-DM1 в дозе 10 мг/кг. Буфер ADC и T-DM1 вводили на 0 и 21 сутки. B20-4.1 вводили на 0; 3; 7; 10; 14; 17; 21 и 24 сутки (2×/неделю ×4, 8 в целом).
На фиг.13 приведен график изменения среднего объема опухолей в течение времени в условиях in vivo для трансгенных опухолей молочной железы MMTV-Her2 Fo5, имплантированных в жировую подушку молочной железы мышей CRL nu/nu, после введения: (1) растворителя (буфера ADC); (2) T-DM1 в дозе 10 мг/кг; (3) 5-FU в дозе 100 мг/кг; (4) гемцитабина в дозе 120 мг/кг; (5) карбоплатина в дозе 100 мг/кг; (6) 5-FU в дозе 100 мг/кг + T-DM1 в дозе 10 мг/кг; (7) гемцитабина в дозе 120 мг/кг + T-DM1 в дозе 10 мг/кг; (8) карбоплатина в дозе 100 мг/кг + T-DM1 в дозе 10 мг/кг. Буфер ADC, T-DM1 и карбоплатин вводили однократно на 0 сутки. 5-FU вводили однократно на 0; 7 и 14 сутки (один раз в неделю ×3). Гемцитабин вводили на 0; 3; 6 и 9 сутки (каждые 3 дня ×4).
На фиг.14 приведен график изменения среднего объема опухолей в течение времени в условиях in vivo для трансгенных опухолей молочной железы MMTV-Her2 Fo5, имплантированных в жировую подушку молочной железы бестимусных мышей Harlan, после введения: (1) растворителя (буфера PBS) в/в, один раз в неделю ×4; (2) лапатиниба в дозе 101 мг/кг, перорально, два раза день ×21; (3) пертузумаба в дозе 40 мг/кг, в/в, один раз в неделю ×4; (4) B20-4.1 в дозе 5 мг/кг, в/б, 2×/в неделю ×4; (5) T-DM1 в дозе 15 мг/кг, в/в, один раз в 3 недели до конца; (6) лапатиниба в дозе 101 мг/кг перорально, два раза в день ×21 + T-DM1 в дозе 15 мг/кг, в/в, один раз в 3 недели до конца; (7) пертузумаба в дозе 40 мг/кг в/в, один раз в неделю ×4 + T-DM1 в дозе 15 мг/кг, в/в, один раз в 3 недели до конца; (8) B20-4.1 в дозе 5 мг/кг, в/б, 2×/в неделю ×4 + T-DM1 в дозе 15 мг/кг, в/в, один раз в 3 недели до конца.
На фиг.15 приведен график изменения среднего объема опухолей в течение времени в условиях in vivo для трансгенных опухолей молочной железы MMTV-Her2 Fo5, имплантированных в жировую подушку молочной железы бестимусных мышей Harlan, после введения: (1) растворителя (буфера PBS) перорально, два раза в день ×21; (2) T-DM1 в дозе 7,5 мг/кг, в/в, один раз в день ×1; (3) T-DM1 в дозе 15 мг/кг, в/в, один раз в день ×1; (4) ABT-869 в дозе 5 мг/кг, перорально, два раза в день ×21; (5) ABT-86 в дозе 15 мг/кг, перорально, два раза в день ×21; (6) T-DM1 в дозе 7,5 мг/кг в/в, один раз в день ×1 + ABT-869 в дозе 5 мг/кг, перорально, два раза в день ×21; (7) T-DM1 в дозе 7,5 мг/кг в/в, один раз в день ×1 + ABT-869 в дозе 15 мг/кг, перорально, два раза в день ×21; (8) T-DM1 в дозе 15 мг/кг, в/в, один раз в день ×1 + ABT-869 в дозе 5 мг/кг, перорально, два раза в день ×21; (9) T-DM1 в дозе 15 мг/кг, в/в, один раз в день ×1 + ABT-869 в дозе 15 мг/кг, перорально, два раза в день ×21.
На фиг.16 приведен график изменения среднего объема опухолей в течение времени в условиях in vivo для трансгенных опухолей молочной железы MMTV-Her2 Fo5, имплантированных в жировую подушку молочной железы бестимусных мышей Harlan, после введения: (1) растворителя в/в, один раз в неделю ×3; (2) T-DM1 в дозе 7,5 мг/кг в/в, один раз в 3 недели ×2; (3) T-DM1 в дозе 15 мг/кг в/в, один раз в 3 недели ×2; (4) доцетаксела в дозе 30 мг/кг в/в, один раз в неделю ×3; (5) T-DM1 в дозе 7,5 мг/кг в/в, один раз в 3 недели ×2 + доцетаксела в дозе 30 мг/кг в/в, один раз в неделю ×3; (6) T-DM1 в дозе 15 мг/кг в/в, один раз в 3 недели ×2 + доцетаксела в дозе 30 мг/кг в/в, один раз в неделю ×3.
На фиг.17 приведен график изменения среднего объема опухолей в условиях in vivo для трансгенных опухолей MMTV-Her2 Fo5, имплантированных в жировую подушку молочной железы бестимусных мышей Harlan, после введения: (1) растворителя перорально, один раз в день ×21; (2) T-DM1 в дозе 7,5 мг/кг в/в, один раз в 3 недели ×2; (3) T-DM1 в дозе 15 мг/кг в/в, один раз в 3 недели ×2; (4) лапатиниба в дозе 100 мг/кг перорально, два раза в день ×21; (5) T-DM1 в дозе 7,5 мг/кг в/в, один раз в 3 недели ×2 + лапатиниба в дозе 100 мг/кг перорально, два раза в день ×21; (6) T-DM1 в дозе 15 мг/кг в/в, один раз в 3 недели ×2 + лапатиниба в дозе 100 мг/кг перорально, два раза в день ×21.
На фиг.18 приведен график зависимости жизнеспособности клеток SK-BR-3 в условиях in vitro на 3 сутки от кратных концентраций IC50 5-FU, трастузумаба-MCC-DM1 (T-DM1) и комбинаций с соотношением фиксированных концентраций 5-FU и T-DM1.
На фиг.19 приведен график зависимости жизнеспособности клеток BT-474 в условиях in vitro на 3 сутки от кратных концентраций IC50 5-FU, трастузумаба-MCC-DM1 (T-DM1) и комбинаций с соотношением фиксированных концентраций 5-FU и T-DM1.
На фиг.20 приведен график зависимости жизнеспособности клеток SK-BR-3 в условиях in vitro на 3 сутки от кратных концентраций IC50 гемцитабина, трастузумаба-MCC-DM1 (T-DM1) и комбинаций с соотношением фиксированных концентраций гемцитабина и T-DM1.
На фиг.21 приведен график зависимости жизнеспособности клеток MDA-MD-361 в условиях in vitro на 3 сутки от кратных концентраций IC50 гемцитабина, трастузумаба-MCC-DM1 (T-DM1) и комбинаций с соотношением фиксированных концентраций гемцитабина и T-DM1.
На фиг.22 приведен график жизнеспособности (пролиферации) клеток KPL4 в условиях in vitro на 3 сутки после обработки T-DM1, GDC-0941 и комбинациями с соотношением фиксированных концентраций 1:10 T-DM1 и GDC-0941 (от 62,5 нМ до 1 мкМ) при кратных концентрациях IC50 от 0,25× до 4×. Строили график прогноза аддитивного действия Блисса в виде пунктирной линии.
На фиг.23 приведен график жизнеспособности (пролиферации) клеток KPL4 в условиях in vitro на 3 сутки после обработки T-DM1, GDC-0941 и комбинациями с соотношением фиксированных концентраций 1:25 (от 1,25 до 80 нг/мл) и GDC-0941 (от 31,25 нМ до 2 мкМ) при кратных концентрациях IC50 от 0,0625× до 16×. Строили график прогноза аддитивного действия Блисса в виде пунктирной линии.
На фиг.24 приведен график жизнеспособности (пролиферации) клеток KPL4 с амплификацией Her2, резистентных к герцептину®, мутантных по PIK3CA (H1047R) в условиях in vitro на 3 сутки после обработки T-DM1, PI103, GDC-0941 и комбинациями с соотношением фиксированных концентраций T-DM1+PI103 и T-DM1+GDC-0941 при кратных концентрациях IC50 от 0 до 16×.
На фиг.25 приведен график жизнеспособности (пролиферации) клеток KPL4 каспаза 3/7 в условиях in vitro через 24 ч после обработки T-DM1, GDC-0941 и комбинациями с соотношением фиксированных концентраций T-DM1 и GDC-0941 при концентрациях T-DM1 до 160 нг/мл.
На фиг.26 приведен график жизнеспособности (пролиферации) клеток KPL4 в условиях in vitro через 3 суток после обработки T-DM1, GDC-0941 и комбинациями с соотношением фиксированных концентраций T-DM1 и GDC-0941 при концентрациях T-DM1 от 0 до 200 нг/мл.
На фиг.27 приведен график жизнеспособности (пролиферации) клеток MDA-0MB-361 в условиях in vitro на 3 сутки после обработки T-DM1, GDC-0941 и комбинациями с соотношением фиксированных концентраций 1:20 T-DM1 (от 3,125 до 50 нг/мл) и GDC-0941 (от 62,5 нМ до 1 мкМ) при кратных концентрациях IC50 от 0,125× до 8×. Строили график прогноза аддитивного действия Блисса в виде пунктирной линии.
На фиг.28 приведен график жизнеспособности (пролиферации) клеток MDA-0MB-361 в условиях in vitro на 3 сутки после обработки T-DM1, GDC-0941 и комбинациями с соотношением фиксированных концентраций 1:20 T-DM1 (от 3,125 до 100 нг/мл) и GDC-0941 (от 62,5 нМ до 2 мкМ) при кратных концентрациях IC50 от 0,125× до 8×. Строили график прогноза аддитивного действия Блисса в виде пунктирной линии.
На фиг.29 приведен график жизнеспособности (пролиферации) клеток BT-474 в условиях in vitro на 3 сутки после обработки T-DM1, GDC-0941 и комбинациями с соотношением фиксированных концентраций 1:10 T-DM1 (от 3,125 до 100 нг/мл) и GDC-0941 (от 31,25 нМ до 1 мкМ) при кратных концентрациях IC50 от 0,125× до 4×. Строили график прогноза аддитивного действия Блисса в виде пунктирной линии.
На фиг.30 приведен график жизнеспособности (пролиферации) клеток BT-474 в условиях in vitro на 3 сутки после обработки T-DM1, GDC-0941 и комбинациями с соотношением фиксированных концентраций 1:10 T-DM1 (от 6,25 до 100 нг/мл) и GDC-0941 (от 62,5 нМ до 1 мкМ) при кратных концентрациях IC50 от 0,25× до 4×. Строили график прогноза аддитивного действия Блисса в виде пунктирной линии.
На фиг.31 приведен график жизнеспособности (пролиферации) клеток AU565 с амплификацией Her2, мутантных без PIK3 в условиях in vitro на 3 сутки после обработки T-DM1, PI103, GDC-0941 и комбинациями с соотношением фиксированных концентраций T-DM1+PI103 и T-DM1+GDC-0941 при кратных концентрациях IC50 от 0 до 16×.
На фиг.32 приведен график жизнеспособности (пролиферации) клеток EFM192A с амплификацией Her2, мутантных по PIK3CA (C420R) в условиях in vitro на 3 сутки после обработки T-DM1, PI103, GDC-0941 и комбинациями с соотношением фиксированных концентраций T-DM1+PI103 и T-DM1+GDC-0941 при кратных концентрациях IC50 от 0 до 16×.
На фиг.33 приведен график жизнеспособности (пролиферации) клеток HCC1954 с амплификацией Her2, резистентных к герцептину®, мутантных по PIK3CA (H1047R) в условиях in vitro после обработки T-DM1, PI103, GDC-0941 и комбинациями с соотношением фиксированных концентраций T-DM1+PI103 и T-DM1+GDC-0941 при кратных концентрациях IC50 от 0 до 16×.
На фиг.34 приведен график изменения среднего объема опухолей в течение времени в условиях in vivo для трансгенных опухолей MMTV-Her2 Fo5, имплантированных в жировую подушку молочной железы мышей CRL nu/nu, после введения: (1) растворителя перорально, один раз в день ×21; (2) T-DM1 в дозе 10 мг/кг в/в, один раз в 3 недели; (3) 5-FU в дозе 100 мг/кг перорально, один раз в неделю ×2; (4) T-DM1 в дозе 5 мг/кг в/в, один раз в 3 недели + 5-FU в дозе 100 мг/кг перорально, один раз в неделю ×2.
На фиг.35 приведен график изменения среднего объема опухолей в течение времени в условиях in vivo для трансгенных опухолей MMTV-Her2 Fo5, имплантированных в жировую подушку молочной железы мышей CRL nu/nu, после введения: (1) растворителя перорально, один раз в день ×21; (2) T-DM1 в дозе 5 мг/кг в/в, один раз в день ×1; (3) GDC-0941 в дозе 100 мг/кг перорально, один раз в день ×21; (4) GDC-0152 дозе 50 мг/кг перорально, один раз в неделю ×3; (5) T-DM1 в дозе 5 мг/кг в/в, один раз в день ×1 + GDC-0941 в дозе 100 мг/кг перорально, один раз в день ×21; (6) T-DM1 в дозе 5 мг/кг в/в, один раз в день ×1 + GDC-0152 в дозе 50 мг/кг перорально, один раз в неделю ×3.
На фиг.36 приведен график изменения среднего объема опухолей в течение времени в условиях in vivo для опухолей MDA-MB-361.1, имплантированных в жировую подушку молочной железы мышей CRL nu/nu, после введения: (1) растворителя перорально, один раз в день ×21; (2) GDC-0941 в дозе 25 мг/кг, перорально, один раз в день ×21; (3) GDC-0941 в дозе 50 мг/кг, перорально, один раз в день ×21; (4) GDC-0941 в дозе 100 мг/кг, перорально, один раз в день ×21; (5) T-DM1 в дозе 3 мг/кг в/в, один раз в день ×1; (6) T-DM1 в дозе 10 мг/кг в/в, один раз в день ×1; (7) GDC-0941 в дозе 25 мг/кг перорально, один раз в день ×21 + T-DM1 в дозе 3 мг/кг в/в, один раз в день ×1; (8) GDC-0941 в дозе 50 мг/кг перорально, один раз в день ×21 + T-DM1 в дозе 3 мг/кг в/в, один раз в день ×1; (9) GDC-0941 в дозе 100 мг/кг перорально, один раз в день ×21 + T-DM1 в дозе 3 мг/кг в/в, один раз в день ×1; (10) GDC-0941 в дозе 25 мг/кг перорально, один раз в день ×21 + T-DM1 в дозе 10 мг/кг в/в, один раз в день ×1; (11) GDC-0941 в дозе 50 мг/кг перорально, один раз в день ×21 + T-DM1 в дозе 10 мг/кг в/в, один раз в день ×1; (12) GDC-0941 в дозе 100 мг/кг перорально, один раз в день ×21 + T-DM1 в дозе 10 мг/кг в/в, один раз в день ×1.
На фиг.37 приведен график изменения среднего объема опухолей в течение времени в условиях in vivo для опухолей MDA-MB-361.1, имплантированных в жировую подушку молочной железы мышей CRL nu/nu, после введения: (1) растворителей [MCT (0,5% метилцеллюлоза/0,2% твин 80) + сукцинатный буфер (100 мМ сукцината натрия, 100 мг/мл трегалозы, 0,1% твина 80, рН 5,0)] перорально+в/в, один раз в день ×21 и один раз в день; (2) GNE-390 в дозе 1,0 мг/кг, перорально, один раз в день ×21; (3) GNE-390 в дозе 2,5 мг/кг, перорально, один раз в день ×21; (4) T-DM1 в дозе 3 мг/кг в/в, один раз в день; (5) GNE-390 в дозе 1,0 мг/кг перорально, один раз в день ×21 + T-DM1 в дозе 3 мг/кг в/в, один раз в день; (6) GNE-390 в дозе 2,5 мг/кг перорально, один раз в день ×21 + T-DM1 в дозе 3 мг/кг в/в, один раз в день.
Подробное описание предпочтительных вариантов осуществления
Далее будут подробно описаны некоторые варианты осуществления изобретения, примеры которых приведены с прилагаемыми структурами и формулами. Несмотря на то, что изобретение будет описано в сочетании с перечисленными вариантами осуществления, очевидно, понятно, что они не предназначены для ограничения изобретения данными вариантами осуществления. Напротив изобретение предназначено для включения всех альтернатив, модификаций и эквивалентных вариантов, которые могут быть включены в объем настоящего изобретения, определенного формулой изобретения. Специалистам в данной области, очевидно, понятно, что существует много способов и веществ, аналогичных или эквивалентных описанным в данном документе, которые можно использовать в практике настоящего изобретения. Настоящее изобретение никоим образом не ограничивается описанными способами и веществами. В случае, когда один или несколько включенных источников литературы, патентов и аналогичных материалов отличается или противоречит данной заявке, включая, не ограничиваясь этим, определение терминов, использование терминов, описание методик или тому подобное, то данная заявка контролирует это.
Определения
Выражения «содержит», «содержащий», «включает», «включающий» и «включает» при использовании в настоящей заявке и формуле изобретения, предназначаются для определения наличия указанных признаков, целых чисел, компонентов или стадий, но они не препятствуют наличию или добавлению одного или несколько признаков, целых чисел, компонентов или стадий или их групп.
Термины «лечить» и «лечение» относятся к лечебным и профилактическим или превентивным мероприятиям, целью которых является предупреждение или замедление (ослабление) нежелательного физиологического изменения или нарушения, такого как рост, развитие или распространение гиперпролиферативного состояния, такого как злокачественная опухоль. Для целей настоящего изобретения положительные или желательные клинические результаты включают, не ограничиваясь этим, ослабление симптомов, снижение степени выраженности заболевания, обеспечение стабильного (т.е., отсутствие ухудшения) состояния заболевания, снижение или замедление прогрессирования заболевания, ослабление или смягчение болезненного состояния и ремиссия (частичная или полная), независимо от того, являются они детектируемыми или не детектируемыми. Также термин «лечение» может означать пролонгированную выживаемость по сравнению с предполагаемой выживаемостью по сравнению с ситуацией при отсутствии лечения. Субъекты, нуждающиеся в лечении, включают пациентов уже с имеющимся состоянием или нарушением, а также субъектов склонных к развитию состояния или нарушения, и субъектов, у которых состояние или нарушение следует предупредить.
Выражение «терапевтически эффективное количество» означает количество соединения по настоящему изобретению, с помощью которого можно (i) лечить конкретное заболевание, состояние или нарушение, (ii) ослаблять, облегчать или элиминировать один или несколько симптомов конкретного заболевания, состояния или нарушения и (iii) предупреждать или замедлять начало развития одного или несколько симптомов конкретного заболевания, состояния или нарушения, описанного в данном документе. В случае злокачественной опухоли терапевтически эффективное количество лекарственного средства может привести к уменьшению количества опухолевых клеток, уменьшению размера опухоли, подавлению (т.е. замедлению до определенной степени и предпочтительно остановке) инфильтрации опухолевых клеток в периферические органы, подавлению (т.е. замедлению до определенной степени и предпочтительно остановке) метастазирования опухоли, подавлению до определенной степени роста опухоли и/или ослаблению до определенной степени одного или несколько симптомов, ассоциированных со злокачественной опухолью. Лекарственное средство может до определенной степени предупредить рост опухоли и/или привести к гибели имеющихся опухолевых клеток, оно может быть цитостатическим и/или цитотоксическим. В отношении терапии злокачественной опухоли, то эффективность можно оценить, например, по времени прогрессирования заболевания (ТТР) и/или по скорости проявления ответной реакции (RR).
Термин «гиперпролиферативное нарушение» относится к опухолям, раку и новообразованиям, включая презлокачественные и не-злокачественные стадии, а также он включает псориаз, эндометриоз, полипы и фиброаденому.
Термины «рак» и «злокачественная опухоль» относятся к или описывают физиологическое состояние у млекопитающих, которое характеризуется неконтролируемым ростом клеток. «Опухоль» содержит одну или несколько опухолевых клеток. Примеры злокачественной опухоли включают, не ограничиваясь этим, карциному, лимфому, бластому, саркому и лейкоз или злокачественные опухоли лимфоидной ткани. Более конкретные примеры таких злокачественных опухолей включают плоскоклеточный рак (например, эпителиальный плоскоклеточный рак), рак легких, в том числе, мелкоклеточную карциному легких, немелкоклеточную карциному легких («NSCLC»), аденокарциному легких и плоскоклеточную карциному легких, рак брюшины, гепатоцеллюлярную карциному, рак желудка, в том числе, злокачественные опухоли органов пищеварительного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, печени, мочевого пузыря, гепатому, рак молочной железы, ободочной кишки, прямой кишки, колоректальный рак, рак эндометрия или матки, рак слюнных желез, почек или органов выделительной системы, вульвы, щитовидной железы, карциному печени, рак анального отверстия, рак полового члена, а также злокачественные опухоли головы и шеи.
Термин «химиотерапевтическое средство» представляет собой химическое соединение, пригодное для лечения рака, независимо от механизма действия. Группы химиотерапевтических средств включают, не ограничиваясь этим: алкилирующие агенты, антиметаболиты, растительные алкалоиды, представляющие собой яды митотического веретена, цитотоксические/противоопухолевые антибиотики, ингибиторы топоизомеразы, антитела, фотосенсибилизаторы и ингибиторы киназы. Химиотерапевтические средства включают соединения, применяемые в «целенаправленной терапии» и обычной химиотерапии. Примеры химиотерапевтических средств включают: эрлотиниб (тарцева®, Genentech/OSI Pharm.), доцетаксел (таксотер®, Sanofi-Aventis), 5-FU (фторурацил, 5-фторурацил, номер по C