Стабилизированные жидкие ферментные композиции
Иллюстрации
Показать всеИзобретение относится к пептидным альдегидам с тирозином в качестве C-концевого остатка, которые являются особенно эффективными для стабилизации протеаз типа субтилизина в жидких моющих средствах. 3 н. и 3 з.п. ф-лы, 3 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к жидкой композиции, включающей субтилизин и пептидное соединение в качестве стабилизатора для субтилизина. Изобретение также относится к пептидному соединению, которое применяется в качестве стабилизатора для субтилизинов.
УРОВЕНЬ ТЕХНИКИ
Протеазы типа субтилизина хорошо известны среди жидких водных моющих средств, особенно в использовании для стирки в прачечной. Часто встречающаяся проблема в таких жидких моющих средствах представляет собой разложение субтилизином других ферментов в композиции и разложение самого субтилизина. Следовательно, стабильность субтилизина и других ферментов в композиции жидкого моющего средства понижена, приводя в результате к получению жидкого моющего средства с пониженной степенью эффективности стирки.
В документах известного уровня техники активно обсуждается улучшение стабильности при хранении ферментов жидких моющих средств, например, путем добавления различных ингибиторов или стабилизаторов субтилизина. Известно, что борная кислота и бороновые кислоты обратимо ингибируют протеолитические ферменты. Применение пептидных альдегидов в жидких моющих средствах раскрыто в WO 94/04651, WO 98/13458, WO 98/13459, WO 98/13460 и WO 98/13462. Более конкретно, WO94/04651 раскрывает применение пептидных альдегидов, Phe-Gly-Ala-PheH и Phe-Gly-Ala-LeuH, для стабилизации протеаз типа субтилизина. WO94/04651 также раскрывает Leu-Leu-TyrH в качестве подходящего пептидного альдегида для стабилизации протеаз типа химотрипсина. Кроме того, WO94/04651 предлагает метилкарбамат или метилмочевину в качестве N-концевой защитной группы пептидных альдегидов. WO98/13460 раскрывает применение ингибиторов пептидных протеаз, и пептидных альдегидов и трифторметилкетонов, где пептидная цепь содержит 2-5 аминокислот, и альдегид/трифторметилкетон получают из аминокислот аланина, валина, изолейцина, лейцина, фенилглицина, фенилаланина или гомофенилаланина и где N-концевая защитная группа предпочтительно представляет собой сульфонамид или амидофосфат.
WO2007/141736, WO2007/145963 и WO2007/145964 раскрывают применение обратимых ингибиторов пептидных протеаз для стабилизации композиций жидких моющих средств. US2003/157088 описывает композиции, содержащие ферменты, стабилизированные ингибиторами.
WO 96/41638 и WO 2005/105826 раскрывают альдегиды и кетоны пептидов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы изобретения неожиданно обнаружили, что определенные альдегидные или кетоновые производные пептидов являются особенно эффективными для стабилизации протеаз типа субтилизина в водных композициях, таких как жидкие моющие средства, включающие пептидные соединения с OH-замещенным фенилаланином в качестве C-концевого остатка.
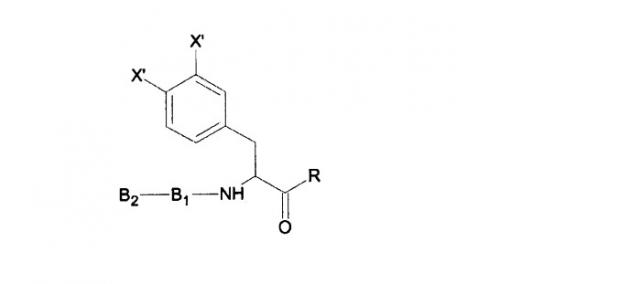
Соответственно, в изобретении предлагается жидкая композиция, включающая субтилизин и пептидное соединение формулы B2-B1-B0-R, где
- R представляет собой водород, CH3, CX3, CHX2 или CH2X, где X представляет собой атом галогена; и
- B1 представляет собой один аминокислотный остаток.
B0 может представлять собой остаток фенилаланина с OH-заместителем в пара-положении и/или в мета-положении; и B2 может состоять из одного или более аминокислотных остатков, причем B2 необязательно включает N-концевую защитную группу. Альтернативно, B0 может представлять собой один аминокислотный остаток; и B2 представляет собой остаток Gly, Arg или Leu с присоединенной N-концевой защитной группой.
В изобретении дополнительно предлагается пептидное соединение формулы B2-B1-B0-R, где
- R представляет собой водород, CH3, CX3, CHX2 или CH2X, где X представляет собой атом галогена; и
- B1 представляет собой один аминокислотный остаток.
- B0 может представлять собой остаток фенилаланина с OH-заместителем в пара-положении и/или в мета-положении; и B2 может состоять из одного или более аминокислотных остатков с бензилоксикарбонилом в качестве N-концевой защитной группы, или B2 может представлять собой остаток Gly, Arg или Leu с присоединенной N-концевой защитной группой. Альтернативно, B0 может представлять собой один аминокислотный остаток, и B1 может представлять собой небольшой аминокислотный остаток, и B2 может представлять собой остаток Gly, Arg или Leu с присоединенной ароматической N-концевой защитной группой.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
"Аминокислотный остаток" означает группу со структурой, подобной -NH-CHR-CO-, с обозначением N-конца слева и C-конца справа.
Названия аминокислотных остатков сокращаются с использованием однобуквенных или трехбуквенных сокращений, включая следующие сокращения: аланин (A), фенилаланин (F), глицин (G), лейцин (L), аргинин (R), валин (V), триптофан (W), тирозин (Y). Сокращение "Y-H" обозначает тирозиналь, подразумевая, что C-концевая область остатка тирозина превращена из карбоксильной группы в альдегидную группу. Тирозиналь может быть получена с помощью известных способов.
Аминокислоты
Каждый аминокислотный остаток в B1 и B2 может представлять собой природную или искусственную альфа- или бета-аминокислоту, содержащую структуру -NH-(CH(R))n-C(=O)-, где n=1-2 (предпочтительно 1) и R выбран из линейной или разветвленной и/или циклической, замещенной или незамещенной структуры из следующих групп: C1-C6 алкил; фенил; C7-C9 алкиларил; C4-C8 циклоалкил. Сюда включены обе L- и D-формы аминокислот.
Аминокислота может представлять собой альфа-аминокислоту, такую как любая из природных аминокислот, норвалин (Nva), норлейцин (Nle), гомофенилаланин (Hph) или фенилглицин (Pgl). Альфа-углеродный атом аминокислоты может быть представлен в D- или L-конфигурации.
Пептидное соединение
OH-замещенный фенилаланин, такой как тирозин, представляет собой относительно гидрофильную аминокислоту, и его присутствие в пептиде будет, как правило, повышать растворимость пептида по сравнению с более гидрофобными аминокислотами типа фенилаланина, лейцина, аланина, цистеина, изолейцина, метионина и валина, которые все обладают положительным индексом гидрофобности по сравнению с отрицательным индексом гидрофобности тирозина (Kyte&Doolittle (1982), J. Mol. Biol. 157 (1), pp 105-132) (чем больше индекс гидрофобности, тем более гидрофобна аминокислота).
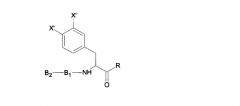
Пептидное соединение может иметь формулу:
где R представляет собой водород, CH3, CX3, CHX2 или CH2X, где X представляет собой атом галогена; X' представляет собой OH или H, причем, по меньшей мере, один X' представляет собой OH; B1 представляет собой один аминокислотный остаток; и B2 представляет собой один или более аминокислотных остатков, причем B2 необязательно включает N-концевую защитную группу.
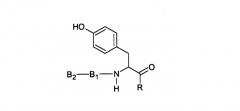
Таким образом, B0 (аминокислотный остаток на C-конце) может представлять собой остаток тирозина (p-тирозин), m-тирозин или 3,4-дигидроксифенилаланин. Вместе с тирозиновым остатком пептидное соединение имеет следующую формулу:
В одном конкретном аспекте изобретения пептидное соединение включает только 3 аминокислотных остатка, включая C-концевой остаток. В этом аспекте изобретения синтез является более экономически эффективным, и признано, что соединения представляют собой высокоэффективные ингибиторы ферментной активности. Предпочтительно, пептидные соединения, содержащие только три аминокислотных остатка, защищены N-концевой защитной группой. Соответственно, в этом аспекте изобретение относится к соединениям, где B2 представляет собой один аминокислотный остаток, включающий N-концевую защитную группу.
В предпочтительном аспекте изобретения пептидное соединение представляет собой альдегид, включающий только 3 аминокислотных остатка, где B2 выбирают из аргинина, глицина и лейцина, включающих N-концевую защитную группу. В случае, где пептидное соединение представляет собой альдегид, включающий только 3 аминокислотных остатка, B2 предпочтительно выбирают из аргинина и глицина, включающих N-концевую защитную группу.
В другом аспекте изобретения пептидное соединение включает, по меньшей мере, четыре аминокислотных остатка. Предпочтительно, пептидное соединение, содержащее, по меньшей мере, четыре аминокислотных остатка, защищают с помощью N-концевой защитной группы. Соответственно, в этом аспекте изобретение относится к соединениям, где B2 представляет собой, по меньшей мере, два аминокислотных остатка, включающих N-концевую защитную группу.
В предпочтительном аспекте, в случае где пептидное соединение включает, по меньшей мере, четыре аминокислотных остатка, B2 включает N-концевой аминокислотный остаток, содержащий неполярную боковую цепь. В более предпочтительном воплощении второй аминокислотный остаток B2, считая от места присоединения к B1, содержит неполярную боковую цепь. В еще более предпочтительном воплощении пептидное соединение включает четыре аминокислотных остатка, где N-концевой аминокислотный остаток, содержащий неполярную боковую цепь, выбирают из глицина, лейцина, фенилаланина, тирозина и триптофана. Предпочтительно, N-концевой аминокислотный остаток дополнительно включает N-концевую защитную группу.
Предпочтительно, чтобы B1 представлял собой небольшой аминокислотный остаток. Более предпочтительно, B1 представляет собой аланин или валин. В этом контексте, предполагается, что следующие аминокислоты являются небольшими аминокислотами: аланин, цистеин, глицин, пролин, серин, треонин, валин, норвалин, норлейцин.
Пептидное соединение может представлять собой альдегид, где R представляет собой водород, B1 представляет собой одну аминокислоту, предпочтительно выбранную из небольших аминокислот, таких как валин и аланин, B2 включает, по меньшей мере, два аминокислотных остатка, и где, по меньшей мере, один из указанных аминокислотных остатков выбирают из фенилалланина, глицина и лейцина и где второй аминокислотный остаток B2, содержащий неполярную боковую цепь, выбирают из фенилаланина, глицина, лейцина, тирозина и триптофана. Предпочтительно, B2 включает ацетильную (Ac) N-концевую защитную группу, представляя среди прочего соединения пептидных альдегидов Ac-FGAY-H, Ac-LGAY-H, Ac-YGAY-H, Ac-FGVY-H и Ac-WLVY-H. Предпочтительно, соединения согласно этому аспекту изобретения включают менее чем 10 аминокислотных остатков, например 9, 8, 7, 6, 5 или, наиболее предпочтительно, 4 аминокислотных остатка.
В другом аспекте пептидное соединение может представлять собой трипептидный альдегид, где R представляет собой водород, B1 представляет собой один аминокислотный остаток, выбранный из небольших аминокислот, например, валина и аланина, B2 включает аминокислотные остатки, выбранные из аргинина, глицина и лейцина. Предпочтительно, B2 включает N-концевую защитную группу, выбранную из бензилоксикарбонила (Z) и ацетила (Ac), с получением среди прочего соединений пептидных альдегидов Z-RAY-H, Z-GAY-H, Z-GAL-H, Z-GAF-H, Z-GAV-H, Z-RVY-H, Z-LVY-H и Ac-GAY-H. Наиболее предпочтительно, согласно этому аспекту B2 включает бензилоксикарбонильную (Z) N-концевую защитную группу.
В предпочтительном аспекте, в случае где пептидное соединение включает, по меньшей мере, четыре аминокислотных остатка, B2 включает N-концевой аминокислотный остаток, содержащий неполярную боковую цепь. В контексте настоящего изобретения с помощью термина "аминокислоты с неполярными боковыми цепями" обозначают аминокислоту или аминокислотный остаток, выбранные из группы, включающей фенилаланин, тирозин, триптофан, изолейцин, лейцин, метионин, валин, аланин, пролин, норвалин или норлейцин.
Особенно предпочтительные пептидные альдегиды по настоящему изобретению включают Z-RAY-H, Ac-GAY-H, Z-GAY-H, Z-GAL-H, Z-GAF-H, Z-GAV-H, Z-RVY-H, Z-LVY-H, Ac-LGAY-H, Ac-FGAY-H, Ac-YGAY-H, Ac-FGVY-H или Ac-WLVY-H, где Z представляет собой бензилоксикарбонил и Ac представляет собой ацетил.
N-концевая защитная группа
N-концевая защитная группа может представлять собой любую аминоконцевую защитную группу, которая может применяться в пептидном синтезе. Публикация Gross and Meinhoffer, eds., The Peptides, Vol. 3; 3-88 (1981), Academic Press, New York 1981 раскрывает многочисленные подходящие защитные группы для амина и для этой цели включена в настоящий документ с помощью ссылки.
Примеры подходящих групп включают формильную, ацетильную, бензоильную, трифторацетильную, фторметоксикарбонильную, метоксисукцинильную, ароматические уретановые защитные группы, такие как бензилоксикарбонильная; и алифатические уретановые защитные группы, такие как трет-бутилоксикарбонильная или адамантилоксикарбанильная, пара-метоксибензилкарбонильная (MOZ), бензильная (Bn), пара-метоксибензильная (PMB) или пара-метоксифенильная (PMP).
Предпочтительно, N-концевую защитную группу по настоящему изобретению выбирают из формила, ацетила, бензоила, ароматических или алифатических уретанов, более предпочтительно из ацетила или бензилоксикарбонила. В случае где пептидное соединение включает три аминокислоты, N-концевая защитная группа предпочтительно представляет собой ароматический уретан или алифатический уретан или ароматическую N-концевую защитную группу, в частности, бензилоксикарбонил (Cbz), пара-метоксибензилкарбонил (MOZ), бензил (Bn), пара-метоксибензил (PMB) или пара-метоксифенил (PMP), более предпочтительно, бензилоксикарбонил. В случае, где пептидное соединение включает четыре или более аминокислот, предпочтительно, чтобы N-концевая защитная группа представляла собой формил, ацетил или бензоил, более предпочтительно, ацетил.
Жидкая композиция
В предпочтительном воплощении пептидные соединения по настоящему изобретению применяются для стабилизации или ингибирования субтилизинов в жидких композициях, которые могут дополнительно включать поверхностно-активное вещество или другие ферменты.
В одном аспекте изобретение дополнительно относится к применению соединения, определенного выше, для стабилизации и/или ингибирования ферментов, включающих протеазу типа субтилизина. В предпочтительном аспекте ферменты стабилизируются и/или ингибируются в жидких моющих средствах. Добавление пептидного соединения к жидкому моющему средству может повысить моющую способность.
Жидкая композиция может представлять собой ферментную композицию, включающую субтилизин и необязательно второй фермент. Второй фермент может представлять собой любой коммерчески доступный фермент, в частности, фермент, выбранный из группы, состоящей из протеаз, амилаз, липаз, целлюлаз, маннаназ, оксидоредуктаз, лиаз и их любой смеси. Сюда также включены смеси ферментов из одного и того же класса (например, протеазы). Ферментная композиция также может включать другие стабилизаторы, например, полиол, такой как глицерин или пропиленгликоль, например, в количестве 25-75% по массе.
Количество фермента, используемого в жидкой композиции, варьируется согласно типу фермента(ов) и типу композиции. В композиции, такой как жидкое моющее средство, количество каждого фермента, рассчитанное для чистого ферментного белка, как правило, составляет 0,04-80 мкМ, в частности, 0,2-30 мкМ, в особенности, 0,4-20 мкМ (как правило, 1-2000 мг/л, в частности, 5-750 мг/л, в особенности, 10-500 мг/л). В композиции, такой как ферментный концентрат, количество каждого фермента, рассчитанное для чистого ферментного белка, как правило, составляет 0,01-20 мМ, в частности, 0,04-10 мМ, в особенности, 0,1-5 мМ (как правило, 0,3-500 г/л, в частности, 1-300 г/л, в особенности, 3-150 г/л).
Ферменты обычно включают в композиции моющих средств с достаточным для получения моющего эффекта уровнем, который известен специалисту в данной области. Обычно количество ферментов находится в интервале от 0,0001% (масс./масс.) до 5% (масс./масс.). Типичные количества находятся в интервале от 0,01% до 1% по массе композиции жидкого моющего средства. Молярное соотношение стабилизатора или ингибитора фермента согласно изобретению к протеазе составляет, по меньшей мере, 1:1 или 1,5:1, и составляет менее чем 1000:1, более предпочтительно, менее чем 500:1, еще более предпочтительно от 100:1 до 2:1 или от 20:1 до 2:1, или, наиболее предпочтительно, молярное соотношение составляет от 10:1 до 3:1.
В одном предпочтительном аспекте изобретение относится к композиции, включающей от 1 до 95% моющих(его) поверхностно-активных(ого) веществ(а) по массе, от 0,0001 до 5% по массе субтилизина, и от 0,00001 до 1% ингибитора пептида по массе, определенного выше. В более предпочтительном воплощении изобретение относится к композиции, включающей от 2 до 60% по массе моющих(его) поверхностно-активных(ого) веществ(а), от 0,0005 до 1% субтилизина по массе, и от 0,00005 до 0,2% определенного выше ингибитора пептида по массе. В еще более предпочтительном воплощении изобретение относится к композиции, включающей от 3 до 50% моющих(его) поверхностно-активных(ого) веществ(а) по массе, от 0,001 до 0,5% субтилизина по массе, и от 0,0001 до 0,1% определенного выше ингибитора пептида по массе.
Субтилизин
Субтилизин может быть животного, растительного или микробного происхождения, включая химически или генетически модифицированные мутанты. Он может быть сериновой протеазой, предпочтительно щелочной микробной протеазой. Примеры представляют собой протеазы типа субтилизина из группы I-S, определенной Siezen et al. (Protein Engineering, 1991, vol. 4 no. 7 pp. 719-737). Примеры субтилизинов представляют собой субтилизины, полученные из Bacillus, например, субтилизин Novo, субтилизин Carlsberg, субтилизин BPN', субтилизин 309, субтилизин 147 и субтилизин 168 (описанные в WO 89/06279). Примеры описаны в WO 1998/020115, WO 01/44452, WO 01/58275, WO 01/58276, WO 2003/006602 и WO 2004/099401.
Примеры коммерчески доступных протеаз (пептидаз) включают KannaseTM, EverlaseTM, EsperaseTM, AlcalaseTM, NeutraseTM, DurazymTM, SavinaseTM, OvozymeTM, LiguanaseTM, PolarzymeTM, PyraseTM, панкреатический Трипсин NOVO (PTN), BiO-FeedTM Pro и Clear-LensTM Pro (все доступны от Novozymes A/S, Багсваерд, Дания). Другие коммерческие легкодоступные протеазы включают RonozymeTM Pro, MaxataseTM, MaxacalTM, MaxapemTM, OpticleanTM, ProperaseTM, PurafectTM, Purafect OxTM и Purafect PrimeTM (доступны от Genencor International Inc., Gist-Brocades, BASF, или от DSM Nutritional Products).
Второй фермент
Дополнительно к субтилизину жидкая композиция может включать второй фермент, выбранный из группы, состоящей из амилаз, липаз, целлюлаз, маннаназ, оксидоредуктаз и лиаз; особенно предпочтительной является жидкая композиция, в которой второй фермент представляет собой липазу.
Подходящие амилазы (альфа и/или бета) включают амилазы бактериального или грибкового происхождения. Сюда включены химически или генетически модифицированные мутанты. Амилазы включают, например, альфа-амилазу из B. licheniformis, описанную в GB 1296839. Коммерчески доступные амилазы представляют собой DuramylTM, TermamylTM, StainzymeTM, Stainzyme PlusTM, Termamyl UltraTM, FungamylTM и BANTM (доступные от Novozymes A/S) и RapidaseTM, Maxamyl PTM, Purastar и Purastar OxAm (доступные от Gist-Brocades и Genencor Inc.).
Подходящие целлюлазы могут быть бактериального или грибкового происхождения. Сюда включены химически или генетически модифицированные мутанты. Целлюлаза может быть из Humicola insolens (US 4435307) или из Trichoderma, например T. reesei или T. viride. Примеры целлюлаз описаны в EP 0495257. Коммерчески доступные целлюлазы включают CarezymeTM, CelluzymeTM, CellucleanTM, CelluclastTM и EndolaseTM (доступные от Novozymes), Puradax, Puradax HA и Puradax EG (доступные от Genencor).
Подходящие оксидоредуктазы включают пероксидазу или оксидазу, такую как лакказа. Сюда включены химически или генетически модифицированные мутанты. Пероксидаза может быть растительного, бактериального или грибкового происхождения. Примеры представляют собой пероксидазы, полученные из штамма Coprinus, например, C. cinerius или C. macrorhizus, или из штамма Bacillus, например, B. pumilus, в частности, пероксидаза согласно WO 91/05858. Подходящие лакказы согласно настоящему документу включают лакказы бактериального или грибкового происхождения. Примеры представляют собой лакказы из Trametes, например, T. villosa или T. versicolor, или из штамма Coprinus, например, C. cinereus, или из штамма Myceliophthora, например, M. thermophila.
Подходящие липолитические ферменты включают липазу или кутиназу бактериального или грибкового происхождения. Сюда включены химически или генетически модифицированные мутанты. Примеры включают липазу из Thermomyces lanuginosus (Humicola lanuginosa), описанную в EP 258068 и EP 305216, липазу Rhizomucor miehei, описанную, например, в EP 238023, липазу Candida, такую как липаза C. antarctica, например, липаза А или В из C. antarctica, которые описаны в EP 214761, липазу Fusarium oxysporum (WO 98/26057), липазу Pseudomonas, такую как липаза из P. pseudoalcaligenes и P. alcaligenes, которые описаны, например, в EP 218272, липазу P. cepacia, описанную, например, в EP 331376, липазу P. stutzeri, раскрытую, например, в BP 1372034, липазу P. fluorescens, липазу Bacillus, например, липазу B. subtilis (Dartois et al. (1993), Biochemica et Biophysica acta 1131, 253-260), липазу B. stearothermophilus (JP 64/744992), липазу B. pumilus (WO 91/16422), липазу Penicillium camenbertii (Yamaguchi et al. (1991), Gene 103, 61-67), липазу Geotrichum candidum (Shimada, Y. et al. (1989), J. Biochem. 106, 383-388), и разнообразные липазы из Rhizopus, такие как липаза R. delemar (Hass, M.J. et al. (1991), Gene 109, 117-113), липазу R. niveus (Kugimiya et al. (1992), Biosci. Biotech. Biochem. 56, 716-719) и липазу R. oryzae. Дополнительные примеры представляют собой кутиназу из Pseudomonas mendocina (WO 88/09367), кутиназу из Fusarium solani pisi (WO 90/09446) и кутиназу из Humicola insolens (WO 2001/092502). Липолитический фермент может представлять собой вариант липазы, описанный, например, в WO 2000/060063.
Примеры коммерчески доступных липаз включают LipexTM, LipoprimeTM, LipopanTM, Lipopan FTM, Lipopan XtraTM, LipolaseTM, LipolaseTM Ultra, LipozymeTM, PalataseTM, ResinaseTM, NovozymTM 435 и LecitaseTM (все доступны от Novozymes A/S). Другие коммерчески доступные липазы включают LumafastTM (липаза Pseudomonas mendocina от Genencor International Inc.); LipomaxTM (липаза Ps. pseudoalcaligenes от Gist-Brocades/Genencor Int. Inc.); и липазу Bacillus sp. от фермента Solvay. Дополнительные липазы доступны из других источников, такие как липаза P "Amano" (Amano Pharmaceutical Co. Ltd.).
Подходящие маннаназы включают маннаназы бактериального или грибкового происхождения. Сюда включены химически или генетически модифицированные мутанты. Примеры коммерчески доступных маннаназ включают MannawayTM (продукт Novozymes) и MannaStar (продукт Genencor).
Подходящие лиазы включают лиазы бактериального или грибкового происхождения. Сюда включены химически или генетически модифицированные мутанты. Примеры лиаз включают пектат-лиазу и пектин-лиазу. Примеры коммерчески доступных лиаз представляют собой PectawashTM и PectawayTM (продукты Novozymes).
Настоящее изобретение дополнительно описано с помощью следующих примеров, которые не следует понимать как ограничение рамок сущности изобретения.
ПРИМЕРЫ
Пример 1
Разнообразные пептидные альдегиды были произведены компанией, специализирующейся на пептидном синтезе, все с чистотой >80%. Пептидные альдегиды растворяют в ДМСО до концентрации 10 мг/мл перед использованием.
Модельное жидкое моющее средство получают для тестирования разнообразных стабилизаторов:
Основа моющего средства:
| Компонент | % масс./масс. |
| Алкилэтоксисульфат натрия (С9-15, 2ЕО) | 6,0 |
| Додецилбензолсульфонат натрия | 3,0 |
| Толуолсульфонат натрия | 3,0 |
| Олеиновая кислота | 2,0 |
| Этоксилат первичного спирта (С12-15, 7ЕО) | 3,0 |
| Этоксилат первичного спирта (С12-15, 3ЕО) | 2,5 |
| Этанол | 0,5 |
| Монопропиленгликоль | 2,0 |
| Тринатрийцитрат 2Н2О | 4,0 |
| Триэтаноламин | 0,4 |
| Деионизированная вода | Добавляли 100% |
| рН доводили до 8,5 с помощью NaOH |
Получали эталонное моющее средство с ферментами:
Моющее средство A:
| Компонент | % масс./масс. |
| Основа моющего средства | 99,0 |
| Протеаза (Savinase 16,0 LEX) | 0,5 |
| Липаза (Lipex 100L) | 0,5 |
Далее получали следующие моющие средства со стабилизаторами по изобретению, все примеры нормализованы к 100 г моющего средства:
| ID Моющего средства | Моющее средство А | Стабилизатор (из раствора 10 мг/мл) | Молярный избыток ингибитора по отношению к протеазе |
| B1 | 100 г | 1,3 мг Z-RAY-H | 3 |
| B2 | 100 г | 2,2 мг Z-RAY-H | 5 |
| B3 | 100 г | 4,4 мг Z-RAY-H | 10 |
| C1 | 100 г | 2,8 мг Ac-GAY-H | 10 |
| C2 | 100 г | 7,0 мг Ac-GAY-H | 25 |
| D1 | 100 г | 1,8 мг Z-GAY-H | 5 |
| D2 | 100 г | 3,6 мг Z-GAY-H | 10 |
| E1 | 100 г | 1,4 мг Z-RVY-H | 3 |
| E2 | 100 г | 2,3 мг Z-RVY-H | 5 |
| E3 | 100 г | 4,6 мг Z-RVY-H | 10 |
| F1 | 100 г | 1,3 мг Z-LVY-H | 3 |
| F2 | 100 г | 2,1 мг Z-LVY-H | 5 |
| F3 | 100 г | 4,3 мг Z-LVY-H | 10 |
| G1 | 100 г | 1,1 мг Ac-LGAY-H | 3 |
| G2 | 100 г | 1,9 мг Ac-LGAY-H | 5 |
| G3 | 100 г | 3,7 мг Ac-LGAY-H | 10 |
| H1 | 100 г | 0,6 мг Ac-FGAY-H | 1,5 |
| H2 | 100 г | 1,2 мг Ac-FGAY-H | 3 |
| H3 | 100 г | 2 мг Ac-FGAY-H | 5 |
| H4 | 100 г | 4 мг Ac-FGAY-H | 10 |
| H5 | 100 г | 10 мг Ac-FGAY-H | 25 |
| I1 | 100 г | 1,2 мг Ac-YGAY-H | 3 |
| I2 | 100 г | 2,1 мг Ac-YGAY-H | 5 |
| I3 | 100 г | 4,2 мг Ac-YGAY-H | 10 |
| J1 | 100 г | 1,3 мг Ac-FGVY-H | 3 |
| J2 | 100 г | 2,1 мг Ac-FGVY-H | 5 |
| J3 | 100 г | 4,3 мг Ac-FGVY-H | 10 |
| K1 | 100 г | 1,5 мг Ac-WLVY-H | 3 |
| K2 | 100 г | 2,5 мг Ac-WLVY-H | 5 |
| K3 | 100 г | 5,1 мг Ac-WLVY-H | 10 |
Моющие средства помещали в закрытые стаканы при 35°C и 40°C. Измеряли остаточную активность липазы и протеазы (путем сравнения с эталоном, который хранили при -18°C) в различные моменты времени с использованием стандартных ферментных аналитических методов (активность протеазы измеряли с помощью гидролиза N,N-диметилказеина при 40°C, pH 8,3, и активность липазы измеряли с помощью гидролиза пара-нитрофенилвалерата при 40°C, pH 7,7). В таблице, приведенной ниже, 3x обозначает 3-молярный избыток ингибитора по сравнению с протеазой и т.д.
| Моющее средство | Остаточная протеазная активность 1 неделя 40°С | Остаточная липазная активность 1 неделя 35°С |
| A (эталон) | 11% | 3% |
| B1 (Z-RAY-H, 3х) | 49% | 12% |
| B2 (Z-RAY-H, 5х) | 69% | 37% |
| B3 (Z-RAY-H, 10х) | 79% | 63% |
| C1 (Ac-GAY-H, 10х) | 59% | |
| C2 (Ac-GAY-H, 25х) | 73% | 62% |
| D1 (Z-GAY-H, 5х) | 55% | 22% |
| D2 (Z-GAY-H, 10х) | 77% | 49% |
| E1 (Z-RVY-H, 3х) | 54% | 21% |
| E2 (Z-RVY-H, 5х) | 67% | 36% |
| E3 (Z-RVY-H, 10х) | 80% | 61% |
| F1 (Z-LVY-H, 3х) | 32% | 7% |
| F2 (Z-LVY-H, 5х) | 43% | 15% |
| F3 (Z-LVY-H, 10х) | 59% | 33% |
| G1 (Ac-LGAY-H, 3х) | 62% | 33% |
| G2 (Ac-LGAY-H, 5х) | 82% | 56% |
| G3 (Ac-LGAY-H, 10х) | 90% | 66% |
| H1 (Ac-FGAY-H, 1,5х) | 24% | 4% |
| H2 (Ac-FGAY-H, 3х) | 42% | 12% |
| H3 (Ac-FGAY-H, 5х) | 78% | 63% |
| H4 (Ac-FGAY-H, 10х) | 91% | 72% |
| H5 (Ac-FGAY-H, 25х) | 93% | 72% |
| I1 (Ac-YGAY-H, 3х) | 53% | 14% |
| I2 (Ac-YGAY-H, 5х) | 90% | 66% |
| I3 (Ac-YGAY-H, 10х) | 88% | 75% |
| J1 (Ac-FGVY-H, 3х) | 62% | 48% |
| J2 (Ac-FGVY-H, 5х) | 82% | 66% |
| J3 (Ac-FGVY-H, 10х) | 96% | 70% |
| K1 (Ac-WLVY-H, 3х) | 26% | 3% |
| K2 (Ac-WLVY-H, 5х) | 35% | 8% |
| K3 (Ac-WLVY-H, 10х) | 53% | 18% |
Результаты демонстрируют, что тирозиновые пептидные альдегиды представляют собой очень эффективные стабилизаторы протеаз.
Пример 2
Получали эталонное моющее средство с ферментами:
Моющее средство L:
| Компонент | % масс./масс. |
| Основа моющего средства из примера 1 | 98,5 |
| Протеаза (Савиназа 16,0 LEX) | 0,5 |
| Липаза (Липекс 100L) | 0,5 |
| Амилаза (Стаинзим 12L) | 0,5 |
Получали следующее моющее средство со стабилизатором по изобретению и нормализовали к 100 г моющего средства:
| ID моющего средства | Моющее средство L | Стабилизатор (из раствора 10 мг/мл) | Молярный избыток ингибитора по отношению к протеазе |
| М | 100 г | 2 мг Ac-FGAY-H | 5 |
Моющие средства помещали в закрытые стаканы при 25°C и 35°C. Измеряли остаточную активность липазы, амилазы и протеазы (путем сравнения с эталоном, который хранили при -18°C) в различные моменты времени (н=недели) с использованием стандартных ферментных аналитических методов (активность протеазы измеряли с помощью гидролиза N,N-диметилказеина при 40°C, pH 8,3, и активность липазы измеряли с помощью гидролиза пара-нитрофенилвалерата при 40°C, pH 7,7 и активность амилазы измеряли с помощью гидролиза 4,6-этилиден-(G7)пара-нитрофенил-(G1)-α,D-мальтогептазоида при 37°C, pH 7,35).
| % остаточной активности | Остаточная протеазная активность | Остаточная липазная активность | Остаточная амилазная активность | |||
| Моющее средство | 4н 35°C | 13н 25°C | 4н 35°C | 13н 25°C | 4н 35°C | 13н 25°C |
| L (эталон) | 35% | 62% | 1% | 2% | 34% | 42% |
| M (Ac-FGAY-H, 5×) | 91% | 100% | 16% | 71% | 70% | 88% |
Видно, что тирозиновый пептидный альдегид значительно улучшает стабильность протеазы, липазы и амилазы в жидком моющем средстве при хранении.
Пример 3
Пептидные альдегиды Z-GAF-H, Z-GAL-H и Z-GAY-H получали с помощью пептидного синтеза, все с чистотой >80%. Пептидные альдегиды растворяли в ДМСО до концентрации 10 мг/мл перед использованием.
Получали следующее моющее средство N с ферментами:
| Компонент | % масс./масс. |
| Алкилэтоксисульфат натрия (С9-15, 2ЕО) | 20,0 |
| Толуолсульфонат натрия | 3,0 |
| Олеиновая кислота | 4,0 |
| Этоксилат первичного спирта (С12-15, 7ЕО) | 2,5 |
| Этоксилат первичного спирта (С12-15, 3ЕО) | 2,0 |
| Этанол | 2,1 |
| Карбонат натрия | 4,5 |
| Тринатрийцитрат 2Н2О | 5,0 |
| Деионизированная вода | Добавляли 99% |
| рН доводили до 8,0 с помощью NaOH | |
| Протеаза (Савиназа 16.0 LEX) | 0,5 |
| Липаза (Липекс 100L) | 0,5 |
Получали следующие моющие средства со стабилизатором по изобретению и нормализовали к 100 г моющего средства:
| ID моющего средства | Моющее средство А | Стабилизатор (из раствора 10 мг/мл) | Молярный избыток ингибитора по отношению к протеазе |
| P (этанол) | 100 г | Нет | 0 |
| Q1 | 100 г | 0,16 мг Z-GAL-H | 0,5 |
| Q2 | 100 г | 0,31 мг Z-GAL-H | 1,0 |
| Q3 | 100 г | 0,62 мг Z-GAL-H | 2,0 |
| Q4 | 100 г | 1,6 мг Z-GAL-H | 5,0 |
| R1 | 100 г | 0,17 мг Z-GAF-H | 0,5 |
| R2 | 100 г | 0,34 мг Z-GAF-H | 1,0 |
| R3 | 100 г | 0,68 мг Z-GAF-H | 2,0 |
| R4 | 100 г | 1,7 мг Z-GAF-H | 5,0 |
| S1 | 100 г | 0,18 мг Z-GAY-H | 0,5 |
| S2 | 100 г | 0,35 мг Z-GAY-H | 1,0 |
| S3 | 100 г | 0,71 мг Z-GAY-H | 2,0 |
| S4 | 100 г | 1,8 мг Z-GAY-H | 5,0 |
Моющие средства помещали в закрытые стаканы при 40°C. Измеряли остаточную протеазную активность (путем сравнения с эталоном, который хранили при -18°C) через 1 неделю с использованием стандартных ферментных аналитических методов (активность протеазы измеряли с помощью гидролиза N,N-диметилказеина при 40°C, pH 8,3).
% остаточной протеазной активности через 1 неделю при 40°C:
| Молярный избыток ингибитора по отношению к протеазе | Моющее средство N (эталон) | Моющее средство N + Z-GAL-H | Моющее средство N + Z-GAF-H | Моющее средство N + Z-GAY-H |
| 0 | 7% (P) | |||
| 0,5 | 12% (Q1) | 11%(R1) | 13%(S1) | |
| 1 | 17% (Q2) | 18%(R2) | 28%(S2) | |
| 2 | 31% (Q3) | 28%(R3) | 41%(S3) | |
| 5 | 42% (Q4) | 44%(R4) | 65%(S4) |
Результаты демонстрируют, что все три пептидных альдегида являются эффективными для стабилизации протеазы. Было обнаружено, что тирозиновый пептидный альдегид Z-GAY-H является наиболее эффективным, поскольку он требует только приблизительно половину избытка ингибитора по отношению к протеазе для достижения таких же остаточных активностей, как с использованием других пептидных альдегидов.
1. Пептидный альдегид формулы B2-B1-B0-H, гдеН означает водород;В0 представляет собой остаток Тyr;B1 представляет собой один аминокислотный остаток Аlа или Val; иB2 представляет собой один аминокислотный остаток с присоединенной бензилоксикарбонильной группой (Cbz) или В2 представляет собой два аминокислотных остатка, содержащих ацетильную (Ас) N-концевую защитную группу.
2. Пептидный альдегид по п.1, где В2 представляет собой один остаток Gly, Arg или Leu с присоединенной бензилоксикарбонильной (Cbz) группой.
3. Пептидный альдегид по п.1, где В2 состоит из двух аминокислотных остатков, содержащих ацетильную (Ас) N-концевую защитную группу, где один из остатков В2 представляет собой Phe, Gly или Leu, а второй остаток В2 представляет собой Phe, Gly, Leu, Тyr или Тrp.
4. Пептидный альдегид формулы Z-RAY-H, Ac-GAY-H, Z-GAY-H, Z-RVY-H, Z-LVY-H, Ac-LGAY-H, Ac-FGAY-H, Ac-YGAY-H, Ac-FGVY-H или Ac-WLVY-H, где Z представляет собой бензилоксикарбонил, и Ас представляет собой ацетил.
5. Пептидный альдегид по п.4, представляющий собой Z-RAY-H, Z-GAY-H, Z-RVY-H или Z-LVY-H, где Z представляет собой бензилоксикарбонил.
6. Жидкая моющая композиция, включающая поверхностно-активное вещество, субтилизин и пептидный альдегид по любому из пп.1-5.