Способ получения глоботриозы
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Способ получения глоботриозы заключается в ферментативном переносе галактозного мономера от донора галактозила на лактозу, выполняющую роль акцептора. В качестве донора галактозного мономера используют β-галактозилазид. В качестве фермента используют α-1,4-галактозилсинтазу, полученную путем введения двух замен D327G и P402D в соответствующих положениях аминокислотной последовательности гена альфа-галактозидазы дикого типа, выделенной из Thermotoga maritima. При этом реакцию проводят при 37°С, рН 5,0 до полного расщепления β-галактозилазида. Изобретение обеспечивает повышение выхода и чистоты глоботриозы. 1 з.п. ф-лы, 2 ил., 1 пр.
Реферат
Изобретение относится к области биотехнологии. В частности, настоящее изобретение раскрывает способ ферментативного синтеза глоботриозы с использованием гликозидгидролаз и лактозы.
Глоботриоза (αGal-(1,4)-β-Gal-(1,4)Glc) - это трисахарид, у которого концевой остаток галактозы присоединен к следующему через α-1,4-O-гликозидную связь. Глоботриоза является концевым эпитопом, обнаруженным на поверхности многих человеческих клеток (так называемый Pk-антиген групп крови) и, как предполагают, является важным вирулентным детерминантом для Н.influenzae (Biochemistry, 2003) [1]. Глоботриоза способна связывать и обеспечивать проникновение в организм человека так называемых шига-токсинов, вырабатываемых Shigella dysenteriae и патогенными штаммами Е.coli, часто обнаруживаемые при пищевых отравлениях: Clin Microbiol Rev 11: 450-479 (1998) [2]. Глоботриоза полностью ингибирует и обращает клеточную агглютинацию, а также вызывает снижение связывания с 3-фимбриальным адгезином уропатогенного штамма Е.coli от 10 до 100 раз (Antimicrob. Agents Chemother., 2005) [3]. Одной из эффективных стратегий борьбы с указанными бактериальными болезнями является адсорбция токсинов и патогенных бактерий и последующее их выведение из организма. В качестве сорбента применяют искусственно синтезированную глоботриозу и ее производные: J Infect Dis 189: 360-368 (2004) [4]. Кроме того, на основе глоботриозы, содержащей наночастицы золота, можно проводить экспресс-анализ для выявления данных заболеваний на ранних стадиях: Antimicrob Agents Chemother 49: 3842-3846 (2005) [3], либо для обнаружения присутствия бактерий в пищевых продуктах: Microbiol Immunol (2007) 51(6): 581-592 [5]. Таким образом, синтез глоботриозы крайне необходим для удовлетворения возрастающего спроса на такие соединения для фармацевтической промышленности: US 2005085441 (А1) [6], US 2003040503 (A1) [7], JP 2002145896 (A) [8].
Существуют два способа синтеза этого соединения и его производных: химический и ферментативный.
Традиционный химический метод синтеза глоботриозы состоит из не менее 12 трудоемких стадий, включающих блокирование и деблокирование реакционно-способных химических групп. Кроме того в результате такого синтеза помимо основного продукта появляются вредные с экологической точки зрения отходы (А concise and practical synthesis of antigenic globotriose, α-d-Gal-(1→4)-β-d-Gal-(1→4)-β-d-Glc by Langqiu Chen; Xing-E. Zhao; Duan Lai; Zhiwei Song; Fanzuo Kong (pp.1174-1180) [9].
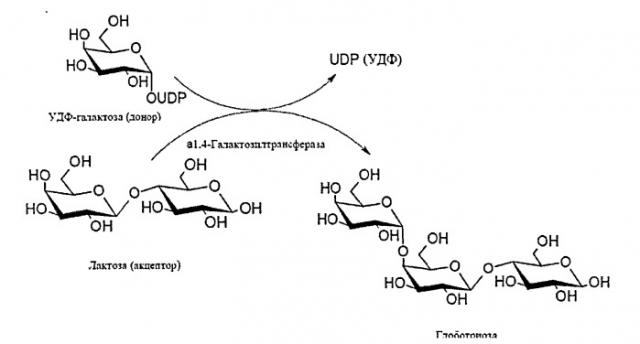
Ферментативный способ заключается в ферментативном переносе (галактозила) от УДФ-галактозы (галактозильный донор) на лактозу (акцептор), катализируемым специальным ферментом, α-1,4-галактозилтрансферазой, и описан в работе Carohydr. Res., 337 (2002) 969-976 [10].
Схема 1. Схема ферментативного синтеза глоботриозы, катализируемого α-1,4-галактозилтрансферазой.
К недостаткам этого способа следует отнести такие факторы, как нестабильность фермента и высокая цена нуклеотид-активированного сахара (УДФ-галактозы), являющегося субстратом при направленном синтезе олигосахаридов с помощью α-1,4-галактозилтрансферазы. Авторы приведенной работы предлагают использование более дешевого нуклеотид-активированного субстрата, УДФ-глюкозы, который для получения конечного продукта необходимо предварительно трансформировать в УДФ-галактозу, что происходит под воздействием еще одного нестабильного фермента, УДФ-галактоза-4-эпимеразы.
Для повышения эффективности процесса переноса галактозильного остатка на лактозу была разработана микробная система синтеза глоботроизы и других глобо-олигосахаридов, включающая в себя использование помимо α-1,4-галактозилтрансферазы еще нескольких ферментов, гены которых были введены в геном штамма Haemophilus influenzae (патент US 2007/202578 A1 [11]).
Для того чтобы избежать необходимости использования нуклеотид-активированных сахаров (донора галактозильного остатка) и гидролиза получаемой глоботриозы самими клетками, был создан такой штамм, в геноме которого искусственно были удалены гены бета-галактозидазы, способной гидролизовать лактозу (субстрат-акцептор), и альфа-галактозидазы, гидролизующей получающуюся глоботриозу. Одновременно в генетическую конструкцию были внесены гены ферментов (α-1,4-галактозилтрансферазы, бета-галактозид пермеазы и УДФ-галактоза-4-эпимеразы), поддерживающих синтез глоботриозы, и создана высокоэффективная система их экспрессии [11].
Данный способ дает хороший выход глоботриозы. Однако его недостатком является образование побочных галакто-олигосахаридов в процессе ферментации микроорганизма, что усложняет выделение глоботриозы и снижает ее чистоту. Кроме того, подобные искусственные генетические конструкции сложны в реализации и, как правило, не являются стабильными для длительного использования и требуют постоянного контроля и воспроизведения.
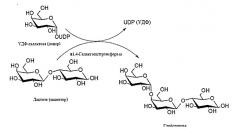
Наиболее близким к заявляемому является следующий способ получения глоботриозы (Rytchkov G.N. et al. Modification of regiospecificity of the alpha-galactosidase from Thermotoga maritima towards pharmaceutically important globotriose. 2008; p.173-174 [12]). Идея авторов данной работы состояла в использовании природной способности альфа-галактозидазы из Thermotoga maritima катализировать реакцию трансгликозилирования, в результате которой при добавлении в реакцию соответствующего акцептора (лактозы) авторы ожидали синтезировать глоботриозу (см. Схему 2). Кроме того, авторы предложили изменить природную региоселективность альфа-галактозидазы путем замены аминокислотных остатков таким образом, чтобы снизить способность фермента синтезировать другие галактозидные связи кроме альфа-1,4-галактозидной, необходимой для синтеза глоботриозы. Для этого в работе предложено разработать стратегию компьютерного дизайна рассматриваемой гликозидгидролазы. В результате данной работы предложены несколько точечных мутаций, которые теоретически могут привести к улучшению природной региоселектинвости альфа-галактозидазы в сторону альфа-1,4-галактозидных связей.
Схема 2. Схема ферментативного синтеза глоботриозы с помощью альфа-галактозидазы.
Однако этот способ имеет существенный недостаток. Глоботриоза, образующаяся в ходе реакции трансгликозилирования, катализируемой альфа-галактозидазой, одновременно подвергается гидролизу той же альфа-галактозидазой, что снижает выход целевого продукта. И кроме того, в этой работе экспериментально не показано наличие генетических мутаций, обеспечивающих альфа-галактозидазе узконаправленную региоселективность по отношению к образованию альфа-1,4-связей, а предложены лишь теоретические предпосылки к изменению этого свойства.
Задачей данного изобретения является повышение выхода и чистоты целевого продукта (глоботриозы).
Поставленная задача достигается тем, что в известном способе получения глоботриозы, заключающемся в ферментативном переносе галактозного мономера от донора галактозила на лактозу, выполняющую роль акцептора, новым является то, что в качестве донора галактозного мономера используют β-галактозилазид, в качестве фермента используют генетически модифицированную гликозидгидролазу, а именно α-1,4-галактозилсинтазу, полученную путем введения двух замен D327G и P402D в соответствующих положениях аминокислотной последовательности гена альфа-галактозидазы дикого типа, выделенной из Thermotoga maritima, причем реакцию проводят при 37°С, рН 5,0 до полного расщепления β-галактозилазида. По окончании реакции избыток акцептора (лактозы) гидролизуют с применением β-галактозидазы, а мономерные остатки сахаров удаляют хроматографией с активированным углем.
Заявляемая совокупность признаков позволяет сместить региоселективность альфа-галактозилсинтазы, полученную на основе природной альфа-галактозидазы, в сторону получения глоботриозы.
Суть способа состоит в том, что получение α-1,4-галактозилсинтазы для синтеза глоботриозы заключается во введении замены аминокислотного остатка в соответствующем положении аминокислотной последовательности исходного фермента дикого типа, выделенного из штамма Thermotora maritima MSB8 [13], выполняющего роль нуклеофила, остатка аспарагиновой кислоты 327 на глицин (D327G), чтобы предотвратить гидролиз альфа-галактозидных связей и способствовать их образованию (синтезу), и замены аминокислотного остатка пролина 402 на аспартат (P402D), который отвечает за региоселективность фермента в отношении α-1,4-галактозидной связи в реакции синтеза глоботриозы.
На фиг.1 показано расположение молекулы глоботриозы вблизи галактозил-α-галактозидазного комплекса мутантной формы фермента, содержащего мутации D327G_P402D. Показаны каталитические аминокислотные остатки D327 и D387, мутированный аминокислотный остаток P402D и глоботриозид. Показано условное расположение +1 и -1 сайтов связывания галактозила в активном центре фермента.
На фиг.2 представлен сравнительный 1Н ЯМР-спектр глоботриозы (αGal-(1,4)-β-Gal-(1,4)Glc), ее региоизомера, изо-глоботриозы (αGal-(1,3)-β-Gal-(1,4)Glc), и реакционной смеси, полученной в результате реакции синтеза глоботриозы, катализируемой α-1,4-галактозилсинтазой (мутантный фермент D327G_P402D), а также после реакции с бета-галактозидазой для гидролиза непрореагировавших лактозы и бета-галактозилазида и после очистки ее на колонке с активированным углем.
На сегодняшний день известно, что альтернативным инструментом синтеза олигосахаридов вообще и, в частности, глоботриозы, могут быть гликозидгидролазы (или так называемые трансгликозидазы). Эти ферменты, помимо своей природной способности гидролизовать олигосахариды, способны катализировать реакции трансгликозилирования, т.е. реакции переноса гликозильного остатка (в нашем случае галактозила) на гидроксильную группу другого сахара, выполняющего роль акцептора: Industrial Enzymes, 2007: 141-157 [14]. Очевидными преимуществами использования таких микробных гликозидгидролаз в ферментативном синтезе олигосахаридов, в частности глоботриозы, являются их стабильность, простота выделения и дешевые субстраты (природные сахариды).
Однако есть два существенных недостатка использования трансгликозидаз в синтезе биологически значимых олигосахаридов. Во-первых, это их природная способность гидролизовать полученные продукты реакции. Во-вторых, это низкая региоселективность описываемых гликозидгидролаз (т.е. их способность синтезировать большой набор региоизомеров в результате реакции трансгликозилирования). Оба эти фактора (гидролиз продуктов и низкая региоселективность) оказывают существенное влияние на выход и чистоту целевого соединения.
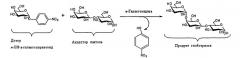
Решением первой проблемы, а именно подавления гидролиза для увеличения выхода целевых соединений в процессе ферментативного синтеза трансгликозидазами, является проведение реакции с использованием генетически модифицированных гликозидгидролаз или так называемых гликозилсинтаз (Biochemistry, 1992, 31(41): 9979-85) [15]. Этот подход реализуется в замене аминокислотного остатка, выполняющего роль нуклеофила в реакции гидролиза гликозидной связи, на нейтральный аминокислотный остаток. Субстратами для подобных ферментов являются активированные сахара с измененной аномерной конфигурацией (так, для α-гликозилсинтаз используются β-гликозилфториды, а для β-гликозилсинтаз - α-гликозилфториды). При этом механизм реакции меняется с двухстадийного на одностадийный, а образованные в результате реакции синтеза соединения не гидролизуются ферментом, что заметно увеличивает их выход.
Теоретически схема реакции получения альфа-галактоолигосахаридов с помощью гликозилсинтазы (α-галактозилсинтазы) может быть описана следующим образом (Схема 3).
Схема 3. Механизм реакции синтеза олигосахаридов α-галактозилсинтазой.
Следует заметить, что описанная стратегия была неэффективна в отношении именно α-гликозилсинтаз, создаваемых на основе α-гликозидгидролаз. Тем не менее, для преодоления проблемы снижения выхода целевых продуктов вследствие гидролитической активности природного фермента была предпринята попытка создать на основе α-D-галактозидазы из Thermotoga maritima (Biochemistry, 2007, 46 (II): 3319-3330 [13]) α-галактозилсинтазу, заменив остаток аспарагиновой кислоты в 327 положении, выполняющий роль нуклеофила при гидролизе гликозидной связи, на остаток глицина. Была опубликована работа, сообщающая о создании α-галактозилсинтазы на основе дикого типа α-D-галактозидазы из Т.maritima. В качестве активированного донора для этого фермента использовался β-галактозилазид: Glycobiology, 2011, 4:48-456 [16]. Однако в данной работе описана низкая региоселективность созданного мутантного фермента (α-галактозилсинтазы), что выражается в способности синтезировать олигосахариды с разными типами связи (в основном, α-1,3 и α-1,6).
Экспериментальным путем было показано, что если в качестве субстрата для данного фермента использовать лактозу, то глоботриоза (αGal-(1,4)-β-Gal-(1,4)Glc) не образуется в детектируемых количествах. Вместо глоботриозы в данной реакции образуется изо-глоботриоза, αGal-(1,3)-β-Gal-(1,4)Glc.
Заявляемый способ основан на том, что решена проблема изменения природной региоселективности α-галактозилсинтазы с помощью замены аминокислотного остатка, оказывающего влияние на образование именно α-1,4-галактозильной связи в синтезе глоботриозы.
Для этого были проведены in silico мутации фермента, способные вызвать изменение региоселективности α-галактозилсинтазы в реакции трансгликозилирования. Для этой цели были построены молекулярные модели трисахаридов αGal-(1,3)-βGal-(1,4)-Glc, αGal-(1,4)-βGal-(1,4)-Glc и αGal-(1,6)-βGal-(1,4)-Glc, а также лактозы βGal-(1,4)-Glc и галактозы αGal в on-line программе GLYCAM Biomolecular Builder (Woods Group. (2005-2008) GLYCAM Web. Complex Carbohydrate Research Center, University of Georgia, Athens, GA (http://www.glycam.com)). Для моделирования реакции трансгликозилирования была построена модель галактозил-ферментного интермедиата и выполнен докинг этого интермедиата с возможным акцептором гликозидной связи, лактозой.
Выбор позиций для сайт-направленного мутагенеза аминокислотной последовательности альфа-галактозилсинтазы D327G [13] осуществляли следующим образом:
а) проводят пространственное наложение активных центров ферментов, обладающих высокой гомологией их аминокислотных последовательностей и сходством трехмерных структур, кристаллическая структура которых содержит остаток D-галактозы, на основании проведенного наложения структур устанавливают возможное расположение D-галактозы в активном центре α-галактозилсинтазы;
б) уточняют методами молекулярной динамики возможное расположение D-галактозы в активном центре α-галактозилсинтазы D327G, определяют общие аминокислотные остатки ферментативного центра, образующие водородные связи с D-галактозой, и выявляют возможные положения D-галактозы относительно каталитического аминокислотного остатка фермента D387, выполняющего роль кислотно-основного катализатора;
в) проводят in silico мутации α-галактозилсинтазы, при этом отбирают позиции аминокислотных остатков для сайт-направленного мутагенеза по следующим критериям: ослабление взаимодействий и препятствование связыванию лиганда в активных конформациях, выгодных для образования связей 1→3 и 1→6; усиление взаимодействий, способствующих связыванию в активных конформациях, выгодных для образования связи 1→4.
После выбора позиций по крайней мере один из отобранных на этапе в) аминокислотных остатков путем введения соответствующей мутации в ген α-D-галактозилсинтазы замещают другим аминокислотным остатком, а именно P402D, обеспечивающим преимущественное образование α-1,4-галактозидной связи и подавление образования других связей.
Анализ результатов моделирования использовался для выработки рекомендаций по заменам аминокислотным остаткам с целью изменения региоселективности фермента для преимущественного выхода глоботриозы. В частности, замена пролина в 402-м положении на полярный остаток аспарагиновой кислоты приводит к расширению входа в активный центр в области аномерного углерода стабильного интермедиата и стабилизации положения акцептора через взаимодействия между ОН-4 акцептора и аномерным центром галактозного кольца в интермедиате. Более плотный контакт гидроксилов лактозы с аномерным центром облегчит реакцию гликозилирования (фиг.1).
Способ получения глоботриозы заключается в следующем.
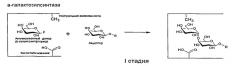
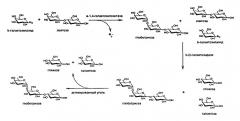
Для синтеза и выделения глоботриозы была разработана схема (Схема 4), включающая в себя три стадии:
1. Собственно реакция синтеза, проведенная при 37°С, рН 5,0, до полного расщепления β-галактозилазида.
2. Обработка реакционной смеси β-галактозидазой. Данная стадия позволяет избавиться от лактозы и остатков субстрата. После этой стадии смесь содержит глоботриозу, а также галактозу и глюкозу.
3. Выделение глоботриозы. Для разделения смеси глоботриозы и моносахаридов используется колонка с активированным углем.
Схема 4. Схема ферментативного синтеза глоботриозы по заявляемому способу.
Пример конкретной реализации 1. Получение α-1,4-специфической D-галактозилсинтазы.
Плазмиду pET24D-galA, позволяющую экспрессировать ген α-галактозидазы из термофильной бактерии Thermotoga maritima (ТмГалА) MSB8 (ORF TM1192) в клетках кишечной палочки Е.coli, был любезно предоставлен проф. Робертом Келли из Государственного университета Северной Каролины (США). Плазмиду pET24D-galAD327GP402G с геном α-галактозидазы, содержащей две аминокислотные замены (а.з.) Asp327Gly и Pro402Asp, получили методом сайт-направленного мутагенеза, введя мутацию в плазмиду pET24D-galAD227G, приводящую к замене P402D в белке ТмГалА, уже имеющем а.з. D327G. Введение мутации в ген galA, приводящей к а.з. D327G в белке ТмГалА, описано в работе, опубликованной в журнале Biochemistry, 2007, 46(11): 3319-3330 [13].
Плазмиду pET24D-galAD327G выделили с помощью набора QIAGEN plasmid midi kit (кат.№12143). Для проведения сайт-направленного мутагенеза была проведена полимеразная цепная реакция с использованием следующих праймеров: P4020for для: 5'-GAACATATAGAAGACAACGGtGCTGACGCTGCAAGATGG-3', P402Drev: 5'-CCATCTTGCAGCGTCAGCaCCGTTGTCTTCTATATGTTC-3'. ПЦР проводили следующим образом: реакционную смесь прогревали при 95°С в течение 3 минут; затем следовали 20 циклов выдерживания смеси при 95°С 30 секунд, при 55°С 1 минуту и при 68°С 12 минут. Продукты ПЦР были обработаны рестриктазой DpnI для того, чтобы избавиться от исходной плазмиды. Далее амплифицированные однонитевые нити плазмиды с геном α-галактозидазы Asp327Gly_Pro402Asp были трансформирована в штамм Escherichia coli BL-21 (DE3) по методу, описанному в работе «Молекулярное клонирование». 1984. С.240-241 [17]. Культуру, выращенную на чашке с агаризованной средой Луриа-Бертони (LB), с добавлением 50 мг/л канамицина, инокулировали в 5 мл жидкой среды LB, содержащей 50 мг/л канамицина, и растили в течение ночи при 37°С. Далее 1 мл ночной культуры инокулировали в 100 мл среды LB с 50 мг/л канамицина, растили при 37°С на шейкере до ОП600 0,4-0,6 и добавляли ИПТГ до конечной концентрации 1 ммоль. Далее колбу оставляли на шейкере при 37°С в течение ночи.
Все стадии очистки рекомбинантной α-1,4-галактозилсинтазы выполняли при 4°С. Клетки центрифугировали (Beckman Coulter, 8000 об/мин, 40 мин), дважды промывали 50 ммоль/л калий-фосфатным буфером, рН 7,0 (буфер А), с добавлением 1 ммоль/л ЭДТА. Клетки ресуспендировали в этот же буфер (объем 5 мл), содержащий 1 мг/мл лизоцима (Sigma Chemical Co., USA), и оставляли на 1 час при 37°С. Полученную суспензию, предварительно выдержанную при +4°С в течение 45 минут, обрабатывали ультразвуком (6×20 сек) и центрифугировали (10000 об/мин, 30 мин). Полученный супернатант выдерживали 20 мин при температуре +60°С для денатурации нерекомбинантных белков и лизоцима. Осадок центрифугировали (10000 об/мин, 30 мин). Супернатант диализовали против 10 ммоль/л калий-фосфатного буфера, рН 7,0 (буфер Б). Полученную фракцию α-1,4-галактозилсинтазы наносили на колонку DEAE-Toypearl 65 ОМ (10×100 мм), уравновешенную буфером Б. Белок элюировали линейным градиентом (0,01-0,5 М) калий-фосфатного буфера, рН 7.0, (скорость протекания 1 мл/мин, в течение 60 мин). Фракции, содержащие α-галактозидазную активность, концентрировали на мембране Millipore (Centriocon YM-30, кат. №4209) до 2 мл. Белок очищали при помощи гель-фильтрации на колонке Sephacryl S-200 (22×960 мм) (Pharmacia), уравновешенной буфером А (объем фракций 5 мл, скорость протекания 1,5 мл/мин).
Чистоту полученного фермента устанавливали с помощью электрофореза в 10%-ном полиакриламидном геле с использованием додецилсульфата натрия по методу Лаэммли: Nature (1970) 227: 680-685 [18] с использованием стандартного набора белков с молекулярными массами 14400-94000 Да в качестве реперов (LMW, Pharmacia Biotech, Швеция).
Концентрацию фермента измеряли методом Лоури с использованием бычьего сывороточного альбумина (БСА) в качестве стандарта: J. Biol. Chem. (1951)193(1): 265-275 [19].
2. Синтез глоботриозы.
Реакцию синтеза глоботриозы проводили следующим образом. Реакционную смесь (общий объем 300 мкл), содержащую 33 мМ β-галактозилазида (в качестве донора галактозильного остатка) и 133 мМ лактозы (в качестве акцептора галактозильного остатка) в 50 мМ натрий-ацетатном буфере (рН 5,0) и 100 мкг фермента (α-1,4-галактозилсинтазы), инкубировали при 37°С до полного гидролиза субстрата. Конверсию (расщепление) субстрата определяли при помощи тонкослойной хроматографии на Kieselgel 60 пластинах (Е.Merck) с подвижной фазой бутан-1-ол-уксусная кислота-вода (в соотношении 3:1:1 об./об.). Аликвоты реакционной смеси по 5 мкл наносили на пластинки, далее высушивали. После окончания хроматографии для проявления хроматографических зон пластину обрабатывали 5% H2S04 в 2-пропаноле и прогревали при 120°С в течение 8 мин.
Препаративная реакция синтеза глоботриозы проводилась следующим образом. В реакционную смесь (общий объем 2,9 мл), содержащую 33 мМ β-галактозилазида и 133 мМ лактозы в 50 мМ натрий ацетатном буфере, рН 5,0, добавлялось 290 мкг фермента (α-1,4-галактозилсинтазы). Далее смесь инкубировали при 37°С до полного гидролиза β-галактозилазида. После этого к смеси добавлялось 100 мкг β-галактозидазы, и смесь инкубировали при 37°С еще сутки. Для инактивации ферментов смесь кипятилась при 100°С в течение 10 минут, после чего ее пропустили через колонку с активированным углем объемом 10 мл. Далее колонку промыли 110 мл воды, после чего смыли глоботриозу 10 мл 50%-ного этанола. Массу сахаров в водной фракции, которая оказалась равна 110 мг, определяли методом Сомоджи-Нельсона. Спиртосодержащая фракция была высушена, и полученная глоботриоза была взвешена. Ее масса составила 14 мг.
3. Проверка чистоты получаемого продукта.
Чтобы детектировать накопление сахаридов в течение реакции, использовался чувствительный метод ЯМР. 1Н ЯМР-спектроскопия в этом случае является чрезвычайно точным и удобным методом, поскольку, в отличие от спектрофотометрических методов, позволяет наблюдать кинетику образования продуктов трансгликозилирования. В отличие от хроматографических методов, 1Н ЯМР-спектроскопия не требует трудоемких процедур выделения продуктов реакции и, соответственно, позволяет избежать дополнительных ошибок.
Все ЯМР-спектры для олигогалактозидов были получены на приборе DRX-400 ЯМР-спектрометр (Bruker, Германия), рабочая частота для протонов 400 МГц, для изотопов углерода С13 100,6 МГц). Олигогалактозиды были растворены в дейтерированной воде (D2O) до минимального объема образца 600 мкл, с добавлением 0,1% ацетона в качестве эталона химического сдвига (химический сдвиг ацетона: 2,225 ppm для 1Н и 31,5 ppm для 13С). Спектры снимались при комнатной температуре 293 K. Для стабилизации поля использовалась D2O с обогащением по дейтерию 99.96% производства фирмы Aldrich.
Интегрирование сигналов аномерных протонов сахаридов, находящихся в реакционной смеси, позволило определить концентрации каждого из продуктов. Область детектирования сигналов от аномерных протонов сахаридов лежит в диапазоне шкалы 3,00-5,40 ppm. На фиг.2 пунктирными линями обозначено соотнесение пиков, характерных для глоботриозы (3,16, 4,06, 4,55 и 5,02 ppm), синтезируемой в процессе реакции, катализируемой альфа-1,4-галактозилсинтазой, после обработки реакционной смеси бета-галактозидазой и очистки ее на колонке с активированным углем.
Интегрирование площадей пиков продуктов реакции методом ЯМР показало, что глоботриоза является основным продуктом, при этом ее выход составляет 62%.
Таким образом, заявляемый способ позволяет упростить ферментативный способ синтеза глоботриозы за счет использования генетически модифицированного фермента, который способен синтезировать только α-1,4-галактозидную связь (решена проблема повышения региоселективности α-галактозилсинтазы и увеличения выхода и чистоты продукта). В данном способе используются более дешевый галактозильный донор и более стабильный фермент.
Область применения: глоботриоза, полученная с использованием α-1,4-галактозилсинтазы, используется как сорбент токсинов и патогенных бактерий для обнаружения присутствия бактерий в пищевых продуктах.
Литература
1. Structure of extended lipopolysaccharide glycoforms containing two globotriose units in Haemophilus influenzae serotype b strain RM7004. Masoud, H., Martin, A., Thibault, P., Moxon, E.R., Richards, J.C. Biochemistry (2003).
2. J.C.Paton and A.W.Paton (1998). Pathogenesis and diagnosis ofShiga toxin-producing Escherichia coli infections, din Microbiol Rev 11:450-479.
3. J.L.Leach, S.A.Garber, A.A.Marcon, and P.A.Prieto (2005). In vitro and in vivo effects of soluble, monovalent globotriose on bacterial attachment and colonization. Antimicrob Agents Chemother 49: 3842-3846.
4. M.Watanabe, К.Matsuoka, E.Kita, К.Igai, N.Higashi, A.Miyagawa, T.Watanabe, R.Yanoshita, et al. (2004). Oral therapeutic agents with highly clustered globotriose for treatment ofShiga toxigenic Escherichia coli infections. JInfect Dis 189:360-368.
5. Neri, P., Nagano, S. I., Yokoyama, S. и др. Neutralizing activity of polyvalent Gb3, Gb2 and galacto-trehalose models against Shiga toxins / Neri, P., Nagano, S. I., Yokoyama, S. [и др.] // Microbiol Immunol - 2007. - V.51. - No.6 - P.581-592.
6. US 2005085441 ГАП. МПК А61К 31/75. приоритет 2002-10-22.
7. US 2003040503 (A1). МПК А61К 31/715, приоритет 2001-05-24.
8. JP 2002145896 (A), МПК Н02М 7/48. приоритет 1999-12-16
9. A concise and practical synthesis of antigenic globotriose, a-d-Gal-(1→4)-β-d-Gal-(1→4)-β-d-Glc by Langqiu Chen; Xing-E. Zhao; Duan Lai; Zhiwei Song; Fanzuo Kong (pp.1174-1180)
10. Zhang J., Rowal P., Fang J., Andreana P., Wang P.G. Efficient chemoenzymatic synthesis of globotriose and its derivatives with a recombinant α-1,4-galactosyltrasnferase. Carohvdr. Res.. 337 (2002) 969-976.
11. US 2007202578 (A1), МПК C12N 1/21, C12N 15/74, приоритет 2005-08-06.
12. Rytchkov G.N. et al., Modification of regiospecificity of the alpha-galactosidase from Thermotoga maritima towards pharmaceutically important globotriose. 2008; p.173-174.
13. Comfort, D.A., Bobrov, K.S., Ivanen, D.Р. [и др.]. Biochemical analysis of Thermotoga maritima GH36 alpha-galactosidase (TmGalA) confirms the mechanistic commonality of clan GH-D glycoside hydrolases. Biochemistry, 2007, 46 (II): 3319-3330.
14. Plou, F.J., de Segura, A.G. and Ballesteros, A. Application of Glycosidases and Transglycosidases in the Synthesis of Oligosaccharides In Industrial Enzymes. Edited by J.Polaina and A.P.MacCabe: Springer Netherlands; 2007:141-157.
15. Withers SG, Rupitz K, Trimbur D, Warren RA. Mechanistic consequences of mutation of the active site nucleophile Glu 358 in Agrobacterium beta-glucosidase. Biochemistry. 1992 Oct 20; 31 (41):9979-85.
16. B.Cobucci-Ponzano, C.Zorzetti, A.Strazzulli, S.Carillo, E.Bedini, M.M.Corsaro, D.A.Comfort, R.M.Kelly, M.Rossi, M.Moracci, A novel {alpha}-D-galactosynthase from Thermotoga maritima converts {beta}-D-galactopyranosyl azide to {alpha}-galacto-oligosaccharides, Glycobiology, 2011,4: 448-456.
17. Маниатис, Т. и др. // Молекулярное клонирование. / Мир. - 1984. - С.240-241. Laemmli, U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. // Nature. - 1970. - V.227. - 680-685.
18. Lowry, O.H., Rosebrough, N.J., Fair A.L., Randall, R.J. Protein measurement with the Folin phenol reagent. // J. Biol. Chem. - 1951. - V.193. - No.1. - P.265-275.
1. Способ получения глоботриозы, заключающийся в ферментативном переносе галактозного мономера от донора галактозила на лактозу, выполняющую роль акцептора, отличающийся тем, что в качестве донора галактозного мономера используют β-галактозилазид, в качестве фермента используют генетически модифицированную гликозидгидролазу, а именно α-1,4-галактозилсинтазу, полученную путем введения двух замен D327G и P402D в соответствующих положениях аминокислотной последовательности гена альфа-галактозидазы дикого типа, выделенной из Thermotoga maritima, причем реакцию проводят при 37°С, рН 5,0 до полного расщепления β-галактозилазида.
2. Способ получения глоботриозы по п.1, отличающийся тем, что избыток акцептора (лактозы) гидролизуют с применением β-галактозидазы, а мономерные остатки сахаров удаляют хроматографией с активированным углем.