Способ получения l-аминокислоты
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и представляет собой способ получения L-аминокислоты, включающий культивирование микроорганизма, относящегося к семейству Enterobacteriaceae, обладающего способностью продуцировать L-аминокислоту и модифицированного так, чтобы повысить активности глицериндегидрогеназы и дигидроксиацетонкиназы, в среде, содержащей глицерин в качестве источника углерода, для продуцирования и накопления L-аминокислоты в среде или в клетках, и сбор L-аминокислоты из среды или клеток, причем активности глицериндегидрогеназы и дигидроксиацетонкиназы повышают путем увеличения количества копий генов, кодирующих указанные ферменты, или замещения промотора для этих генов более сильным промотором, и ген дигидроксиацетонкиназы кодирует белок, выбранный из группы, состоящей из: а) белка, содержащего аминокислотную последовательность SEQ ID NO: 4; и б) белка, содержащего аминокислотную последовательность, гомологичную не менее чем на 95% аминокислотной последовательности SEQ ID NO: 4, и белок имеет активность дигидроксиацетонкиназы. Изобретение позволяет получать на повышенном уровне L-аминокислоты при использовании указанного микроорганизма, в котором дигидроксиацетонкиназа использует АТФ в качестве донора фосфата. 13 з.п. ф-лы, 6 табл., 4 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к области ферментации, и более конкретно к получению L-аминокислот посредством ферментации микроорганизмов.
УРОВЕНЬ ТЕХНИКИ
L-аминокислоты получают промышленным способом посредством ферментации с использованием микроорганизмов, относящихся к роду Brevibacterium, Corynebacterium, Escherichia или тому подобных. В таких способах получения используют штаммы, которые выделяют из природы, или искусственно полученные варианты таких штаммов. Кроме того, могут быть использованы штаммы микроорганизмов, которые модифицированы способом, основанным на рекомбинации ДНК, так чтобы увеличить активность основного фермента биосинтеза L-аминокислоты, и т.д. (патентные документы 1-9).
Когда аминокислоты получают с использованием микроорганизмов, обычно используют сахара в качестве основного компонента субстрата, но также можно использовать глицерин в качестве субстрата, подобного сахарам (патентные документы 10 и 11).
Известно, что Escherichia coli имеет множество генов, которые принимают участие в метаболизме глицерина. Однако было выявлено, что мутантный штамм, дефицитный по glpK, который представляет собой ген, кодирующий глицеринкиназу, или glpD, который представляет собой ген, кодирующий глицерин-3-фосфатдегидрогеназу, не может расти на среде, когда глицерин является единственным источником углерода, основной путь ассимиляции глицерина у E. coli включает в себя глицеринкиназу и глицерин-3-фосфатдегидрогеназу (непатентный документ 1).
Известно, что глицериндегидрогеназа E. coli также является одним из ферментов, которые принимают участие в метаболизме глицерина, и указанный фермент спасает мутантный штамм, дефицитный по трем генам glpK, glpD и glpR, который является геном репрессора регулона glp, от гибели в среде, содержащей глицерин в качестве единственного источника углерода при скрининге с использованием такого штамма (непатентный документ 2).
Считается, что путь через глицерин-3-фосфат, в который вовлечены глицеринкиназа и глицерин-3-фосфатдегидрогеназа, является основным путем ассимиляции глицерина у микроорганизмов, относящихся к семейству Enterobacteriaceae, которые описаны выше, а путь ассимиляции глицерина через дигидроксиацетон является путем, не нужным для ассимиляции глицерина у микроорганизмов, относящихся к семейству Enterobacteriaceae.
Патентный документ 1: EP 0643135 B
Патентный документ 2: EP 0733712 B
Патентный документ 3: EP 1477565 A
Патентный документ 4: EP 0796912 A
Патентный документ 5: EP 0837134 A
Патентный документ 6: WO01/53459
Патентный документ 7: EP 1170376 A
Патентный документ 8: WO2005/010175
Патентный документ 9: WO96/17930
Патентный документ 10: EP 1715055 A
Патентный документ 11: EP 1715056 A
Непатентный документ 1: J. Bacteriol., 23 (2006) 8259-8271
Непатентный документ 2: J. Bacteriol., 131 (1977) 1026-1028
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Цель изобретения
Одним аспектом настоящего изобретения является способ получения L-аминокислоты ферментацией с использованием субстрата, содержащего глицерин, который представляет собой улучшенный способ по сравнению с традиционными способами.
Средства достижения цели
Для достижения указанной выше цели авторы настоящего изобретения тщательно проводили различные исследования. В результате было обнаружено, что усиление либо глицериндегидрогеназы, либо дигидроксиацетонкиназы, которые являются ферментами пути ассимиляции глицерина через дигидроксиацетон, не влияло на продукцию L-аминокислот из глицерина. Однако усиление обоих ферментов, глицериндегидрогеназы и дигидроксиацетонкиназы, заметно повышало продукцию L-аминокислот из глицерина, что позволило осуществить настоящее изобретение.
Таким образом, в настоящем изобретении предлагается следующее:
(1) Способ получения L-аминокислоты, включающий в себя:
культивирование микроорганизма, относящегося к семейству Enterobacteriaceae, обладающего способностью продуцировать L-аминокислоты и модифицированного так, чтобы повысить активности глицериндегидрогеназы и дигидроксиацетонкиназы, в среде, содержащей глицерин в качестве источника углерода, для продуцирования и накопления L-аминокислоты в среде или в клетках, и
сбор L-аминокислоты из среды или клеток.
(2) Способ по п. (1), в котором активности глицериндегидрогеназы и дигидроксиацетонкиназы повышены в результате увеличения количества копий генов, кодирующих глицериндегидрогеназу и дигидроксиацетонкиназу, или в результате модификации последовательностей регуляции экспрессии генов.
(3) Способ по п. (1) или (2), в котором дигидроксиацетонкиназа использует АТФ в качестве донора фосфата.
(4) Способ по любому из пп. (1)-(3), в котором микроорганизм дополнительно модифицирован, чтобы повысить активность поглощения глицерина.
(5) Способ по любому из пп. (1)-(4), в котором микроорганизм дополнительно модифицирован, чтобы повысить активность или активности одного или нескольких ферментов, выбранных из группы, состоящей из триозофосфатизомеразы, фруктозобисфосфатальдолазы, фруктозо-1,6-бисфосфатазы и фруктозо-6-фосфатальдолазы.
(6) Способ по любому из пп. (1)-(5), в котором микроорганизм дополнительно модифицирован, чтобы уменьшить активность или активности глицеринкиназы и/или глицерин-3-фосфатдегидрогеназы связанного с мембраной типа.
(7) Способ по любому из пп. (1)-(6), в котором микроорганизм, относящийся к семейству Enterobacteriaceae, представляет собой бактерию Escherichia или бактерию Pantoea.
(8) Способ по любому из пп. (1)-(7), в котором L-аминокислота выбрана из группы, состоящей из L-глутаминовой кислоты, L-лизина, L-лейцина, L-изолейцина, L-валина, L-триптофана, L-фенилаланина, L-тирозина, L-треонина, L-метионина, L-цистеина, L-аргинина, L-серина, L-пролина, L-аспарагиновой кислоты, L-аспарагина, L-глутамина и L-гистидина.
Наилучший способ осуществления изобретения
Далее настоящее изобретение будет объяснено подробно.
Микроорганизм согласно настоящему изобретению
Примеры микроорганизмов согласно настоящему изобретению включают микроорганизм, относящийся к семейству Enterobacteriaceae, который обладает способностью продуцировать L-аминокислоту и модифицирован, чтобы повысить активности глицериндегидрогеназы и дигидроксиацетонкиназы. Способность продуцировать L-аминокислоту (продуцирующая L-аминокислоту способность) может означать способность приведенных в качестве примера микроорганизмов согласно настоящему изобретению продуцировать и накапливать L-аминокислоту в среде или клетках при культивировании в среде. Типичный микроорганизм согласно настоящему изобретению может обладать способностью продуцировать два или более видов L-аминокислот. Хотя микроорганизм, обладающий способностью продуцировать L-аминокислоту, может обладать наследственным свойством продуцировать L-аминокислоту, такой микроорганизм может быть получен в результате модификации таких микроорганизмов, которые указаны ниже, с использованием методики рекомбинантной ДНК так, чтобы они обладали способностью продуцировать L-аминокислоту.
Хотя тип L-аминокислоты особо не ограничен, примерами являются основные аминокислоты, такие как L-лизин, L-орнитин, L-аргинин, L-гистидин и L-цитруллин, алифатические аминокислоты, такие как L-изолейцин, L-аланин, L-валин, L-лейцин и L-глицин, аминокислоты, которые являются гидроксимоноаминокарбоновыми кислотами, такие как L-треонин и L-серин, циклические аминокислоты, такие как L-пролин, ароматические аминокислоты, такие как L-фенилаланин, L-тирозин и L-триптофан, серосодержащие аминокислоты, такие как L-цистеин, L-цистин и L-метионин, кислые аминокислоты, такие как L-глутаминовая кислота и L-аспарагиновая кислота, и аминокислоты с амидной группой в боковой цепи, такие как L-глутамин и L-аспарагин. Типичный микроорганизм согласно настоящему изобретению может обладать способностью продуцировать два или более видов L-аминокислот.
Микроорганизмы, относящиеся к семейству Enterobacteriaceae, включают бактерии Escherichia и бактерии Pantoea. Другие примеры микроорганизмов, относящихся к семейству Enterobacteriaceae, включают микроорганизмы, относящиеся к γ-протеобактериям, такие как бактерии рода Enterobacter, Klebsiella, Serratia, Erwinia, Salmonella, Morganella или тому подобные.
В настоящем изобретении термин «глицериндегидрогеназа» означает фермент, который обратимо катализирует следующую реакцию окисления, которая превращает глицерин в дигидроксиацетон с использованием NAD в качестве кофермента (EC:1.1.1.6).
Глицерин+NAD=дигидроксиацетон+NADH+H+
В настоящем изобретении фраза «модифицирован, чтобы повысить активность глицериндегидрогеназы» может означать, что количество молекул глицериндегидрогеназы в клетке может быть увеличено по сравнению с количеством в штамме дикого типа или в немодифицированном штамме, или что активность глицериндегидрогеназы на молекулу может быть повышена по сравнению с активностью в штамме дикого типа или немодифицированном штамме. Кроме того, когда активность фермента не регистрируется в штамме дикого типа и ее повышают до регистрируемого уровня, такое состояние также включено в определение состояния «повышения активности». В настоящем изобретении активность глицериндегидрогеназы может быть на любом уровне, при условии, что она может быть выявлена, но модификацию предпочтительно осуществляют так, чтобы активность глицериндегидрогеназы составляла 0,05 ед./мг или выше, предпочтительно 0,25 ед./мг или выше, более предпочтительно 0,5 ед./мг или выше. Примеры штаммов дикого типа микроорганизма, относящегося к семейству Enterobacteriaceae, которые могут служить в качестве эталона для сравнения, включают штамм MG1655 (ATCC No. 47076) и штамм W3110 (ATCC No. 27325) Escherichia coli, штамм AJ13335 Pantoea ananatis (FERM BP-6615), и другие. Активность глицериндегидрогеназы может быть измерена согласно способу Ansis, R.E. et al. (J. Biol. Chem., 2-3, 153-159 (1953)).
В настоящем изобретении «дигидроксиацетонкиназа» представляет собой фермент, который обратимо катализирует следующую реакцию превращения дигидроксиацетона в дигидроксиацетонфосфат и использует АТФ в качестве донора фосфата (EC 2.7.1.29), и фермент, использующий PEP в качестве донора фосфата (EC 2.7.1.29) (Cell. Mol. Life Sci., 63 (2006) 890-900; Biochemistry, 43 (2004) 1337-13045):
АТФ+дигидроксиацетон=АДФ+дигидроксиацетонфосфат (EC 2.7.1.29)
Фосфоенолпируват+дигидроксиацетон=пируват+дигидроксиацетон-фосфат (EC2.7.1.29)
В настоящем изобретении особенно предпочтительно, чтобы дигидроксиацетонкиназа использовала АТФ в качестве донора фосфата.
Фраза «модифицирован, чтобы повысить активность дигидроксиацетонкиназы» может означать, что количество молекул дигидроксиацетонкиназы в клетке увеличено по сравнению с количеством в штамме дикого типа или в немодифицированном штамме или что активность дигидроксиацетонкиназы на молекулу может быть повышена по сравнению с активностью в штамме дикого типа или немодифицированном штамме. Модификацию предпочтительно осуществляют так, чтобы активность дигидроксиацетонкиназы на клетку была повышена до 150% или выше, более предпочтительно до 200% или выше, еще более предпочтительно до 300% или выше по сравнению с активностью штамма дикого типа или немодифицированного штамма. Примеры штаммов дикого типа микроорганизма, относящегося к семейству Enterobacteriaceae, которые могут служить в качестве эталона для сравнения, включают штамм MG1655 (ATCC No. 47076) и штамм W3110 (ATCC No. 27325) Escherichia coli, штамм AJ13335 Pantoea ananatis (FERM BP-6615) и другие. Активность дигидроксиацетонкиназы может быть измерена способом Johnson E.A. (J. Bacteriol., 1984 Oct; 160(1): 55-60).
Примеры гена, кодирующего глицериндегидрогеназу, включают ген gldA, и предпочтительным примером является ген gldA, полученного из микроорганизма, относящегося к семейству Enterobacteriaceae. Примеры микроорганизма, относящегося к семейству Enterobacteriaceae, включают Escherichia coli. Примером гена Escherichia coli является, например, ген gldA с последовательностью SEQ ID NO: 1 (нить, комплементарная нуклеотидам с номерами 4135955..4137058 в GenBank с номером доступа NC_000913).
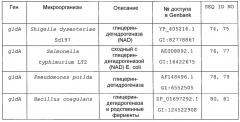
Кроме того, гомологами гена, кодирующего глицериндегидрогеназу, могут быть гены, клонированные на основе гомологии с приведенным выше в качестве примера геном из бактерии рода Escherichia, Enterobacter, Klebsiella, Serratia, Erwinia, Yersinia, Shigella, Salmonella, Vibrio, Aeromonas, Bacillus, Staphylococcus, Lactobacillus, Enterococcus, Clostridium, Pseudomonas, Agrobacterium, Citrobacter, Corynebacterium или тому подобной. Примеры генов, которые обладают высокой степенью гомологии с геном gldA Escherichia coli и могут быть использованы в настоящем изобретении в качестве гена, кодирующего глицериндегидрогеназу, приведены в таблице 1.
| Таблица 1 Гены, обладающие высокой степенью гомологии с геном gldA Escherichia coli и кодирующие глицериндегидрогеназу | |
Гомология (идентичность и т.д.) аминокислотных последовательностей и нуклеотидных последовательностей может быть определена, например, с использованием алгоритма BLAST согласно Karlin and Altschul (Pro. Natl. Acad. Sci. USA, 90, 5873 (1993)) или FASTA согласно Pearson (Methods Enzymol., 183, 63 (1990)). Программы, названные BLASTN и BLASTX, были разработаны на основе указанного алгоритма BLAST (смотри www.ncbi.nlm.nih.gov).
В качестве гена, кодирующего дигидроксиацетонкиназу согласно настоящему изобретению, можно использовать гены, названные геном dhaKLM, геном dak1, геном dhaK и геном dhbK. Примерами гена, кодирующего фермент, использующий PEP в качестве донора фосфата, являются гены, полученные из Escherichia coli, такие как ген dhaK с последовательностью SEQ ID NO: 34 (нить, комплементарная нуклеотидам с номерами 1248991..1250061 в GenBank с номером доступа No. NC_000913), ген dhaL с последовательностью SEQ ID NO: 36 (нить, комплементарная нуклеотидам с номерами 1248348..1248980 в GenBank с No. доступа NC_000913), и ген dhaM с последовательностью SEQ ID NO: 38 (нить, комплементарная нуклеотидам с номерами 1246919..1248337 в GenBank с No. доступа NC_000913).
В настоящем изобретении предпочтительно может быть использован ген, кодирующий дигидроксиацетонкиназу, которая использует АТФ в качестве донора фосфата, и таким геном может быть ген dak1, полученный из дрожжей, ген dhbK, полученный из бактерий Agrobacterium, и ген dhaK, полученный из бактерий Citrobacter. Примером гена dak1, полученного из дрожжей, является ген dak1 с последовательностью SEQ ID NO: 3, полученный из Saccharomyces cerevisiae (No. доступа в GenBank NP_013641.1 GI: 6323570), примером гена dhbK, полученного из бактерий Agrobacterium, является ген dhbK с последовательностью SEQ ID NO: 5, полученный из Agrobacterium tumefaciens (No. доступа в GenBank. NP_357070.1 GI: 15891398), и примером гена dhaK, полученного из бактерий Citrobacter, является ген dhaK с последовательностью SEQ ID NO: 7, полученный из Citrobacter freundii (No. доступа в GenBank. U09771).
Кроме того, гомологи гена, кодирующего дигидроксиацетонкиназу, могут представлять собой гены, клонированные на основе гомологии с геном, приведенным в качестве примера выше, из бактерии, такой как бактерии рода Escherichia, Enterobacter, Klebsiella, Serratia, Erwinia, Yersinia, Shigella, Salmonella, Vibrio, Aeromonas, Bacillus, Staphylococcus, Lactobacillus, Enterococcus, Clostridium, Agrobacterium, Citrobacter и Mycobacterium, дрожжей, таких как дрожжи рода Saccharomyces, Schizosaccharomyces или Pichia, или тому подобных.
В частности, в качестве гена, кодирующего дигидроксиацетонкиназу, которая использует АТФ в качестве донора фосфата, можно применять следующие последовательности. Гены, кодирующие дигидроксиацетонкиназу и обладающие высокой степенью гомологии с геном dak1, полученным из Saccharomyces cerevisiae, показаны в таблице 2, гены дигидроксиацетонкиназы, обладающие высокой степенью гомологии с геном dhbK, полученным из Agrobacterium tumefaciens, показаны в таблице 3, и гены дигидроксиацетонкиназы, обладающие высокой степенью гомологии с геном dhaK, полученным из Citrobacter freundii, показаны в таблице 4.
| Таблица 2 Гены, кодирующие дигидроксиацетонкиназу и обладающие высокой степенью гомологии с геном dak1, полученным из Saccharomyces cerevisiae | |
| Таблица 3 Гены, кодирующие дигидроксиацетонкиназу и обладающие высокой степенью гомологии с геном dhbK, полученным из Agrobacterium tumefaciens | |
| Таблица 4 Гены, кодирующие дигидроксиацетонкиназу и обладающие высокой степенью гомологии с геном dhaK, полученным из Citrobacter freundii | |
Гомологи указанных выше генов могут представлять собой мутантные гены, полученные из других микроорганизмов, или природные или искусственные мутантные гены, которые имеют высокое структурное сходство с указанными выше генами и которые могут повышать активность глицериндегидрогеназы и активность дигидроксиацетонкиназы при введении в хозяина или при амплификации. Гомологи генов глицериндегидрогеназы и дигидроксиацетонкиназы могут представлять собой гены, кодирующие белок, имеющий гомологию 80% или выше, предпочтительно 90% или выше, более предпочтительно 95% или выше, особенно предпочтительно 98% или выше, с общей аминокислотной последовательностью SEQ ID NO: 2, 4, 6 или 8 или любой из аминокислотных последовательностей, кодируемых последовательностями, указанными в таблицах 1-4, и обладающими функцией глицериндегидрогеназы или дигидроксиацетонкиназы. Кодирует ли ген белок, обладающий активностью глицериндегидрогеназы или активностью дигидроксиацетонкиназы, можно подтвердить посредством экспрессии гена в клетке-хозяине и определения того, повышена ли ферментативная активность по сравнению с немодифицированным штаммом, согласно указанному выше способу измерения ферментативной активности. Кроме того, тот факт, является ли ген гомологом или не является, можно подтвердить посредством получения штамма с нарушенным геном, в котором соответствующий ген дикого типа нарушен, введения гена в штамм с нарушением и исследования того, комплементирует ли ген функцию гена дикого типа, например, восстанавливается ли ферментативная активность, сниженная в результате нарушения гена.
Кроме того, гены, кодирующие глицериндегидрогеназу и дигидроксиацетонкиназу, используемые в настоящем изобретении, не ограничены генами дикого типа, и гены могут представлять собой мутантные или искусственно модифицированные гены, кодирующие белок, имеющий аминокислотную последовательность SEQ ID NO: 2, 4, 6 или 8 или любую из аминокислотных последовательностей, указанных в таблице 1-4, которые могут включать в себя замену, делецию, инсерцию, добавление или тому подобное одного или нескольких аминокислотных остатков в одном или нескольких положениях, при условии, что функция кодируемой глицериндегидрогеназы или дигидроксиацетонкиназы не снижена. Хотя количество, определяемое как «один или несколько» аминокислотных остатков, может отличаться в зависимости от положений в трехмерной структуре или типов аминокислотных остатков белка, такое количество может составлять, в частности, от 1 до 20, предпочтительно от 1 до 10, более предпочтительно от 1 до 5, еще более предпочтительно от 1 до 3. Указанные замены предпочтительно являются консервативными заменами. Консервативная замена представляет собой мутацию, при которой замена происходит взаимно между аминокислотами Phe, Trp и Tyr в том случае, если местом замены является ароматическая аминокислота; между Leu, Ile и Val, если аминокислота представляет собой гидрофобную аминокислоту; между Gln и Asn, если аминокислота представляет собой полярную аминокислоту; между Lys, Arg и His, если аминокислота является основной аминокислотой; между Asp и Glu, если аминокислота является кислой аминокислотой; и между Ser и Thr, если аминокислота представляет собой аминокислоту, имеющую гидроксильную группу. Примерами консервативной замены являются замена Ala на Ser или Thr, замена Arg на Gln, His или Lys, замена Asn на Glu, Gln, Lys, His или Asp, замена Asp на Asn, Glu или Gln, замена Cys на Ser или Ala, замена Gln на Asn, Glu, Lys, His, Asp или Arg, замена Glu на Gly, Asn, Gln, Lys или Asp, замена Gly на Pro, замена His на Asn, Lys, Gln, Arg или Tyr, замена Ile на Leu, Met, Val или Phe, замена Leu на Ile, Met, Val или Phe, замена Lys на Asn, Glu, Gln, His или Arg, замена Met на Ile, Leu, Val или Phe, замена Phe на Trp, Tyr, Met, Ile или Leu, замена Ser на Thr или Ala, замена Thr на Ser или Ala, замена Trp на Phe или Tyr, замена Tyr на His, Phe или Trp и замена Val на Met, Ile или Leu. Вышеуказанная аминокислотная замена, делеция, инсерция, добавление, инверсия или тому подобное может быть результатом встречающейся в природе мутации вследствие индивидуального отличия или видового отличия (мутант или вариант) микроорганизма, имеющего гены, кодирующие глицериндегидрогеназу и дигидроксиацетонкиназу.
Гены, кодирующие глицериндегидрогеназу и дигидроксиацетонкиназу, также могут представлять собой ДНК, которая способна гибридизоваться с последовательностью, комплементарной нуклеотидной последовательности SEQ ID NO: 2, 4, 6 или 8 или любой из нуклеотидных последовательностей, указанных в таблицах 1-4, или зондом, который может быть получен из нуклеотидных последовательностей, в жестких условиях и кодирует белок, обладающий глицериндегидрогеназной активностью или дигидроксиацетонкиназной активностью. «Жесткие условия» представляют собой условия, при которых образуется так называемый специфичный гибрид и не образуется неспецифичный гибрид. Хотя трудно четко определить условие числовыми значениями, примеры жестких условий включают условия, при которых высокогомологичные ДНК гибридизуются друг с другом, например, ДНК, гомологичные не менее чем на 80%, предпочтительно гомологичные не менее чем на 90%, более предпочтительно гомологичные не менее чем на 95%, особенно предпочтительно гомологичные не менее чем на 98%, гибридизуются друг с другом, а DДНК с меньшей гомологией, чем указанная выше, не гибридизуются друг с другом, или условия промывки для типичной Саузерн-гибридизации, т.е. промывка один раз, предпочтительно 2 или 3 раза при концентрации соли и температуре, соответствующей 1×SSC, 0,1% SDS при 60°C, предпочтительно 0,1×SSC, 0,1% SDS при 60°C, более предпочтительно 0,1×SSC, 0,1% SDS при 68°C.
В настоящем изобретении фраза «внутриклеточная активность фермента возрастает» означает состояние, при котором внутриклеточная активность фермента повышена по сравнению со штаммом дикого типа (например, штаммами W3110 и MG1655 Escherichia coli) или родительским штаммом (штаммом, в котором внутриклеточные активности всех ферментов, указанных в настоящем изобретении, не повышены), а также включает состояние, при котором клетки обладают активностью, которой штамм дикого типа или родительский штамм не обладают.
Примеры способов повышения внутриклеточной активности включают указанные ниже способы и их сочетания. Однако способы не ограничены указанным. В качестве способов повышения активностей глицериндегидрогеназы и дигидроксиацетонкиназы можно использовать любой из способов (1)-(5), и можно применять один и тот же или разные способы.
(1) Увеличение количества копий гена, кодирующего каждый белок, в результате трансформации с использованием вектора, содержащего ген.
(2) Увеличение количества копий гена, кодирующего каждый белок, в результате интеграции гена в хромосому.
(3) Повышение уровня экспрессии гена, кодирующего каждый белок, посредством модификации области регуляции экспрессии гена.
(4) Повышение уровня экспрессии посредством модификации фактора, который влияет на регуляцию экспрессии.
(5) Увеличение ферментативной активности посредством введения мутации в кодирующую область гена, кодирующего каждый белок.
(6) Увеличение количества белка в результате повышения эффективности трансляции.
Далее гены, кодирующие глицериндегидрогеназу и дигидроксиацетонкиназу, могут быть названы целевыми генами.
(1) Увеличение количества копий гена, кодирующего каждый белок, посредством трансформации с использованием вектора, содержащего ген
Например, фрагмент ДНК, содержащий целевой ген, может быть лигирован в вектор, который функционирует в микроорганизме-хозяине, предпочтительно в вектор многокопийного типа, чтобы получить рекомбинантную ДНК, и рекомбинантная ДНК может быть введена в микроорганизм, чтобы его трансформировать. Целевой ген может быть получен в ПЦР (полимеразной цепной реакции, см. White, T.J. et al., Trends Genet., 5, 185 (1989)) с использованием в качестве матрицы хромосомной ДНК Escherichia coli, дрожжей, бактерии Citrobacter, бактерии Agrobacterium или тому подобной. Целевые гены из других микроорганизмов также можно получить из хромосомной ДНК или библиотеки хромосомной ДНК любого микроорганизма с помощью ПЦР, используя в качестве праймеров олигонуклеотиды, полученные на основе известного целевого гена микроорганизма или на основе информации о последовательности целевого гена или белка микроорганизма другого вида, или с помощью гибридизации с использованием в качестве зонда олигонуклеотида, полученного на основе информации о такой последовательности, которая указана выше. Хромосомная ДНК может быть получена из микроорганизма, который служит в качестве донора ДНК, способом, описанным Saito and Miura (см. Saito H. and Miura K., Biochem. Biophys. Acta, 72, 619 (1963); Experimental Manual for Biotechnology, edited by The Society for Biotechnology, Japan, pp.97-98, Baifukan Co., Ltd., 1992) или тому подобным.
Затем целевой ген, амплифицированный в ПЦР, может быть лигирован в векторную ДНК, которая может функционировать в клетке микроорганизма-хозяина, чтобы получить рекомбинантную ДНК. Примерами вектора, который может функционировать в клетке микроорганизма-хозяина, являются векторы, которые автономно реплицируются в клетках микроорганизма-хозяина.
Примерами векторов, которые автономно реплицируются в микроорганизмах, относящихся к семейству Enterobacteriaceae, являются pUC19, pUC18, pHSG299, pHSG399, pHSG398, pACYC184, (векторы серий pHSG и pACYC доступны из Takara Bio), RSF1010 (Gene, vol. 75(2), p. 271-288, 1989), pBR322, pMW219, pMW119 (векторы серий pMW доступны из Nippon Gene), pSTV28, pSTV29 (Takara Bio) и т.д. Можно использовать вектор на основе фаговой ДНК.
Чтобы получить рекомбинантную ДНК лигированием какого-либо гена с указанным выше вектором конструируют вектор так, чтобы рестрикционный фермент соответствовал концам фрагмента ДНК, содержащего целевой ген. Лигирование обычно осуществляют, используя лигазу, такую как ДНК-лигаза T4. В качестве способов расщепления и лигирования ДНК можно применять способы получения хромосомной ДНК, ПЦР, получения плазмидной ДНК, трансформации, конструирования олигонуклеотидов, используемых в качестве праймеров, и т.д., которые хорошо известны специалисту в данной области. Указанные способы описаны в Sambrook, J., Fritsch, E.F., and Maniatis, T., "Molecular Cloning A Laboratory Manual, Second Edition", Cold Sprig Harbor Laboratory Press, (1989), и других публикациях.
Рекомбинантная ДНК, полученная, как описано выше, может быть введена в бактерию согласно обычному известному способу трансформации. Примеры включают электропорацию (Canadian Journal of Microbiology, 43, 197 (1997)). Также можно применять способ увеличения проникающей способности ДНК обработкой реципиентных клеток хлоридом кальция, как описано для Escherichia coli K-12 (Mandel, M. and Higa, A., J. Mol. Biol., 53, 159 (1970), или способ введения ДНК в компетентную клетку, полученную из клетки на стадии пролиферации, как описано для Bacillus subtilis (Duncan, C.H., Wilson, G.A and Young, F.E, Gene, 1, 153 (1977)).
(2) Увеличение количества копий гена, кодирующего каждый белок, в результате интеграции гена в хромосому
Увеличение внутриклеточной активности каждого фермента может быть достигнуто в результате увеличения количества копий целевого гена посредством введения целевого гена в хромосомную ДНК микроорганизма. Введение целевого гена в хромосомную ДНК микроорганизма можно осуществить с помощью гомологичной рекомбинации, используя последовательность-мишень, присутствующую в хромосомной ДНК в многочисленных копиях. Так как такая последовательность присутствует в хромосомной ДНК в многочисленных копиях, то можно использовать повторяющуюся ДНК или инвертированный повтор, имеющийся на концах транспозируемого элемента. Альтернативно, как описано в выложенном патенте Японии (Kokai) No. 2-109985, целевой ген может быть введен в хромосомную ДНК путем встраивания гена в транспозон и его переноса так, чтобы ген был интегрирован в хромосомную ДНК. Кроме того, также можно ввести целевой ген в хромосому, используя способ зависимой от Red интеграции (WO2005/010175). Целевой ген также может быть введен в хромосому посредством трансдукции с использованием фага, такого как фаг P1, или с использованием вектора для конъюгативного переноса. Перенос гена в хромосому может быть подтвержден при осуществлении Саузерн-гибридизации с использованием части гена в качестве зонда. Увеличение количества копий может быть подтверждено Саузерн-гибридизацией с использованием зонда, комплементарного целевому гену. Хотя количество копий может быть увеличено в любой степени, при условии, что оно увеличено на одну или несколько копий, ген, кодирующий глицериндегидрогеназу, предпочтительно амплифицируют на две или более копий, более предпочтительно на три или более копий, еще более предпочтительно на пять или более копий, а ген, кодирующий дигидроксиацетонкиназу, предпочтительно амплифицируют на две или более копий, более предпочтительно на три или более копий, еще более предпочтительно на пять или более копий. В том случае, когда вводят ген, который не является нативным для выбранного микроорганизма-хозяина, может быть введено любое количество копий, при условии, что вводят одну или несколько копий.
(3) Повышение уровня экспрессии гена, кодирующего каждый белок, посредством модификации области регуляции экспрессии гена
Кроме того, помимо увеличения количества копий целевого гена, описанного выше, может быть достигнуто повышение внутриклеточной активности каждого фермента, посредством замены последовательности регуляции экспрессии, такой как промотор гена, в хромосомной ДНК или в плазмиде более сильным промотором способом, описанным в WO 00/18935. В качестве сильных промоторов известны, например, промотор lac, промотор trp, промотор trc, промотор PR фага лямбда, промотор PL, промотор lpp, промотор T7, промотор tet и другие. В настоящем изобретении, в частности, для того, чтобы амплифицировать глицериндегидрогеназу, предпочтительно используют промотор tacM (SEQ ID NO: 10). dhaK, dhaL и dhaM, кодирующие дигидроксиацетонкиназу Escherichia coli, составляют структуру оперона, и уровни экспрессии всех трех генов повышают, усиливая промотор, расположенный перед dhaK.
Кроме того, также возможно введение нуклеотидной замены или тому подобного в область промотора целевого гена, чтобы модифицировать его с получением более сильного промотора. Способы оценки силы промоторов и примеры сильных промоторов описаны в публикации Goldstein et al. (Prokaryotic promoters in biotechnology, Biotechnol. Annu. Rev., 1995, 1, 105-128) и других публикациях. Кроме того, известно, что замена нескольких нуклеотидов в области спейсера между сайтом связывания рибосом (RBS) и стартовым кодоном, в частности, в области, расположенной непосредственно перед стартовым кодоном, существенно влияет на эффективность трансляции мРНК, и такая область также может быть модифицирована. Экспрессия целевого гена усиливается при такой замене или модификации промотора.
Что касается замены промотора в хромосоме более сильным промотором, то промотор, расположенный перед целевым геном в геноме, может быть заменен более сильным промотором посредством трансформации микроорганизма, относящегося к семейству Enterobacteriaceae, ДНК, содержащей более сильный промотор, амплифицированный в ПЦР или т.п., чтобы вызвать рекомбинацию более сильного промотора и промотора дикого типа в геноме. Для такой замены в гене с использованием гомологичной рекомбинации можно применять способ, называемый зависимой от Red интеграцией (Datsenko, K.A, and Wanner, B.L., Proc. Natl. Acad. Sci. USA, 97: 6640-6645 (2000)), способ, основанный на использовании линейной ДНК, такой как способ с использованием зависимой от Red интеграции в сочетании с системой разрезания, полученной из фага λ (Cho, E.H., Gumport, R.I., Gardner, J.F., J. Bacteriol., 184: 5200-5203 (2002)) (см. WO2005/010175), способ с применением плазмиды, содержащей чувствительное к температуре начало репликации (Datsenko, K.A, and Wanner, B.L., Proc. Natl. Acad. Sci. USA, 97: 6640-6645 (2000), патента США No. 6303383, выложенный патент Японии No. 05-007491), и т.д.
(4) Повышение уровня экспрессии посредством модификации фактора, который влияет на регуляцию экспрессии
Повышение уровня экспрессии посредством модификации фактора, который влияет на регуляцию экспрессии, можно осуществить в результате амплификации гена, кодирующего активатор, который увеличивает экспрессию генов, кодирующих глицериндегидрогеназу и дигидроксиацетонкиназу, или в результате делеции или ослабления гена, кодирующего регулятор, который снижает экспрессию генов. Примером активатора dhaKLM, кодирующего дигидроксиацетонкиназу, является, например, dhaR (SEQ ID NO: 66, номера нуклеотидов 1250289..1252208 в GenBank с No. доступа NC_000913), и уровень экспрессии dhaKLM, кодирующего дигидроксиацетонкиназу, увеличивается при мутации гена dhaR (1: EMBO J., 2005 Jan. 26, 24(2): 283-93). Уровень экспрессии dhaKLM, кодирующего дигидроксиацетонкиназу, также увеличивают в результате нарушения гена ptsI (SEQ ID NO: 86, номера нуклеотидов 2532088..2533815 в GenBank с No. доступа NC_000913) (Microbiology, 147 (2001) 247-253).
(5) Увеличение ферментативной активности посредством введения мутации в кодирующую область гена, кодирующего каждый белок
Кроме того, увеличение активностей глицериндегидрогеназы и дигидроксиацетонкиназы также можно достичь в результате введения мутации, которая увеличивает удельные активности белков или улучшает субстратные специфичности ферментов в кодирующих областях целевых генов.
Такой ген, кодирующий какой-либо фермент, имеющий мутацию, может быть получен, например, посредством модификации нуклеотидной последовательности SEQ ID NO: 1, 3, 5 или 7, или кодирующей области в любой из нуклеотидных последовательностей, указанных в таблицах 1-4, так чтобы аминокислотные остатки конкретной части кодируемого белка включали в себя замену, делецию, инсерцию, добавление аминокислотных остатков или тому подобное. Кроме того, такой ген также может быть получен общеизвестными мутагенными обработками, описанными ниже. Что касается мутагенных обработок, то способом обработки нуклеотидной последовательности SEQ ID NO: 1, 3, 5 или 7, любой из нуклеотидных последовательностей, указанных в таблицах 1-4, или последовательности кодирующей области в любой из таких последовательностей гидроксиламином или подобным веществом in vitro, способом обработки микроорганизма, такого как микроорганизм, относящийся к семейству Enterobacteriaceae, содержащего ген, ультрафиолетовым излучением или мутагенным средством, используемым для обычных мутагенных обработок, таким как N-метил-N'-нитро-N-нитрозогуанидин (NTG) или этилметансульфонат (EMS), посредством склонной к ошибкам ПЦР (Cadwell, R.C., PCR Meth. Appl., 2, 28 (1992)), перетасовкой ДНК (Stemmer, W.P., Nature, 370, 389 (1994)), или StEP-ПЦР (Zhao, H., Nature Biotechnol., 16, 258 (1998)), мутация может быть искусственно введена в гены, кодирующие глицериндегидрогеназу и дигидроксиацетонкиназу, посредством рекомбинации генов, чтобы получить гены, кодирующие высокоактивные глицериндегидрогеназу и дигидроксиацетонкиназу. Кодируют ли такие мутантные ферменты глицериндегидрогеназу и дигидроксиацетонкиназу, можно подтвердить, например, введением генов в микроорганизм, относящийся к семейству Enterobacteriaceae и обладающий способностью продуцировать L-аминокислоту, его культивированием в среде, содержащей глицерин в качестве источника углерода, и определением того, повышена ли способность продуцировать L-аминокислоту, или измерением активностей ферментов указанными выше способами.
(6) Увеличение количества белка в результате повышения эффективности трансляции
Увеличение количества белка в результате повышения эффективности трансляции можно осуществить в результате увеличения количества тРНК, соответствующей кодонам, менее часто используемым в хозяине, или в результате модификации целевого гена так, чтобы он имел оптимальные кодоны в отношении частоты использования кодонов у хозяина (Gene 85, 109-114 (1989), Biochemistry, 31, 2598-2608 (1992), J. Bacteriol., 175, 716-722 (1993), Protein Expression and Purification, 50, 49-57 (2006)). Увеличение количества целевого белка по сравнению с немодифицированным штаммом или штаммом дикого типа можно подтвердить, например, регистрацией при Вестерн-блоттинге с использованием антител (Molecular Cloning (Cold Spring Harbor Laboratory Press, Cold spring Harbor (USA), 2001)).
Микроорганизм, используемый в способе получения согласно настоящему изобретению, может представлять собой микроорганизм, модифицированный так, чтобы повысить активность поглощения глицерина в добавление к усилению активности глицериндегидрогеназы и дигидроксиацетонкиназы. Активность поглощения глицерина означает активность включения глицерина в