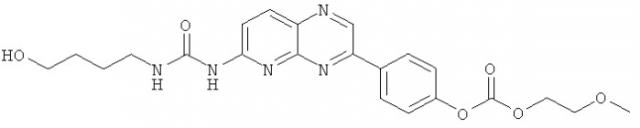
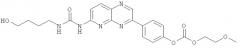
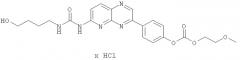
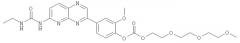
Производные пиридопиразина, фармацевтическая композиция и способ лечения или профилактики физиологических и/или патофизиологических состояний посредством ингибирования ферментов erk, erk1, erk2, pi3k, pi3kальфа, pi3kбета, pi3kгамма, pi3kдельта, pi3k-с2альфа, pi3k-с2бета, pi3k-vps34р (варианты)
Иллюстрации
Показать всеИзобретение относится к новым производным пиридо[2,3-b]пиразина общей формулы (I), в которой радикалы и символы имеют значения, приведенные в формуле изобретения. Данные соединения ингибируют ферменты ERK, ERK1, ERK2, PI3K, PI3Kальфа, PI3Kбета, PI3Kгамма, PI3Kдельта, PI3K-C2альфа, PI3K-C2бета, PI3K-Vps34p. Изобретение также относится к фармацевтической композиции и их применению для получения лекарственных средств, предназначенных прежде всего для лечения злокачественных и других заболеваний, включающих патологическую пролиферацию клеток. 4 н. и 6 з.п. ф-лы, 3 табл., 66 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к модуляторам киназ типа пиридо[2,3-b]пиразинов, к их получению и применению в качестве лекарственного средства для модуляции анормальных процессов передачи клеточного сигнала, прежде всего, к воздействию на функцию тирозин-, серин/треонин- и липидкиназ, а также к лечению злокачественных или доброкачественных опухолей и других патологических заболеваний, опосредованных пролиферацией клеток, например, рестеноза, псориаза, артериосклероза и цирроза печени.
Уровень техники
Активация протеинкиназ является главным фактором в процессе передачи сигнала в клетках. Аномальная активация киназ наблюдается при многих патологических состояниях. В связи с этим, направленное ингибирование киназ является фундаментальной целью при разработке способов лечения.
Фосфорилирование белков в основном инициируется внеклеточным сигналом и является универсальным механизмом контроля множества событий в клетках, таких как, например, метаболические процессы, рост, миграция, дифференциация клеток, мембранный транспорт и апоптоз. Фосфорилирование белков осуществляет семейство белков - киназы. Эти ферменты катализируют перенос фосфата на специфические белки-субстраты. В зависимости от субстратной специфичности киназы подразделяют на три основных класса: тирозинкиназы, серин/треонинкиназы и липидкиназы. Рецепторные тирозинкиназы, также как и цитоплазматические тирозинкиназы, серин/треонинкиназы и липидкиназы, являются важными белками, принимающими участие в передаче сигнала в клетках. Сверхэкспрессия или повреждение таких белков играет важную роль при развитии патологических заболеваний, зависимых от пролиферации клеток. К таким заболеваниям, кроме прочих, относятся метаболические заболевания, заболевания соединительных тканей и кровеностных сосудов, а также злокачественные и доброкачественные опухоли. При образовании и развитии опухоли такие киназы в большинстве случаев являются онкогенами, то есть аномально и констутивно активированными киназами. В результате такой избыточной активации киназ происходит, например, неконтролируемый рост клеток и сниженная гибель клеток. Причиной сверхстимуляции может служить также стимуляция индуцированных опухолью факторов роста. В связи с этим, поиск модуляторов киназ представляет особый интерес при разработке способов лечения всех патогенных процессов, зависимых от киназ.
Каскады передачи сигнала ras-Raf-Mek-Erk и PI3K играют центральную роль в процессах клеточного роста, пролиферации, апоптоза, адгезии, миграции и метаболизма глюкозы. Таким образом, подтверждается основное участие сигнальных путей ras-Raf-Mek-Erk и PI3K-Akt в патогенезе заболеваний, таких как рак, нейродегенеративные и воспалительные заболевания. В связи с этим, отдельные компоненты указанных каскадов передачи сигнала представляют собой перспективные мишени при разработке новых способов терапии различных заболеваний (Weinstein-Oppenheimer C.R. и др., (2000), Chang F. и др., (2003), Katso R., и др., (2001) и Lu Y. и др., (2003)).
В следующем разделе подробно описаны молекулярные и биохимические свойства указанных путей передачи сигнала.
Множество ростовых факторов, цитокинов и онкогенов передают сигналы, необходимые для роста, посредством активации ассоциированной с G-белком киназы ras, что приводит к активации серин-треонинкиназы Raf и к активации митогенактивируемых протеинкиназой киназ 1 и 2 (MAPKK1/2 или Mek1/2) и кфосфорилированию и активации МАРК 1 и 2, известных также под названием регулирующих передачу внеклеточного сигнала киназ (Erk1 и 2). По сравнению с другими путями передачи сигналов, путь ras-Raf-Mek-Erk включает множество прото-онкогенов, включая лиганды, рецепторные тирозинкиназы, G-белки, киназы и ядерные факторы транскрипции. Тирозинкиназы, например, такие как EGFR (Mendelsohn J., и др., 2000), принимают участие в развитии опухоли за счет сверхэкспрессии и мутации частично конститутивно активированного сигнала в пути передачи сигнала ras-Raf-Mek-Erk, расположенном ниже в каскаде. Мутации ras наблюдаются в 30% всех опухолей человека (Khieif S.N., и др., 1999, Marshall С., 1999), и наибольшая частота случаев новых заболеваний (90%) наблюдается в случае карциномы поджелудочной железы (Friess Y., и др., 1996, Sirivatanauksorn V., и др., 1998). В случае c-Raf описаны различные опухоли, при которых наблюдается анормальная экспрессия и/или активация (Hoshino R. и др., 1999, McPhillips F. и др., 2001). Точечные мутации B-Raf выявлены в 66% всех случаев злокачественных меланом человека, в 14% всех случаев злокачественных карцином яичников и в 12% всех случаев карцином ободочной кишки (Davies Н. и др., 2002). Неудивительно, что киназа Erk1/2 принимает участие во многих клеточных процессах, таких как рост, пролиферация и дифференциация клеток (Lewis Т.S. и др., 1998, Chang F. и др., 2003).
Кроме того, члены пути киназ Raf проявляют независимые от Mek-Erk антиапоптозные функции, молекулярные механизмы которых еще недостаточно изучены. В качестве возможных компонентов активности Raf, независимой от Mek-Erk, описаны Ask-1, Bcl-2, Akt и Bag1 (Chen J и др., 2001, Troppmaier J. и др., 2003, Rapp U.R. и др., 2004, Gotz R. и др., 2005). В настоящее время установлено, что в механизм зависимого и независимого от киназ Mek-Erk пути передачи сигнала включена активация расположенных выше в каскаде стимулов ras и Raf.
Изоферменты фосфатидилинозит3-киназы (PI3K) действуют в качестве липидкиназ и катализируют D-3 фосфорилирование липидов-вторичных мессенджеров Ptdlns (фосфатидилинозитов) с образованием фосфатидилинозитфосфатов Ptdlns(3)P, Ptdlns(3,4)P2, Ptdlns(3,4,5)P3. Киназы PI3K класса 1 включают в своей структуре каталитические субъединицы (р110 alpha, beta, gamma, delta) и регуляторные субъединицы (р85 alpha, beta, или p101 gamma). Описаны также киназы класса II (PI3KC2alpha, PI3K-C2beta) и класса III (Vps34p), которые принадлежат к семейству киназ PI3K (Wymann М.Р. и др., 1998, VanHaesebroeck В. и др., 2001). Подавление вызванного киназами PI3K повышения PIP с одной стороны активирует пролиферативный путь передачи сигнала ras-Raf-Mek-Erk за счет связвания с ras (Rodriguez-Viciana P. и др., 1994), а с другой стороны стимулирует антиапоптозный путь передачи сигнала за счет накопления Akt на клеточной мембране и последующего сверхактивирования указанной киназы (Alessi D.R. и др., 1996, Chang H.W. et al., 1997, Moore S.M. и др., 1998). Таким образом, активация PI3K включена по меньшей мере в два различных механизма возникновения опухоли, а именно в активацию роста и дифференциации клеток и в подавление апоптоза. Кроме того, PI3K обладают свойствами фосфорилирования белков (Dhand и др., 1994, Bondeva Т. и др., 1998, Bondev А. и др., 1999, VanHaesebroeck В. и др., 1999), которые, например, играют роль при инициации внутренней регуляции аутофосфорилирования серина киназой PI3K. Кроме того, известно, что киназы PI3K обладают также киназа-независимыми эффектор-регуляторными свойствами, например, при контроле сокращения сердечной мышцы (Crackower M.A. и др., 2002, Patrucco и др., 2004). Более того, было установлено, что киназы PI3Kdelta и PI3Kgamma оказывают специфическое действие на кроветворные клетки и, в связи с этим, представляют интерес при разработке специфических ингибиторов в отношении изоферментов PI3Kdelta и PI3Kgamma, предназначенных для лечения воспалительных заболеваний, таких как ревматизм, астма и аллергия, а также для лечения В- и Т-клеточных лимфом (Okkenhaug К. и др., 2003, Ali К. и др., 2004, Sujobert Р. и др., 2005). Киназа PI3Kalpha, которая недавно идентифицирована в качестве прото-онкогена (Shayesteh L и др., 1999, Ма Y.Y. и др., 2000, Samuels Y. и др., 2004, Campbell I.G. и др., 2004, Levine D.A., 2005), представляет важную мишень при разработке способов лечения опухолей. Исследование киназ типа PI3K в качестве мишеней при разработке активных веществ имеет чрезвычайно важное значение (Chang F. & Lee JT. и др., 2003).
Особый интерес представляют PI3K-родственные киназы (P1KK), которые включают серин/треонинкиназы mTOR, ATM, ATR, h-SMG-1 и DNA-PK (Chiang G.G. и др., 2004). Их каталитические домены характеризуются высокой гомологией с каталитическими доменами киназ PI3K.
Кроме того, потеря белков-супрессоров опухоли PTEN (Li J. и др., 1997, Steck P.A. и др., 1997), которые обращают функцию фосфорилирования, индуцированную киназами PI3K, приводит к сверхактивации киназы Akt и расположенных ниже в каскаде компонентов, и следовательно указанные киназы имеют значение при разработке способов лечения опухоли в качестве молекул-мишеней.
Различные ингибиторы отдельных компонентов путей передачи сигналов ras-Raf-Mek-Erk и PI3K-Akt описаны в различных статьях и патентах. Предшествующий уровень техники в области ингибиторов киназ, прежде всего киназ, включенных в пути ras-Raf-Mek-Erk и PI3K-Akt, описан в обзорах J. S. Sebolt-Leopold и др., 2004, и R. Wetzker и др., 2004. В указанных публикациях описаны синтез и применение низкомолекулярных ингибиторов путей ras-Raf-Mek-Erk и PI3K-Akt со ссылкой на соответствующие патенты. Прошедший клинические испытания ингибитор киназы Bay 43-9006 (WO 99/32111, WO 03/068223) является относительно неспецифичным ингибитором серин/треонин- и тирозинкиназ, таких как Raf, VEGFR2/3, Flt-3, PDGFR, c-Kit и других киназ. Этому ингибитору придают большое значение при лечении индуцирующих ангиогенез, прогрессирующих опухолей (например, карцинома почек), а также меланом с высокой степенью мутаций B-Raf. Клиническое действие Bay 43-9006 оценивали только на пациентах с рефракторными солидными опухолями в комбинации, например, с доцетакселем. До настоящего времени выявлены слабые побочные действия и описан многообещающий противоопухолевый эффект. Ингибирование киназ в пути передачи сигнала PI3K-Akt для препарата Bay 43-9006 не описано. Ингибитор Mek1/2 PD 0325901 (WO 02/06213) в настоящее время находится в фазе I клинических испытаний. Описано также соединение-предшественник Cl-1040 (WO 00/35435, WO 00/37141), которое обладает высокой специфичностью к Mek и аффинностью к мишени. Однако, результаты испытаний в фазе I/II показали метаболическую нестабильность указанного соединения. Клинические данные следующего актуального препарата PD 032901 еще не опубликованы. Кроме того, для указанного ингибитора Mek не описано взаимодействие с Erk1 или Erk2, и не описано ингибирующее действие на сигнальный путь PI3K-Akt или одновременное модулирующее действие на указанный путь.
Описанные в настоящее время ингибиторы PI3K находятся в стадии доклинических испытаний. Фирма ICOS опубликовала данные об ингибиторе PI3K 1С87114 с высокой специфичностью к изоферменту PI3Kdelta (WO 01/81346). Для P1103 (WO 04/017950, Yamanouchi/Piramed) описана селективность в отношении изоформы PI3Kalpha. Таким образом, существует необходимость в разработке ингибиторов PI3K (см. обзор R. Wetzker и др., 2004).
Ингибиторы SAPK-сигнальных путей Jnk или р38 описаны в литературе (Gum RJ., 1998, Bennett В.L и др., 2001, Davies S.P. и др., 2000). Однако, для указанных SAPK-ингибиторов не описана ингибирующая PI3K активность, а также специфическая ингибирующая активность в отношении Erk1 или Erk2 или одновременная ингибирующая активность в отношении SAPK, Erk1, Erk2 или PI3K.
6- или 7-замещенные пиридо[2,3-b]пиразины нашли широкое применение в качестве фармацевтически активных веществ и в качестве синтетических фрагментов в фармацевтической химии.
В заявках WO 04/104002 и WO 04/104003 описаны производные пиридо[2,3-b] пиразина, которые замещены в положении 6 или 7 остатками мочевины, тиомочевины, амидина или гуанидина. Эти соединения обладают свойствами ингибиторов или модуляторов киназ, прежде всего тирозин- и серин/треонинкиназ, и их можно использовать в качестве лекарственных средств. Однако, не описано применение этих соединений в качестве модуляторов липидкиназ в отдельности или в комбинации с тирозин- и серин/треонинкиназами.
В заявке WO 99/17759 описаны производные пиридо[2,3-b]пиразина, которые содержат алкил-, арил- и гетероарилзамещенные карбаматные группы в положении 6. Указанные соединения можно использовать в качестве модуляторов серин/треонинпротеинкиназ.
В заявке WO 05/007099 (Kawakami и др.) описаны пиридо[2,3-b]пиразины, которые содержат в качестве заместителей остатки мочевины, в качестве ингибиторов серин/треонинкиназ РКВ. Однако, в этой заявке заместитель R, который является заместителем остатка мочевины, подробно не описан и, таким образом, диапазон заместителей остатка мочевины также не определен. Для этих соединений описано применение для лечения рака. Однако, не представлены конкретные примеры замещенных остатками мочевины пиридопиразинов, обладающих указанной биологической активностью. Кроме того, описанные в этой заявке пиридопиразины в структурном отношении четко отличаются от описанных в данном описании соединений пиридо[2,3-b]пиразинов.
Другие замещенные остатками мочевины пиридо[2,3-b]пиразины в положении 6 и 7 описаны в заявке WO 05/056547 (Bemis и др.). Соединения, описанные в этой заявке, содержат в положении 2 или 3 дополнительные заместители, карбонил, сульфокси, сульфоно или имино, и таким образом в структурном отношении четко отличаются от описанных в данном описании соединений пиридо[2,3-b]пиразинов. Соединения, описанные в заявке WO 05/056547, проявляют активность ингибиторов протеинкиназ, прежде всего GSK-3, Syk и JAK-3. Для этих ингибиторов кроме прочего описано применение для лечения пролиферативных заболеваний. Применение указанных соединений в качестве модуляторов липидкиназ в отдельности или в комбинации с серин/треонинкиназами не описано.
В заявке WO 04/005472 среди прочих описаны 6-карбаматзамещенные пиридо[2,3-b]пиразины, которые являются антибактериальными соединениями, то есть подавляют рост бактерий. Противоопухолевое действие не описано.
В заявках WO 03/084473 (Barnett и др.), WO 03/086394 (Bilodeau и др.) и WO 03/086403 (Lindsley и др.) описаны определенные дифенилхиноксалин и -пиридо[2,3-b]пиразины, содержащие специфические заместители алкилпиррролидина, алкилпиперидина или алкилсульфонамида в фенильном кольце и, кроме того, остатки мочевины или карбамата в качестве заместителей в положении 6 или 7, в качестве ингибиторов активности серин/треонинкиназы Akt. Описано применение указанных соединений для лечения рака. Для описанных в данной заявке соединений пиридо[2,3-b]пиразинов не представлены определенные данные по их биологической активности. Кроме того, описанные в этих заявках пиридопиразины в структурном отношении четко отличаются от описанных в данном описании соединений пиридо[2,3-b]пиразинов.
В заявке WO 03/024448 (Delorme и др.) описаны амид- и акриламид-замещенные пиридо[2,3-b]пиразины, содержащие дополнительные карбаматные заместители, и описано их применение в качестве ингибиторов гистондеацетилазы для лечения пролиферативных заболеваний.
В других публикациях (Temple С.Jr., J. Med. Chem. 1990, 3044-3050) описаны примеры синтеза 6-этилкарбамат-замещенных производных пиридо[2,3-b]пиразинов. Противоопухолевое действие не описано. В статье R.D. Elliott (J. Org. Chem. 1968, 2393-2397) описан синтез других производных 6-этилкарбаматзамещенных пиридо[2,3-b]пиразинов. Биологическое действие указанных соединений также не описано.
В публикации С. Temple Jr., J. Med. Chem. 1968, 1216-1218) описан синтез и исследование 6-этилкарбамат-замещенных производных пиридо[2,3-b]пиразинов в качестве эффективных антималярийных агентов. Противоопухолевое действие не описано.
Раскрытие изобретения
В настоящем изобретении предлагаются новые производные пиридопиразина, которые являются модуляторами рецепторных тирозинкиназ, цитоплазматических тирозин-, треонин/серинкиназ и липидкиназ. Так как не все киназы, расположенные в анормальном каскаде путей передачи сигнала, например, в путях Raf-Mek-Erk и PI3K-Akt, являются онкогенными или конститутивно активированными ферментами, в настоящем изобретении неактивные киназы рассматриваются в качестве белков-мишеней при лечении, то есть новые производные пиридопиразина связываются не только с активными, но и с неактивными киназами, и при этом оказывают влияние на путь передачи сигнала.
Настоящее изобретение относится также к новым производным пиридопиразина, которые являются модуляторами рецепторных тирозинкиназ, цитоплазматических тирозин-, треонин/серинкиназ и липидкиназ, причем модулирующее действие оказывается как на отдельные киназы, так и на две или более киназы, прежде всего, киназы Erk1/2 и PI3K, расположенные в одном каскаде или различных каскадах путей передачи сигнала, прежде всего, ras-Raf-Mek-Erk и PI3K-Akt. Такой двойной механизм действия, то есть, одновременное ингибирование двух или более каскадов передачи сигнала, обладает преимуществом при применении в терапии по сравнению с ингибированием только одного пути передачи сигнала, так как за счет аддитивного действия достигается увеличение эффективности при лечении всех патологических процессов, зависимых от киназ.
Неожиданно было установлено, что новые производные пиридо[2,3-d] пиразинов, содержащие в положении 6 или 7 остатки мочевины или тиомочевины, можно использовать для получения лекарственного средства, предназначенного для модуляции анормальных процессов передачи сигнала в клетках, прежде всего, для влияния на функцию рецепторных тирозинкиназ, цитоплазматических тирозин-, треонин/серинкиназ и липидкиназ и для лечения злокачественных или доборокачественных опухолей, например молочной железы, предстательной железы, легких, кожи, яичников и других заболеваний, опосредованных патологической пролиферацией клеток.
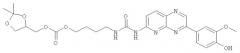
Первый аспект настоящего изобретения относится к новым производным пиридо[2,3-d]пиразинов, охватываемых общей формулой (I):
где:
(А) один из заместителей Z3, Z4 или оба заместителя Z3, Z4 независимо друг от друга означают замещенный арил, где замещенный арил замещен по меньшей мере одним заместителем, одинаковым или различным, который выбран из группы, включающей:
(а) алкил, циклоалкил, гетероциклил, арил, гетероарил, -NH-X1, -N(алкил)2, -NHC(O)-алкил, -NHC(O)-циклоалкил, -NHC(O)-гетероциклил, -NHC(O)-арил, -NHC(O)-гетероарил, -NHC(O)-арилалкил, -NHC(O)-гетероарилалкил, -NHS(O2)-алкил, -NHS(O)2-циклоалкил, -NHS(O2)-гетероциклил, -NHS(O2)арил, -NHS(O2)-гетероарил, -NHS(O2)-арилалкил, -NHS(O2)-гетероарилалкил, -S-алкил, -S-арил, -S-гетероарил, O-Х2, -ОС(O)-алкил, -ОС(O)-циклоалкил, -ОС(O)-гетероциклил, -ОС(O)-арил, -ОС(O)-гетероарил, -ОС(O)-арилалкил, -ОС(O)-гетероарилалкил, -OS(O2)-алкил, -OS(O2)-циклоалкил, -OS(O2)-гетероциклил, -OS(O2)-арил, -OS(O2)-гетероарил, -OS(O2)-арилалкил, -OS(O2)-гетероарилалкил, -С(O)-алкил, -С(O)-арил, -С(O)-гетероарил, -С(O)O-Х3, -С(O)NH-Х4, -С(O)N(алкил)2, -С(O)N(циклоалкил)2, -С(O)N(арил)2, -С(O)N(гетероарил)2, -S(O)-алкил, -S(O)-арил, -S(O2)-алкил, -S(O2)-арил, -S(O2)NH-алкил, -S(O2)NH-арил, -S(O2)NH-гетероарил, -S(O2)NH-арилалкил, -S(O2)O-алкил, -S(O2)O-арил, -S(O2)O-арилалкил,
где Х1, Х2, Х3, Х4 независимо друг от друга выбраны из группы, включающей алкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, арилалкил, гетероарил, гетероарилалкил,
при условии, что указанные выше заместители группы (а) независимо в свою очередь замещены по меньшей мере одним заместителем, одинаковым или различным, который выбран из группы, включающей
(i) (С9-С30)алкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, арилалкил, гетероарил, гетероарилалкил, N3,
-NH-циклоалкил, -NH-циклоалкилалкил, -NH-гетероарил,
-NH-гетероарилалкил, -NH-арилалкил, -NH-гетероциклил,
-NH-гетероциклилалкил, -NX5X6, -S-циклоалкил, -S-циклоалкилалкил, -S-арил, -S-арилалкил, -S-гетероарил, -S-гетероарилалкил, -S-гетероциклил, -S-гетероциклилалкил, -О-циклоалкил, -O-циклоалкилалкил, -O-арилалкил, -O-гетероарил, -O-гетероарилалкил, -O-гетероциклил, -O-гетероциклилалкил, -O(-Х7-O)р-Х8 (p равно 1, 2, 3, 4, 5), -OP(O)(OX9)(OX10), -C(O)O-X11-C(O)NH2, -C(O)NH-X12, -C(O)NX13X14, -S(O2)-X15, -P(O)(OH)2, -P(O)(OX16)(OX17), -Si(X18)(X19)(X20), -O-Si(X21)(X22)(X23), -O-C(O)-O-X24, -O-C(O)-NH-X25, -O-C(O)-NX26X27, -NH-C(O)-O-X28, -NH-C(O)-NH-X29, -NH-C(O)-NX30X31, -NX32-C(O)-O-X33, -NX34-C(O)-NH-X35, -NX36-C(O)-NX37X38, -O-S(O2)-X39, -NH-C(O)-X40, -NX41-C(O)-X42, -C(O)-X43, -OC(O)-X44, -S(O)-X45, -S(O2)-NHX46, -S(O2)-NX47X48, -S(O2)-OX49, -O(-X50-O)p-H (p равно 1, 2, 3, 4, 5),
при условии, что -N(алкил)2 содержит заместители, по меньшей мере один заместитель, который выбран из группы (b),
где Х5, Х6, Х7, Х8, Х9, Х10, Х11, Х12, Х13, Х14, Х15, Х16, Х17, Х18, Х19, Х20, Х21, Х22, Х23, Х24, Х25, Х26, Х27, Х28, Х29, Х30, Х31, Х32, Х33, Х34, Х35, Х36, Х37, Х38, Х39, Х40, Х41, Х42, Х43, Х44, Х45, Х46, Х47, Х48, Х49, Х50 независимо друг от друга выбраны из группы, включающей: алкил, (С9-С30)алкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, арилалкил, гетероарил, гетероарилалкил и где в другом варианте Х13, Х14 и/или Х26, Х27 и/или Х30, Х31 и/или Х37, Х38 и/или Х47, Х48 в каждом случае вместе образуют гетероциклил,
и при условии, что если один из заместителей замещеный арил Z3 или Z4 замещен гетероциклилалкилом, а другой заместитель Z3 или Z4 не означает замещеный или незамещеный арил,
кроме того, необязательно один из заместителей Z3, Z4 или оба заместителя Z3, Z4 независимо друг от друга так же замещены по меньшей мере одним заместителем, одинаковыми или различными, выбранным из группы, включающей:
(b) алкил, (С9-С30)алкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, арилалкил, гетероарил, гетероарилалкил, F, Cl, Br, I, CN, CF3, N3, NH2, -NHX51, -NX52X53, -NO2, -ОН, -OCF3, -SH, -O-SO3H, -ОР(O)(ОН)2, -СНО, -СООН, -C(O)NH2, -SO3H, -Р(O)(ОН)2, -С(O)-Х54, -С(O)O-Х55, -C(O)NH-X56, -C(O)NX57X58, -O-Х59, -O(-Х60-O)r-Н (r равно 1, 2, 3, 4, 5), -O(-Х61-O)r-Х62 (r равно 1, 2, 3, 4, 5), -ОС(O)-Х63, -ОС(O)-O-Х64, -OC(O)-NHX65, -O-C(O)-NX66X67, -OP(O)(OX68)(OX69), -OSi(X70)(X71)(X72), -OS(O2)-X73, -NHC(O)-X74, -NX75C(O)-X76, -NH-C(O)-O-X77, -NH-C(O)-NH-X78, -NH-C(O)-NX79X80, -NX81-C(O)-O-X82, -NX83-C(O)-NH-X84, -NX85-C(O)-NX86X87, -NHS(O2)-X88, -NX89S(O2)-X90, -S-X91, -S(O)-X92, -S(O2)-X93, -S(O2)NH-X94, -S(O2)NX95X96, -S(O2)O-X97, -P(O)(OX98)(OX99), -Si(X100)(X101)(X102),
где X51, X52, X53, X54, X55, X56, X57, X58, X59, X60, X61, X62, X63, X64, X65, X66, X67, X68, X69, X70, X71, X72, X73, X74, X75, X76, X77, X78, X79, X80, X81, X82, X83, X84, X85, X86, X87, X88, X89, X90, X91, X92, X93, X94, X95, X96, X97, X98, X99, X100, X101, X102 независимо друг от друга выбраны из группы, включающей: алкил, (С9-С30)алкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, арилалкил, гетероарил, гетероарилалкил и где в другом варианте X57, X58 и/или X66, X67 и/или X79, X80 и/или X86, X87 и/или X95, X96 в каждом случае вместе образуют гетероциклил,
кроме того, необязательно вышеперечисленные заместители из подгруппы (b) независимо друг от друга в свою очередь замещены по меньшей мере одним заместителем, одинаковым или различными, выбранным из группы, включающей:
(ii) алкил, (С9-С30)алкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, арилалкил, гетероарил, гетероарилалкил, F, Cl, Br, I, CN, CF3, N3, NH2, -NHX103, -NX104X105, -NO2, -ОН, -OCF3, -SH, -О-SO3H, -ОР(O)(ОН)2, -СНО, -СООН, -C(O)NH2, -SO3H, -Р(O)(ОН)2, -С(O)-Х106, -С(O)O-Х107, -C(O)NH-X108, -C(O)NX109X110, -O-Х111, -O(-Х112-O)s-H (s равно 1, 2, 3, 4, 5), -O(-X113-O)s-X114 (s равно 1, 2, 3, 4,5), -ОС(O)-Х115, -OC(O)-O-X116, -OC(O)-NHX117, -O-C(O)-NX118X119, -OP(O)(OX120)(OX121), -OSi(X122)(X123)(X124), -OS(O2)-X125, -NHC(O)-X126, -NX127C(O)-X128, -NH-C(O)-O-X129, -NH-C(O)-NH-X130, -NH-C(O)-NX131X132, -NX133-C(O)-O-X134, -NX135-C(O)-NH-X136, -NX137-C(O)-NX138X139, -NHS(O2)-X140, -NX141S(O2)-X142, -S-X143, -S(O)-X144, -S(O2)-X145, -S(O2)NH-X146, -(O2)NX147X148, -S(O2)O-X149, -P(O)(OX150)(OX151), -Si(X152)(X153)(X154),
где Х103, X104, X105, X106, X107, X1OS, X109, X110, X111, X112, X113, X114, X115, X116, X117, X118, X119, X120, X121, X122, X123, X124, X125, X126, X127, X128, X129, X130, X131, X132, X133, X134, X135, X136, X137, X138, X139, X140, X141, X142, X143, X144, X145, X146, X147, X148, X149, X150, X151, X152, X153, X154 независимо друг от друга выбраны из группы, включающей: алкил, (С9-С30)алкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, арилалкил, гетероарил, гетероарилалкил и где в другом варианте X109, X110 и/или X118, X119 и/или X131, X132 и/или Х138, X139 и/или Х147, X148 в каждом случае вместе образуют гетероциклил,
где необязательно вышеперечисленные заместители из группы (i) и/или группы заместителей (ii) независимо друг от друга в свою очередь замещены по меньшей мере одним заместителем, одинаковым или различным, выбранным из группы, включающей:
(iii) алкил, (С9-С30)алкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, арилалкил, гетероарил, гетероарилалкил, F, Cl, Br, I, CN, CF3, N3, NH2, -NHX155, -NX156X157, -NO2, -ОН, -OCF3, -SH, -O-SO3H, -OP(O)(OH)2, -СНО, -СООН, -C(O)NH2, -SO3H, -Р(O)(ОН)2, -С(O)-Х158, -С(O)O-Х159, -C(O)NH-X160, -C(O)NX161X162, -O-X163, -O(-Х164-O)t-Н (t равно 1, 2, 3, 4, 5), -O(-X165-O)t-X166 (t равно 1, 2, 3, 4, 5), -ОС(O)-Х167, -OC(O)-O-X168, -OC(O)-NHX169, -O-C(O)-NX170X171, -OP(O)(OX172)(OX173), -OSi(X174)(X175)(X176), -OS(O2)-X177, -NHC(O)-X178, -NX179C(O)-X180, -NH-C(O)-O-X181, -NH-C(O)-NH-X182, -NH-C(O)-NX183X184, -NX185-C(O)-O-X186, -NX187-C(O)-NH-X188, -NX189-C(O)-NX190X191, -NHS(O2)-X192, -NX193S(O2)-X194, -S-X195, -S(O)-X196, -S(O2)-X197, -S(O2)NH-X198, -S(O2)NX1 99Х200, -S(O2)O-X201, -P(O)(OX202)(OX203), -Si(X204)(X205)(X206),
где X155, X156, X157, X158, X159, X160, X161, X162, X163, X164, X165, X166, X167, X168, X169, X170, X171, X172, X173, X174, X175, X176, X177, X178, X179, X180, X181, X182, X183, X184, X185, X186, X187, X188, X189, X190, X191, X192, X193, X194, X195, X196, X197, X198, X199, X200, X201, X202, X203, X204, X205, X206 независимо друг от друга выбраны из группы, включающей: алкил, (С9-С30)алкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, арилалкил, гетероарил, гетероарилалкил и где в другом варианте X161, X162 и/или X170, X171 и/или X183, X184 и/или X190, X191 и/или X199, X200 вместе образуют гетероциклил,
или один из заместителей Z3, Z4 или оба заместителя Z3, Z4 независимо друг от друга означают замещеный арил, где замещеный арил замещен по меньшей мере одним заместителем, одинаковым или различным, выбранным из группы, включающей:
(с) (С9-С30)алкил, -NX207X208, -NH-(С9-С30)алкил, -NHC(O)-циклоалкилалкил, -NHC(O)-гетероциклилалкил, -NHC(O)-(С9-С30)алкил, -NX209C(O)-X210, -NX211C(O)-(С9-С30)алкил, -NHC(O)-OX212, -NX213C(O)-OX214, -NHC(O)-NHX215, -NHC(O)-NX216X217, -NX218C(O)-NHX219, -NX220C(O)-NX221X222, -NHS(O2)-циклоалкилалкил, -NHS(O2)-гетероциклилалкил, -NX223S(O2)-X224, -O-(С9-С30)алкил, -S-циклоалкил, -S-гетероциклил, -S-арилалкил, -S-гетероарилалкил, -S-циклоалкилалкил, -S-гетероциклилалкил, -S-(С9-С30)алкил, -ОС(O)-циклоалкилалкил, -ОС(O)-гетероциклилалкил, -ОС(O)-(С9-С30)алкил, -OS(O2)-циклоалкилалкил, -OS(O2)-гетероциклилалкил, -OS(O2)-(С9-С30)алкил, -ОС(O)-ОХ225, -OC(O)-NHX226, -OC(O)-NX227X228, -OP(O)(OX229)(OX230), -С(O)-циклоалкил, -С(O)-гетероциклил, -С(O)-арилалкил, -С(O)-гетероарилалкил, -С(O)-циклоалкилалкил, -С(O)-гетероциклилалкил, -С(O)-(С9-С30)алкил, -С(O)O-(С9-С30)алкил, -С(O)NH-(С9-С30)алкил, -C(O)NX231X232, -C(O)NH-OX233, -C(O)NX234-OX235, -C(O)NH-NX236X237, -C(O)NX238-NX239X240, -S(O)-циклоалкил, -3(O)-гетероциклил, -S(O)-гетероарил, -S(O)-арилалкил, -S(O)-гетероарилалкил, -S(O)-циклоалкилалкил, -S(O)-гетероциклилалкил, -S(O)-(С9-С30)алкил, -S(O2)-циклоалкил, -S(O2)-гетероциклил, -S(O2)-гетероарил, -S(O2)-арилалкил, -S(O2)-гетероарилалкил, -S(O2)-циклоалкилалкил, -S(O2)-гетероциклилалкил, -S(O2)-(С9-С30)алкил, -S(O2)NH-циклоалкил, -S(O2)NH-гетероциклил, -S(O2)NH-гетероарилалкил, -S(O2)NH-циклоалкилалкил, -S(O2)NH-гетероциклилалкил, -S(O2)NH-(С9-С30)алкил, -S(O2)O-циклоалкил, -S(O2)O-гетероциклил, -S(O2)O-гетероарил, -S(O2)O-гетероарилалкил, -S(O2)O-циклоалкилалкил, -S(O2)O-гетероциклилалкил, -S(O2)O-(С9-С30)алкил, -Р(O)(ОН)2, -Р(O)(ОХ241)(ОХ242), -Si(X243)(X244)(X245), -O-Si(X246)(X247)(X248),
где Х207, X208, X209, X210, X211, X212, X213, X214, X215, X216, X217, X218, X219, X220, X221, X222, X223, X224, X225, X226, X227, X228, X229, X230, X231, X232, X233, X234, X235, X236, X237, X238, X239, X240, X241, X242, X243, X244, X245, X246, X247, X248 независимо друг от друга выбраны из группы, включающей: алкил, (С9-С30)алкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, арилалкил, гетероарил, гетероарилалкил и где в другом варианте X216, X217 и/или X221, X222 и/или X227, X228 и/или X231, X232 и/или X236, X237 и/или X239, X240 в каждом случае вместе образуют гетероциклил,
при условии, что заместители -N(алкил)2, -С(O)N(алкил)2, -С(O)N(циклоалкил)2, -С(O)N(арил)2, -С(O)N(гетероарил)2 содержат заместитетили, по меньшей мере один заместитель выбран из группы (i), указанной ниже,
при условии, что если один из заместителей Z3 или Z4 означает замещеный арил и замещен гетероциклилалкилом, другой из заместителей Z3 или Z4 не означает незамещеный или замещеный арил,
кроме того, необязательно вышеперечисленные заместители из подгруппы (с) независимо друг от друга в свою очередь замещены по меньшей мере одним заместителем, одинаковым или различным, выбранным из группы, включающей:
(i) алкил, (С9-С30)алкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, арилалкил, гетероарил, гетероарилалкил, F, Cl, Br, I, CN, CF3, N3, NH2, -NHX249, -NX250X251, -NO2, -ОН, -OCF3, -SH, -O-SO3H, -ОР(O)(ОН)2, -СНО, -СООН, -C(O)NH2, -SO3H, -Р(O)(ОН)2, -С(O)-Х252, -C(O)O-X253, -C(O)NH-X254, -C(O)NX255X256, -O-X257, -O(-X258-O)u-H (u равно 1, 2, 3, 4, 5), -O(-Х259-O)u-Х260 (u равно 1, 2, 3, 4, 5), -ОС(O)-Х261, -OC(O)-O-X262, -OC(O)-NHX263, -O-C(O)-NX264X265, -OP(O)(OX266)(OX267), -OSi(X268)(X269)(X270), -OS(O2)-X271, -NHC(O)-X272, -NX273C(O)-X274, -NH-C(O)-O-X275, -NH-C(O)-NH-X276, -NH-C(O)-NX277X278, -NX279-C(O)-O-X280, -NX281-C(O)-NH-X282, -NX283-C(O)-NX284X285, -NHS(O2)-X286, -NX287S(O2)-X288, -S-X289, -S(O)-X290, -S(O2)-X291, -S(O2)NH-X292, -S(O2)NX293X294, -S(O2)O-X295, -P(O)(OX296)(OX297), -Si(X298)(X299)(X300),
где X249, X250, X251, X252, X253, X254, X255, X256, X257, X258, X259, X260, X261, X262, X263, X264, X265, X266, X267, X268, X269, X270, X271, X272, X273, X274, X275, X276, X277, X278, X279, X280, X281, X282, X283, X284, X285, X286, X287, X288, X289, X290, X291, X292, X293, X294, X295, X296, X297, X298, X299, Х300 независимо друг от друга выбраны из группы, включающей: алкил, (С9-С30)алкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, арилалкил, гетероарил, гетероарилалкил, и где в другом варианте X255, X256 и/или X264, X265 и/или X277, X278 и/или X284, X285 и/или X293, X294 в каждом случае вместе образуют гетероциклил,
где необязательно один из заместителей Z3, Z4 или оба заместителя Z3, Z4 независимо друг от друга так же замещены по меньшей мере одним заместителем, одинаковымии или различнымии, выбранным из группы включающей:
(d) алкил, (С9-С30)алкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, арилалкил, гетероарил, гетероарилалкил, F, Cl, Br, I, CN, CF3, N3, NH2, -NHX301, -NX3O2X303, -NO2, -ОН, -OCF3, -SH, -O-SO3H, -ОР(O)(ОН)2, -СНО, -СООН, -C(O)NH2, -SO3H, -Р(O)(ОН)2, -С(O)-Х304, -С(O)O-Х305, -C(O)NH-X306, -C(O)NX307X308, -O-Х309, -O(-Х310-O)uu-Н (uu равно 1, 2, 3, 4, 5), -O(-X311-O)uu-X312 (uu равно 1, 2, 3, 4, 5), -ОС(O)-Х313, -OC(O)-O-X314, -OC(O)-NHX315, -O-C(O)-NX316X317, -OP(O)(OX318)(OX319), -OSi(X320)(X321)(X322), -OS(О2)-Х323, -NHC(O)-X324, -NX325C(O)-X326, -NH-C(O)-O-X327, -NH-C(O)-NH-X328, -NH-C(O)-NX329X330, -NX331-C(O)-O-X332, -NX333-C(O)-NH-X334, -NX335-C(O)-NX336X337, -NHS(O2)-X338, -NX339S(O2)-X340, -S-X341, -S(O)-X342, -S(O2)-X343, -S(O2)NH-X344, -S(O2)NX345X346, -S(O2)O-X347, -P(O)(OX348)(OX349), -Si(X350)(X351)(X352),
где X301, X302, X303, X304, X305, X306, X307, X308, X309, X310, X311, X312, X313, X314, X315, X316, X317, X318, X319, Х320, Х321, Х322, Х323, Х324, Х325, Х326, Х327, Х328, Х329, Х330, Х331, Х332, Х333, Х334, Х335, Х336, Х337, Х338, Х339, Х340, Х341, Х342, Х343, Х344, Х345, Х346, Х347, Х348, Х349, Х350, Х351, Х352 независимо друг от друга выбраны из группы, включающей: алкил, (С9-С30)алкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, арилалкил, гетероарил, гетероарилалкил и где в другом варианте X307, X308 и/или X316, X317 и/или Х329, Х330 и/или Х336, Х337 и/или Х345, Х346 в каждом случае вместе образуют гетероциклил,
где необязательно вышеперечисленные заместители из группы (а) независимо друг от друга в свою очередь замещены по меньшей мере одним заместителем, одинаковым или различным, выбранным из группы, включающей:
(ii) алкил, (С9-С30)алкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, арилалкил, гетероарил, гетероарилалкил, F, Cl, Br, I, CN, CF3, N3, NH2, -NHX353, -NX354X355, -NO2, -ОН, -OCF3, -SH, -O-SO3H, -OP(O)(OH)2, -CHO, -СООН, -C(O)NH2, -SO3H, -Р(O)(ОН)2, -С(O)-Х356, -С(O)O-Х357, -C(O)NH-X358, -C(O)NX359X360, -O-Х361, -O(-Х362-O)v-Н (v равно 1, 2, 3, 4, 5), -O(-Х363-O)v-Х364 (v равно 1, 2, 3, 4, 5), -ОС(O)-Х365, -OC(O)-O-X366, -OC(O)-NHX367, -O-C(O)-NX368X369, -OP(O)(OX370)(OX371), -OSi(X372)(X373)(X374), -OS(O2)-X375, -NHC(O)-X376, -NX377C(O)-X378, -NH-C(O)-O-X379, -NH-C(O)-NH-X380, -NH-C(O)-NX381X382, -NX383-C(O)-O-X384, -NX385-C(O)-NH-X386, -NX387-C(O)-NX388X389, -NHS(O2)-X390, -NX391S(O2)-X392, -S-X393, -S(O)-X394, -S(O2)-X395, -S(O2)NH-X396, -S(O2)NX397X398, -S(O2)O-X399, -P(O)(OX400)(OX401), -Si(X402)(X403)(X404),
где X353, X354, X355, X356, X357, X358, X359, X360, X361, X362, X363, X364, X365, X366, X367, X368, X369, X370, X371, X372, X373, X374, X375, X376, X377, X378, X379, X380, X381, X382, X383, X384, X385, X386, X387, X388, X389, X390, X391, X392, X393, X394, X395, X396, X397, X398, X399, X400, X401, X402, X403, X404 независимо друг от друга выбраны из группы, включающей: алкил, (С9-С30)алкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, арилалкил, гетероарил, гетероарилалкил и где в другом варианте X359, X360 и/или X368, X369 и/или X381, X382 и/или X388, X389 и/или X397, X398 в каждом случае вместе образуют гетероциклил,
где необязательно вышеперечисленные заместители из группы (i) и/или группы (ii) независимо друг от друга в свою очередь замещены по меньшей мере одним заместителем, одинаковым или различным, выбранным из группы, включающей:
(iii) алкил, (С9-С30)алкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, арилалкил, гетероарил, гетероарилалкил, F, Cl, Br, I, CN, CF3, N3, NH2, -NHX405, -NX406X407, -NO2, -ОН, -OCF3, -SH, -O-SO3H, -ОР(O)(ОН)2, -СНО, -СООН, -С(O)NH2, -SO3H, -Р(O)(ОН)2, -С(O)-Х408, -С(O)O-Х409, -C(O)NH-X410, -C(O)NX411X412, -O-Х413, -O(-Х414-O)w-Н (w равно 1, 2, 3, 4, 5), -O(-Х415-O)w-Х416 (w равно 1, 2, 3, 4, 5), -ОС(O)-Х417, -OC(O)-O-X418, -OC(O)-NHX419, -O-C(O)-NX420X421, -OP(O)(OX422)(OX423), -OSi(X424)(X425)(X426), -OS(O2)-X427, -NHC(O)-X428, -NX429C(O)-X430, -NH-C(O)-O-X431, -NH-C(O)-NH-X432, -NH-C(O)-NX433X434, -NX435-C(O)-O-X436, -NX437-C(O)-NH-X438, -NX439-C(O)-NX440X441, -NHS(O2)-X442, -NX443S(O2)-X444, -S-X445, -S(O)-X446, -S(O2)-X447, -S(O2)NH-X448, -S(O2)NX449X450, -S(O2)O-X451, -P(O)(OX452)(OX453), -Si(X454)(X455)(X456),
где X405, X406, X407, X408, X409, X410, X411, X412, X413, X414, X415, X416, X417, X418, X419, X420, X421, X422, X423, X424, X425, X426, X427, X428, X429, X430, X431, X432, X433, X434, X435, X436, X437, X438, X439, X440, X441, X442, X443, X444, X445, X446, X447, X448, X449, X450, X451, X452, X453, X454, X455, X456 независимо друг от друга выбраны из группы, включающей: алкил, (С9-С30)алкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, арилалкил, гетероарил, гетероарилалкил и где в другом варианте Х411, X412 и/или X420, X421 и/или X433, X434 и/или X440, X441 и/или X449, X450 в каждом случае вместе образуют гетероциклил,
и один из заместителей Z3, Z4 или ни один из заместителей Z3, Z4 независимо друг от друга выбраны из группы, включающей:
(e) водород,
(f) галоген, F, Cl, Br, I,
(g) незамещенный или замещенный алкил или (С9-С30)алкил, где необязательно заместитель алкил или (С9-С30)алкил замещен по меньшей мере одним заместителем, одинаковым или различным, выбранным из группы, включающей:
(i) алкил, (С9-С30)алкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, арилалкил, гетероарил, гетероарилалкил, F, Cl, Br, I, CN, CF3, N3, NH2, -NHX457, -NX458X459, -NO2, -ОН, -OCF3, -SH, -О-SO3H, -ОР(O)(ОН)2, -СНО, -СООН, -С(O)NH2, -SO3H, -Р(O)(ОН)2, -С(O)-Х460, -С(O)O-Х461, -C(O)NH-X462, -C(O)NX463X464, -O-Х465, -O(-Х466-O)х-Н (х равно 1, 2, 3, 4, 5), -O(-Х467-O)x-Х468 (х равно 1, 2, 3, 4, 5), -ОС(O)-Х469, -OC(O)-O-X470, -OC(O)-NHX471, -O-C(O)-NX472X473, -OP(O)(OX474)(OX475), -OSi(X476)(X477)(X478), -OS(O2)-X479, -NHC(O)-X480, -NX481 C(O)-X482, -NH-C(O)-O-X483, -NH-C(O)-NH-X484, -NH-C(O)-NX485X486, -NX487-C(O)-O-X488, -NX489-C(O)-NH-X490, -NX491-C(O)-NX492X493, -NHS(O2)-X494, -NX495S(O2)-X496, -S-X497, -S(O)-X498, -S(O2)-X499, -S(O2)NH-X500, -S(O2)NX501X502, -S(O2)O-X503, -P(O)(OX504)(OX505), -Si(X506)(X507)(X508),
где X457, X458, X459, X460, X461, X462, X463, X464, X465, X466, X467, X468, X469, X470, X471, X472, X473, X474, X475, X476, X477, X478, X479, X480, X481, X482, X483, X484, X485, X486, X487, X488, X489, X490, X491, X492, X493, X494, X495, X496, X497, X498, X499, X500, X501, X502, X503, X504, X505, X506, X507, X508 независимо друг от друга выбраны из группы, включающей: алкил, (С9-С30)алкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, арилалкил, гетероарил, гетероарилалкил и где в другом варианте X463, X464 и/или X472, X473 и/или Х485, Х486 и/или X492, Х493 и/или Х501, Х502 в каждом случае вместе образуют гетероциклил,
кроме того, необязательно вышеперечисленные заместители из группы (i) независимо друг от друга в свою очередь замещены по меньшей мере одним заместителем, одинаковым или различным, выбранным из группы, включающей:
(ii) алкил, (С9-С30)алкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, арилалкил, гетероарил, гетероарилалкил, F, Cl, Br, I, CN, CF3, N3, NH2, -NHX509, -NX510X511, -NO2, -ОН, -OCF3, -SH, -O-SO3H, -ОР(O)(ОН)2, -СНО, -СООН, -С(O)NH2, -SO3H, -Р(O)(ОН)2, -С(O)-Х512, -С(O)O-Х513, -C(O)NH-X514, -C(O)NX515X516, -O-Х517, -O(-Х518-O)y-Н (y равно 1, 2, 3, 4, 5), -O(-Х519-O)y-Х520 (y равно 1, 2, 3, 4, 5), -ОС(O)-Х521, -OC(O)-O-X522, -OC(O)-NHX523, -O-C(O)-NX524X525, -OP(O)(OX526)(OX527), -OSi(X528)(X529)(X530), -OS(O2)-X531, -NHC(O)-X532, -NX533C(O)-X534, -NH-C(O)-O-X535, -NH-C(O)-NH-X536, -NH-C(O)-NX537X538, -NX539-C(O)-O-X540, -NX541-C(O)-NH-X542, -NX543-C(O)-NX544X545, -NHS(O2)-X546, -NX547S(O2)-X548, -S-X549, -S(O)-X550, -S(O2)-X551, -S(O2)NH-X552, -S(O2)NX553X554, -S(O2)O-X555, -P(O)(OX556)(OX557), -Si(X558)(X559)(X560),
где Х509, X510, X511, X512, X513, X514, X515, X516, X517, X518, X519, X520, X521, X522, X523, X524, X525, X526, X527, X528, X529, X530, X531, X532, X533, X534, X535, X536, X537, X538, X539, X540, X541, X542, X543, X544, X545, X546, X547, X548, X549, X550, X551, X552, X553, X554, X555, X556, X557, X558, X559, X560 независимо друг от друга выбраны из группы, включающей: алкил, (С9-С30)алкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, арилалкил, гетероарил, гетероарилалкил и где в другом варианте Х515, Х516 и/или Х524, Х525 и/или Х537, Х538 и/или Х544, Х545 и/или Х553, Х554 в каждом случае вместе образуют гетероциклил,
где необязательно вышеперечисленные заместители из группы (ii) независимо друг от друга в свою очередь замещены по меньшей мере одним заместителем, одинаковым или различным, выбранным из группы, включающей:
(iii) алкил, (С9-С30)алкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, арилалкил, гетероарил, гетероарила