Аналоги галихондрина в
Иллюстрации
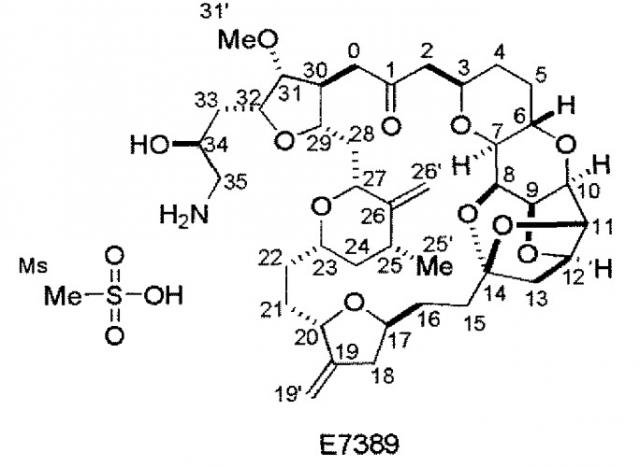
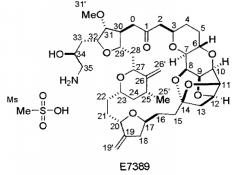
Показать всеДанное изобретение относится к различным аналогам галихондрина В, в кристаллической форме, имеющим противораковую активность, а также к способу получения соединений Е-086526 или Е-7389 формул:
7 н. и 1 з.п. ф-лы, 21 ил., 11 табл., 7 пр.
Реферат
Область изобретения
Изобретение относится к аналогам галихондрина В, имеющим фармацевтическую активность. В некоторых вариантах осуществления аналоги имеют кристаллическую форму и/или дополнительно применимы в качестве синтетического промежуточного соединения в синтезе аналога Е7389 галихондрина В, соединения, имеющего сильные противораковые свойства.
Предшествующий уровень техники
Галихондрин В, сильный противораковый агент, первоначально был выделен из морской губки Halichondria okadai. Он обнаружен также в Axinella sp., Phakellia carteri и Lissondendryx sp. Галихондрин В проявляет in vitro ингибирование полимеризации тубулина, скопления микротрубочек, сшивки бетаS-тубулина, связывание GTR и винбластина с тубулином и зависимый от тубулина гидролиз GTR. Была также показана in vitro и in vivo противораковая активность.
Aicher и др. опубликовали общий синтез галихондрина В в 1992 г. См. Aicher, T.D. et al., J. Am. Chem. Soc. 114:3162-3164, и Zheng, W.J. et al., J. Bioorg. Med. Chem. Lett. 2004, 14, 5551. Синтезы галихондрина В и различных аналогов описаны также в патентах США 6214865, 6365759, 6469182 и 6653341, в опубликованных патентных заявках США 2004/0198806 и 2006/0104984 и в опубликованной заявке РСТ WO 2005/118565, все они приобщены к сему ссылкой во всей их полноте.
Сущность изобретения
Данное изобретение относится к аналогам галихондрина В, имеющим фармацевтическую активность. Аналоги имеют кристаллическую форму и/или находят дополнительное применение в качестве синтетического промежуточного соединения в синтезе аналога Е7389 галихондрина В, соединения, имеющего сильные противораковые свойства. Соответственно, изобретение относится к кристаллической форме моногидрата ER-076349, кристаллической форме ER-809681, соединению ER-820057 или кристаллической форме ER-820057, соединению ER-818906 или кристаллической форме ER-818906, соединению ER-819531 или кристаллической форме ER-819531, соединению ER-111197 или кристаллической форме ER-111197. Изобретение также относится к фармацевтическим композициям, содержащим указанные соединения, и способам лечения рака введением этих соединений.
Краткое описание чертежей
Фиг.1-А представляет изображение ORTEP структуры монокристалла моногидрата ER-076349-00.
Фиг.1-В представляет диаграмму кристаллической упаковки моногидрата ER-076349 вдоль b-оси.
Фиг.1-С представляет порошковую рентгенограмму (XRPD) моногидрата ER-076349, кристаллизованного из изопропилового спирта.
Фиг.1-D представляет график рентгенограмм XRPD моногидрата ER-076349, кристаллизованного из различных растворителей.
Фиг.1-Е представляет график DSC моногидрата ER-076349, кристаллизованного из этанола.
Фиг.1-F представляет график DSC моногидрата ER-076349, кристаллизованного из изопропанола.
Фиг.1-G представляет график DSC моногидрата ER-076349, кристаллизованного из пропионитрила.
Фиг.2-А представляет изображение ORTEP структуры монокристалла сольвата моноацетонитрила ER-818906.
Фиг.2-В представляет диаграмму кристаллической упаковки сольвата моноацетонитрила ER-818906 вдоль с-оси.
Фиг.2-С представляет рентгенограмму XRPD сольвата моноацетонитрила ER-818906 (эпи-С20 диол).
Фиг.3-А представляет изображение ORTEP структуры монокристалла моногидрата ER-819531 (эпи-С23 диол).
Фиг.3-В представляет диаграмму кристаллической упаковки моногидрата ER-819531 (эпи-С23 диол) вдоль b-оси.
Фиг.3-С представляет рентгенограмму XRPD ER-819531 (эпи-С23 диол).
Фиг.4-А представляет рентгенограмму XRPD ER-820057 (эпи-С23 амин).
Фиг.5-А представляет изображение ORTEP структуры монокристалла моногидрата ER-111197 (эпи-С34 диол).
Фиг.5-В представляет диаграмму кристаллической упаковки моногидрата ER-111197 (эпи-С34 диол) вдоль а-оси.
Фиг.6-А представляет изображение ORTEP структуры монокристалла ER-809681 (эпоксид).
Фиг.6-В представляет диаграмму кристаллической упаковки ER-809681 (эпоксид) вдоль b-оси.
Фиг.6-С представляет рентгенограмму XRPD ER-809681 (эпоксид).
Фиг.6-D представляет рассчитанную рентгенограмму XRPD ER-809681 (эпоксид).
Подробное описание изобретения
Как описано в патенте США 6214865, аналог галихондрина В, ER-086526 (идентифицированный как соединение В-1939), является сильным противоопухолевым агентом. ER-086526 получают из промежуточного соединения диола, ER-076349 (идентифицированного как соединение В-1793). Патент США 6214865 описывает получение ER-076349 (В-1793), а также его применение при получении некоторых других аналогов галихондрина В.
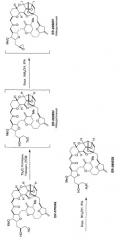
Альтернативный путь синтеза ER-086526 через ER-076349 описан в опубликованной заявке РСТ WO 2005/118565. Согласно WO 2005/118565 ER-076349 превращают в ER-086526 следующим образом:
В способе по WO 2005/118565 ER-076349 подвергают реакции in situ до образования тозилата, ER-082892, который затем превращается in situ в эпоксид, ER-809681, перед образованием ER-086526, как показано на следующей схеме:
ER-076349 кристаллизуется из различных растворителей как моногидрат. Эпоксид, ER-809681, также может быть выделен как кристаллическое соединение. Кристаллический моногидрат ER-076349 (пример 1) и кристаллический ER-809681 (пример 6) представляют отдельные варианты осуществления данного изобретения.
В многостадийных синтезах, таких как описанные в патенте США 6214865 и WO 2005/118565, получают промежуточные продукты, и нежелательные побочные продукты или примеси могут быть перенесены далее по процессу с более ранних стадий. Часто стадии фильтрования, разделения и/или очистки вводят, чтобы удалить нежелательные побочные продукты или примеси. Включение таких стадий может не только увеличить затраты, но и снизить общий выход синтеза. Наличие кристаллического промежуточного соединения в многостадийном синтезе может быть направлено на решение указанных проблем. Кристаллическое промежуточное соединение предоставляет конкретные преимущества - промежуточное соединение высокой чистоты может снижать потребность в других стадиях очистки и снижать стоимость процесса синтеза. При получении ER-086526 наличие кристаллического моногидрата ER-076349 как промежуточного соединения высокой чистоты дает возможность отделить его эпимер С25. В основной массе кристаллического ER-076349 количество эпимера С25 обычно ниже 0,1% мас.
Данное изобретение относится также к кристаллическим формам некоторых диастереомеров ER-076349. Один или несколько диастереомеров являются распространенными примесями, встречающимися в многостадийном синтезе соединений, имеющих несколько хиральных атомов углерода. Полезно характеризовать различные диастереомеры, чтобы идентифицировать эпимерные примеси, которые появляются или могут появляться при получении желательного соединения. Идентификация эпимерной примеси может привести к усовершенствованиям процесса, чтобы уменьшить, исключить, определить или удалить примесь. Кристаллические формы различных эпимеров дают возможность специфической характеристики конкретного эпимера и его идентификации в синтезе. К тому же, кристаллизация конкретного эпимера может быть средством удаления его и тем самым очистки желательного соединения. Кристаллические формы эпимеров ER-076349 направлены на эти потребности в синтезе ER-086526. Кристаллические формы следующих соединений, родственных ER-076349, представляют дополнительные варианты осуществления данного изобретения: ER-809681, ER-820057, ER-818906, ER-819531 и ER-111197, все они проявляют противораковую активность. Эта группа соединений и кристаллических форм этих соединений вместе упоминаются как аналоги галихондрина В и индивидуально каждое из них рассматривается как аналог галихондрина В для целей данного раскрытия.
Существуют многочисленные типы подходов к лечению рака, которые могут быть использованы в сочетании с лечением аналогом галихондрина В по изобретению. Они включают, например, лечение химиотерапевтическими агентами (см. ниже), биологическими агентами (например, гормональными агентами, цитокинами (например, интерлейкинами, интерферонами, гранулоцитарным колониестимулирующим фактором (G-CSF), макрофаговым колониестимулирующим фактором (M-CSF) и гранулоцитарно-макрофаговым колониестимулирующим фактором (GM-CSF)), хемокинами, вакцинными антигенами и антителами), анти-ангиогенными агентами (например, ангиостатином и эндостатином), облучением и хирургическим путем.
Способы по изобретению могут использовать указанные подходы для лечения таких же типов рака, как те, для которых они известны как применяемые в медицине, а также других, которые могут быть определены специалистами в этой области. Кроме того, указанные подходы могут быть осуществлены в соответствии с параметрами (например, режимами и дозами), которые подобны тем, которые известны в медицине для их применения. Однако, как это понятно в данной области, может быть желательным приспосабливать некоторые из этих параметров из-за дополнительного применения аналога галихондрина В с указанными подходами. Например, если лекарство обычно вводят как единственный терапевтический агент, то при объединении с аналогом галихондрина В по изобретению может быть желательным снизить дозу лекарства, как это может быть установлено специалистами в этой области. Примеры способов по изобретению, а также композиций, которые могут быть использованы в этих способах, приведены ниже.
Химиотерапевтические лекарства нескольких различных типов, включая, например, антиметаболиты, антибиотики, алкилирующие агенты, растительные алкалоиды, гормональные агенты, антикоагулянты, тромболитические средства и другие натуральные продукты, наряду с прочим, могут быть использованы в сочетании с лечением галихондрином В по изобретению. Конкретные неограничительные примеры указанных классов лекарств, а также типов рака, которые можно лечить с их применением, являются следующими.
Антиметаболитные лекарства, с которыми могут быть использованы аналоги галихондрина В, включают, например, метотрексат, антагонисты пурина (например, меркаптопурин, тиогуанин, флударабин фосфат, кладрибин и пентостатин) и антагонисты пиримидина (например, гемцитабин, карецитабин, фторурацил (например, 5-FU), цитарабин и азацитидин). Применение указанных агентов для лечения конкретных типов рака хорошо известно в этой области и указанные агенты могут быть использованы в сочетании с аналогами галихондрина В для лечения этих и других типов рака. В качестве конкретных неограничительных примеров, аналог галихондрина В может быть использован с гемцитабином при лечении немелкоклеточной карциномы легких, рака поджелудочной железы или метастатического рака молочной железы. В дополнительном примере аналог галихондрина В может быть использован в сочетании с капецитабином для лечения рака молочной железы и колоректального рака.
Как отмечено выше, другой класс химиотерапевтических лекарств, с которыми могут быть использованы аналоги галихондрина В, включает противораковые антибиотики. К ним относятся, например, антрациклины (например, доксорубицин, эпирубицин, даунорубицин и идарубицин), адриамицин, дактиномицин, идарубинцин, пликамицин, митомицин и блеомицин. Как и с лекарствами, упомянутыми выше, применение указанных агентов для лечения конкретных типов рака хорошо известно в медицине и они могут быть использованы в сочетании с применением аналога галихондрина В для лечения указанных и других типов рака. В качестве конкретного неограничительного примера, антрациклин, такой как доксорубицин, может быть введен в сочетании с терапией галихондрином В для лечения рака молочной железы и поджелудочной железы. В качестве варианта, третий агент, циклофосфамид, может быть использован в этом способе.
Алкилирующие агенты образуют другой класс химиотерапевтических лекарств, которые могут быть введены в сочетании с аналогом галихондрина В по изобретению. Примеры таких лекарств включают прокарбазин, дакарбазин, алтретамин, цисплатин, карбоплатин и нитрозомочевины. Аналоги галихондрина В могут быть использованы с указанными агентами при лечении типов рака, для которых известно применение указанных агентов на практике, а также для лечения других типов рака. Например, аналог галихондрина В может быть использован в сочетании с карбоплатином при лечении немелкоклеточной карциномы легких или рака яичников.
Дополнительным типом химиотерапевтического лекарства, с которым аналоги галихондрина В могут быть введены по изобретению, являются растительные алкалоиды, такие как винбластин, винкристин, этопозид, тенипозид, топотекан, иринотекан, паклитаксел и доцетаксел. В качестве конкретных неограничительных примеров, аналог галихондрина В может быть использован в сочетании с иринотеканом для лечения колоректального рака или с топотеканом для лечения рака яичников или немелкоклеточного рака легких.
Дополнительными типами противораковых агентов, которые могут быть использованы в сочетании с лечением аналогом галихондрина В по изобретению, являются антикоагулянты и тромболитические агенты. Например, может быть использован гепарин (например, низкомолекулярный гепарин или гепарин сульфат) или варфарин. Применение указанных агентов при лечении пациентов путем, например, инъекции или перорального введения, хорошо известно на практике и поэтому они легко могут быть приспособлены специалистами в этой области для применения по данному изобретению.
В медицине известны различные пути введения противораковых лекарств, и они легко могут быть приспособлены для применения по изобретению. В случае одного или нескольких лекарств, которые должны быть введены в сочетании с аналогом галихондрина В, например, лекарства могут быть введены вместе в единой композиции или раздельно как часть всестороннего режима лечения. Для системного введения лекарства могут быть введены, например, внутривенным вливанием (непрерывным или болюсом). Соответствующее расписание и дозирование такого введения легко может быть определено специалистами в этой области на основе, например, предклинических исследований на животных и клинических исследований (например, исследований фазы I) на людях. Кроме того, могут быть использованы анализ лечения с применением подобных лекарств, а также контрольные факторы, такие как формула крови (например, подсчет нейтрофилов и тромбоцитов) и основные показатели состояния пациентов, как это хорошо понятно для специалистов.
Многие режимы, используемые для введения химиотерапевтических лекарств, предусматривают, например, внутривенное введение лекарства (лекарств) с последующим повторением этого лечения после периода времени (например, 1-4 недель), во время которого пациент оправляется от каких-либо вредных побочных эффектов лечения. Может быть желательным применять оба лекарства при каждом введении или, в качестве варианта, или так, чтобы некоторые (или все) лечебные мероприятия включали только одно лекарство (или подмножество лекарств).
В качестве конкретного неограничительного примера режима лечения, включенного в изобретение, аналог галихондрина В (например, 0,01-5 мг/м2) может быть введен пациенту внутривенным вливанием в течение 0,5-3 часов с последующим внутривенным вливанием другого лекарства (например, гемцитабина, например, 500-900 мг/м2) в течение 0,5-3 часов. Указанный курс лечения может быть повторен каждые 2-3 недели, как определено специалистами по его толерантности и эффективности. В варианте указанного способа лечение проводят обоими лекарствами в первый день, как указано выше, но затем сопровождают лечением с использованием только вторичного лекарства (например, гемцитабина) в течение обеспечивающих недель.
Далее, как хорошо известно на практике, лечение с применением способов по изобретению может быть проведено в сочетании с введением противорвотных средств, которые являются лекарствами, которые используют, чтобы уменьшить тошноту и рвоту, которые являются распространенными побочными эффектами химиотерапии рака. Примеры таких лекарств включают главные транквилизаторы (например, фенотиазины, такие как хлорпромазин и прохлорперазин), антагонисты допамина (например, метоклопрамид), антагонисты серотонина (например, ондансетрон и гранисетрон), каннабиноиды (например, дронабинол) и бензодиазепиновые седативные средства.
В дополнение к указанным выше типам рака способы и композиции по изобретению могут быть использованы для лечения следующих типов рака также, как и других: рак кожи (например, плоскоклеточная карцинома, базально-клеточная карцинома или меланома), простаты, головного мозга и нервной системы, головы и шеи, яичек, легких, печени (например, гепатома), почек, мочевого пузыря, желудочно-кишечного рака, рака костей, рака эндокринной системы (например, опухоли щитовидной железы и гипофиза) и рака лимфотической системы (например, лимфома Ходжкина и неходжкинская лимфома). Другие типы рака, которые можно лечить с применением способов по изобретению, включают фибросаркому, нейрэктодермальную опухоль, мезотелиому, эпидермоидную карциному и саркому Капоши.
Данное изобретение относится также к композициям, которые включают аналог галихондрина В в комбинации с дополнительным терапевтическим агентом (агентами), таким как какой-либо из указанных выше агентов. Лекарства в таких композициях предпочтительно приготовлены для введения пациентам (например,в физиологическом растворе) или, в качестве варианта, могут быть в форме, требующей дополнительной переработки перед введением. Например, композиция может содержать лекарства в лиофилизованной форме или в концентрированной форме, требующей разбавления. Составление лекарств для применения в химиотерапевтических способах может быть осуществлено с использованием стандартных методик (см., например, Remington's Pharmaceutical Sciences (18th edition). ed. A. Gennaro, 1990, Mack Publishing Co., Easton, Pa.).
ПРИМЕРЫ
Сбор данных рентгенографии и определения структуры монокристалла
Данные собирали с помощью дифрактометра на основе Bruker SMART APEX CCD (зарядное сдвоенное устройство), снабженного низкотемпературным аппаратом Oxford Cryostream, работающим при 193 К. Данные измеряли, используя омега-сканирования 0,3° на фрейм в течение 30 секунд, так что собирали полусферу. Всего было собрано 1271 фрейм с максимальным разрешением 0,76 Å. Первые 50 фреймов повторно собирали в конце сбора данных, чтобы отследить угасание. Параметры ячейки возвращали в исходное состояние, используя программное обеспечение SMART (SMART V 5.625 (NT) Software for the CCD Detector System; Bruker Analytical X-ray Systems, Madison, WI (2001)), и данные уточняли с помощью SAINT на всех наблюдаемых отображениях. Обработку данных проводили, используя программное обеспечение SAINT (SAINT V 6.22 (NT) Software for the CCD Detector System Bruker Analytical X-ray Systems, Madison, WI (2001), которое корректировало Lp и угасание. Структуры выясняли непосредственным методом с использованием программы SHELXS-97 (Sheldrick, G. M. SHELXS-90, Program for the Solution of Crystal Struture, University of Göttingen, Germany, 1990) и уточняли методом наименьших квадратов по F2, SHELXS-97 (Sheldrick, G. M. SHELXL-97, Program for the Refinement of Crystal Struture, University of Göttingen, Germany, 1997), включенным в SHELXTL-РС V 6.10 (SHELXTL 6.1 (PC-Version), Program library for Structure Solution and Molecular Graphics; Bruker Analytical X-ray Systems, Madison, WI (2000).
Процедура сбора данных порошковой рентгенографии (XRPD)
Небольшое количество кристаллического материала использовали для исследований дифракции XRPD, описанных ниже. Материал не дробили и поэтому могли иметь эффекты предпочтительной ориентации. Использовали кварцевую пластину на дифрактометре Scintag. Данные получали при нормальном условии порошковой дифракции с диапазоном 2 тэта 5-70 градусов с использованием излучения меди. Никакой поправки фона не применяли. В таблице 1 перечислены параметры приобретения данных.
| Таблица 1 | |
| Условия измерения XRPD | |
| Рентгеновский дифрактометр: | Scintag |
| Мишень: | Cu |
| Детектор: | литиевый смещенный диод |
| Напряжение на трубке: | 40 кВ |
| Ток трубки: | 30 мА |
| Щель: | DS 1,0, RS 0,3 мм, SS 2 мм трубка, 0,5 мм детектор |
| Скорость сканирования: | 1°/мин |
| Шаг/образец: | 0,02° |
| Диапазон сканирования: | 5-70° |
| Держатель образца: | кварцевый держатель (25×25 мм) |
| Гониометр: | Theta-Theta, фиксированная горизонтальная основа, гониометр |
| Фильтр: | электронный |
| Монохроматор: | не использовали |
Пример 1
Характеристика кристаллического моногидрата ER-076349
Рентгенограммы XRPD этанола, изопропанола (IPA), пропионитрила идентичны образцу ацетонитрил/вода. Характеристика в качестве моногидрата основана на этом сравнении. Рентгеновская единичная ячейка кристалла ацетонитрил/вода ясно показала наличие единственной молекулы воды.
А. Процедуры кристаллизации моногидрата ER-076349
Кристаллизация ER-076349 из этанола, изопропанола и пропионитрила (образец XRPD): ER-076349 растворяли в растворителе (5 об.). Раствору давали возможность испаряться при комнатной температуре, и кристалл, подходящий для тестирования XRPD, образовывался в течение 16-24 ч.
Кристаллизация ER-076349 из раствора ацетонитрил/вода (образец XRPD): ER-076349 растворяли в ацетонитриле (1 об.). К этому раствору медленно добавляли раствор ацетонитрил/вода (10 об., 2 части воды, 1 часть ацетонитрила); если раствор становился мутным, можно было добавить минимальное количество ацетонитрила. В раствор вносили затравку ER-076349 (0,004 вес.). Смесь перемешивали при комнатной температуре и растворитель выпаривали с потоком инертного газа, пока содержание цетонитрила не достигало ≤5%. Твердые вещества суспендировали в воде (5 об.) и смесь фильтровали. Отфильтрованные твердые вещества сушили в высоком вакууме и потоке инертного газа в течение 12-24 часов.
Кристаллизация ER-076349 из раствора ацетонитрил/вода (монокристалл): ER-076349 растворяли в ацетонитриле (5 об.). Затем добавляли воду (0,5 об.). Контейнер хранили при комнатной температуре и вентилировали для медленного испарения растворителя в течение 4 недель, и монокристалл, подходящий для ренгеновского исследования структуры, образовывался медленно.
В. Рентгеновское определение монокристалла моногидрата ER-076349
Бесцветный плоский кристалл с размерами 0,10×0,10×0,04 мм размещали на нейлоновой петле 0,2 нм, используя очень небольшое количество масла сходного оттенка. Структуру монокристалла, показанную на фиг.1-А, определяли, используя процедуру, описанную выше. В таблице 2 приведены данные кристалла и параметры уточнения структуры, использованные для определения структуры монокристалла моногидрата ER-076349. Структуру выясняли в пространственной группе Р212121 (# 19) путем анализа систематических неупорядоченностей. Все неводородные атомы уточняли анизотропно. Атомы водорода рассчитывали геометрическими методами и уточняли как модель перекрывания. Кристалл, используемый для исследования методом дифракции, не обнаружил никакого разложения во время сбора данных. Все рисунки были сделаны при 50% эллипсоидах. Фиг.1-В представляет диаграмму кристаллической упаковки моногидрата ER-076349 вдоль b-оси, которая показывает наилучшую диаграмму водородного связывания внутри кристалла, пунктирные линии.
| Таблица 2 | |
| Данные кристалла и уточнение структуры для моногидрата ER-076349 | |
| Эмпирическая формула | С40Н59О13 |
| Масса по формуле | 747,87 |
| Температура | 193(2)К |
| Длина волны | 0,71073 Å |
| Кристаллическая система | Орторомбическая |
| Пространственная группа | Р2(1)2(1)2(1) |
| Размеры единичной ячейки | а=9,9189(14)Å α=90° b=11,3394(17)Å β=90°с=34,029(5)Å γ=90° |
| Объем | 3827,3(10) Å3 |
| Z | 4 |
| Плотность (рассчитанная) | 1,298 Мг/м3 |
| Коэффициент поглощения | 0,096 мм-1 |
| F(000) | 1612 |
| Размер кристалла | 0,10×0,10×0,04 мм3 |
| Диапазон тэта для сбора данных | 1,20-26,39° |
| Пределы индексов | -10<=h<=12, -13<=k<=14, -32<=I<=42 |
| Собранные отображения | 23198 |
| Независимые отображения | 7808[R(int)=0,1131] |
| Полнота до тэта = 26,39° | 99,9% |
| Поправка поглощения | нет |
| Метод уточнения | Полноматричные наименьшие квадраты по F2 |
| Данные/ограничения/параметры | 7808/0/482 |
| Критерий согласия по F2 | 0,938 |
| Конечные R индексы [I>2сигма(I)] | R1=0,0627, wR2=0,0911 |
| R индексы (все данные) | R1=0,1693, wR2=0,1150 |
| Абсолютный структурный параметр | -0,7(12) |
| Максимальные дифф. вершина и дырка | 0,380 и -0,182 э.Å-3 |
С. Характеристика порошковой рентгенографией (XRPD) моногидрата ER-076349
Фиг.1-С представляет рентгенограмму XRPD моногидрата ER-076349, кристаллизованного из изопропилового спирта, как описано выше. В таблице 3 показаны пики с относительными интенсивностями на рентгенограмме XRPD.
| Таблица 3 | |
| Пики XRPD моногидрата ER-076349 | |
| Положение (2θ) | Отн. инт.(%) |
| 18,2 | 100,0% |
| 20,8 | 91,0% |
| 18,7 | 60,3% |
| 20,3 | 59,6% |
| 10,4 | 59,3% |
| 22,2 | 51,2% |
| 15,9 | 42,5% |
| 13,0 | 37,4% |
| 9,3 | 37,1% |
| 14,2 | 35,5% |
| 12,1 | 29,3% |
| 11,9 | 28,3% |
| 5,2 | 22,9% |
Фиг.1-D представляет многоярусный график характерных рентгенограмм XRPD моногодрата ER-076349, полученного перекристаллизацией из различных растворителей, включая ацетонитрил и воду, этанол, изопропанол и пропионитрил. Для получения рентгенограмм использовали тот же способ, который описан выше.
Фиг.1-Е, 1-F и 1-G отображают термограммы дифференциальной сканирующей калориметрии (DSC) моногодрата ER-076349. Фиг.1-Е отображает график DSC ER-076349, кристаллизованного из раствора в этаноле. DSC показывает эндотермический пик при 160°С. Фиг.1-F отображает график DSC ER-076349, кристаллизованного из раствора в изопропаноле. DSC показывает эндотермический пик при 157°С. Фиг.1-G отображает график DSC ER-076349, кристаллизованного из раствора в пропионитриле. DSC показывает эндотермический пик при 161°С.
Пример 2
Характеристика ER-818906 (эпи-С20 диола), моно-ацетонитрил сольвата
А. Процедура кристаллизации для создания кристаллических образцов для рентгеновского исследования и XRPD
ER-818906 (1 вес.) суспендировали в ацетонитриле (10 об.) и осторожно нагревали для гарантии полного растворения. Раствор выдерживали при комнатной температуре, и рост кристалла начинался через 30 минут. Образец монокристалла, пригодный для рентгеноструктурного анализа, образовывался через 16-24 часа. Химическая структура ER-818906 (эпи-С20 диола) показана ниже.
В. Рентгеновское определение монокристалла моно-ацетонитрил сольвата ER-818906 (эпи-С20 диола)
Бесцветный блок-кристалл с размерами 0,12 × 0,12 × 0,10 мм размещали на нейлоновой петле 0,2 нм, используя очень небольшое количество масла сходного оттенка. Структуру монокристалла, показанную на фиг.2-А, определяли, используя процедуру, описанную выше. В таблице 3 приведены данные кристалла и параметры уточнения структуры, использованные для определения структуры монокристалла моно-ацетонитрил сольвата ER-818906. Структуру выясняли в пространственной группе Р21 (# 4). Все неводородные атомы уточняли анизотропно. Атомы водорода рассчитывали геометрическими методами и уточняли как модель перекрывания. Flack параметр использовали для анализа кристалла. Если величина Flack параметра близка к нолю, абсолютная структура, заданная уточнением структурного элемента, является вероятно корректной; если величина близка к 1,0, тогда инвертированная структура (другой энантиомер) является вероятно корректной; если величина близка к 0,5, кристалл является вероятно рацемическим. См. Flack, H.D., Acta Cryst. A39, 1983, 876-881. Flack параметр был уточнен до 0,3(4). Хиральность указанного соединения подтверждали его синтетическим происхождением. Кристалл, используемый для исследования методом дифракции, не обнаружил никакого разложения во время сбора данных. Все рисунки сделаны при 50% эллипсоидах. Фиг.2-В представляет диаграмму кристаллической упаковки моно-ацетонитрил сольвата ER-818906 вдоль с-оси.
| Таблица 3 | |
| Данные кристалла и уточнение структуры для моно-ацетонитрил сольвата ER-818906 | |
| Эмпирическая формула | C42H61NO12 |
| Масса по формуле | 771,92 |
| Температура | 193(2)К |
| Длина волны | 0,71073 Å |
| Кристаллическая система | моноклинная |
| Пространственная группа | Р2(1) |
| Размеры единичной ячейки | а=10,610(4)Å α=90° b=17,114(7)Å β=94,341(7)°с=11,251(5)Å γ=90° |
| Объем | 2036,9(15) Å3 |
| Z | 2 |
| Плотность (рассчитанная) | 1,259 Мг/м3 |
| Коэффициент поглощения | 0,091 мм-1 |
| F(000) | 832 |
| Размер кристалла | 0,12×0,12×0,10 мм3 |
| Диапазон тэта для сбора данных | 1,82 - 27,87° |
| Пределы индексов | -13<=h<=12, -22<=k<=22, -14<=I<=14 |
| Собранные отображения | 14960 |
| Независимые отображения | 9147[R(int)=0,0160] |
| Полнота до тэта = 27,87° | 98,6% |
| Поправка поглощения | эмпирическая |
| Макс. и мин. трансмиссия | 0,9909 и 0,9891 |
| Метод уточнения | Полноматричные наименьшие квадраты по F2 |
| Данные/ограничения/параметры | 9147/1/501 |
| Критерий согласия по F2 | 1,044 |
| Конечные R индексы [I>2сигма(I)] | R1=0,0410, wR2=0,0881 |
| R индексы (все данные) | R1=0,0473, wR2=0,0909 |
| Абсолютный структурный параметр | 0,3(6) |
| Максимальные дифф. вершина и дырка | 0,222 и -0,199 э.Å-3 |
С. Характеристика порошковой рентгенографией (XRPD) моно-ацетонитрил сольвата ER-818906 (эпи-С20 диола)
Небольшое количество материала оставляли после удаления образца для исследования монокристалла в примере 2А. Рентгенограмму XRPD получали, как описано выше. Рентгенограмма XRPD показана на фиг.2-С. В таблице 4 показаны пики с относительными интенсивностями на рентгенограмме XRPD.
| Таблица 4 | |
| Пики XRPD ER-818906 (эпи-С20 диол) | |
| Положение (2θ) | Отн. инт.(%) |
| 23,7 | 100,0 |
| 32,8 | 35,6 |
| 7,9 | 25,0 |
| 40,0 | 19,4 |
| 68,4 | 14,5 |
| 23,9 | 12,2 |
| 29,2 | 10,4 |
| 26,7 | 7,7 |
| 8,1 | 7,3 |
| 48,6 | 7.2 |
| 57,5 | 6,4 |
| 48,9 | 5,9 |
| 40,7 | 5,7 |
| 34,1 | 4,0 |
Пример 3
Характеристика моногидрата ER-819531 (эпи-С23 диола)
А. Процедура кристаллизации для качественного образца для XRPD
ER-819531 (1 вес.) растворяли в ацетонитриле (10 об.) при комнатной температуре и температуру снижали до -20°С и выдерживали при этой температуре в течение 16 часов. Кластеры кристалла, пригодные для порошкового анализа XPRD, образовывались через 16 часов. Химическая структура ER-819531 (эпи-С23 диола) показана ниже.
В. Рентгеновское определение монокристалла моногидрата ER-819531 (эпи-С23 диола)
Часть образца ER-819531 растворяли в смеси ацетонитрила, нескольких капель толуола и одной капли воды. Этому затем давали возможность медленно испаряться в небольшом сосуде. Это имело результатом монокристаллы, один из которых выбирали для использования в этом исследовании. Бесцветный блок-кристалл с размерами 0,12×0,12×0,04 мм размещали на нейлоновой петле 0,2 нм, используя очень небольшое количество масла сходного оттенка. Структуру монокристалла, показанную на фиг.3-А, определяли, используя процедуру, описанную выше. В таблице 5 приведены данные кристалла и параметры уточнения структуры, использованные для определения структуры моногидрата ER-819531. Структуру выясняли в пространственной группе Р212121 (# 19) путем анализа систематических неупорядоченностей. Все неводородные атомы уточняли анизотропно. Атомы водорода рассчитывали геометрическими методами и уточняли как модель перекрывания. Flack параметр использовали для анализа кристалла. Если величина Flack параметра близка к нолю, абсолютная структура, заданная уточнением структурного элемента, является вероятно корректной; если величина близка к 1,0, тогда инвертированная структура (другой энантиомер) является вероятно корректной; если величина близка к 0,5, кристалл является вероятно рацемическим. См. Flack, H.D., Acta Cryst. A39, 1983, 876-881. Flack параметр был уточнен до 0,50(16). Хиральность указанного соединения подтверждали его синтетическим происхождением. Кристалл, используемый для исследования методом дифракции, не обнаружил никакого разложения во время сбора данных. Все рисунки сделаны при 50% эллипсоидах. Фиг.3-В представляет диаграмму кристаллической упаковки вдоль b-оси, которая показывает водородную связь внутри кристалла, пунктирные линии.
| Таблица 5 | |
| Данные кристалла и уточнение структуры для моно-гидрата ER-819531 | |
| Эмпирическая формула | C40H60O13 |
| Масса по формуле | 748,88 |
| Температура | 193(2)К |
| Длина волны | 0,71073 Å |
| Кристаллическая система | Орторомбическая |
| Пространственная группа | Р2(1)2(1)2(1) |
| Размеры единичной ячейки | а=9,6545(16)Å α=90° b=11,6562(19)Å β=90°с=33,618(6)Å γ=90° |
| Объем | 3783,1(11) Å3 |
| Z | 4 |
| Плотность (рассчитанная) | 1,315 Мг/м3 |
| Коэффициент поглощения | 0,097 мм-1 |
| F(000) | 1616 |
| Размер кристалла | 0,12×0,12×0,04 мм3 |
| Диапазон тэта для сбора данных | 1,85-23,25° |
| Пределы индексов | -10<=h<=10, -12<=k<=12, -37<=I<=25 |
| Собранные отображения | 18298 |
| Независимые отображения | 5420[R(int)=0,0866] |
| Полнота до тэта = 27,87° | 100,0% |
| Поправка поглощения | Нет |
| Метод уточнения | Полноматричные наименьшие квадраты по F2 |
| Данные/ограничения/параметры | 5420/0/482 |
| Критерий согласия по F2 | 1,025 |
| Конечные R индексы [I>2сигма(I)] | R1=0,0670, wR2=0,1275 |
| R индексы (все данные) | R1=0,1032, wR2=0,1421 |
| Абсолютный структурный параметр | 0,5(16) |
| Максимальные дифф. вершина и дырка | 0,503 и -0,261 э.Å-3 |
С. Характеристика порошковой рентгенографией (XRPD) моногидрата ER-819531 (эпи-С23 диола)
Моногидрат ER-819531 получали, как описано выше. Рентгенограмма XRPD показана на фиг.3-С. В таблице 6 показаны пики с относительными интенсивностями на рентгенограмме XRPD.
| Таблица 6 | |
| Пики XRPD ER-819531 (эпи-С23 диол) | |
| Положение (2θ) | Отн. инт.(%) |
| 20,6 | 100,0% |
| 17,2 | 91,9% |
| 16,1 | 83,1% |
| 24,4 | 77,9% |
| 17,8 | 77,8% |
| 22,1 | 76,4% |
| 20,0 | 73,2% |
| 15,2 | 71,9% |
| 19,1 | 71,5% |
| 32,1 | 70,8% |
| 17,3 | 69,4% |
| 18,6 | 69,4% |
| 21,4 | 68,6% |
| 28,2 | 67,5% |
| 26,2 | 67,3% |
| 22,7 | 62,6% |
| 29,2 | 61,8% |
| 13,1 | 55,8% |
| 10,5 | 50,2% |
| 12,3 | 41,6% |
| 14,4 | 40,7% |
| 9,6 | 27,8% |
| 8,1 | 25,5% |
Пример 4
Характеристика ER-820057 (эпи-С23 амина)
А. Получение кристаллического образца ER-820057
ER-820057 растворяли в ацетонитриле (10 об.) при комнатной температуре и раствор выдерживали при комнатной температуре. Рост кристалла наблюдается спустя 2 часа. Кристаллический образец, подходящий для порошкового анализа XPRD, выделяли через 16-24 часа. Химическая структура ER-820057 (эпи-С23 амина) показана ниже.
В. Характеристика порошковой рентгенографией (XRPD) ER-820057 (эпи-С23 амина)
XRPD ER-820057 осуществляли, как описано выше. Рентгенограмма XRPD показана на фиг.4-А. В таблице 7 показаны пики с относительными интенсивностями на рентгенограмме XRPD.
| Таблица 7 | |
| Пики XRPD ER-820057 (эпи-С23 амин) | |
| Положение (2θ) | Отн. инт.(%) |
| 20,6 | 108,9% |
| 15,9 | 100,0% |
| 17,0 | 96,4% |
| 18,5 | 93,9% |
| 21,4 | 87,3% |
| 20,0 | 85,8% |
| 19,1 | 84,6% |
| 24,4 | 84,3% |
| 17,8 | 80,6% |
| 21,9 | 74,8% |
| 13,0 | 73,1% |
| 15,0 | 66,1% |
| 22,6 | 65,4% |
| 24,0 | 63,3% |
| 26,2 | 62,0% |