Твердофазный иммуноферментный анализ (elisa) для фактора роста эндотелия сосудов (vegf)
Иллюстрации
Показать всеИзобретение относится к области иммунологии, а именно к иммуноферментному анализу, конкретнее к способу детекции форм фактора роста эндотелия сосудов (VEGF) c размером более чем 110 аминокислот в биологическом образце. Способ включает следующие стадии: контактирования и инкубации биологического образца с реагентом захвата, иммобилизованным на твердой подложке, где реагент захвата содержит моноклональное антитело, которое распознает и специфично связывается с остатками, в количестве более чем 110, из VEGF человека; отделение биологического образца от иммобилизованных реагентов захвата; контактирование иммобилизованного молекулярного комплекса реагента захвата-мишени с детектируемым антителом, которое связывается с доменами VEGF, ответственными за связывание с рецептором KDR и/или FLT1, или которое связывается с эпитопом в VEGF1-110; измерение уровня VEGF110+, связанного с реагентами захвата, с использованием средства детекции для детектируемого антитела. Набор реагентов иммуноанализа для детекции форм VEGF110+ в биологическом образце. Антитело 5С3, получаемое из гибридомы 5С3.1.1 с депозитарным номером PTA-7737, при этом указанное антитело 5С3 связывает формы VEGF110+, включая VEGF121+. Гибридома 5С3.1.1, депонированная в АТСС с депозитным номером PTA-7737, для получения моноклонального антитела 5С3. Использование заявленного изобретения позволяет повысить точность детектирования изоформ VEGF, которые не должны включать изоформу VEGF110 и при этом должны обязательно включать изоформу VEGF121. 4 н. и 21 з.п. ф-лы, 3 ил., 2 табл., 1 пр.
Реферат
РОДСТВЕННАЯ ЗАЯВКА
По настоящей заявке испрашивается приоритет и преимущество Предварительной Заявки США №60/828203, поданной 4 октября 2006 г., описание которой включено в настоящее описание полностью.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к иммуноанализам для детекции определенных популяций VEGF, которые могут применяться в качестве диагностических и прогностических способов для пациентов с раковыми, сердечно-сосудистыми или другими патологиями.
УРОВЕНЬ ТЕХНИКИ
К настоящему моменту четко установлено, что ангиогенез вовлечен в патогенез разнообразных нарушений. Эти нарушения включают солидные опухоли, интраокулярные неоваскулярные синдромы, такие как пролиферативные ретинопатии или возрастная дегенерация желтого пятна (AMD), ревматоидный артрит и псориаз (Folkman et al. J. Biol. Chem. 267:10931-10934 (1992); Klagsbrun et al. Annu. Rev. Physiol. 53:217-239 (1991); и Garner A, Vascular diseases. In: Pathobiology of ocular disease. A dynamic approach. Garner A, Klintworth GK, Eds. 2nd Edition (Marcel Dekker, NY, 1994), pp. 1625-1710). В случае солидных опухолей неоваскуляризация предоставляет возможность опухолевым клеткам приобретать преимущество роста и пролиферативную автономию в сравнении с нормальными клетками. Соответственно наблюдалась корреляция между плотностью микрососудов в опухолевых участках и выживаемостью пациентов, страдающих раком груди, а также имеющими некоторые другие виды опухолей (Weidner et al. N Engl J Med 324: 1-6 (1991); Horak et al. Lancet 340: 1120-1124 (1992); и Macchiarini et al. Lancet 340: 145-146 (1992)).
Поиск положительных регуляторов ангиогенеза привел к получению множества кандидатов, включая, например, aFGF, bFGF, TGF-α, TGF-β, HGF, TNF-α, ангиогенин, IL-8, и т.д. (Folkman et al., выше, и Klagsbrun et al., выше). Некоторые отрицательные регуляторы, идентифицированные к настоящему времени, включают тромбоспондин (Good et al. Proc. Natl. Acad. Sci. USA. 87: 6624-6628 (1990)), N-концевой фрагмент пролактина с молекулярной массой 16 килодальтон (Clapp et al. Endocrinology, 133: 1292-1299 (1993)), ангиостатин (O'Reilly et al. Cell 79: 315-328 (1994)), и эндостатин (O'Reilly et al. Cell 88: 277-285 (1996)).
С помощью работы, проделанной в течение последних нескольких лет, установили ключевую роль фактора роста эндотелия сосудов (VEGF) в регуляции нормального и аномального ангиогенеза (Ferrara et al. Endocr. Rev. 18: 4-25 (1997)). Открытие того, что потеря даже одного аллеля VEGF приводит в результате к летальным случаям для эмбрионов, указывает на незаменимую роль, которую играет этот фактор в развитии и дифференцировке сосудистой системы (Ferrara et al., выше).
Кроме того, было показано, что VEGF является ключевым медиатором неоваскуляризации, ассоциированной с опухолями и интраокулярными нарушениями (Ferrara et al., выше). мРНК VEGF сверхэкспрессируется большинством исследованных опухолей человека (Berkman et al. J Clin Invest 91: 153-159 (1993); Brown et al. Human Pathol. 26: 86-91 (1995); Brown et al. Cancer Res. 53: 4727-4735 (1993); Mattern et al. Brit. J. Cancer. 73: 931-934 (1996); и Dvorak et al. Am J. Pathol. 146: 1029-1039 (1995)). Также концентрация VEGF в глазной жидкости в значительной степени коррелирует с наличием активной пролиферации кровеносных сосудов у пациентов с диабетической и другими связанными с ишемией ретинопатиями (Aiello et al. N. Engl. J. Med. 331: 1480-1487 (1994)). Кроме того, исследования продемонстрировали локализацию VEGF в хороидальных неоваскулярных мембранах у пациентов, страдающих острой дегенерацией желтого пятна (AMD) (Lopez et al. Invest. Ophtalmo. Vis. Sci. 37: 855-868 (1996)).
VEGF продуцируется в тканях, и ему нет необходимости попадать в кровоток для проявления его биологического эффекта, но он скорее действует локально в качестве паракринного регулятора. В недавнем исследовании, описанном в публикации Yang et al. J. Pharm. Exp. Ther. 284: 103 (1998), было обнаружено, что выведение rhVEGF165 из кровотока происходит очень быстро, что позволяет предположить, что присутствие эндогенного VEGF в кровотоке, наиболее вероятно, является результатом непрерывного синтеза VEGF. Кроме того, в некоторых исследованиях были сделаны попытки соотнесения уровней циркулирующего VEGF с тяжестью опухоли, и предлагалось использовать уровни VEGF в качестве потенциального прогностического маркера (Ferrari and Scagliotti Eur. J. Cancer 32A: 2368 (1996); Gasparini et al. J. Natl. Cancer Inst. 89: 139 (1997); Kohn Cancer 80: 2219 (1997); Baccala et al. Urology 51: 327 (1998); Fujisaki et al. Am. J. Gastroenterol. 93: 249 (1998)). Очевидно, что способность точного измерения VEGF является важной для понимания его потенциальной роли(ей) во множестве биологических процессов, таких как поддержание проходимости сосудов, менструальный цикл, ишемия, диабет, рак, интраокулярные нарушения и т.д.
В публикациях концентрации эндогенного VEGF широко варьировались у здоровых и больных пациентов, находясь в интервале от недетектируемого до высокого уровня. Способность к измерению уровня эндогенного VEGF зависит от доступности чувствительных и специфичных анализов. Были опубликованы варианты твердофазных иммуноферментных анализов (ELISA) для VEGF на основе колориметрического, хемилюминесцентного и флуоресцентного методов. Houck et al., выше, (1992); Yeo et al. Clin. Chem. 38: 71 (1992); Kondo et al. Biochim. Biophys. Acta 1221: 211 (1994); Baker et al. Obstet. Gynecol. 86: 815 (1995); Hanatani et al. Biosci. Biotechnol. Biochem. 59: 1958 (1995); Leith and Michelson Cell Prolif. 28:415 (1995); Shifren et al. J. Clin. Endocrinol. Metab. 81: 3112 (1996); Takano et al. Cancer Res. 56: 2185 (1996); Toi et al. Cancer 77: 1101 (1996); Brekken et al. Cancer Res. 58: 1952 (1998); Obermair et al. Br. J. Cancer 77: 1870-1874 (1998); Webb et al. Clin. Sci. 94: 395-404 (1998).
Например, в публикации Houck et al., выше (1992) описан колориметрический метод ELISA, который, очевидно, имеет чувствительность порядка нг/мл, которая не является достаточно чувствительной для детекции эндогенных уровней VEGF. В публикации Yeo et al., выше (1992) описан двухсайтный иммунофлуоресцентный анализ с разрешением по времени, однако, в нормальной сыворотке VEGF не детектировался (Yeo et al. Cancer Res. 53: 2912(1993)). В публикации Baker et al., выше (1995), описано, что с использованием модифицированной версии этого иммунофлуоресцентного анализа наблюдали детектируемые уровни VEGF в плазме беременных женщин, с наблюдением более высоких уровней у женщин с преэклампсией. Подобные данные для беременных женщин были описаны в публикации Anthony et al. Ann. Clin. Biochem. 34: 276 (1997) с использованием радиоиммуноанализа. Hanatani et al., выше (1995) разработали хемилюминесцентный метод ELISA, способный измерять уровень циркулирующего VEGF, и в публикации было описано, что уровень VEGF в сыворотке 30 здоровых индивидуумов (мужчин и женщин) составляет от 8-36 пг/мл. В публикации Brekken et al выше (1998) описаны анализы ELISA с использованием антител, предпочтительно связывающихся или с отдельным VEGF, или с комплексом VEGF:F1k-1.
Набор ELISA для детекции VEGF является коммерчески доступным от фирмы R&D Systems (Minneapolis, MN). Набор R&D VEGF ELISA также использовался в сэндвич-анализах, где моноклональное антитело используется для захвата мишени в виде VEGF-антигена, и поликлональное антитело используется для детекции VEGF. Webb et al. выше (1998). См. также, например, Obermair et al. выше (1998).
Keyt et al. J. Biol. Chem. 271: 7788-7795 (1996); Keyt et al. J. Biol. Chem. 271: 5638 (1996); и Shifren et al., выше (1996) также разработали колориметрический метод ELISA на основе сдвоенной пары моноклональных антител. Хотя этот метод ELISA был способен к детекции повышенного уровня VEGF у пациентов со злокачественной опухолью, ему не хватает чувствительности, необходимой для измерения эндогенных уровней VEGF у здоровых индивидуумов. Rodriguez et al. J. Immunol. Methods 219:45 (1998) описали двухсайтный флуоресцентный метод VEGF-ELISA, который дает чувствительность, составляющую 10 пг/мл VEGF в исходной плазме или сыворотке. Однако этот флуоресцентный анализ детектирует полностью интактные образцы 165/165 и 165/110 VEGF (Было описано, что VEGF 165/165 может быть протеолитически расщеплен на три другие формы: гетеродимер 165/110, гомодимер 110/110 и С-концевой фрагмент из 55 аминокислот (Keyt et al. J. Biol. Chem. 271: 7788-7795 (1996); Keck et al. Arch. Biochem. Biophys. 344: 103-113 (1997))).
Таким образом, существует необходимость в разработке диагностического и прогностического анализа, который бы детектировал более высокие измеряемые уровни VEGF в биологическом образце экспериментальной модели животного или у пациента, чем существующие в настоящее время методы ELISA, и/или мог бы измерять различные изоформы VEGF.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Способы ELISA антитело-сэндвич-типа для VEGF в качестве антигена были разработаны для детекции форм VEGF в биологических образцах. Способ VEGF-ELISA, предлагаемый настоящим изобретением, способен к детекции изоформ VEGF и фрагментов VEGF с размером более чем 110 аминокислот ("VEGF110+"). Также предлагаются наборы.
Например, способы детекции селективных форм фактора роста эндотелия сосудов (VEGF) с размером более чем 110 аминокислот (VEGF110+) в биологическом образце включает стадии: (a) контактирования и инкубации биологического образца с реагентом захвата, иммобилизованным на твердой подложке, где реагент захвата представляет собой антитело, которое распознает тот же эпитоп, что и антитело 5C3 против VEGF человека, причем указанное моноклональное антитело специфично связывается с остатками, в количестве более чем 110, из VEGF человека; (b) отделение биологического образца от иммобилизованных реагентов захвата; (c) контактирование иммобилизованного молекулярного комплекса реагента захвата-мишени с детектируемым антителом, которое связывается с доменами VEGF, ответственными за связывание с рецептором KDR и/или FLT1; и (d) измерение уровня VEGF110+, связанного с реагентами захвата, с использованием средств детекции для детектируемого антитела. В определенных воплощениях детектируемое антитело связывается с эпитопом в VEGF 1-110. В определенных воплощениях сравнительный анализ ELISA может быть осуществлен для детекции различных типов VEGF. В определенных воплощениях биологический образец (например, образцы опухоли или лизаты опухоли, плазма, сыворотка или моча и т.д.) отбирают у человека.
В одном воплощении реагент захвата представляет собой моноклональное антитело 5C3. В одном воплощении иммобилизованный реагент захвата наносят в качестве покрытия на микротитрационный планшет. В определенных воплощениях детектируемое антитело представляет собой моноклональное антитело. В одном воплощении детектируемое антитело представляет собой мышиное моноклональное антитело. В одном воплощении иммобилизованное моноклональное антитело представляет собой антитело MAb 5C3, и детектируемое антитело представляет собой антитело MAb A4.6.1. В определенных воплощениях детектируемое антитело является непосредственно детектируемым. В одном воплощении детектируемое антитело амплифицируется с помощью колориметрического реагента. В одном воплощении детектируемое антитело биотинилируется и средством детекции является авидин или стрептавидин-пероксидаза и 3,3',5,5'-тетраметилбензидин.
В определенных воплощениях изобретения человек является пациентом с сосудистым, диабетическим или раковым заболеванием, и стадия измерения (d) дополнительно включает сравнение со стандартной кривой для определения уровня VEGF в сравнении с уровнем у здорового индивидуума.
Также предлагаются наборы. Например, набор для иммуноанализа для детекции форм фактора роста эндотелия сосудов (VEGF), содержащих более чем 110 аминокислот (VEGF110+), в биологическом образце включает: (a) антитело против VEGF человека, в качестве реагента захвата, где моноклональное антитело специфично связывается с остатками, в количестве более чем 110, из VEGF человека; и (b) детектируемое антитело, в качестве реагента детекции, которое связывается с доменами VEGF, ответственными за связывание с рецептором, KDR и/или FLT1. В определенных воплощениях детектируемое антитело связывается с эпитопом в VEGF 1-110. В определенных воплощениях набор дополнительно включает твердую подложку для реагентов захвата. Например, реагенты захвата могут быть иммобилизованы на твердой подложке (например, микротитрационном планшете). В определенных воплощениях набор дополнительно включает средство детекции (например, колориметрическое средство, флуоресцентное средство и т.д.) для детектируемых антител. В определенных воплощениях набор дополнительно включает очищенный VEGF в качестве стандарта антигена. В определенных воплощениях изобретения дополнительный анализ VEGF-ELISA или более может предлагаться для сравнительных исследований, полученных с помощью VEGF110+-ELISA. В одном воплощении набор включает реагент захвата в виде моноклонального антитела, которое представляет собой мышиное моноклональное антитело MAb 5C3, и детектируемое антитело, которое представляет собой антитело MAb A4.6.1.
Еще в одном воплощении в изобретении предлагается антитело 5C3 против VEGF (получаемое из гибридомы, депонированной в ATCC под номером PTA-7737 или продуцируемое указанной гибридомой). В изобретении также предлагается антитело, которое не связывается с VEGF 1-110, и связывается с тем же эпитопом VEGF110+, что и моноклональное антитело, продуцируемое гибридомной клеточной линией PTA-7737. В определенных воплощениях антитело по изобретению конъюгировано с детектируемой меткой. В одном воплощении предлагается гибридома 5C3.1.1, депонированная в ATCC под номером PTA-7737.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
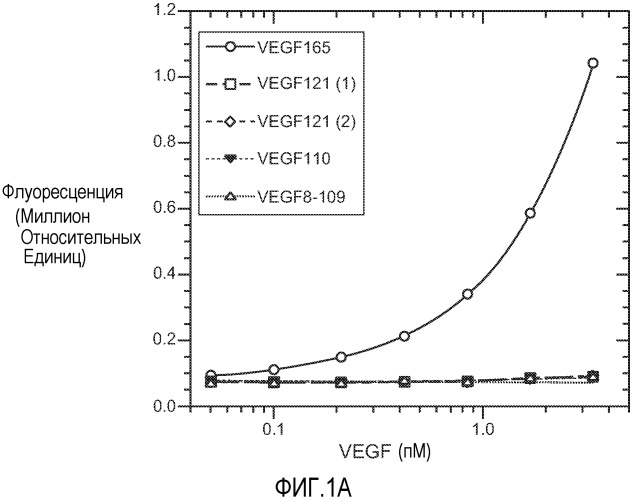
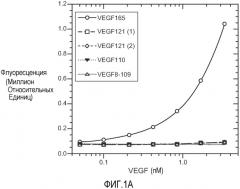
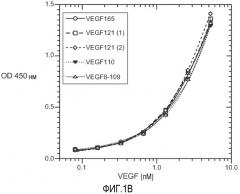
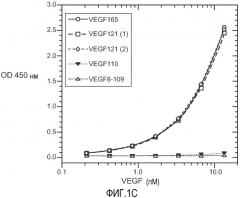
Фиг. 1. Панели A, B и C иллюстрируют детекцию молекул рекомбинантного VEGF 165, VEGF 121 (1) (укороченный, с вероятным отсутствием приблизительно 9 аминокислот на С-конце, согласно производителю R&D systems), VEGF 121 (2) (от Pepro Tech), VEGF 110 (N-концевой фрагмент, полученный расщеплением плазмином VEGF) и VEGF8-109 (синтетический VEGF с аминокислотами 8-109 VEGF 165) с помощью различных анализов VEGF-ELISA. (A). ELISA A с использованием 3.5F8 для нанесения покрытия и биотинилированного A4.6.1 для детекции. (B). ELISA B с использованием A4.6.1 для нанесения покрытия и биотинилированного 2E3 для детекции. (C). ELISA C с использованием 5C3 для нанесения покрытия и биотинилированного A4.6.1 для детекции.
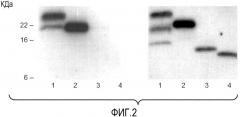
Фиг. 2 иллюстрирует белковый блоттинг VEGF, продуцированного клетками A673, с использованием в качестве зондов 3.5F8 (слева) или A4.6.1 (справа). Образцы представляют собой VEGF, очищенный из кондиционированной среды клеток A673 с использованием A4.6.1-аффинной колонки (дорожка 1), и рекомбинантные VEGF-белки: VEGF165, VEGF121 (с вероятным отсутствием приблизительно 9 аминокислот на С-конце, согласно производителю R&D systems), и VEGF8-109, продуцируемого с помощью E.coli (дорожки 2, 3 и 4, соответственно).
Фиг. 3 иллюстрирует диаграмму VEGF165, VEGF121 и VEGF110 (N-концевой фрагмент, полученный расщеплением плазмином VEGF), показывающую предполагаемые сайты связывания антител, использованных в трех анализах VEGF-ELISA.
ПОДРОБНОЕ ОПИСАНИЕ
Определения
Перед подробным описанием настоящего изобретения следует понимать, что настоящее изобретение не ограничивается конкретными композициями или биологическими системами, которые, без сомнения, могут варьироваться. Также следует понимать, что здесь используется терминология только в целях описания конкретных воплощений, и подразумевается, что она не является ограничением. При использовании в этом описании и приложенной формуле изобретения формы единственного числа включают обозначения множественного числа, если по содержанию ясно не указано иначе. Таким образом, например, обозначение "молекула" необязательно включает комбинацию двух или более молекул и так далее.
При использовании здесь термин "VEGF" обозначает фактор роста эндотелия сосудов из 165 аминокислот и родственные факторы роста эндотелия сосудов из 121, 145, 189 и 206 аминокислот, как описано в публикациях Leung et al. Science 246: 1306 (1989), Houck et al. Mol. Endocrin. 5: 1806 (1991), и Neufeld et al., выше, вместе с природными аллельными и процессированными формами этих факторов роста. См. также, например, Фиг. 1 A и B из Патента США № 6057428. Активный фрагмент VEGF может высвобождаться из ECM-связанного VEGF с помощью расщепления плазмином, с получением первых 110 аминокислот (см., например, Keyt BA, et al.: The carboxyl-terminal domain (111-165) of vascular endothelial growth factor is critical for its mitogenic potency. J Biol Chem. 271: 7788-7795 (1996)). При использовании в настоящем описании термин "VEGF110+" обозначает фрагменты VEGF, которые содержат более чем 110 аминокислот (от N-конца), но не включают первые 110 аминокислот или меньшие фрагменты (например, VEGF8-109).
Термин "детекция" используется в широком смысле, включая оба измерения молекулы-мишени - качественное и количественное. В одном аспекте описанный здесь способ детекции используется для идентификации всего лишь присутствия VEGF110+ или VEGF в биологическом образце. В другом аспекте способ используется для тестирования, присутствует ли VEGF110+ или VEGF в образце на детектируемом уровне. Еще в одном аспекте способ может использоваться для количественной оценки количества VEGF110+ или VEGF в образце, и, кроме того, для сравнения уровней VEGF110+ или VEGF из различных образцов.
Термин "биологический образец" обозначает образец из организма, полученный от любого животного, но, предпочтительно, от млекопитающего, более предпочтительно, от человека. В определенных воплощениях такой биологический образец получают от пациента с сосудистым, диабетическим или раковым заболеванием. Такие образцы включают биологические жидкости, такие как сыворотка, плазма, жидкость стекловидного тела, лимфатическая жидкость, синовиальная жидкость, фолликулярная жидкость, семенная жидкость, амниотическая жидкость, молоко, цельная кровь, моча, спинномозговая жидкость, слюна, мокрота, слезная жидкость, жидкость при потоотделении, слизь, опухолевые лизаты и среда тканевых клеточных культур, а также тканевые экстракты, такие как гомогенизированная ткань, опухолевая ткань и клеточные экстракты. В определенных воплощениях образец представляет собой образец из организма, полученный от любого животного, в одном воплощении - от млекопитающего, еще в одном воплощении - от человека. В одном воплощении такой биологический образец получают от клинических пациентов.
Термин "детектируемое антитело" обозначает антитело, которое может быть детектировано либо непосредственно с помощью метки, амплифицированной с помощью средств детекции, или косвенно - с помощью, например, другого меченого антитела. Для прямого мечения антитело обычно конъюгируется с компонентом, который детектируется с помощью некоторых средств. В одном воплощении детектируемое антитело представляет собой биотинилированное антитело.
Термин "средство детекции" обозначает компонент или метод, используемый для детекции присутствия детектируемого антитела в настоящем анализе ELISA, и включает агенты детекции, которые амплифицируют иммобилизованную метку, такую как метка, захваченная на титрационном микропланшете. В одном воплощении средство детекции представляет собой агент колориметрической детекции, такой как авидин или стрептавидин-HRP.
Термин "реагент захвата" обозначает реагент, способный к связыванию и захвату молекулы-мишени в образце, так чтобы при подходящих условиях комплекс в виде реагента захвата и молекулы-мишени мог отделяться от остальной части образца. Обычно реагент захвата является иммобилизованным или может быть иммобилизован. В иммуноанализе сэндвич-типа реагент захвата предпочтительно представляет собой антитело или смесь различных антител против антигена-мишени.
Термин "антитело" используется в настоящем описании в широком смысле и конкретно охватывает интактные моноклональные антитела, поликлональные антитела, мультиспецифичные антитела (например, биспецифичные антитела), образованные, по меньшей мере, из двух интактных антител, и фрагменты антител, при условии, что они проявляют желаемую биологическую активность.
Термин "фрагменты антител" включает часть интактного антитела, предпочтительно, включающую его антиген-связывающий или вариабельный участок. Примеры фрагментов антитела включают фрагменты Fab, Fab', F(ab')2, и Fv; димерные антитела; линейные антитела; одноцепочечные молекулы антител; и мультиспецифичные антитела, образованные из фрагментов антител.
В целях настоящего изобретения "интактное антитело" представляет собой антитело, включающее вариабельные домены тяжелой и легкой цепей, а также участок Fc.
"Нативные антитела" обычно представляют собой гетеротетрамерные гликопротеины с молекулярной массой, составляющей примерно 150000 дальтон, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Каждая легкая цепь соединена с тяжелой цепью с помощью одной ковалентной дисульфидной связи, в то время как количество дисульфидных связей варьируется среди тяжелых цепей иммуноглобулинов различных изотипов. Каждая тяжелая и легкая цепь также содержит дисульфидные мостики внутри цепи, расположенные через определенные интервалы. Каждая тяжелая цепь содержит на одном конце вариабельный домен (VH), следующий за рядом константных доменов. Каждая легкая цепь содержит на одном конце вариабельный домен (VL) и константный домен - на ее другом конце; константный домен легкой цепи располагается по одной линии с первым константным доменом тяжелой цепи, и вариабельный домен легкой цепи располагается по одной линии с вариабельным доменом тяжелой цепи. Предполагается, что конкретные аминокислотные остатки образуют границу раздела между вариабельными доменами легкой цепи и тяжелой цепи.
При использовании здесь, термин "моноклональное антитело" обозначает антитело, полученное из популяции, по существу, гомогенных антител, т.е. индивидуальные антитела, включенные в популяцию, являются идентичными, за исключением возможных природных мутаций, которые могут присутствовать в минорных количествах. Моноклональные антитела являются высокоспецифичными, будучи направленными против одного антигенного сайта. Кроме того, в противоположность препаратам обычных (поликлональных) антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты антигена. В дополнение к их специфичности, преимущество моноклональных антител заключается в том, что они синтезируются с помощью гибридомных культур, не содержащих других иммуноглобулинов. Обозначение "моноклональное" указывает на характер антитела, которое получено из по существу гомогенной популяции антител, и это обозначение не следует понимать, как необходимость получения антитела любым конкретным методом. Например, моноклональные антитела, используемые согласно настоящему изобретению, могут быть получены с помощью гибридомного метода, впервые описанного в публикации Kohler et al., Nature, 256: 495 (1975), или могут быть получены с помощью методов рекомбинантной ДНК (см., например, Патент США № 4816567). "Моноклональные антитела" также могут быть выделены из фаговых библиотек антител с использованием методов, описанных, например, в публикациях Clackson et al. Nature 352: 624-628 (1991) и Marks et al., J. Mol. Biol. 222: 581-597 (1991).
В настоящем описании моноклональные антитела конкретно включают "химерные" антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи является идентичной или гомологичной с соответствующими последовательностями в антителах, выделенных из конкретных видов или принадлежащих конкретному классу или подклассу антител, в то время как оставшаяся часть цепи(ей) является идентичной или гомологичной с соответствующими последовательностями в антителах, выделенных из других видов или принадлежащих другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они проявляют желаемую биологическую активность (Патент США № 4816567; Morrison et al., Proc. Natl. Acad. Sci. USA. 81: 6851-6855 (1984)). Здесь, химерные антитела, представляющие интерес, включают "приматизированные" антитела, включающие антиген-связывающие последовательности вариабельного домена, выделенные из примата, отличного от человека (например, из обезьяны старого света, такой как бабуин, макака-резус или макака-крабоед), и включающие последовательности константного участка человека (Патент США № 5693780).
"Гуманизированные" формы не человеческих (например, мышиных) антител представляют собой химерные антитела, которые содержат минимальную последовательность, выделенную из не человеческого иммуноглобулина. По большей части гуманизированные антитела представляют собой иммуноглобулины человека (реципиентное антитело), в которых остатки из гипервариабельного участка реципиента заменены на остатки из гипервариабельного участка вида, отличного от человека (донорное антитело), такого как мышь, крыса, кролик или примат, отличный от человека, причем эти антитела обладают желаемой специфичностью, аффинностью и способностью. В некоторых случаях, остатки каркасного участка (FR) иммуноглобулина человека заменяют на соответствующие не человеческие остатки. Кроме того, гуманизированные антитела могут включать остатки, которые не обнаружены в реципиентном антителе или в донорном антителе. Эти модификации производят дополнительно для улучшения функций антитела. Как правило, гуманизированное антитело включает, по существу, все из, по меньшей мере, одного, и обычно, из двух вариабельных доменов, в которых все или, по существу, все из гипервариабельных петель соответствуют таким последовательностям из не человеческого иммуноглобулина, и все или, по существу, все из участков FR представляют собой такие последовательности из иммуноглобулина человека. Гуманизированное антитело также необязательно включает, по меньшей мере, часть константного участка иммуноглобулина (Fc), обычно иммуноглобулина человека. Для дополнительных подробностей, см. публикации Jones et al., Nature, 321: 522-525 (1986); Riechmann et al., Nature, 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol., 2: 593-596 (1992). В одном воплощении предлагается гуманизированное антитело 5C3, и применяются предлагаемые здесь способы.
Термин "вариабельный" обозначает тот факт, что определенные части вариабельных доменов существенно отличаются по последовательностям среди антител и используются для связывания и специфичности каждого конкретного антитела для его конкретного антигена. Однако вариабельность представлена неравномерно на протяжении последовательности вариабельных доменов антител. Она концентрируется в трех сегментах, называемых гипервариабельными участками в обоих вариабельных доменах - легкой цепи и тяжелой цепи. Наиболее высококонсервативные части вариабельных доменов называются каркасными участками (FR). Вариабельные домены нативных, тяжелой и легкой, цепей, каждый, включают по четыре участка FR, преимущественно принимающих конфигурацию β-листа, связанных с помощью трех гипервариабельных участков, которые образуют петли, связывающие и, в некоторых случаях, образующие часть структуры β-листа. Гипервариабельные участки в каждой цепи поддерживаются вместе в непосредственной близости с помощью FR, и вместе с гипервариабельными участками из другой цепи, что способствует образованию антиген-связывающего сайта антител (см. публикацию Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). Константные домены не вовлечены непосредственно в связывание антитела с антигеном, но проявляют разнообразные эффекторные функции, такие как участие антитела в антитело-зависимой клеточной цитотоксичности (ADCC).
С помощью расщепления папаином антител получают два идентичных антиген-связывающих фрагмента, называемых фрагментами "Fab", каждый из которых содержит один антиген-связывающий сайт, и остаточный фрагмент "Fc", название которого отражает его способность легко кристаллизоваться. С помощью обработки пепсином получают фрагмент F(ab')2, который содержит два антиген-связывающих сайта, и все еще остается способным к перекрестному связыванию антигена.
"Fv" представляет собой фрагмент антитела, который содержит полный антиген-распознающий и антиген-связывающий сайт. Этот участок состоит из димера одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи, которые находятся в плотной нековалентной ассоциации. Фрагмент находится в такой конфигурации, что три гипервариабельных участка каждого вариабельного домена взаимодействуют для определения антиген-связывающего сайта на поверхности димера VH-VL. Вместе шесть гипервариабельных участков придают антителу антиген-связывающую специфичность. Однако даже один вариабельный домен (или половина фрагмента Fv, включающая только три гипервариабельных участка, специфичных к антигену) обладает способностью связывать антиген, хотя с меньшей аффинностью, чем цельный сайт связывания.
Фрагмент Fab также содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Фрагменты Fab' отличаются от фрагментов Fab вставкой нескольких остатков в карбокси-конец домена CH1 тяжелой цепи, включающих один или боле цистеинов из шарнирного участка антитела. Fab'-SH в настоящем описании представляет собой обозначение для Fab', в котором остаток(ки) цистеина в константных доменах несут, по меньшей мере, одну свободную тиольную группу. Фрагменты F(ab')2 антитела исходно были получены в виде пар фрагментов Fab', которые содержали между собой цистеины шарнирного участка. Также известны другие химические конденсации фрагментов антитела.
"Легкие цепи" антител (иммуноглобулинов) из любого вида позвоночных могут быть отнесены к одному из двух совершенно различных типов, называемых каппа (κ) и лямбда (λ), на основе аминокислотных последовательностей их константных доменов.
В зависимости от аминокислотной последовательности константного домена их тяжелых цепей, антитела могут быть отнесены к различным классам. Существует пять главных классов интактных антител: IgA, IgD, IgE, IgG и IgM, и некоторые из этих классов могут быть дополнительно разделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам антител, называются α, δ, ε, γ и μ, соответственно. Субъединичные структуры и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны.
Фрагменты антитела "одноцепочечный Fv" или "scFv" включают домены VH и VL антитела, где эти домены присутствуют в одной полипептидной цепи. Предпочтительно, полипептид Fv дополнительно включает полипептидный линкер между доменами VH и VL, который предоставляет возможность scFv образовывать желаемую структуру для связывания антигена. В качестве обзора на тему scFv, см. публикацию Pluckthun, The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994).
При использовании здесь, термин "гипервариабельный участок" обозначает аминокислотные остатки антитела, которые ответственны за связывание антигена. Гипервариабельный участок включает аминокислотные остатки из "участка, определяющего комплементарность" или "CDR" (например, остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и 31-35 (H1), 50-65 (H2) и 95-102 (H3) в вариабельном домене тяжелой цепи; Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)), и/или такие остатки из "гипервариабельной петли" (например, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (H1), 53-55 (H2) и 96-101 (H3) в вариабельном домене тяжелой цепи; Chothia and Lesk J. Mol. Biol. 196:901-917 (1987)). Остатки "каркаса" или "FR" представляют собой такие остатки вариабельного домена, которые отличны от остатков гипервариабельного участка, как здесь определено.
"Млекопитающее" для целей лечения обозначает любое животное, классифицированное как млекопитающее, включая людей, домашних и сельскохозяйственных животных, и животных зоопарка, спортивных животных, или домашних животных, таких как собаки, лошади, кошки, овцы, свиньи, коровы и т.д. Предпочтительным млекопитающим является человек.
Термины "рак", "раковый" и "злокачественный" обозначают или описывают физиологическое заболевание у млекопитающих, которое обычно характеризуется неконтролируемым клеточным ростом. Примеры рака включают, но не ограничены ими, карциному, включающую аденокарциному, лимфому, бластому, меланому, саркому и лейкемию. Более конкретные примеры таких раковых заболеваний включают плоскоклеточный рак, рак легкого (включающий мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого и плоскоклеточную карциному легкого), рак брюшины, печеночно-клеточный рак, гастральный или желудочный рак (включая желудочно-кишечный рак), желудочно-кишечный стромальный рак, панкреатический рак, глиобластому, рак шейки матки, рак яичников, рак печени (например, печеночную карциному и гепатому), рак мочевого пузыря, гепатому, рак груди, рак прямой кишки, колоректальный рак, ректальный рак, эндометриальную или утробную карциному, карциному слюнной железы, рак почки или почечный рак, рак печени, рак простаты, рак вульвы, рак щитовидной железы, базально-клеточную карциному, рак яичка, рак пищевода, печеночную карциному, саркому мягкой ткани, саркому Капоши, карциноидную карциному, мезотелиому, множественную миелому, и различные типы рака головы и шеи, а также B-клеточную лимфому (включая низкодифференцированную/фолликулярную неходжкинскую лимфому (НХЛ); НХЛ малых лимфоцитов (SL); среднедифференцированную/фолликулярную НХЛ; среднедифференцированную дифузную НХЛ; высокодифференцированную иммунобластную НХЛ; высокодифференцированную лимфообластную НХЛ; высокодифференцированную мелкоклеточную лимфому НХЛ с нерасщепленным ядром; массивное поражение НХЛ; лимфому клеток мантийной ткани; СПИД-ассоциированную лимфому; и Макроглобулинемию Вальденстрема); лимфому Ходжкина, хроническую лимфоцитарную лейкемию (CLL), острую лимфобластную лейкемию (ALL), лейкемию волосковых клеток; хроническую миелобластную лейкемию, и пост-трансплантационное лимфопролиферативное нарушение (PTLD), а также аномальную сосудистую пролиферацию, ассоциированную с факоматозом, отек (такой как отек, ассоциированный с опухолями головного мозга), и синдром Мейгса.
Выражения "сосудистый" и "сердечно-сосудистый" используются взаимозаменяемо и описывают пациентов с признаками, которые стимулируют ангиогенез и/или кардиоваскуляризацию, и с признаками, которые ингибируют ангиогенез и/или кардиоваскуляризацию. Такие нарушения включают, например, артериальное заболевание, такое как атеросклероз, гипертензия, воспалительный васкулит, болезнь Рейно и феномен Рейно, аневризмы и артериальный рестеноз; венозные и лимфатические нарушения, такие как тромбофлебит, лимфангиит и лимфедема; и другие сосудистые нарушения, такие как периферическое сосудистое заболевание, AMD, рак, такой как опухоли сосудов, например, гемангиома (капиллярная и полостная), гломусные опухоли, телеангиэктазия, бациллярный ангиоматоз, гемангиоэндотелиома, ангиосаркома, гемангиопериктома, саркома Капоши, лимфангиома и лимфангиосаркома, опухолевый ангиогенез, травма, такая как раны, ожоги и другие тканевые повреждения, фиксация имплантанта, рубец, ишемическое реперфузионное повреждение, ревматоидный артрит, цереброваскулярное заболевание, почечные заболевания, такие как острая почечная недостаточность, и остеопороз. Эти нарушения также включают стенокардию, инфаркты миокарда, такие как острые инфаркты миокарда, сердечная гипертрофия и сердечную недостаточность, такую как застойная сердечная недостаточность (CHF).
Термин "диабет" обозначает прогрессирующее заболевание углеводного метаболизма, включающего неадекватное продуцирование или утилизацию инсулина, и характеризуется гипергликемией и глюкозурией. Этот термин включает все формы диабета, такие как диабет I типа и II типа, и инсулиноустойчивый диабет, такой как синдром Менденхолла (Mendenhall), синдром Вернера, лепречаунизм, липоатрофический диабет и другие липоатрофии.
Термин "аффинно-очищенный" обозначает очистку вещества с помощью его элюирования сквозь колонку для аффинной хроматографии.
ELISA
Фактор роста эндотелия сосудов (VEGF) представляет собой гомодимерный гликопротеин и представляет собой ключевой ангиогенный фактор образования кровеносных сосудов во время развития и при патологическом ангиогенезе, ассоциированном с опухолями. Экспрессия VEGF усиливается в ответ на гипоксию, и потенциально в ответ на другие факторы, такие как факторы роста, гормоны и онкогены (см., например, публикацию Ferrara N: Vascular endothelial growth factor: Basic science and clinical progress. Endocrine Reviews 25: 581-611 (2004)). Ген VEGF человека содержит восемь экзонов, разделенных интронами. Альтернативный сплайсинг РНК приводит в результате к получению, по меньшей мере, четырех основных изоформ, содержащих в мономере 121, 165, 189 и 206 аминокислот (см., например, публикации Houck KA, et al.: The vascular endothelial growth factor family: identification of a fourth molecular species and characterization of alternative splicing of RNA. Mol Endocrinol 5: 1806-1814 (1991); и Tischer E, et al.: The human gene for vascular endothelial growth factor. Multiple protein forms are encoded through alternative exon splicing. J Biol Chem 266: 11947-11954 (1991)). Также были описаны менее представленные изоформы, включающие изоформы, содержащие