Гены дельта-8-десатуразы, ферменты, кодируемые ими, и их применение
Иллюстрации
Показать всеИзобретение относится к биохимии и представляет собой выделенные полинуклеотиды, кодирующие Δ8-десатуразу. Изобретение также относится к самим Δ8-десатуразам, кодируемым выделенными полинуклеотидами, векторам экспрессии, содержащим выделенные полинуклеотиды, клеткам-хозяевам, содержащим векторы экспрессии, и к способам получения Δ8-десатураз и полиненасыщенных жирных кислот, выбранных из группы, состоящей из дигомо-гамма-линоленовой кислоты (DGLA), ω3-эйкозатетраеновой кислоты (ω3-ЕТА) и любых их сочетаний. Изобретение позволяет расширить ассортимент Δ8-десатураз, используемых для получения полиненасыщенных жирных кислот. 10 н. и 2 з.п. ф-лы, 12 ил., 14 табл., 6 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к выделенным полинуклеотидам, кодирующим дельта-8-десатуразу, к дельта-8-десатуразам, кодируемым выделенными полинуклеотидами, векторам экспрессии, содержащим выделенные полинуклеотиды, клеткам-хозяевам, содержащим векторы экспрессии, и к способам получения дельта-8-десатураз и полиненасыщенных жирных кислот.
УРОВЕНЬ ТЕХНИКИ
Полиненасыщенные жирные кислоты (PUFA) участвуют в правильном функционировании всех живых организмов. Например, PUFA являются важными составляющими плазматической мембраны клетки, в составе которой они находятся в виде фосфолипидов. PUFA необходимы для нормального развития мозга у детей, а также для образования и восстановления тканей у взрослых млекопитающих.
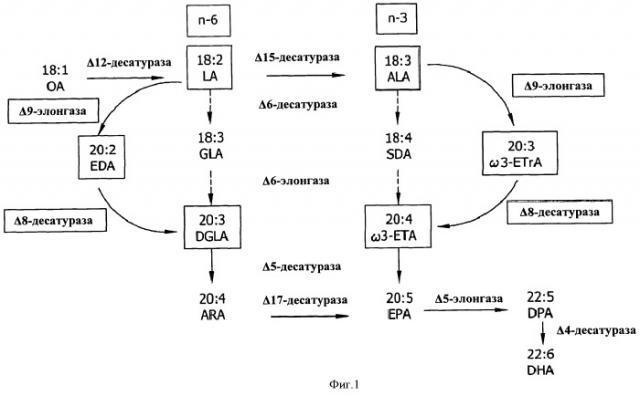
В биологическом синтезе PUFA участвуют несколько типов ферментов, прежде всего, десатуразы и элонгазы (см. ФИГ.1). Десатуразы катализируют внесение участков ненасыщения (например, двойных связей) между атомами углерода в алкильной цепи жирной кислоты в субстрате. Элонгазы катализируют присоединение единицы, состоящей из двух атомов углерода, к субстрату жирной кислоты. Например, линолевую кислоту (LA, 18:2n-6) получают из олеиновой кислоты (OA, 18:1n-9) с помощью Δ12-десатуразы. Эйкозадиеновую кислоту (EDA, 20:2n-6) получают из LA с помощью Δ9-элонгазы. Дихомо-γ-линоленовую кислоту (DGLA, 20:3n-6) получают из EDA с помощью Δ8-десатуразы (см. ФИГ.1). Арахидоновую кислоту (ARA, 20:4n-6) получают из DGLA с помощью Δ5-десатуразы (см. ФИГ.1).
В данной области техники известно несколько важных PUFA с длинной цепью. Например, одной из наиболее важных PUFA с длинной цепью является эйкозапентаеновая кислота (EPA). EPA содержится в грибах и жирах морских продуктов. Второй важной PUFA с длинной цепью является докозагексаеновая кислота (DHA). DHA часто содержится в рыбьем жире, а также ее можно получить путем выделения из ткани мозга млекопитающих. Третьей важной PUFA с длинной цепью является ARA. ARA содержится в мицелиальных грибах, а также ее можно получить путем выделения из тканей млекопитающих, включая ткани печени и надпочечников.
ARA, EPA и/или DHA можно получить как с помощью альтернативной цепочки превращений Δ8-десатуразы/Δ9-элонгазы, так и с помощью традиционной цепочки превращений Δ6-десатуразы (см. ФИГ.1). Ранее были идентифицированы элонгазы, обладающие активностью в отношении жирных кислот в качестве субстрата в классической цепочке превращений Δ6 для образования PUFA с длинной цепью, в частности, ARA, EPA и DHA. В ходе традиционной цепочки превращений Δ6-десатуразы, направленной на превращение LA в DGLA и альфа-линоленовой кислоты (ALA) в ω3-эйкозатетраеновую кислоту (ω3-ETA), используют Δ6-десатуразный фермент для превращения LA в гамма-линоленовую кислоту (GLA) и ALA в стеаридоновую кислоту (SDA), и C18-элонгазный фермент для превращения GLA в DGLA и SDA в ω3-ETA. Тем не менее, в некоторых случаях более предпочтительной может являться альтернативная цепочка превращений Δ8-десатуразы/Δ9-элонгазы по сравнению с традиционной цепочкой превращений Δ6-десатуразы. Например, если в ходе получения DGLA, ARA, ω3-ETA, EPA, ω3-докозапентаеновой кислоты (DPA) и/или DHA является нежелательным образование остаточных промежуточных продуктов омега-6 или омега-3 жирных кислот, например, GLA или SDA, можно применять альтернативный путь Δ8-десатуразы/Δ9-элонгазы вместо традиционного пути Δ6-десатуразы для того, чтобы избежать образования GLA и SDA. Возможность применения Δ8-десатураз в указанной цепочке превращений обусловлена способностью десатурировать молекулу жирной кислоты в положении между восьмым и девятым атомами углерода (нумерация осуществляется от карбоксильного конца молекулы) и их способностью, например, катализировать превращение ω6-эйкозадиеновой кислоты (EDA) в DGLA и/или ω3-эйкозатриеновой кислоты (ω3-ETrA) в ω3-ETA. Следовательно, в данной области техники существует потребность в новых источниках Δ8-десатураз, которые можно применять для получения PUFA с длинной цепью.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном аспекте настоящее изобретение относится к выделенной нуклеотидной кислоте или ее фрагменту, содержащей последовательность нуклеотидов, кодирующую полипептид, обладающий десатуразной активностью, или комплементарной указанной последовательности, причем аминокислотная последовательность полипептида по меньшей мере на 55% идентична аминокислотной последовательности, содержащей SEQ ID NO:29. Выделенная нуклеиновая кислота или ее фрагмент кодирует функционально активный фермент Δ8-десатуразу, использующий в качестве субстрата ω6-эйкозадиеновую кислоту или ω3-эйкозатриеновую кислоту. Указанную выделенную последовательность нуклеиновой кислоты можно получать из Emiliana huxleyi, предпочтительно, из Emiliana huxleyi CCMP 378.
В другом аспекте настоящее изобретение относится к выделенной нуклеотидной последовательности или ее фрагменту, содержащей или комплементарной по меньшей мере 55% нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO:28 и SEQ ID NO:30. Выделенная нуклеотидная последовательность или ее фрагмент кодирует функционально активный фермент десатуразу, использующий в качестве субстрата ω6-эйкозадиеновую кислоту или ω3-эйкозатриеновую кислоту. Выделенная нуклеотидная последовательность может содержать последовательность, представленную в SEQ ID NO:28. В качестве альтернативного варианта, выделенная нуклеотидная последовательность может содержать последовательность, представленную в SEQ ID NO:30. Указанную выделенную нуклеотидную последовательность можно получить из Emiliana huxleyi, предпочтительно, Emiliana huxleyi CCMP 378.
В другом аспекте настоящее изобретение относится к вектору экспрессии. Указанный вектор экспрессии согласно настоящему изобретению содержит нуклеотидную последовательность, функционально связанную с регуляторной последовательностью, причем нуклеотидная последовательность содержит или комплементарна по меньшей мере 55% нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO:28 и SEQ ID NO:30.
В еще одном дополнительном аспекте настоящее изобретение относится к клетке-хозяину, содержащей описанный выше вектор экспрессии. Клетка-хозяин может представлять собой клетку эукариот. В частности, клетку эукариот выбирают из группы, состоящей из: клетки млекопитающего, клетки насекомого, клетки растения и клетки гриба. Примеры применяемых клеток грибов включают клетки грибов, выбранные из группы, состоящей из: Saccharomyces spp., Candida spp., Lipomyces spp., Yarrowia spp., Kluyveromyces spp., Hansenula spp., Aspergillus spp., Penicillium spp., Neurospora spp., Trichoderma spp. и Pichia spp. Примеры применяемых клеток растений включают клетки растений, выбранные из группы, состоящей из: клеток растений сои, видов рода Brassica, сафлора, подсолнечника, кукурузы, хлопка и льна.
В еще одном аспекте настоящее изобретение относится к клетке растения, зерну растения, растению или ткани растения, содержащим описанный выше вектор экспрессии, при этом экспрессия нуклеотидной последовательности вектора приводит к образованию клеткой растения, зерном растения растением или тканью растения по меньшей мере одной полиненасыщенной жирной кислоты. Полиненасыщенная жирная кислота, образуемая указанным вектором экспрессии, выбрана из группы, состоящей из: арахидоновой кислоты (ARA), эйкозапентаеновой кислоты (EPA), докозагексаеновой кислоты (DHA), дихомо-гамма-линоленовой кислоты (DGLA) или ω3-эйкозатетраеновой кислоты (ω3-ETA), а также комбинаций указанных кислот.
В еще одном аспекте настоящее изобретение относится к одному или более растительных масел или жирных кислот, образуемых клеткой растения, зерном растения, растением или тканью растения, описанными выше.
В еще одном аспекте настоящее изобретение относится к очищенному полипептиду, кодируемому нуклеотидной последовательностью, содержащей или комплементарной по меньшей мере 55% нуклеотидной последовательности, выбранной из группы, состоящей из: SEQ ID NO:28 и SEQ ID NO:30.
В еще одном аспекте настоящее изобретение относится к очищенному полипептиду, десатурирующему полиненасыщенную жирную кислоту, длина углеродной цепи которой составляет 20 атомов углерода (C20-PUFA), используемую в качестве субстрата, в положении между 8 и 9 атомами углерода, и при этом аминокислотная последовательность полипептида по меньшей мере на 55% идентична аминокислотной последовательности, содержащей SEQ ID NO:29.
В еще одном варианте реализации настоящее изобретение относится к очищенному полипептиду, содержащему аминокислотную последовательность, представленную в SEQ ID NO:29.
В еще одном варианте реализации настоящее изобретение относится к способу получения фермента Δ8-десатуразы. Указанный способ включает этапы:
a) выделения нуклеотидной последовательности, содержащей или комплементарной по меньшей мере 55% нуклеотидной последовательности, выбранной из группы, состоящей из: SEQ ID NO:28 и SEQ ID NO:30;
b) конструирования вектора экспрессии, содержащего выделенную нуклеотидную последовательность согласно этапу a), функционально связанную с регуляторной последовательностью; и
c) введения вектора экспрессии в клетку-хозяина на период времени и в условиях, достаточных для образования фермента Δ8-десатуразы.
В способе, описанном выше, клетка-хозяин представляет собой клетку эукариот. В частности, указанную клетку эукариот выбирают из группы, состоящей из: клетки млекопитающего, клетки насекомого, клетки растения и клетки гриба. Примеры применяемых клеток грибов включают клетки грибов, выбранные из группы, состоящей из: Saccharomyces spp., Candida spp., Lipomyces spp., Yarrowia spp., Kluyveromyces spp., Hansenula spp., Aspergillus spp., Penicillium spp., Neurospora spp., Trichoderma spp. и Pichia spp. Примеры применяемых клеток растений включают клетки растений, выбранные из группы, состоящей из: клеток растений сои, видов рода Brassica, сафлора, подсолнечника, кукурузы, хлопка и льна.
В еще одном варианте реализации настоящее изобретение относится к способу получения полиненасыщенной жирной кислоты, включающий этапы:
a) выделения нуклеотидной последовательности, содержащей или комплементарной по меньшей мере 55% нуклеотидной последовательности, выбранной из группы, состоящей из: SEQ ID NO:28 и SEQ ID NO:30;
b) конструирования вектора экспрессии, содержащего выделенную нуклеотидную последовательность согласно этапу a), функционально связанную с регуляторной последовательностью;
c) введения вектора экспрессии в клетку-хозяина на период времени и в условиях, достаточных для образования фермента Δ8-десатуразы; и
d) приведения во взаимодействие фермента Δ8-десатуразы с субстратом, выбранным из группы, состоящей из: ω6-эйкозадиеновой кислоты, ω3-эйкозатриеновой кислоты, а также комбинаций указанных кислот, для превращения субстрата в получаемую полиненасыщенную жирную кислоту.
В способе, описанном выше, получаемая полиненасыщенная жирная кислота представляет собой дихомо-гамма-линоленовую кислоту (DGLA), ω3-эйкозатетраеновую кислоту (ω3-ETA) или любые комбинации указанных кислот.
Также, способ, описанный выше, дополнительно может включать этап:
приведения во взаимодействие получаемой полиненасыщенной жирной кислоты с по меньшей мере одной дополнительной десатуразой или элонгазой, для превращения получаемой полиненасыщенной жирной кислоты в другую или дополнительную полиненасыщенную жирную кислоту. Получаемая в результате полиненасыщенная жирная кислота представляет собой арахидоновую кислоту (ARA), эйкозапентаеновую кислоту (EPA), докозапентаеновую кислоту (DPA) или докозагексаеновую кислоту (DHA) или любую комбинацию указанных кислот.
В еще одном аспекте настоящее изобретение относится к способу получения полиненасыщенной жирной кислоты в клетке-хозяине, включающий этапы:
a) выделения нуклеотидной последовательности, содержащей или комплементарной по меньшей мере 55% нуклеотидной последовательности, выбранной из группы, состоящей из: SEQ ID NO:28 и SEQ ID NO:30;
b) конструирования вектора экспрессии, содержащего выделенную нуклеотидную последовательность согласно этапу a), функционально связанную с регуляторной последовательностью;
c) введения вектора экспрессии согласно этапу b) и по меньшей мере одной дополнительной рекомбинантной ДНК конструкции, содержащей выделенную нуклеотидную последовательность, функционально связанную с по меньшей мере одной регуляторной последовательностью, кодирующую дельта-9 элонгазу, в клетку-хозяина;
d) приведения во взаимодействие экспрессированного фермента Δ8-десатуразы и дельта-9 элонгазы с субстратом, выбранным из группы, состоящей из: линолевой кислоты (LA), альфа-линоленовой кислоты (ALA) и комбинаций указанных кислот, для превращения субстрата в получаемую полиненасыщенную жирную кислоту.
В описанном выше способе, получаемая полиненасыщенная жирная кислота представляет собой дихомо-гамма-линоленовую кислоту (DGLA) или ω3-эйкозатетраеновую кислоту (ω3-ETA) или любую комбинацию указанных кислот.
описанный выше способ дополнительно может включать этап:
приведения во взаимодействие полиненасыщенной жирной кислоты с по меньшей мере одной дополнительной десатуразой или элонгазой для превращения получаемой полиненасыщенной жирной кислоты в другую или дополнительную полиненасыщенную аминокислоту. Получаемая полиненасыщенная жирная кислота представляет собой арахидоновую кислоту (ARA), эйкозапентаеновую кислоту (EPA), докозапентаеновую кислоту (DPA), докозагексаеновую кислоту (DHA) или любую комбинацию указанных кислот.
В способе, описанном выше, клетка-хозяин представляет собой клетку эукариот. В частности, клетку эукариот выбирают из группы, состоящей из: клетки млекопитающего, клетки насекомого, клетки растения и клетки гриба. Примеры применяемых клеток грибов включают клетки грибов, выбранные из группы, состоящей из: Saccharomyces spp., Candida spp., Lipomyces spp., Yarrowia spp., Kluyveromyces spp., Hansenula spp., Aspergillus spp., Penicillium spp., Neurospora spp., Trichoderma spp. и Pichia spp. Примеры применяемых клеток растений включают клетки растений, выбранные из группы, состоящей из: клеток растений семейства бобовых, видов рода Brassica, сафлора, подсолнечника, кукурузы, хлопка и льна.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На ФИГ.1 показан путь биологического синтеза жирной кислоты и роль Δ8-десатуразы в указанном пути.
На ФИГ.2A и 2B показано выравнивание аминокислотной последовательности, кодируемой ED3-8 (SEQ ID NO:29) с известными Δ8-десатуразами Pavlova lutheri CCMP 459 (SEQ ID NO:2), Pavlova salina (SEQ ID NO:3), Euglena gracialis (SEQ ID NO:1) и Perkinsus (SEQ ID NO:4). Идентичные остатки выделены, консервативные гистидиновые боксы подчеркнуты, консервативный участок в домене цитохрома b5 подчеркнут (двойной чертой).
На ФИГ.3A показаны аминокислотные последовательности Δ8-десатуразы Euglena gracialis (# доступа AF139720, SEQ ID NO:1).
На ФИГ.3B показаны аминокислотные последовательности Δ8-десатуразы Pavlova lutheri CCMP 459 (SEQ ID NO:2).
На ФИГ.4A показаны аминокислотные последовательности Δ8-десатуразы Pavlova salina (# доступа DQ995518, SEQ ID NO:3).
На ФИГ.4B показаны аминокислотные последовательности Δ8-десатуразы Perkinsus marinus (# доступа DQ508730, SEQ ID NO:4).
На ФИГ.4C показаны аминокислотные последовательности Δ8-десатуразы Acanthamoenba castellani (# доступа CS608483, SEQ ID NO:5).
На ФИГ.5 показана последовательность ДНК (SEQ ID NO:11) клона ED3-8, полученного в соответствии со способом, описанным в Примере 2.
ФИГ.6 показана расшифрованная аминокислотная последовательность (SEQ ID NO:12) клона ED3-8 полученного в соответствии со способом, описанным в Примере 2.
ФИГ.7A показана последовательность ДНК (SEQ ID NO:15) клона PK15 полученного в соответствии со способом, описанным в Примере 2.
ФИГ.7B показана аминокислотная последовательность (SEQ ID NO:16) клона PK15, полученного в соответствии со способом, описанным в Примере 2.
ФИГ.8A показана последовательность ДНК (SEQ ID NO:24) предполагаемого 3′-конца клона клона ED3-8, полученного в соответствии со способом, описанным в Примере 2.
ФИГ.8B показана аминокислотная последовательность (SEQ ID NOS:25 и Δ4-46, соответственно, в порядке появления) предполагаемого 3′-конца клона ED3-8, полученного в соответствии со способом, описанным в Примере 2.
На ФИГ.9 показана последовательность гена 1254 пары азотистых оснований предполагаемой Δ8-десатуразы Emiliana huxleyi CCMP 378 (SEQ ID NO:28).
На ФИГ.10 показан белок, содержащий в составе 417 аминокислот (SEQ ID NO:29), кодируемый последовательностью гена, содержащего 1254 пары азотистых оснований, (SEQ ID NO:28) предполагаемой Δ8-десатуразы Emiliana huxleyi CCMP 378.
На ФИГ.11 показана последовательность гена, оптимизированная относительно кодонов, предполагаемой Δ8-десатуразы Emiliana huxleyi CCMP 378 (SEQ ID NO:30), обозначенная 'ED3-8-EP2-5-SC'. ED3-8-EP2-5-SC обладает 66.98% идентичности с исходной последовательностью гена ED3-8 (SEQ ID NO:28; ФИГ.9). Ни одна из модификаций в составе гена, оптимизированного относительно кодонов, не изменяет аминокислотной последовательности кодируемого белка (SEQ ID NO:29; ФИГ.10).
На ФИГ.12 показана последовательность гена Δ9-элонгазы, полученная из Isochrysis galbana (IsoD9) (№ доступа CQ831422, SEQ ID NO:31).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к нуклеотидным последовательностям (например, нуклеотидным последовательностям гена) и транслированным аминокислотным последовательностям гена Δ8-десатуразы Emiliana sp; например, Emiliana huxley, в частности, Emiliana huxley CCMP 378. Далее, в объем настоящего изобретения включены области применения гена и фермента, кодируемого указанным геном. Например, нуклеотид и соответствующий фермент можно применять для получения полиненасыщенных жирных кислот, например, DGLA, ARA, EPA, ω3-ETA DPA и DHA или любых комбинаций указанных кислот, которые можно включать в состав фармацевтических композиций, пищевых составов и других ценных продуктов.
A. Определения
Формы единственного числа, используемые в настоящем описании, включают также и множественное число обозначаемых объектов, если в контексте четко не указано обратного. Для перечисления в пределах областей числовых значений, приведенных в настоящем описании, предусматривается каждое промежуточное значение с одинаковой степенью точности. Например, в интервале 6-9, помимо чисел 6 и 9, также предусматриваются 7 и 8, а для интервала 6.0-7.0, явно предусматриваются числа 6.0, 6.1, 6.2, 6.3, 6.4, 6.5, 6.6, 6.7, 6.8, 6.9 и 7.0.
a) Виды рода Brassica
Фраза ″виды рода Brassica″, используемая в настоящем описании, относится к любому из растений: Brassica juncea, Brassica napus, Brassica carinata, Brassica oleracea, Brassica nigra и Brassica campestris.
b) Химерная конструкция
Термин ″химерная конструкция″, используемая в настоящем описании, относится к комбинации молекул нуклеиновых кислот, не встречающемуся в естественном виде в природе. Соответственно, химерная конструкция может содержать регуляторные последовательности и кодирующие последовательности, полученные из различных источников, или регуляторные последовательности и кодирующие последовательности, полученные из одного источника, но расположенные в порядке, отличающемся от встречающегося в естественном виде в природе.
c) Кодирующая последовательность
Термин ″кодирующая последовательность″, используемый в настоящем описании, относится к последовательности ДНК, кодирующей определенную аминокислотную последовательность. Термин ″регуляторные последовательности″ относится к нуклеотидным последовательностям, расположенным в 3′-5′ направлении (5′ некодирующие последовательности), в составе кодирующей последовательности или в 5′-3′ направлении (3′ некодирующие последовательности) от кодирующей последовательности, влияющим на транскрипцию, процессинг и стабильность РНК, или на трансляцию соответствующей кодирующей последовательности. Регуляторные последовательности могут включать, но не ограничиваются укаанными: промоторы, лидерные последовательности трансляции, интроны и последовательности распознавания полиаденилирования.
d) Оптимизированный относительно кодона
Термин ″оптимизированный относительно кодона″, употребляемый в отношении гена или молекулы нуклеиновой кислоты, относится к гену или молекуле нуклеиновой кислоты, частота использования кодонов которых приспособлена для воспроизведения предпочтительной частоты использования кодонов в клетке-хозяине.
e) Комплементарность
Термин ″Комплементарность″, использцемый в настоящем описании, относится к степени соответствия между двумя сегментами ДНК. Комплементарность определяют путем оценки способности кодирующей нити одного сегмента ДНК гибридизироваться с некодирующей нитью другого сегмента ДНК, в соответствующих условиях, с образованием двойной спирали. В двойной спирали, аденин находится в составе одной нити, тимин находится в составе другой нити. Также, в тех положениях, в которых в составе одной нити находится гуанин, в составе другой находится цитозин. Чем больше степень соответствия между нуклеотидными последовательностями двух сегментов ДНК, тем выше способность образовывать гибридные дуплексы указанными двумя сегментами ДНК.
f) Кодируемый, гибридизация и жесткие условия
Термин ″кодируемый″, используемый в настоящем описании, относится к последовательности нуклеиновой кислоты, кодирующей последовательность полипептида, причем последовательность полипептида или ее фрагмент содержит аминокислотную последовательность, состоящую по меньшей мере из трех последовательных аминокислот, более предпочтительно - по меньшей мере 8 последовательных аминокислот, еще более предпочтительно - 15 последовательных аминокислот из состава полипептида, кодируемого последовательностью нуклеиновой кислоты.
Также в объем настоящего изобретения входит выделенная нуклеотидная последовательность, кодирующая фермент, обладающий десатуразной активностью в отношении PUFA, гибридизуемая в жестких условиях с нуклеиновой кислотой, нуклеотидная последовательность которой содержит или комплементарна нуклеотидной последовательности, содержащей SEQ ID NO:28 или SEQ ID NO:30 (См., ФИГ.9 и 11). Молекула нуклеиновой кислоты способна ″гибридизоваться″ с другой молекулой нуклеиновой кислоты, если молекула нуклеиновой кислоты в одноцепочечной форме может соединяться с дугой молекулой нуклеиновой кислоты в соответствующих температурных условиях и при соответствующей ионной силе (См., Sambrook et al., Molecular Cloning: A Laboratory Manual, Second Edition (1989), Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.)). Температурные условия и ионная сила определяют ″жесткость″ гибридизации. Для ″гибридизации″ необходимо, чтобы две нуклеиновые кислоты содержали комплементарные последовательности. Тем не менее, в зависимости от жесткости условий гибридизации, могут возникать несоответствия в основаниях. Соответствующая жесткость условий гибридизации нуклеиновых кислот зависит от длины нуклеиновых кислот и степени комплементарности. Указанные параметры хорошо известны специалистам в данной области техники. В частности, чем больше степень сходства или гомологичности двух нуклеотидных последовательностей, тем большая величина Tm соответствует гибридам нуклеиновых кислот, содержащих указанные последовательности. Для гибридов, длина которых составляет более 100 нуклеотидов, были получены уравнения для расчета Tm (См., Sambrook et al., выше). Для гибридизации с более короткой нуклеиновой кислотой, положение несоответствий имеет большее значение, и длина олигонуклеотида определяет его специфичность (См., Sambrook et al., выше).
Обычно, жесткими условиями считаются такие условия, в которых концентрация солей составляет менее приблизительно 1.5 M ионов Na, обычно приблизительно от 0.01 до 1.0 M ионов Na (или других солей) при pH от 7.0 до 8.3 и температуре по меньшей мере приблизительно 30°C для коротких зондов (например, от 10 до 50 нуклеотидов) и по меньшей мере приблизительно 60°C для длинных зондов (например, длина которых составляет более 50 нуклеотидов). Жесткие условия также можно создать путем добавления дестабилизирующих агентов, например, формамида. Пример минимально жестких условий включает гибридизацию с применением буферного раствора с 30-35% формамидом, 1 M NaCl, 1% SDS (додецилсульфат натрия) при 37°C, и отмывкой в 1× - 2×SSC (20×SSC=3.0 M NaCl/0.3 M тринатриевым цитратом) при 50-55°C. Пример умеренно жестких условий включает гибридизацию в 40-45% формамиде, 1 M NaCl, 1% SDS при 37°C, и отмывкой в 0.5× to 1×SSC при 55-60°C. Пример очень жестких условий включает гибридизацию в 50% формамиде, 1 M NaCl, 1% SDS при 37°C, и отмывкой в 0.1×SSC при 60-65°C.
g) Экзон
Термин ″экзон″, используемый в настоящем описании, относится к участку последовательности гена, подвергаемому транскрипции и обнаруживаемому в составе зрелой информационной РНК, полученной на основе гена, но не обязательно являющемуся частью последовательности, кодирующей конечный продукт гена.
h) Экспрессия, антисмысловое ингибирование и ко-супрессия
Термин ″экспрессия″, используемый в настоящем описании, относится к образованию функционально активного конечного продукта. Экспрессия гена включает транскрипцию гена и трансляцию мРНК в предшественник зрелого белка.
Выражение ″антисмысловое ингибирование″, используемое в настоящем описании, относится к образованию антисмысловых транскриптов РНК, способных подавлять экспрессию целевого белка.
Термин ″ко-супрессия″, используемый в настоящем описании, относится к образованию смысловых транскриптов РНК, способных подавлять экспрессию идентичных или, по существу, аналогичных посторонних или эндогенных генов (См. патент США №5,231,020).
i) Фрагмент или субфрагмент, являющийся функционально эквивалентным
Термины ″фрагмент или субфрагмент, являющийся функционально эквивалентным″ и ″функционально активный фрагмент или субфрагмент″, используемые взаимозаменяемо в настоящем описании, относятся к фрагменту или субпоследовательности молекулы выделенной нуклеиновой кислоты, сохраняющим способность влиять на экспрессию гена или проявлять определенный фенотип, независимо от того, кодирует ли указанный фрагмент или субфрагмент активный фермент. Например, фрагмент или субфрагмент можно применять для разработки химерных конструкций, предназначенных для получения целевого фенотипа трансформированного растения. Химерные конструкции можно разрабатывать с целью применения для ко-супрессии или антисмыслового ингибирования путем присоединения фрагмента или субфрагмента нуклеиновой кислоты, независимо от того, кодирует ли он активный фермент, в соответствующем положении относительно промоторной последовательности растения.
j) Ген, нативный ген и трансген
Термин ″ген″, используемый в настоящем описании, относится к молекуле нуклеиновой кислоты, экспрессирующей определенный белок, включая регуляторные последовательности, предшествующие (5′ не-кодирующие последовательности) и следующие за (3′ не-кодирующие последовательности) кодирующей последовательностью.
Выражение ″нативный ген″, используемое в настоящем описании, относится к гену, обнаруживаемому в природе, вместе с характерными для него регуляторными последовательностями.
Термин ″трансген″, используемый в настоящем описании, относится к гену, введенному в состав генома с помощью процедуры трансформации.
k) Виды рода Gossypium
Выражение ″виды рода Gossypium″, употребляемое в настоящем описании, относится к любому из растений Gossypium arboreum, Gossypium barbadense, Gossypium herbaceum, Gossypium hirsutum, Gossypium hirsutum var hirsutum, Gossypium hirsutum var marie - galante, Gossypium lapideum, Gossypium sturtianum, Gossypium thuberi, Gossypium thurberi, Gossypium tomentosum или Gossypium tormentosum.
l) Гомология
Термины ″гомология″, ″гомологичный″, ″по существу, аналогичный″ и ″по существу, соответствующий″, используются взаимозаменяемо в настоящем описании и относятся к молекулам нуклеиновых кислот, изменения в одном или более нуклеотидных оснований в составе которых не влияют на способность молекулы нуклеиновой кислоты опосредовать экспрессию гена или влиять на проявление определенного фенотипа. Указанные термины также относятся к таким модификациям молекул нуклеиновых кислот согласно настоящему изобретению, как делеция или введение одного или более нуклеотидов, по существу, не влияющим на функциональные свойства получаемой молекулы нуклеиновой кислоты по сравнению с исходной молекулой, не содержащей изменений. Следовательно, для специалиста в данной области техники будет очевидно, что в объем настоящего изобретения входит более одной примерной определенной последовательности.
m) Клетка-хозяин
Выражение ″клетка-хозяин″, используемое в настоящем описании, обозначает клетку, содержащую выделенную последовательность нуклеиновой кислоты или ее фрагмент, согласно настоящему изобретению. Клетки-хозяева могут представлять собой клетки прокариот (например, Escherichia coli, цианобактерии и Bacillus subtilis) или клетки эукариот (например, клетки грибов, насекомых, растений или млекопитающих).
Примерами клеток грибов, подходящих для применения, являются Saccharomyces spp., Candida spp., Lipomyces spp., Yarrowia spp., Kluyveromyces spp., Hansenula spp., Aspergillus spp., Penicillium spp., Neurospora spp., Trichoderma spp. и Pichia spp. Особо предпочтительными клетками грибов являются клетки Saccharomyces cerevisiae.
Клетки растений могут представлять собой клетки однодольных или двудольных растений. Особо предпочтительными клетками растений являются клетки Glycine max (например, соя), видов рода Brassica, Carthamus tinctorius L. (например, сафлор), Helianthus annuus (например, подсолнечника), Zea mays (например, кукруза), видов рода Gossypium и Linum usitatissimum (например, лен).
n) Идентичность, идентичность последовательностей и процент идентичности последовательностей (% идентичности)
Термины ″идентичность″ или ″идентичность последовательностей″, используемые взаимозаменяемо в настоящем описании в контексте нуклеотидных последовательностей или последовательностей полипептидов, относятся к одинаковым азотистым основаниями или аминокислотным остаткам в составе двух последовательностей, при выравнивании на максимальное соответствие в определенном окне сравнения. Следовательно, идентичность определяется степенью подобия, соответствия или эквивалентности одинаковых цепей (кодирующих или не кодирующих) двух сегментов ДНК или полипептидов.
″Процент идентичности последовательностей″ или ″% идентичности″ вычисляют в ходе сравнения двух оптимально выровненных последовательностей на определенном участке, путем определения числа положений, в которых в обеих последовательностях находится идентичное основание, для получения числа соответствующих положений, деления числа указанных положений на общее число положений в сравниваемом участке и умножения результата на 100. Оптимальное выравнивание последовательностей можно осуществлять с помощью алгоритма Smith & Waterman, Appl. Math. 2:482 (1981), алгоритма Needleman & Wunsch, J. Mol. Biol. 48:443 (1970), способа Pearson & Lipman, Proc. Natl. Acad. Sci. (USA) 85:2444 (1988) и с помощью компьютерных программ, применяющих соответствующие алгоритмы (например, Higgins et al., CABIOS. 5L151-153 (1989)), FASTDB (Intelligenetics), BLAST (National Center for Biomedical Information; Altschul et al., Nucleic Acids Research 25:3389-3402 (1997)), PILEUP (Genetics Computer Group, Madison, Wis.) or GAP, BESTFIT, FASTA and TFASTA (Wisconsin Genetics Software Package Release 7.0, Genetics Computer Group, Madison, Wis.). (См. патент США №5,912,120). Пригодные примеры процента идентичности последовательностей включают, но не ограничиваются указанными, 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%. Указанные величины процента идентичности можно определять с помощью любой из программ, описанных в настоящей заявке.
о) Прямо или опосредованно
Термин ″опосредованно″, используемый в настоящем описании в отношении применения гена и соответствующего ему фермента для получения полиненасыщенных жирных кислот, обозначает превращение первой кислоты во вторую кислоту (то есть, наличие промежуточного продукта пути) с помощью первого фермента (например, LA превращают в EDA, например, с помощью Δ9-элонгазы), после чего вторую кислоту превращают в третью кислоту с помощью второго фермента (например, EDA превращают в DGLA например, с помощью Δ8-десатуразы).
Термин ″прямо″, используемый в настоящем описании в отношении применения гена и соответствующего ему фермента для получения полиненасыщенных жирных кислот, обозначает непосредственное превращение ферментом первой кислоты во вторую кислоту, при этом вторую кислоту впоследствии применяют в составе композиции (например, превращение LA в EDA например, с помощью Δ9-элонгазы или ω3-ETra в ω3-ETA например, с помощью Δ8-десатуразы).
p) Интрон
Термин ″интрон″, используемый в настоящем описании, относится к промежуточной последовательности в составе гена, не кодирующей часть последовательности белка. Следовательно, указанные последовательности транскрибируются в РНК, но после этого исключаются и не транслируются. Термин также применяется для обозначения исключенных последовательностей РНК.
q) Выделенный
Термин ″выделенный (выделенная)″, используемый в настоящем описании, относится к молекуле нуклеиновой кислоты (ДНК или РНК) или белку и его участку, обладающему биологической активностью, извлеченной из естественного окружения или источника, с помощью стандартных методик, известных в данной области техники (например, из бактерии, водоросли, гриба, растений, позвоночных, млекопитающих, и т.д.). Выделенные молекулы нуклеиновых кислот или белки являются, по существу, или главным образом свободными от компонентов, в нормальных условиях сопутствующих или взаимодействующих с молекулами нуклеиновых кислот или белков в их естественном окружении.
r) Фрагмент выделенной нуклеиновой кислоты или последовательность выделенной нуклеиновой кислоты
Выражения ″фрагмент выделенной нуклеиновой кислоты″ или "последовательность выделенной нуклеиновой кислоты", используемые в настоящем описании, относятся к одно- или двухцепочечному полимеру РНК или ДНК, возможно, содержащему синтезированные, не природные или измененные азотистые основания. Фрагмент выделенной нуклеиновой кислоты в форме полимера ДНК может включать один или более сегментов кДНК, геномной ДНК или синтезированной ДНК. (″Фрагмент″ определенного полинуклеотида относится к последовательности полинуклеотида, включающей непрерывную последовательность, длина которой составляет по меньшей мере приблизительно 10 последовательных нуклеотидов по меньшей мере приблизительно 15 последовательных нуклеотидов по меньшей мере приблизительно 20 последовательных нуклеотидов, и т.д., идентичной или комплементарной участку указанной нуклеотидной последовательности.) Для нуклеотидов (обычно находящихся в форме их 5′-монофосфатов) использованы их следующие однобуквенные обозначения: ″A″ для аденилата или дезоксиаденилата (для РНК или ДНК, соответственно), ″C″ для цитидилата или дезоксицитидилата, ″G″ для гуанилата или дезоксигуанилата, ″U″ для уридилата, ″T″ для дезокситимидилата, ″R″ для пуринов (A или G), ″Y″ для пиримидинов (C или T), ″K″ для G или T, ″H″ для A или C или T, ″I″ для инозина и ″N″ для любого нуклеотида.
s) Зрелый и предшественник
Термин ″зрелый″, используемый в настоящем описании в отношении термина ″белок″, относится к полипептиду, прошедшему пост-трансляционные модификации; то есть, к белку, из состава которого удалили все пре- или пропептиды, присутствующие в первичном продукте трансляции.
Термин ″предшественник″, используемый в настоящем описании в отношении термина ″белок″, относится к первичному продукту трансляции мРНК; то есть, в составе которого еще присутствуют пре- и пропептиды. Пре- и пропептиды могут являться сигналами внутриклеточной локализации, но не ограничиваются указанными.
t) 3′ He-кодирующие последовательности
Выражение ″3′-некодирующие последовательности″, используемое в настоящем описании, относится к последовательностям ДНК, расположенным в 5′-3′ направлении от кодирующей последовательности и включающим последовательности распознавания полиаденилирования и другие последовательности, кодирующие сигналы регуляции, способные влиять на процессинг мРНК или на экспрессию гена. Сигнал полиаденилирования часто характеризуется влиянием на внесение путей полиадениловой кислоты в 3′-конец предшественника мРНК. Применение различных 3′-некодирующих последовательностей описано у Ingelbrecht et al., (1989) Plant Cell 1:671-680.
u) He-природный, не встречающийся в природе
Выражения ″не природный″ или ″не встречающийся в природе″, используемые в настоящем описании, относятся к объекту, полученному искусственным путем, не соответствующему обычно встречающемуся в природе.
v) Функционально связанный
Выражение ″функционально связанный″, используемое в настоящем описании, относится к объединению последовательностей нуклеин