Ароиламино- и гетероароиламино-замещенные пиперидины в качестве ингибиторов glyt-1
Иллюстрации
Показать всеИзобретение относится к соединению общей Формулы I
где R1 представляет собой атом водорода, низший алкил, CD3, -(CH2)n-CHO, -(CH2)n-O-низший алкил, -(CH2)n-OH, -(CH2)n-циклоалкил или представляет собой гетероциклоалкил (где гетероциклоалкил представляет собой частично ненасыщенное кольцо, содержащее до 6 атомов углерода, по меньшей мере один из которых заменен на O); R2 представляет собой атом водорода, атом галогена, гидрокси, низший алкил, ди-низший алкил, -OCH2-O-низший алкил или низший алкокси; или пиперидиновое кольцо вместе с R2 образует спиро-кольцо, выбранное из 4-аза-спиро[2,5]окт-6-ила; Ar представляет собой арил или гетероарил (где гетероарил представляет собой циклический ароматический углеводородный радикал, состоящий из одного кольца и содержащий 6 кольцевых атомов, и который содержит по меньшей мере один гетероатом, выбранный из N), которые, возможно, имеют один, два или три заместителя, выбранные из атома галогена, низшего алкила, низшего алкила, имеющего в качестве заместителей атом галогена, низшего алкокси, имеющего в качестве заместителей атом галогена, циклоалкила, низшего алкокси, S-низшего алкила, гетероциклоалкила (где гетероциклоалкил представляет собой частично ненасыщенное кольцо, содержащее до 6 атомов углерода, по меньшей мере один из которых заменен на N), или, возможно, имеют в качестве заместителей фенил, возможно, имеющий в качестве заместителей R', и R' представляет собой атом галогена, CF3, низший алкил, низший алкокси или низший алкокси, имеющий в качестве заместителей атом галогена, или представляет собой гетероарил (где гетероарил представляет собой циклический ароматический углеводородный радикал, состоящий из одного кольца и содержащий 5 кольцевых атомов, и который содержит по меньшей мере один гетероатом, выбранный из N и S); R представляет собой низший алкил, гетероциклоалкил (где гетероциклоалкил представляет собой частично ненасыщенное кольцо, содержащее до 6 атомов углерода, по меньшей мере один из которых заменен на O), арил или гетероарил (где гетероарил представляет собой циклический ароматический углеводородный радикал, состоящий из одного кольца и содержащий 6 кольцевых атомов, и который содержит по меньшей мере один гетероатом, выбранный из N), где арил и гетероарил, возможно, имеют в качестве заместителей один или два R'; n имеет значение 0, 1, 2 или 3; или к фармацевтически приемлемой соли присоединения кислоты, к рацемической смеси или к соответствующему энантиомеру и/или оптическому изомеру данного соединения. Изобретение также относится к фармацевтическим композициям на основе ингибитора обратного захвата глицина соединения Формулы I. Технический результат: получены новые соединения и фармацевтическая композиция на их основе, которые могут найти применение в медицине для лечения неврологических и психоневрологических расстройств. 3 н. и 19 з.п. ф-лы, 1 табл., 128 пр.
Реферат
Настоящее изобретение относится к соединению общей Формулы I
где
R1 представляет собой атом водорода, низший алкил, CD3, -(CH2)n-CHO, -(СН2)n-О-низший алкил, -(СН2)n-ОН, -(СН2)n-циклоалкил или представляет собой гетероциклоалкил;
R2 представляет собой атом водорода, атом галогена, гидрокси, низший алкил, ди-низший алкил, -ОСН2-О-низший алкил или низший алкокси; или пиперидиновое кольцо вместе с R2 образует спиро-кольцо, выбранное из 4-аза-спиро[2,5]окт-6-ила;
Ar представляет собой арил или гетероарил, которые, возможно, имеют один, два или три заместителя, выбранные из атома галогена, низшего алкила, низшего алкила, имеющего в качестве заместителей атом галогена, низшего алкокси, имеющего в качестве заместителей атом галогена, циклоалкила, низшего алкокси, S-низшего алкила, гетероарила, гетероциклоалкила, или, возможно, имеют в качестве заместителей фенил, возможно, имеющий в качестве заместителей R', и
R' представляет собой атом галогена, низший алкил, низший алкокси или низший алкокси, имеющий в качестве заместителей атом галогена, или представляет собой гетероарил;
R представляет собой низший алкил, циклоалкил, гетероциклоалкил, арил или гетероарил, где арил и гетероарил, возможно, имеют в качестве заместителей один или два R';
n имеет значение 0, 1, 2 или 3;
или к фармацевтически приемлемой соли присоединения кислоты, к рацемической смеси или к соответствующему энантиомеру и/или оптическому изомеру данного соединения.
Кроме того, настоящее изобретение относится к фармацевтическим композициям, содержащим соединения Формулы I, и к их применению в лечении неврологических и психоневрологических расстройств.
Неожиданно было найдено, что соединения общей Формулы I являются хорошими ингибиторами глицинового переносчика 1 (GlyT-1) и что они обладают хорошей селективностью в отношении ингибиторов глицинового переносчика 2 (GlyT-2).
Шизофрения представляет собой прогрессирующее и изнуряющее неврологическое заболевание, характеризующееся эпизодическими позитивными симптомами, такими как бред, галлюцинации, расстройства мышления и психоз, и стойкими негативными симптомами, такими как притупленный аффект, нарушение внимания и социальная самоизоляция, и когнитивными нарушениями (Lewis DA and Lieberman JA, Neuron, 2000, 28:325-33). В течение нескольких десятилетий исследования были сконцентрированы на гипотезе "дофаминергической гиперактивности", что привело к терапевтическим вмешательствам, включающим блокаду дофаминергической системы (Vandenberg RJ and Aubrey KR., Exp.Opin. Ther. Targets, 2001, 5(4): 507-518; Nakazato A and Okuyama S, et al., 2000, Exp. Opin. Ther. Patents, 10(1): 75-98). Этот фармакологический подход плохо соответствует лечению негативных и когнитивных симптомов, которые являются лучшими показателями функционального результата (Sharma Т., Br.J.Psychiatry, 1999, 174 (suppl. 28): 44-51).
В середине 1960-х годов была предложена дополнительная модель шизофрении, основанная на психотомиметическом действии, вызываемом блокадой глутаматной системы соединениями, подобными фенциклидину (РСР) и родственным агентам (кетамину), которые являются неконкурентными антагонистами NMDA-рецептора. Интересно, что у здоровых волонтеров РСР-индуцированное психотомиметическое действие включает позитивные и негативные симптомы, а также когнитивную дисфункцию и, таким образом, сильно напоминает шизофрению у пациентов (Javitt DC et al., 1999, Biol. Psychiatry, 45: 668-679 и ссылки в данном описании). Кроме того, трансгенные мыши, экспрессирующие пониженные уровни NMDAR1-субъединицы, проявляют аномалии в поведении, подобные тем, которые наблюдают в фармакологически индуцированных моделях шизофрении, что подтверждает модель, в которой уменьшение активности NMDA-рецептора приводит к шизофреническому поведению (Mohn AR et al., 1999, Cell, 98: 427-236).
Глутаматная нейротрансмиссия, в частности активность NMDA-рецептора, играет ключевую роль в синаптической пластичности, обучении и памяти, а именно NMDA-рецепторы, по-видимому, служат в качестве дифференцированного переключателя для синхронизации порогового значения синаптической пластичности и формирования памяти (Hebb DO, 1949, The organization of behavior, Wiley, NY; Bliss TV и Collingridge GL, 1993, Nature, 361: 31-39). Трансгенные мыши, сверхэкспрессирующие МК2 В-субъединицу NMDA, проявляют повышенную синаптическую пластичность, имеют лучшие способности к обучению и лучшую память (Tang JP et al., 1999, Nature: 401: 63-69).
Таким образом, если патофизиология шизофрении включает дефицит глутамата, можно ожидать, что увеличение глутаматной трансмиссии, в частности посредством активации NMDA-рецептора, будет вызывать как антипсихотические эффекты, так и эффекты повышения когнитивной функции.
Известно, что в ЦНС аминокислота глицин имеет по меньшей мере две важные функции. Связываясь со стрихнин-чувствительными глициновыми рецепторами, она действует как тормозная аминокислота, а действуя в качестве основного коагониста глутамата на функцию рецептора N-метил-D-аспартата (NMDA), эта аминокислота оказывает влияние также на возбудительную активность. В то время как глутамат высвобождается из синаптических окончаний в зависимости от активности, глицин присутствует предположительно на более постоянном уровне и, по-видимому, модулирует/контролирует рецептор для его ответа на глутамат.
Одним из наиболее эффективных путей контроля синаптических концентраций нейромедиатора состоит в том, чтобы воздействовать на его обратный захват в синапсах. Путем удаления нейромедиаторов из внеклеточного пространства переносчики нейромедиаторов могут контролировать их внеклеточное время жизни и тем самым модулировать параметры синаптической передачи (Gainetdinov RR et al, 2002, Trends в Pharm. Sci., 23(8): 367-373).
Глициновые переносчики, которые принадлежат натрий- и хлоридзависимому семейству переносчиков нейромедиаторов, играют важную роль в терминации постсинаптических глицинергических воздействий и поддержании низкой внеклеточной концентрации глицина путем обратного захвата глицина в пресинаптических нервных окончаниях и в близлежащих тонких глиальных отростках.
Из головного мозга млекопитающих были клонированы два разных гена глициновых переносчиков (GlyT-1 и GlyT-2), которые дают начало двум переносчикам примерно с 50% гомологией аминокислотной последовательности. GlyT-1 представлен четырьмя изоформами, являющимися результатом альтернативного сплайсинга и альтернативного использования промоторов (1а, 1b, 1c и 1d). Только две из этих изоформ были найдены в головном мозге грызунов (GlyT-1a и GlyT-1b). GlyT-2 также показывает некоторую степень гетерогенности. В головном мозге грызунов были идентифицированы две изоформы GlyT-2 (2а и 2b). Известно, что GlyT-1 локализуется в ЦНС и в периферических тканях, тогда как GlyT-2 является специфичным для ЦНС.GlyT-1 имеет преимущественно глиальное распределение, и его находят не только в областях, соответствующих стрихнин-чувствительному глициновому рецептору, но также за пределами этих областей, где, как предполагается, он участвует в модуляции функции NMDA-рецептора (Lopez-Corcuera В et al., 2001, Mol. Mem. Biol., 18: 13-20). Соответственно, один из способов повышения активности NMDA-рецептора состоит в увеличении концентрации глицина в локальном микроокружении синаптических NMDA-рецепторов путем ингибирования GlyT-1-переносчика (Bergereon R. et al. 1998, Proc. Natl. Acad. Sci. USA, 95: 15730-15734; Chen L et al., 2003, J. Neurophysiol., 89 (2): 691-703).
Ингибиторы глициновых переносчиков подходят для лечения неврологических и психоневрологических расстройств. Большинство связанных с ними болезненных состояний представляют собой психозы, шизофрению (Armer RE and Miller DJ, 2001, Exp. Opin. Ther. Patents, 11 (4): 563-572), психотические расстройства настроения, такие как большое депрессивное расстройство тяжелого типа, расстройства настроения, связанные с психотическими расстройствами, такими как острый маниакальный синдром или депрессия, связанная с биполярными расстройствами, и расстройства настроения, связанные с шизофренией (Pralong ET et al., 2002, Prog. Neurobiol., 67: 173-202), аутистические расстройства (Carlsson ML, 1998, J. Neural Transm. 105: 525-535), когнитивные расстройства, такие как деменции, включая возрастную деменцию и сенильную деменцию Альцгеймеровского типа, нарушения памяти у млекопитающих, включая человека, синдромы дефицита внимания и боль (Armer RE and Miller DJ, 2001, Exp.Opin. Ther. Patents, 11 (4): 563-572).
Соответственно, увеличение активации NMDA-рецепторов посредством ингибирования GlyT-1 может привести к агентам, которые лечат психоз, шизофрению, деменцию и другие заболевания, при которых нарушены когнитивные процессы, такие как синдромы дефицита внимания или болезнь Альцгеймера.
Предметами настоящего изобретения являются соединения Формулы I per se, применение соединений Формулы I и их фармацевтически приемлемых солей в изготовлении лекарств для лечения заболеваний, на которые можно воздействовать путем активации NMDA-рецепторов посредством ингибирования GlyT-1, получение указанных соединений, лекарства на основе соединения согласно изобретению и их изготовление, а также применение соединений Формулы I в лечении или предупреждении таких заболеваний, как психозы, дисфункция памяти и обучения, шизофрения, деменция и другие заболевания, при которых нарушены когнитивные процессы, такие как синдромы дефицита внимания или болезнь Альцгеймера.
Предпочтительными показаниями для применения соединений по настоящему изобретению является шизофрения, когнитивное нарушение и болезнь Альцгеймера.
Кроме того, изобретение включает все рацемические смеси, все соответствующие энантиомеры и/или оптические изомеры.
В контексте данного описания термин "низший алкил" означает группу с насыщенной нормальной или разветвленной цепью, содержащую от 1 до 7 атомов углерода, например метил, этил, пропил, изопропил, н-бутил, изобутил, 2-бутил, трет-бутил и тому подобное. Предпочтительными алкильными группами являются группы, содержащие от 1 до 4 атомов углерода.
В контексте данного описания термин "низший алкокси" означает низшую алкильную группу, такую, как определено выше, которая связана с атомом О.
Термин "циклоалкил" означает насыщенное или частично ненасыщенное кольцо, содержащее от 3 до 7 атомов углерода, например циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогептил или циклогептенил. Предпочтительными циклоалкильными кольцами являются циклопропил и циклопентил.
Термин "гетероциклоалкил" означает насыщенное или частично ненасыщенное кольцо, содержащее от 3 до 6 атомов углерода, где по меньшей мере один атом углерода заменен гетероатомом, выбранным из N, S или О, например пиперазинил, пирролидинил, оксетанил, морфолинил, пиперидинил или тетрагидропиранил.
Термин "галоген" означает атом хлора, атом йода, атом фтора и атом брома.
Термин "арил" означает одновалентный циклический ароматический углеводородный радикал, состоящий из одного кольца или нескольких конденсированных колец, у которого по меньшей мере одно кольцо является ароматическим по природе, например фенил или нафтил.
Термин "низший алкил, имеющий в качестве заместителей атом галогена", означает низшую алкильную группу, такую, как определено выше, где по меньшей мере один атом водорода заменен атомом галогена, например следующие группы: CF3, CHF2, CH2F, CH2CF3, CH2CHF2, CH2CH2F, CH2CH2CF3, CH2CH2CH2CF3, CH2CH2Cl, CH2CF2CF3, CH2CF2CHF2, CF2CHFCF3, С(СН3)2CF3, СН(СН3)CF3 или CH(CH2F)CH2F.
Термин "низший алкокси, имеющий в качестве заместителей атом галогена", означает алкокси-группу, такую, как определено выше, где по меньшей мере один атом водорода заменен атомом галогена.
Термин "гетероарил" означает циклический ароматический углеводородный радикал, состоящий из одного кольца или нескольких конденсированных колец, содержащий от 5 до 14 кольцевых атомов, предпочтительно содержащий от 5 до 10 кольцевых атомов, у которого по меньшей мере одно кольцо является ароматическим по природе и который содержит по меньшей мере один гетероатом, выбранный из N, О или S, например хиноксалинил, дигидроизохинолинил, пиразинил, пиридазинил, пиразолил, пиридинил, пиридил, пиримидинил, оксадиазолил, триазолил, тетразолил, тиазолил, тиадиазолил, тиенил, фурил, имидазолил, бензофуранил, дигидробензофуранил и бензо[1,3]диоксол. Предпочтительная гетероарильная группа представляет собой пиридинил.
Термин "фармацевтически приемлемые соли присоединения кислот" включает соли с неорганическими и органическими кислотами, такими как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метан-сульфоновая кислота, пара-толуолсульфоновая кислота и тому подобное.
Предпочтительными соединениями Формулы I являются соединения, у которых R1 представляет собой низший алкил и Ar и R представляют собой фенил.
Особенно предпочтительными являются соединения, у которых фенильная группа Ar имеет в качестве заместителей по меньшей мере две группы CF3, например следующие соединения:
рац-2-фтор-N-(1-метил-3-фенил-пиперидин-3-ил)-4,6-бис-трифторметил-бензамид;
рац-2-метокси-N-(1-метил-3-фенил-пиперидин-3-ил)-4,6-бис-трифторметил-бензамид;
рац-2-этил-N-(1-метил-3-фенил-пиперидин-3-ил)-4,6-бис-трифторметил-бензамид;
рац-N-[3-(4-фтор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-4,6-бис-трифторметил-бензамид или
2-метокси-N-((R)-1-метил-3-фенил-пиперидин-3-ил)-4,6-бис-трифторметил-бензамид.
Другим предпочтительными соединениями являются соединения, у которых фенильная группа Ar имеет в качестве заместителей по меньшей мере одну группу CF3, например следующие соединения:
рац-2-этил-N-(1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
рац-2-бром-6-метокси-N-(1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
рац-N-(1,2-диметил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
рац-2-циклопропил-N-(1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
рац-2-метокси-N-(1-метил-3-фенил-пиперидин-3-ил)-6-метилсульфанил-4-трифторметил-бензамид;
рац-N-(1-метил-3-фенил-пиперидин-3-ил)-2-метилсульфанил-4-трифторметил-бензамид;
рац-N-[3-(4-фтор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
рац-N-[3-(4-хлор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
2-метокси-N-((S)-1-метил-3-фенил-пиперидин-3-ил)-6-метилсульфанил-4-трифторметил-бензамид;
2-метокси-N-((R)-1-метил-3-фенил-пиперидин-3-ил)-6-метилсульфанил-4-трифторметил-бензамид;
рац-2-дифторметокси-N-(1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
рац-N-[3-(3-хлор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
рац-2-метокси-N-[3-(4-метокси-фенил)-1-метил-пиперидин-3-ил]-6-метилсульфанил-4-трифторметил-бензамид;
рац-N-(5-фтор-1-метил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
рац-N-(1-изопропил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
2-циклопропил-N-((S)-1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
2-циклопропил-N-((R)-1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
рац-2-циклобутил-N-(1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
рац-N-[3-(2,4-дифтор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
рац-N-[3-(2-фтор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
рац-N-[3-(2,5-дифтор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
рац-2-изопропил-N-(1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
рац-2-метокси-6-метилсульфанил-N-(1-метил-1,4,5,6-тетрагидро-2Н-[3,4']бипиридинил-3-ил)-4-трифторметил-бензамид;
рац-2-этил-N-(1-метил-1,4,5,6-тетрагидро-2Н-[3,4']бипиридинил-3-ил)-4-трифторметил-бензамид;
рац-2-метокси-6-метилсульфанил-N-(1-метил-1,4,5,6-тетрагидро-2Н-[3,3']бипиридинил-3-ил)-4-трифторметил-бензамид;
рац-2-этил-N-(1-метил-1,4,5,6-тетрагидро-2H-[3,3']бипиридинил-3-ил)-4-трифторметил-бензамида гидрохлорид;
2-метокси-N-((3RS,5SR)-5-метокси-1-метил-3-фенил-пиперидин-3-ил)-6-метилсульфанил-4-трифторметил-бензамид;
2-циклопропил-N-((3RS,5SR)-5-метокси-1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
2-этил-N-((3RS,5SR)-5-метокси-1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
рац-2,6-диметокси-N-(1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
2-циклопропил-N-((3RS,5SR)-1,5-диметил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
рац-2-циклопропил-4-трифторметил-N-(1,5,5-триметил-3-фенил-пиперидин-3-ил)-бензамид;
рац-2-метокси-6-метилсульфанил-4-трифторметил-N-(1,6,6-триметил-3-фенил-пиперидин-3-ил)-бензамид;
N-((3RS,5SR)-1,5-диметил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
2-метокси-N-((3RS,5SR)-5-метоксиметокси-1-метил-3-фенил-пиперидин-3-ил)-6-метилсульфанил-4-трифторметил-бензамид;
рац-N-[3-(3-бром-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
рац-N-[3-(2-хлор-4-фтор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
рац-2-метокси-6-метилсульфанил-N-[1-метил-3-(3-трифторметил-фенил)-пиперидин-3-ил]-4-трифторметил-бензамид;
рац-2-метокси-N-[3-(3-метокси-фенил)-1-метил-пиперидин-3-ил]-6-метилсульфанил-4-трифторметил-бензамид;
рац-N-[3-(3-фтор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
рац-N-[3-(3-хлор-4-фтор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
рац-N-[3-(3,4-дифтор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
рац-2-метокси-6-метилсульфанил-N-(1-метил-3-мета-толил-пиперидин-3-ил)-4-трифторметил-бензамид;
рац-N-[3-(4-фтор-3-метил-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
рац-N-[3-(3,5-дифтор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
рац-2-метокси-6-метилсульфанил-4-трифторметил-N-(1,5,5-триметил-3-фенил-пиперидин-3-ил)-бензамид;
рац-2-этил-3-метил-N-(1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
рац-N-(1-трет-бутил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
рац-2-метокси-N-(4-метил-6-фенил-4-аза-спиро[2,5]окт-6-ил)-6-метилсульфанил-4-трифторметил-бензамид;
N-((3R,5S) или (3S,5R)-5-гидрокси-1-метил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
2-метокси-N-((3R,5S) или (3S,5R)-5-метокси-1-метил-3-фенил-пиперидин-3-ил)-6-метилсульфанил-4-трифторметил-бензамид;
2-метокси-N-((3S,5R) или (3R,5S)-5-метокси-1-метил-3-фенил-пиперидин-3-ил)-6-метилсульфанил-4-трифторметил-бензамид;
N-[(R или S)-3-(2-фтор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
N-[(R или S)-3-(2,5-дифтор-фенил)-1-метил-пиперидин-3-ил]-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
2-этил-N-((R или S)-1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
2-метокси-6-метилсульфанил-4-трифторметил-N-((S или R)-1,5,5-триметил-3-фенил-пиперидин-3-ил)-бензамид;
N-((3S,6S) или (3R,6R)-1,6-диметил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
N-((3R,6R)или (3S,6S)-1,6-диметил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
N-((3R,6S) или (3S,6R)-1,6-диметил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
N-((3S,5R) или (3R,5S)-1,5-диметил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид;
N-((3R,5S) или (3S,5R)-1,5-диметил-3-фенил-пиперидин-3-ил)-2-этил-4-трифторметил-бензамид;
2-этил-N-((3R,5S) или (3S,5R)-5-метокси-1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид;
2-циклопропил-N-((3R,5S) или (3S,5R)-5-метокси-1-метил-3-фенил-пиперидин-3-
ил)-4-трифторметил-бензамид или
2,6-диметокси-N-(R или (S)-1-метил-3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид.
Предпочтительными соединениями Формулы I являются соединения, у которых R1 представляет собой циклоалкил или гетероциклоалкил и Ar и R представляют собой фенил, например
рац-N-(1-циклопентил-3-фенил-пиперидин-3-ил)-2-метокси-4,6-бис-трифторметил-бензамид,
рац-N-(1-циклопропилметил-3-фенил-пиперидин-3-ил)-2-метокси-4,6-бис-трифторметил-бензамид или
рац-2-метокси-N-[3-фенил-1-(тетрагидро-пиран-4-ил)-пиперидин-3-ил]-4,6-бис-трифторметил-бензамид.
Предпочтительными соединениями Формулы I являются соединения, у которых R1 представляет собой низший алкил, Ar представляет собой фенил и R представляет собой гетероарил, например
рац-N-(5-фтор-1'-метил-1',4',5',6'-тетрагидро-2'Н-[2,3']бипиридинил-3'-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид,
рац-2-метокси-6-метилсульфанил-N-(1-метил-1,4,5,6-тетрагидро-2Н-[3,4']бипиридинил-3-ил)-4-трифторметил-бензамид,
рац-2-этил-N-(1-метил-1,4,5,6-тетрагидро-2H-[3,4']бипиридинил-3-ил)-4-трифторметил-бензамида гидрохлорид,
рац-2-метокси-6-метилсульфанил-N-(1-метил-1,4,5,6-тетрагидро-2Н-[3,3']бипиридинил-3-ил)-4-трифторметил-бензамид или
рац-2-этил-N-(1-метил-1,4,5,6-тетрагидро-2H-[3,3']бипиридинил-3-ил)-4-трифторметил-бензамид.
Предпочтительными соединениями Формулы I являются соединения, у которых R1 представляет собой атом водорода и Ar и R представляют собой фенил, например
рац-2-циклопропил-N-(3-фенил-пиперидин-3-ил)-4-трифторметил-бензамид.
Предпочтительными соединениями Формулы I являются соединения, у которых R2 представляет собой гидрокси, например
рац-N-(5-гидрокси-1-метил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид или
N-((3R,5S) или (3S,5R)-5-гидрокси-1 -метил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид.
Предпочтительными соединениями Формулы I являются соединения, у которых R2 представляет собой атом галогена, например
рац-N-(5-фтор-1-метил-3-фенил-пиперидин-3-ил)-2-метокси-6-метилсульфанил-4-трифторметил-бензамид.
Предпочтительными соединениями Формулы I являются соединения, у которых R1 представляет собой CD3, например следующие соединения:
[2Н-метил]-2-метокси-N-(R) или (S)-1-метил-3-фенил-пиперидин-3-ил)-6-метилсульфанил-4-трифторметил-бензамида гидрохлорид.
Соединения по настоящему изобретению Формулы I и их фармацевтически приемлемые соли могут быть получены с помощью методик, известных в данной области техники, например с помощью методик, описанных ниже, которые включают а) взаимодействие соединения Формулы
с соединением Формулы
в присутствии активирующего агента, такого как HATU (орто-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат) или тионилхлорид, с получением соединения Формулы
,
где заместители являются такими, как определено выше, или b) взаимодействие соединения Формулы
,
с соединением Формулы
R1X
в присутствии основания, такого как N-этилдиизопропиламин, с получением соединения Формулы
,
где Х представляет собой атом галогена и другие заместители являются такими, как определено выше, или
с) взаимодействие соединения Формулы
с карбонильным реагентом Формулы R4-C(O)-R5
в присутствии восстанавливающего агента, такого как цианоборгидрид натрия, с получением соединения Формулы
,
где заместители являются такими, как определено выше, R4 и R5 представляют собой низший алкил или вместе с атомом углерода, к которому они присоединены, образуют циклоалкильную или гетероциклоалкильную группу, и при желании превращение полученных соединений в фармацевтически приемлемые соли присоединения кислот.
Соединения Формулы I могут быть получены с использованием одной из методик a), b) или c) в соответствии с приведенными ниже Схемами 1-12. Исходные вещества либо имеются в продаже, либо могут быть получены в соответствии с известными методиками.
Схема 1
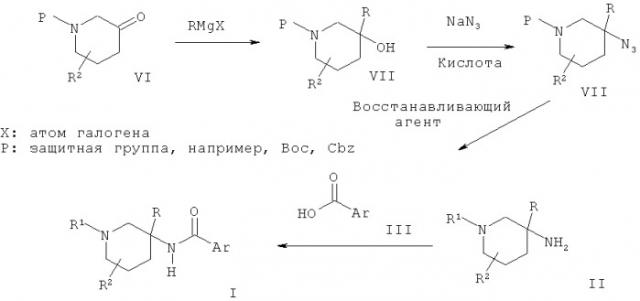
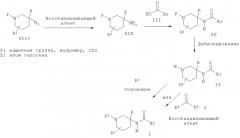
Соединения общей Формулы I могут быть получены в результате взаимодействия пиперидиновых производных Формулы II с кислотой Формулы III в присутствии активирующего агента, такого как HATU (орто-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат) или тионилхлорид. Пиперидиновые производные Формулы II могут быть получены в результате взаимодействия пиперидонового производного VI с металлоорганическим реагентом, таким как реагент Гриньяра, последующей обработки полученного спирта VII азидом натрия в присутствии кислоты, такой как ТФУ, и превращения полученного азидного производного VIII в соединение II в присутствии восстанавливающего агента, такого как алюмогидрид лития.
Схема 2
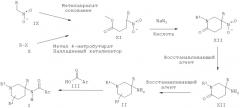
Альтернативно пиперидиновые производные Формулы II, где R2 представляет собой атом водорода, могут быть получены из нитро-пиперидоновых производных XII в результате восстановления нитро-группы восстанавливающим агентом, например никелем Ренея в атмосфере водорода или цинком в присутствии кислоты, такой как соляная кислота, и последующего восстановления полученных амино-пиперидоновых производных XIII до соединения II, которое может быть выполнено в присутствии восстанавливающего агента, такого как алюмогидрид лития. Нитро-пиперидоновые производные XII могут быть получены из нитро-производных XI с использованием внутримолекулярной реакции Манниха, выполняемой в присутствии амина R1NH2 и альдегида, такого как формальдегид.
Соединения XI могут быть получены путем присоединения нитро-метил-арильных производных IX к метилакрилату в присутствии основания, такого как Amberlyst A21 или Triton В, с использованием реакции Михаэля или в результате взаимодействия арилгалогенидных производных Х с метил 4-нитробутиратом в присутствии палладиевого катализатора, такого как Pd2dba3, лиганда, такого как 2-(ди-трет-бутилфосфино)-2'-метилбифенил, и основания, такого как карбонат цезия, в соответствии с методикой, описанной Buchwald et al. в J. Org. Chem. 2002, 106.
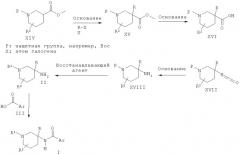
Схема 3
Альтернативно пиперидиновые производные Формулы II, где R представляет собой алкильную группу, могут быть получены из кислоты XVI с использованием перегруппировки Курциуса в присутствии такого реагента, как DPPA (дифенилфосфоразидат), и последующего гидролиза полученного изоцианата XVII в присутствии основания, такого как гидроксид натрия, до защищенного пиперидина XVIII, который восстанавливают до соединения II в присутствии восстанавливающего агента, такого как алюмогидрид лития. Кислота XVI может быть получена из эфира XIV в результате обработки основанием, таким как диизопропиламид лития, и алкилирующим агентом R-X и последующего
омыления полученного промежуточного соединения, эфира XV, до соединения XVI в присутствии основания, такого как гидроксид лития.
Схема 4
Заместители являются такими, как описано выше, R4 и R5 представляют собой низший алкил или вместе с атомом углерода, к которому они присоединены, образуют циклоалкильную или гетероциклоалкильную группу.
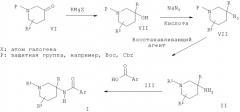
Альтернативно соединения общей Формулы I могут быть получены в результате взаимодействия пиперидинового производного IV либо с алкилирующим агентом R1X в присутствии основания, такого как N-этилдиизопропиламин, либо с карбонильным реагентом V в присутствии восстанавливающего агента, такого как цианоборгидрид натрия. Пиперидиновое производное IV может быть получено в результате восстановления азида VIII таким реагентом, как боргидрид натрия, с получением аминного производного XIX, которое затем может быть подвергнуто взаимодействию с кислотой III в присутствии активирующего агента, такого как HATU или тионилхлорид, и последующего превращения полученного амидного производного XX в соединение IV путем удаления N-защитной группы.
Схема 5
Альтернативно пиперидиновые производные Формулы II, где R2 представляет собой атом фтора, могут быть получены из фторированного нитро-пиперидона XXI путем двух последовательных восстановлений, сначала с использованием такого агента, как никель Ренея, и затем с использованием такого агента, как алюмогидрид лития. Соединение XXI может быть получено в результате взаимодействия нитро-пиперидина XII с основанием, таким как диизопропиламин лития, и последующей обработки электрофильным фторирующим агентом, таким как N-фторбензолсульфонимид.
Схема 6
Альтернативно пиперидиновые производные Формулы II, где R2 представляет собой алкил, могут быть получены из алкилированного нитро-пиперидона XXIII путем двух последовательных восстановлений, сначала с использованием такого агента, как никель Ренея, и затем с использованием такого агента, как алюмогидрид лития. Соединение XXIII может быть получено в результате взаимодействия нитро-пиперидина XII с основанием, таким как диизопропиламин лития, и последующей обработки электрофильным алкилирующим агентом, таким как R2X, где Х представляет собой атом галогена.
Схема 7
Альтернативно пиперидиновые производные Формулы II, которые содержат две геминальных алкильных группы R2, могут быть получены из бис-алкилированного нитро-пиперидона XXV путем двух последовательных восстановлений, сначала с использованием такого агента, как никель Ренея, и затем с использованием такого агента, как алюмогидрид лития. Соединение XXV может быть получено в результате взаимодействия моно-алкилированного нитро-пиперидина XXIII с основанием, таким как диизопропиламин лития, в присутствии TMEDA (тетраметилэтилендиамина) и последующей обработки электрофильным алкилирующим агентом, таким как R2X, где Х представляет собой атом галогена.
Схема 8
Альтернативно пиперидиновые производные Формулы II, где R2 представляет собой гидроксил (R6=Н) или алкокси-группу (R6=Алкил), могут быть получены из гидрокси нитро-пиперидона XXVII или алкокси нитро-пиперидона XXVIII путем двух последовательных восстановлений, сначала с использованием такого агента, как никель Ренея, и затем с использованием такого агента, как алюмогидрид лития. Соединение XXVIII может быть получено из соединения XXVII в результате взаимодействия с основанием, таким как гидрид натрия, и электрофильным алкилирующим агентом, таким как R6X, где Х представляет собой атом галогена. Соединение XXVII может быть получено в результате взаимодействия нитро-пиперидина XII с основанием, таким как диизопропиламин лития, и последующей обработки электрофильным гидроксилирующим агентом, таким как (оксодиперокси(пиридин) (1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидон)молибден(IV)) или бис(триметилсилил)пероксид.
Схема 9
Альтернативно пиперидиновые производные Формулы II, где R представляет собой гетероарильную группу, такую как пиридин, могут быть получены из нитро-пиперидинтиона XXX путем двух последовательных восстановлений, сначала с использованием такого агента, как боргидрид натрия, и затем с использованием такого агента, как никель Ренея. Соединение XXX может быть получено из нитро-пиперидинона XXII в результате взаимодействия с реагентом Лавессона.
Схема 10
Альтернативно пиперидиновые производные Формулы II, которые содержат две геминальные метильные группы, могут быть получены из Boc-защищенного амино-пиперидинона XXXII в результате взаимодействия с бромидом метилмагния и хлоридом циркония (IV) и последующего удаления Boc-группы в кислых условиях. Соединение XXXII может быть получено в результате взаимодействия амино-пиперидона XIII с ди-трет-бутил дикарбонатом.
Схема 11
Альтернативно пиперидиновые производные Формулы II, которые содержат циклопропил, могут быть получены из Boc-защищенного амино-пиперидинона XXXII в результате взаимодействия с бромидом этилмагния и изопропоксидом титана и последующего удаления Boc-группы в кислых условиях.
Схема 12
Альтернативно пиперидиновые производные Формулы II, где R2 представляет собой алкильную группу, могут быть получены из нитро-производного XXXIX с использованием внутримолекулярной реакции Манниха, выполняемой в присутствии альдегида, такого как формальдегид, и последующей обработки полученного нитро-пиперидина ХХХХ восстанавливающим агентом, таким как никель Ренея. Соединение XXXIX может быть получено путем деблокирования Boc-защищенного нитро-производного XXXVIII, которое может быть получено в результате взаимодействия нитро-производного XXXXI с галогенированным соединением XXXVII в присутствии основания, такого как н-бутиллитий. Соединение XXXVII может быть получено в результате введения защитной группы в аминоспирт XXXV и последующего галогенирования.
Рацемические смеси хиральных соединений I могут быть разделены с использованием хиральной ЖХВД.
Соли присоединения кислот основных соединений Формулы I могут быть превращены в соответствующее свободные основания путем обработки по меньшей мере стехиометрическим эквивалентом подходящего основания, такого как гидроксид натрия или калия, карбонат калия, бикарбонат натрия, аммиак и тому подобное.
Экспериментальная часть
Аббревиатуры
HATU O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат
ДМФА Диметилформамид
ДМСО Диметилсульфоксид
ТГФ Тетрагидрофуран
TMEDA Тетраметилэтилендиамин
Получение промежуточных соединений
Пример А.1
Получение рац-1-Метил-3-фенил-пиперидин-3-иламина
а) Стадия 1: рац-3-Гидрокси-3-фенил-пиперидин-1-карбоновой кислоты бензиловый эфир
К раствору 9 мл (9 ммоль) бромида фенилмагния (1 М раствор в ТГФ) в ТГФ (13 мл) добавляли в течение 15 мин раствор 1,5 г (6,00 ммоль) 3-оксо-пиперидин-1-карбоновой кислоты бензилового эфира (имеется в продаже) в ТГФ (5 мл) при комнатной температуре. Данную смесь перемешивали в течение 30 мин и затем гасили 20% раствором хлорида аммония (4 мл), используя охлаждение в ледяной бане. Органический слой декантировали и остаток один раз экстрагировали этилацетатом. Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученное неочищенное масло очищали на силикагеле (элюент: гептан/этилацетат 0-50%) с выходом указанного в заголовке соединения (0,55 г, 30%) в виде белого твердого вещества. Масс-спектр (m/z): 312,0 (M+H+).
b) Стадия 2: рац-3-Азидо-3-Фенил-пиперидин-1-карбоновой кислоты бензиловый эфир
1,0 г (3,212 ммоль) 3-гидрокси-3-фенил-пиперидин-1-карбоновой кислоты бензилового эфира растворяли в холодной смеси (10°С) трифторуксусной кислоты (12,3 мл) и воды (2,0 мл). Данный раствор охлаждали до 0°С и добавляли порциями азид натрия (1,46 г, 22,48 ммоль). Температура поднималась до 10°С. Ледяную баню удаляли и смесь перемешивали в течение 3 ч при комнатной температуре. Затем смесь охлаждали в ледяной бане и подщелачивали, добавляя по каплям 25% раствор гидроксида аммония (13,0 мл), поддерживая температуру ниже 20°С. Смесь разбавляли водой (45 мл) и 3 раза экстрагировали дихлорметаном. Объединенные экстракты один раз промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом с получением указанного в заголовке соединения в виде светло-желтого масла, которое использовали на следующей стадии без дополнительной очистки.
с) Стадия 3: рац-1-Метил-3-фенил-пиперидин-3-иламин
К суспензии 126 мг (3,15 ммоль) LiAIH4 в ТГФ (2,7 мл) при температуре ниже 10°С добавляли по каплям раствор 530 мг (1,576 ммоль) рац-3-азидо-3-фенил-пиперидин-1-карбоновой кислоты бензилового эфира в ТГФ (5,3 мл). Ледяную баню удаляли. Темп