Способ получения n-(1,5,3-дитиазонан-3-ил)амидов
Иллюстрации
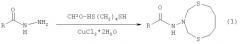
Показать всеИзобретение относится к области органической химии, конкретно к способу получения N-(1,5,3-дитиазонан-3-ил)амидов общей формулы (1):
где R = p-C5H4N (a), (СН3)3СО (b), m-C5H4N (c),
который заключается в том, что гидразиды общей формулы RC(O)NHNH2 (R = указанные выше) подвергаются взаимодействию с 1,4-бутандитиолом, предварительно смешанным при 20°C с водным раствором формальдегида, в присутствии катализатора кристаллогидрата хлорида меди CuCl2·2H2O при мольном соотношении 1,4-бутандитиол : CH2O : RC(O)NHNH2 : CuCl2·2H2O = 10:20:10:(0.3-0.7) при 75-85°C и атмосферном давлении в течение 44-52 ч. Технический результат: разработан способ получения новых соединений, которые могут найти применение в качестве биологически активных соединений, селективных сорбентов и экстрагентов благородных и драгоценных металлов. 1 табл., 1 пр.
Реферат
Предлагаемое изобретение относится к области органической химии, конкретно к способу получения N-(1,5,3-дитиазонан-3-ил)амидов общей формулы (1):
где R=p-C5H4N (a), (СН3)3СО (b), m-C5H4N (c)
Циклические азот- и серусодержащие соединения перспективны в качестве биологически активных соединений [Z.Brzozowski, F.Saczewski, М.Gdaniec. Bioorganic & Medicinal Chemistry, 2003, №11, p 3673; R.B.Pawar, V.V.Mulwad. ХГС, 2004, №2, c.257], селективных сорбентов и экстрагентов благородных и драгоценных металлов [Ю.И.Муринов, В.Н.Майстренко, Н.Г.Афзалетдинова. Экстракция металлов S,N-органическими соединениями. М: Наука, 1993, 192 с.].
Известен способ [Arya V.P., Shenoy Mrs.J. Synthesis of new heterocycles: Part XV. Synthesis of novel cyclic and acyclic sulfamides. Indian J. Chem., 1976, 14B(10), p.766] получения 1,2,9-тиадиазонин-1,1-диоксида (2) взаимодействием сульфамида с 1,6-пентандиамином с выходом 55%.
Известным способом не могут быть получены N-(1,5,3-дитиазонан -3-ил)амиды общей формулы (1).
Известен способ [Regainia Z. et al. General synthesis of и-membered cyclic sulfamides. Tetrahedron, 2003, 59(32), p.6051] получения 1,2,9-тиадиазонана (3) внутримолекулярной циклизацией галогенсодержащего сульфамида с выходом 60%.
Известный способ не позволяет получать N-(1,5,3-дитиазонан-3-ил)-амиды общей формулы (1).
Таким образом, в литературе отсутствуют сведения о селективном получении N-(1,5,3-дитиазонан-3-ил)амидов формулы (1).
Предлагается новый способ селективного получения N-(1,5,3-дитиазонан-3-ил)амидов общей формулы (1).
Сущность способа заключается во взаимодействии 1,4-бутандитиола [HS(CH2)4SH] с формальдегидом (CH2O, 37%-ный водный раствор) при 20°C с последующим добавлением гидразида общей формулы RC(О)NHNH2, где R=p-C6H4N, (CH3)3CO, m-C6H4N (изоникотингидразид, трет-бутилгидразинкарбоксилат, никотингидразид) в присутствии катализатора CuCl2·2H2O, взятых в мольном соотношении RC(O)NHNH2:1,4-бутандитиол:формальдегид:CuCl2·2H2O=10:10:20:(0.3-0.7), предпочтительно 10:10:20:0.5, при температуре 75-85°C и атмосферном давлении в смеси хлороформ-этиловый спирт (1:1 объемные) в качестве растворителя в течение 44-52 ч. Выход N-(1,5,3-дитиазонан-3-ил)амидов (1) составляет 15-25%. Реакция проходит по схеме:
R=p-C5H4N (a), (СН3)3СО (b), m-C5H4N (c)
N-(1,5,3-дитиазонан-3-ил)амиды (1) образуются только лишь с участием гидразидов общей формулы RC(O)NHNH2 (изоникотингидразид, трет-бутилгидразинкарбоксилат, никотингидразид), формальдегида и 1,4-бутандитиола. В присутствии других гидразидов (например, алкилгидразиды) целевые продукты (1) не образуются. В присутствии других α,ω-дитиолов (например, 1,5-бутандитиол, 1,6-гександитиол) или других альдегидов (например, уксусный, масляный) целевые продукты (1) не образуются. Изменение стехиометрического соотношения исходных реагентов в сторону увеличения или уменьшения содержания формальдегида или 1,4-бутандитиола по отношению к исходному гидразиду приводит к снижению селективности реакции и выхода целевого продукта (1).
Проведение указанной реакции в присутствии катализатора CuCl2·2H2O больше 7 мол. % по отношению к 1,4-бутандитиолу не приводит к существенному увеличению выхода целевого продукта (1). Использование катализатора CuCl2·2H2O 3 мол. % снижает выход (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе.
Реакции проводили при температуре 75-85°C. При температуре выше 85°C (например, 100°C) снижается селективность реакции и увеличиваются энергозатраты, а при температуре ниже 75°C (например, 40°C) снижается скорость реакции. В качестве растворителя использовали смесь растворителей хлороформ-этиловый спирт, т.к. в ней хорошо растворимы исходные реагенты и целевые продукты.
Существенные отличия предлагаемого способа
В предлагаемом способе в реакцию с гидразидами вовлекаются водный раствор формальдегида и 1,4-бутандитиол в присутствии каталитических количеств CuCl2·2H2O. Реакция идет с селективным образованием N-(1,5,3-дитиазонан-3-ил)амидов общей формулы (1).
В известном способе 1,2,9-тиадиазонаны общей формулы (3) получают внутримолекулярной циклизацией галогенсодержащего сульфамида.
Предлагаемый способ обладает следующими преимуществами:
Способ позволяет получать с высокой селективностью N-(1,5,3-дитиа-зонан-3-ил)амиды общей формулы (1).
Способ поясняется примерами:
Пример 1. В стеклянный реактор, установленный на магнитной мешалке, помещают 10 ммоль 1,4-бутандитиола, 20 ммоль формальдегида и перемешивают в течение 30 мин при комнатной температуре (~20°C). Затем в реактор добавляют 10 ммоль изоникотингидразида и 0.5 ммоль катализатора CuCl2·2H2O в 10 мл смеси растворителей хлороформ-этиловый спирт (1:1 объемные). Реакционную смесь перемешивают 48 ч при температуре 80°C. Из реакционной массы выделяют N-(1,5,3-дитиазонан-3-ил)изоникотинамид (1a) с выходом 21%.
Другие примеры, подтверждающие способ, приведены в таблице.
| № п/п | Исходный гидразид RC(O)NHNH2 | Соотношение HS(CH2)4SH:RC(O)NHNH2:CH2O:CuCl2·2H2O, ммоль | Время реакции, час | Темпера-тура, °C | Выход (1), % | |
| 1 | изоникотингидразид | 10 | 10:20:0.5 | 48 | 80 | 21 |
| 2 | -//- | 10 | 10:20:0.7 | 48 | 80 | 25 |
| 3 | -//- | 10 | 10:20:0.3 | 48 | 80 | 17 |
| 4 | -//- | 10 | 10:20:0.5 | 52 | 80 | 22 |
| 5 | -//- | 10 | 10:20:0.5 | 44 | 80 | 19 |
| 6 | -//- | 10 | 10:20:0.5 | 48 | 85 | 23 |
| 7 | -//- | 10 | 10:20:0.5 | 48 | 75 | 18 |
| 8 | трет-бутилгидразинкарбоксилат | 10 | 10:20:0.5 | 48 | 80 | 15 |
| 9 | никотингидразид | 10:10:20:0.5 | 48 | 80 | 20 |
Все опыты проводили в смеси растворителей этиловый спирт-хлороформ (1:1 объемные).
Спектральные характеристики N-(1,5,3-дитиазонан-3-ил)изоникотинамид (Ia)
Спектр ЯМР 1H (δ, м.д., CDCl3): 1.72 (c, 4H, CH2(7,8)); 2.70 (с, 4Н, СН2(6,9)); 4.27 (с, 4Н, H2C(2,4)); 7.64 (уш.с, 2Н, HC(13,17)); 8.74 (уш.с, 2Н, НС(14,16)).
Спектр ЯМР 13C (δ, м.д., CDCl3): 28.60 (C(7,8)); 31.38 (C(6,9)); 58.46 (C(2,4)); 121.12 (C(13,17)); 140.53 (C(12)); 150.64 (C(14,16)); 163.00 (C(11)). Масс-спектр, m/z (Iотн., %): 280.509 (100) [М-H]+. C12H17N3S2O.
N-(1,5,3-дитиазонан-3-ил)трет-бутилкарбамат (Ib)
Спектр ЯМР 1H (δ, м.д., CDCl3): 1.42 (с, 9Н, CH3(14,15,16)); 1.66(с, 4Н, СН2(7,8)),2.63 (уш.с, 4Н, f 6 СН2(6,9)), 4.05 (с, 4Н, Н2С(2,4)); 6.01 (с, 1H, NH(10)). Спектр ЯМР 13C (δ, м.д., CDCl3): 28.32 (C(14,15,16)); 28.76 (C(6,9)); 32.85 (C(7,8)); 58.76 (C(2,4)); 80.46 (C(13)); 154.54 (с, C(11)). Масс-спектр, m/z (Iотн., %): 278.343 [M]+(100). C11H22N2S2O2.
N-(1,5,3-дитиазонан-3-ил)никотинамид (Ic)
Спектр ЯМР 1H (δ, м.д., CDCl3): 1.75 (с, 4Н, H2C(7,8)); 2.74 (с, 4Н, Н2С(6,9)); 4.29 (с, 4H, Н2С(2,4)); 7.44, 8.13, 8.79 и 9.01 (уш.с, 4Н, Ar); 7.62 (с, 1Н, NH(10)). Спектр ЯМР, 13C (CDCl3, δ, м.д.): 28.40 (C(7,8)); 32.00 (C(6,9)); 59.00 (C(2,4)); 124.50 (C(16)); 134.00 (C(12)); 136.50 (C(15)); 148.00 (C(13)); 153.50 (C(17)); 165.48 (C (11)). Масс-спектр, m/z (Iотн., %): 284.340 (100)[M+H]+.C12H17N3S2O.
Способ получения N-(1,5,3-дитиазонан-3-ил)амидов общей формулы (1): где R = p-C5H4N (a), (СН3)3СО (b), m-C5H4N (c),отличающийся тем, что гидразиды общей формулы RC(O)NHNH2 (R = указанные выше) подвергаются взаимодействию с 1,4-бутандитиолом, предварительно смешанным при 20°C с водным раствором формальдегида, в присутствии катализатора кристаллогидрата хлорида меди CuCl2·2H2O при мольном соотношении 1,4-бутандитиол : CH2O : RC(O)NHNH2 : CuCl2·2H2O = 10:20:10:(0.3-0.7) при 75-85°C и атмосферном давлении в течение 44-52 ч.