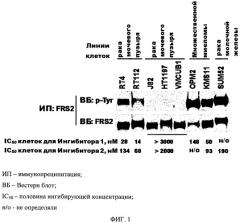
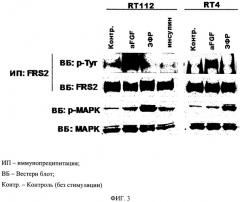
Способ индентификации клеток, проявляющих восприимчивость к модуляции передачи сигнала, опосредованной рецептором фактора роста фибробластов или его вариантом
Иллюстрации
Показать всеИзобретение относится к области биохимии. Способ идентификации клеток, которые показывают восприимчивость к ингибированию передачи сигнала, в которую вовлечены рецептор фактора роста фибробластов (FGF-R) или его вариант, включающий определение статуса фосфорилирования субстрата 2 рецептора FGF-R (FRS-2), его варианта или его фрагмента, содержащего тирозин, в биологическом образце, в качестве биомаркера такой чувствительности к ингибированию, где в отношении клеток, которые показывают фосфорилирование тирозина FRS-2, можно ожидать, что они покажут восприимчивость к ингибированию передачи сигнала с участием FGF-R. Способ идентификации фосфорилирования в FRS-2, его варианта или его фрагмента, содержащих тирозин, в качестве биомаркера для клеток, тканей или органов. Применение идентификации фосфорилирования в FRS-2, его варианта или его фрагмента, содержащего тирозин, в качестве биомаркера для клеток, тканей или органов, которые показывают гиперактивную передачу сигнала с участием FGF-R. Применение реагента биоспецифического распознавания FGF-R. Способ идентификации клеток, пролиферация которых требует активации рецептора FGF-R. Использование заявленного изобретения позволяет эффективно идентифицировать клетки, которые показывают восприимчивость к ингибированию передачи сигнала, в которую вовлечены рецептор FGF-R, и клеток, пролиферация которых требует активации рецептора FGF, а также осуществляют идентификацию фосфорилирования идентификации фосфорилирования в FRS-2. 5 н. и 5 з.п.ф-лы, 2 табл., 3 ил., 1 пр.
Реферат
Настоящее изобретение относится к способу определения in vivo активации или ингибирования рецептора FGF или его варианта и/или к способу идентификации клеток, таких как опухолевые клетки (например, опухолевые образцы), проявляющих чувствительность к модуляции (например, к ингибированию или активации) передачи сигналов, в которых участвует рецептор фактора роста фибробластов (FGF-R) или его вариант, к применению агентов биоспецифического распознавания для указанной цели, к содержащим их наборам, к реагентам для их обнаружения, используемым для выявления клеток, которые восприимчивы к модуляции, в особенности к ингибированию, передачи сигнала, в котором участвует рецептор фактора роста фибробластов (FGF-R) или его вариант, а также к применению вышеперечисленного для производства таких наборов, а также к другим указанным применениям, способам и вариантам осуществления изобретения.
Факторы роста фибробластов (FGF) представляют собой семейство, заключающее свыше двадцати структурно соотносящихся полипептидов, экспрессия которых обнаружена и рост которых регулируется в самых различных тканях или органах. Факторы роста фибробластов стимулируют пролиферацию, миграцию клеток и дифференцировку клеток и играют важную роль в формировании скелетной структуры и развитии конечностей, в заживлении ран, восстановлении тканей, гомепоэзе, ангиогенезе и онкогенезе (см. Ornitz, Novartis Found Svmp 232, 2001, cc.63-76; обсуждение cc.76-80, 272-282).
Биологическое действие фактора роста фибробластов опосредовано конкретными рецепторами клеточной поверхности, тирозинкиназными рецепторами из семейства протеинкиназ. Эти белки состоят из внеклеточного лиганд-связывающего домена, одного трансмембранного домена и внутриклеточного тирозинкиназного домена, который подвергается фосфорилированию при связывании FGF. На сегодняшний день известны четыре рецептора FGF: рецептор FGF-R1 (также называемый Flg, fms-подобный ген, flt-2, bFGF-R, N-bFGF-R или Cekl), рецептор FGF-R2 (также называемый -ВЕК-Bacterial Expressed Kinase-, KGFR, Ksam, Ksami и Cek3), рецептор FGF-R3 (также называемый Cek2) и рецептор FGF-R4. Все зрелые рецепторы FGF-R имеют общую структуру, состоящую из амино-концевого сигнального пептида, трех внеклеточных иммуноглобулин-подобных доменов (Ig домен I, Ig домен II, Ig домен III), с кислотной областью между Ig доменами ("кислотная ячейка" {англ. - "acidic box") домен), трансмембранного домена и внутриклеточных киназных доменов (Ullrich and Schlessinger, Cell, 61, 1990, с.203; Johnson and Williams, Adv. Cancer Res. 60, 1992, cc.1-41). Различные изоформы рецептора FGF имеют разную аффинность связывания с различными лигандами FGF, таким образом, отмечается повышение избирательности FGF8 (фактора роста, индуцируемого андрогеном) и FGF9 (глиального фактора активации) по отношению к рецептору FGF-R3 (Chellaiah et al., J Biol. Chem, 269, 1994, с.11620).
Последние исследования показали, что растущее число скелетных аномалий, в том числе ахондроплазии, наиболее распространенной формы человеческого дварфизма, происходит в результате мутации в рецепторах FGF. Специфичные точечные мутации, происходящие в различных доменах рецепторов FGF-R1, FGF-R2 и FGF-R3, связаны со скелетными дисплазиями человека аутосомно-доминантого типа наследования, классифицированными как синдромальный краниосиностоз и дварфизм. (Coumoul and Deng, Birth Defects Research 69, 2003, cc.286-304). Скелетные дисплазии, связанные с мутацией рецептора FGF-R3, включают гипохондроплазию, тяжелую ахондроплазию с задержкой развития и акантокератодермией (от англ. - SADDAN - severe achondroplasia with developmental delay and acanthosis nigricans) и танатоформную дисплазию (ТД) (Webster et al., Trends Genetics 13 (5), 1997, cc.178-182; Tavormina et al., Am. J. Hum. Genet., 64, 1999, cc.722-731). Мутации рецептора FGF-R3 также были описаны в двух фенотипах краниосиностоза: краниосиностоз венечного шва (синдром Муенке (Muenke)) (Bellus et al., Nature Genetics, 14, 1996, cc.174-176; Muenke et al., Am. J. Hum. Genet., 60, 1997, cc.555-564) и синдром Крузона с акантокератодермией (Meyers et al., Nature Genetics, 11, 1995, cc.462-464). Синдром Крузона связан со специфическими точечными мутациями в рецепторе FGF-R2, а наследственная и спонтанная формы синдрома Пфайфера связаны с мутациями в рецепторах FGF-R1 и FGF-R2 (Galvin et al., PNAS USA, 93, 1996, cc.7894-7899; Schell et al., Hum Mol Gen, 4, 1995, cc.323-328). Мутации в рецепторах FGF вызывают конститутивную активацию мутированных рецепторов и повышенную активность рецепторной протеинтирозинкиназы, приводя клетки и ткани в состояние, неспособное к видоизменению.
В частности, такая мутация, как ахондроплазия, приводит к повышенной стабильности мутированного рецептора, разрушая активацию рецептора по типу обратной связи, что приводит к сдерживанию созревания хондроцитов и замедлению роста костей (см. Vajo et al., Endocrine Reviews, 21(1), 2000, cc.23-39).
Существует множество подтверждений мутаций, обуславливающих активацию рецептора FGF-R3 при различных типах рака.
Конститутивно активированный рецептор FGF-R3 в двух широко распространенных видах эпителиального рака мочевого пузыря и шейки матки, а также во множественной миеломе в первую очередь доказывает онкогенную роль рецептора FGF-R3 в карциномах. Кроме того, согласно самым последним исследованиям мутации, вызывающие активацию рецептора FGF-R3, присутствует в значительной части доброкачественных опухолей кожи (Logie et al., Hum Mol Genet, 2005). В настоящее время рецептор FGF-R3 является наиболее часто мутировавшим онкогеном при раке мочевого пузыря, где он мутирует почти в 50% случаев от общего числа случаев заболевания раком мочевого пузыря и примерно в 70% случаев при поверхностной форме опухоли мочевого пузыря (Cappellen, et al., Nature Genetics, 23, 1999, cc.19-20; van Rhijn, et al., Cancer Research, 61, 2001, cc.1265-1268; Billerey, et al, Am. J. Pathol., 158, 2001, cc.1955-1959, WO 2004/085676). Кроме того, имеются сведения о сверхэкспрессии рецептора FGF-R3 при раке мочевого пузыря (поверхностном и инвазивном) (Gomez-Roman et al., Clinical Cancer Research, 2005). Аберрантная сверхэкспрессия рецептора FGF-R3 вследствие хромосомной транслокации t(4,14) зафиксирована в 10-25% случаев множественной миеломы (Chesi et al., Nature Genetics, 16, 1997, cc.260-264; Richelda et al., Blood, 90, 1997, cc.4061-4070; Sibley et al., BJH, 118, 2002, cc.514-520; Santra et al., Blood, 101, 2003, cc.2374-2476). Мутации, вызывающие активацию рецептора FGF-R3, наблюдаются в 5-10% случаях множественной миеломы с хромосомной транслокацией t(4,14) и связаны с прогрессией опухоли (Chesi et al., Nature Genetics, 16, 1997, cc.260-264; Chesi et al., Blood, 97(3), 2001, cc.729-736; Intini, et al., BJH, 114, 2001, cc.362-364). В данном контексте, последствия передачи сигнала через рецептор FGF-R3 зачастую зависят от типа клеток. В хондроцитах гиперактивация рецептора FGF-R3 приводит к росту ингибирования (см. Omitz, 2001), тогда как в миеломной клетке она способствует прогрессии опухоли (Chesi et. al., 2001).
Согласно данным исследований ингибирование активности рецептора FGF-R3 представляет собой средство для лечения Т-клеточно-опосредованных воспалительных или аутоиммунных заболеваний, например для лечения Т-клеточно-опосредованных воспалительных или аутоиммунных заболеваний, включая, но, не ограничиваясь, ревматоидным артритом (РА), артритом, индуцированным коллагеном II типа, рассеянным склерозом (PC), системной красной волчанкой (СКВ), псориазом, юношеским диабетом, болезнью Шегрена, заболеванием щитовидной железы, саркоидозом, аутоиммуннымувеитом, воспалительным заболеванием кишечника (болезнь Крона и язвенный колит), целиакией и миастенией (см. WO 2004/110487). Заболевания, вызванные мутациями рецептора FGF-R3, описаны также в WO 03/023004 и WO 02/102972.
Среди заболеваний, возникновению которых способствует рецептор FGF-R3, а также другие рецепторы FGF-R (главным образом, в связи с, например, аберрантным уровнем FGF23 в сыворотке) кроме того, следует упомянуть аутосомно-доминантный гипофосфатемический фахит (англ. - ADHR), гипофосфатемический рахит, сцепленный с Х-хромосомой, остеомаляцию, вызванную опухолью, а также фиброзную дисплазию костей (см. также X.Yu et al., Cytokine & Growth Factor Reviews, 16, 2005, cc.221-232; X.Yu et al., Therapeutic Apheresis and Dialysis 9(4), 2005, cc.308-312).
При раке молочной железы имели место амплификация и/или сверхэкспрессия рецепторов FGF-R1, FGF-R2 и FGF-R4 (Penault-Llorca et al., Int J Cancer, 1995; Theillet et al., Genes Chrom. Cancer, 1993; Adnane et al., Oncogene, 1991; Jaakola et al., Int J Cancer, 1993; Yamada et al., Neuro Res, 2002). Сверхэкспрессия рецепторов FGF-R1 и FGF-R4 также вызывает аденокарциному поджелудочной железы и астроцитомой (Kobrin et al., Cancer Research, 1993; Yamanaka et al., Cancer Research, 1993; Shah et al., Oncogene, 2002; Yamaguchi et al., PNAS, 1994; Yamada et al., Neuro Res, 2002). Заболевание раком предстательной железы также обусловлено сверхэкспрессией рецептора FGF-R1 (Giri et al., Clin Cancer Res, 1999).
Факторы роста фибробластов и рецепторы фактора роста фибробластов также участвуют в ангиогенезе. Поэтому антиангиогенная терапия для лечения первичной опухоли и метастазов также предусматривает нацеленность на рецептор FGF-R (см., например, Presta et al., Cytokine & Growth Factors Reviews, 16, 2005, cc.159-178).
Согласно представленным данным мутации, в особенности в рецепторе FGF-R3 (например, FGF-R3b), также ответственны за конститутивную активацию данных рецепторов в случае эпидермоидного рака слизистой оболочки рта и губ (см., например, Y.Zhang et al., Int. J. Cancer, 117, 2005, cc.166-168).
Имеются сведения о том, что усиление (в особенности, в бронхах) экспрессии рецептора FGF-R, в особенности экспрессии FGF-R1, связано с хронической обструктивной болезнью легких (ХОБЛ) (см., например, А. Kranenburg et al., J. Pathol., 206, 2005, cc.28-38).
Приводятся данные о пользе методов противодействия рецепторам FGF-R, в особенности рецепторам FGF-R1 или FGF-R4, при лечении ожирения, диабета и/или связанных с ним заболеваний, такими как метаболический синдром, сердечно-сосудистые заболевания, гипертония, отклонение содержания холестерина и триглицеридов от нормы, дерматологические заболевания (например, инфекция, варикозное расширение вен, акантокератодермия, экзема, непереносимость физических нагрузок, сахарный диабет типа 2, невосприимчивость к инсулину, гиперхолестеринемия, желчно-каменная болезнь, ортопедические травмы, тромбоэмболические заболевания, сердечно-сосудистая недостаточность (например, атеросклероз), дневная сонливость, апноэ сна, терминальная стадия почечной недостаточности, болезни желчного пузыря, подагра, повышение температуры, нарушения иммунного ответа, нарушения функции внешнего дыхания, раневые инфекции, бесплодие, заболевания печени, боли в пояснице, акушерские и гинекологические осложнения, панкреатит, инсульт, хирургические осложнения, стрессовое недержание мочи и/или желудочно-кишечные расстройства (см., например, WO 2005/037235 А2).
По приведенным данным, кислотный фактор роста фибробластов (в особенности FGF-1) и рецептор FGF-R1 при связывании FGF-1 принимают участие в изменении передачи сигнала при ретинобластоме и приводят к пролиферации (см., например, S.Siffroi-Fernandez et al., Arch. Ophthalmology, 123, 2005, cc.368-376).
Подавление роста синовиальной саркомы зафиксировано в результате разрушения пути передачи сигнала фактора роста фибробластов (см., например, Т.Ishibe et al., Clin. Cancer Res., 11(7), 2005, cc.2702-2712).
Кроме того, имеются доказательства участия рецептора FGF-R в случае рака щитовидной железы.
Во всех вышеупомянутых случаях целесообразно применение модуляции изменяющейся активности передачи сигнала через рецептор FGF-R (в особенности, ингибирование активности киназы) при лечении указанных заболеваний.
Однако желательно иметь свидетельства ожидаемой пользы лечения лекарственными средствами, которые модулируют, например замедляют или активизируют, передачу сигнала через рецептор FGF-R, и в дальнейшем иметь возможность опираться на показатель, позволяющий контролировать модуляцию рецептора FGF-R, и оценивать, является ли лечение эффективным или нет при использовании таких модулирующих соединений.
В особенности предпочтительно иметь показания при лечении препаратами, которые подавляют передачу сигнала через рецептор FGF-R.
Белок FRS-2, который также называется SNT1, представляет собой липид-связывающий адаптерный белок, который служит главным связующим звеном между активацией рецептора FGF-R и внутриклеточными сигнальными путями (Lin et al., Mol. Cell Biol., 18, 1998, cc.3762-3770; Xu et al., J. Biol. Chem., 273, 1998, cc.17987-17990; Dhalluin et al., Mol. Cell, 6, 2000, cc.921-929; Ong et al., Mol. Cell Biol., 20, 2000, cc.979-989). Белок FRS-2 содержит последовательность фосфотирозин-связывающего домена (РТВ) рецептора распознавания, которая конститутивно схожа с околомембранной областью рецепторов FGF-R, и эффекторный домен с несколькими сайтами фосфорилирования по тирозину и серину. Активация рецептора FGF-R приводит к фосфорилированию белка FRS-2 по остаткам тирозина, в котором Grb2 и тирозин фосфатаза Shp2 впоследствии инициируют передачу сигнала через МАРК и PI3K (Xu et al., 1998, loc.cit.; Ong et al., 2000, loc. cit.; Hadari et al., Proc. Natl. Acad. Sci. USA, 98, 2001, cc.8578-8583). Значимость белка FRS-2 в передаче сигнала через рецептор FGF-R отражена в эмбриональном летальном фенотипе, наблюдаемом в период развития мыши после распада гена FRS-2. Кроме того, фибробласты эмбриона мыши с дефицитом FRS-2 показывают ухудшение вызванной рецептором FGF-R активации миграции, пролиферации и МАК активации (Hadari et al., 2001).
Краткое изложение сущности изобретения
При создании изобретения неожиданно было установлено, что статус фосфорилирования FRS-2 (в особенности, по тирозину) может служить биомаркером для определения эффективности подобных модулирующих соединений в борьбе против вышеуказанных (в особенности, пролиферативных) заболеваний и расстройств. Полученные данные наглядно показывают, что белок FRS-2 отлично фосфорилируется по тирозину именно в тех клетках, которые восприимчивы к ингибированию передачи сигнала через рецептор FGF-R, но не в тех цепочках, в которых рецепторы FGF-R не зависят от пролиферации.
Таким образом, настоящее изобретение основано на обнаружении того, что ингибирование рецептора FGFR посредством модуляторов рецептора FGFR приводит к снижению уровня фосфорилирования белка FRS-2. В пролиферирующих (например, опухолевых) клетках, реагирующих на ингибирование передачи сигнала через рецептор FGF-R, степень фосфорилирования по тирозину белка FRS-2 уменьшается в присутствии ингибиторов передачи сигнала через рецептор FGF-R, тогда как в клетках, которые не реагируют на ингибирование передачи сигнала, уровень фосфорилирования по тирозину невозможно определить, так как он близок к нулю, или вообще отсутствует восприимчивость к изменениям после добавления модулятора, в особенности ингибитора, поэтому восприимчивость к ингибированию передачи сигнала через рецептор FGF-R можно ожидать только от клеток, которые показывают фосфорилирование по тирозину белка FRS-2.
В качестве альтернативы, когда желательна активация передачи сигнала через рецептор FGF-R (например, в случае заживления ран), можно рассмотреть способность любого из активаторов (таких, как производные от FGF или подобные им) приводить к увеличению фосфорилирования белка FRS-2, его варианта или его фрагмента, содержащего фосфотирозин, и, таким образом, получить желаемый результат, определив активацию передачи сигнала через рецептор FGF-R.
Следовательно, уровень фосфорилирования по тирозину белка FRS-2 (в особенности, в присутствии фосфорилирования по тирозину) в пролиферирующих клетках может быть использован для возможности различения клеток, которые восприимчивы к лечению посредством модуляции передачи сигнала через рецептор FGF-R (в особенности, ингибирование) и клеток, которые не проявляют реакции при подобном лечении. Таким образом, статус фосфорилирования по тирозину белка FRS-2 в клетках является биомаркером для определения возможности модуляции, в особенности ингибирования (например, нежелательной) пролиферации клеток с помощью ингибиторов передачи сигнала через рецептор FGF-R. Уровни фосфорилирования по тирозину белка FRS-2 также могут быть использованы для ex vivo определения активности модуляторов рецепторов FGF-R и его вариантов.
Кроме того, определение фосфорилирования по тирозину белка FRS-2 (или, в качестве синонима, фосфорилированных форм белка FRS-2, его варианта или его фрагмента, содержащих тирозин), в частности, успешно используется для определения соединений или лекарственных средств, модулирующих активность рецептора FGF-R (в особенности, относительно его активности), и может также находить применение в диагностическом методе выявления пациентов, которым может принести пользу лечение посредством модуляторов, в особенности, ингибиторов, рецептора FGF-R, а также для контроля эффективности лечения.
Подробное описание изобретения
Первый вариант осуществления изобретение относится к способу идентификации (предпочтительно выделенных, например, в культуре клеток или в клеточной суспензии) клеток (в том числе выделенных клеток или клеток из выделенных тканей и/или органов, как правило, из биологических образцов, наиболее предпочтительно от пациента), которые проявляют восприимчивость к модуляции, в особенности к ингибированию, передачи сигнала, в котором участвует рецептор фактора роста фибробластов (FGF-R) или его вариант, заключающемуся в определении статуса фосфорилирования по тирозину субстрата 2 (FRS-2) рецептора FGF-R, его варианта или его фрагмента, содержащего тирозин, в биологическом образце, в качестве биомаркера такой восприимчивости к ингибированию.
В другом своем варианте осуществления изобретение относится к способу или применению определения фосфорилирования (в особенности, по фосфотирозину) в белке FRS-2, его варианте или его фрагменте, содержащем тирозин, в качестве биомаркера клеток или тканей или органов, в особенности из биологических образцов пациентов, которые проявляют гиперактивную, главным образом конститутивно активированную, передачу сигнала через рецептор FGF-R, и которые, в особенности, поддаются действию ингибиторов рецептора FGF-R или его варианта, и которые реагируют на такие ингибиторы, где указанные способ или применение включают определение наличия фосфотирозина в белке FRS-2, в его варианте, или в его фрагменте, содержащем тирозин, из биологического образца с помощью реагента биоспецифического распознавания, способного распознавать фосфотирозин в белке FRS-2, успешное обнаружение фосфорилирования в белке FRS-2, указывающего на гиперактивную, в особенности конститутивно активированную передачу сигнала через рецептор FGF-R, и, предпочтительно, с целью различения восприимчивых клеток, тканей или органов от клеток, тканей или органов, которые не восприимчивы к ингибиторам передачи сигнала, в котором участвует рецептор фактора роста фибробластов (FGF-R) либо его вариант, сравнение статуса фосфорилирования в отсутствие и в присутствии ингибитора передачи сигнала, опосредованного рецептором FGF-R или его вариантом, снижение фосфорилирования в присутствии ингибитора указывает на такую восприимчивость.
Настоящее изобретение также относится к способу определения (предпочтительно выделенных, например, в культуре клеток или в клеточной суспензии) клеток (в том числе выделенных клеток или клеток из выделенных тканей и/или органов, как правило, из биологических образцов, в особенности от пациента), проявляющих восприимчивость к модуляции, в особенности к ингибированию, передачи сигнала, в котором участвует рецептор фактора роста фибробластов (FGF-R) или его вариант, включающему:
а) взаимодействие биологического образца с реагентом биоспецифического распознавания, способным распознавать белок FRS-2, его вариант или его фрагмент, содержащий тирозин, и
б) определение статуса фосфорилирования тирозина в указанном FRS-2, его варианте или его фрагменте, содержащем тирозин, с биоспецифическим реагентом распознавания, способным распознавать указанный статус фосфорилирования, и
в) корреляцию статуса фосфорилирования по отношению к восприимчивости ингибирования передачи сигнала, в котором участвует рецептор фактора роста фибробластов (FGF-R) или его вариант (в особенности, гиперактивная, например конститутивно активная, форма) и/или к состоянию и/или к эффективности лечения.
В другом предпочтительном варианте осуществления изобретение также относится к набору, используемому для определения биологического образца, в частности от пациента, чувствительного к модуляции, в особенности, к ингибированию, передачи сигнала, в котором участвует рецептор FGF-R или его вариант, в особенности для применения с целью выявления пациентов, лечение которых эффективно посредством ингибитора рецептора FGF-R, содержащему средства определения статуса фосфорилирования белка FRS-2, его вариант или его фрагмент, содержащий тирозин, в особенности средства выявления фосфорилированных, наиболее предпочтительно фосфорилированных по тирозину, форм белка FRS-2, его вариант или его фрагмент, содержащий тирозин, в биологических образцах, предпочтительно от пациентов, в качестве биомаркера такой чувствительности к модуляции, в особенности к ингибированию, где предпочтительно, если набор позволяет обнаружить фосфорилирование при отсутствии модуляции, более предпочтительно в отсутствие стимуляции FGF, то есть еще более предпочтительно в случае с конститутивной активацией передачи сигнала через рецептор FGF-R, то это свидетельствует о восприимчивости к ингибированию, в особенности, если фосфорилирование понижается в образце, обработанном ингибитором, по сравнению с образцом, не обработанным ингибитором.
В следующем своем варианте осуществления изобретения относится к применению реагента биоспецифического распознавания (в особенности, в виде антитела против фосфотирозина), способного распознавать фосфорилированную форму белка FRS-2, его варианта или его фрагмента, содержащего тирозин (в особенности распознающий в нем фосфотирозин), или к указанному реагенту биоспецифического распознавания как таковому, применяемому для идентификации клеток, в особенности в биологических образцах, в особенности от пациентов, которые проявляют чувствительность к модуляции, в особенности к ингибированию передачи сигнала, в котором участвует рецептор фактора роста фибробластов (FGF-R) или его вариант (наиболее предпочтительно, применяемый для выявления больных, лечение которых посредством ингибитора рецептора FGF-R эффективно), где указанное применение предпочтительно включает определение статуса фосфорилирования указанного белка FRS-2, его варианта или его фрагмента; где обнаружение фосфорилирования в отсутствие модуляции предпочтительно означает вероятность восприимчивости к указанному ингибированию; предпочтительно применяемому для идентификации гиперактивности, в особенности, FGF-независимой активации, главным образом, конститутивной активации передачи сигнала через рецептор FGF-R. Предпочтительным является применение реагента биоспецифического распознавания для определения состояния пациента, который восприимчив к лечению ингибитором передачи сигнала через рецептор FGF-R, предусматривающему определение фосфорилирования, в особенности фосфорилирования по тирозину, в белке FRS-2, в его варианте или в его фрагменте, содержащем фосфотирозин, в биологическом образце указанного пациента.
В другом своем варианте осуществления изобретение относится к способу определения фосфорилирования белка FRS-2 (или, в качестве синонима, фосфорилированных форм белка FRS-2, его варианта или его фрагмента, содержащего тирозин), применяемому для идентификации модулятора (соединение или лекарственное средство, модулирующее активность) передачи сигнала, в котором участвует рецептор фактора роста фибробластов (FGF-R) или его вариант, заключающемуся в определении статуса фосфорилирования белка FRS-2 в отсутствие и в присутствии такого модулятора, и если при добавлении указанного (возможного) модулятора обнаружено снижение указанного фосфорилирования, то модулятор относят к классу ингибиторов, и, соответственно, если при добавлении модулятора обнаружено увеличение указанного фосфорилирования, то модулятор относят к классу активаторов передачи сигнала; в особенности для идентификации клеток, проявляющих гиперактивность, в особенности FGF-независимую активацию, более предпочтительно конститутивную активацию передачи сигнала через рецептор FGF-R.
В следующем своем варианте осуществления изобретение относится к способу диагностики или к применению реагента биоспецифического распознавания (в особенности, в виде антитела против фосфотирозина), способного распознавать фосфорилированную форму белка FRS-2, его варианта или его фрагмента, содержащего тирозин, или к указанному реагенту биоспецифического распознавания, применяемому для идентификации пациентов, которым принесет пользу лечение посредством модуляторов, особенно ингибиторов, рецепторов FGF-R, в особенности, заключающемуся в определении фосфорилирования без ингибитора (в особенности, успешное выявление такого фосфорилирования, указывающее на вероятную пользу лечения пациента посредством такого ингибитора), и, предпочтительно, в определении снижения фосфорилирования в присутствии ингибитора в биологическом образце от такого пациента; или для контроля эффективности лечения посредством таких модуляторов рецептора FGF-R, в особенности ингибиторов, заключающегося в определении изменения фосфорилирования при успешном его выявлении без такого лечения, в особенности его снижения в присутствии модулятора, в особенности ингибитора, в биологическом образце от такого пациента; предпочтительно применяемому для определения гиперактивности, в особенности, FGF-независимой активации, в особой степени, конститутивной активации передачи сигнала через рецептор FGF-R, в биологическом образце такого пациента.
Еще в одном своем варианте осуществления изобретение относится к способу диагностики (в частности, пролиферативного) заболевания (или пациента) восприимчивого к лечению посредством ингибитора передачи сигнала через рецептор FGF-R, заключающемуся в определении фосфорилированной формы (желательно по тирозину) белка FRS-2, его варианта или его фрагмента, содержащего тирозин, в биологическом образце от пациента, предпочтительно с помощью реагента биоспецифического распознавания, способного распознавать фосфорилированную форму белка FRS-2, его варианта или его фрагмента, содержащего тирозин, или к указанному реагенту биоспецифического распознавания, применяемому в указанном способе диагностики, предпочтительно, применяемому в определении гиперактивности, в особенности в определении FGF-независимой активации, в особой степени в конститутивной активации передачи сигнала через рецептор FGF-R.
В другом своем варианте осуществления изобретение относится к способу диагностики пролиферативного заболевания, не поддающегося лечению посредством ингибитора передачи сигнала через рецептор FGF-R, заключающемуся в определении отсутствия фосфорилированной формы белка FRS-2, его варианта или его фрагмента, содержащего тирозин, в биологическом образце, предпочтительно с помощью реагента биоспецифического распознавания, способного распознавать фосфорилированную форму белка FRS-2, его варианта или его фрагмента, содержащего тирозин, в биологическом образце, или к указанному реагенту биоспецифического распознавания, применяемому в указанном способе диагностики.
В другом своем варианте осуществления изобретение относится к способу контроля реакции на воздействие лечения расстройства, зависящего от передачи сигнала через рецептор FGF-R у пациента, заключающемуся в получении биологического образца от указанного пациента до начала проведения указанного лечения, в определении наличия фосфорилированной формы белка FRS-2, его варианта или его фрагмента, содержащего тирозин, в особенности соответствующей степени фосфорилирования, и в получении одного или более биологических образцов в дальнейшем после начала указанного лечения и в определении изменения, в особенности уменьшения, степени фосфорилирования указанного белка FRS-2, его указанного варианта или его указанного фрагмента, содержащего тирозин, где уменьшение степени фосфорилирования указывает на успешное лечение.
В еще одном своем варианте осуществления изобретение относится к применению реагента биоспецифического распознавания, способного распознавать фосфорилированный белок FRS-2, его вариант или его фрагмент, содержащий тирозин, в разработке способа диагностики для идентификации таких клеток из числа клеток или тканей биологического образца, которые восприимчивы к модуляции передачи сигнала, в котором участвует рецептор фактора роста фибробластов (FGF-R) или его вариант, где указанная идентификация заключается в определении статуса фосфорилирования субстрата 2 (FRS-2) рецептора FGF-R, его варианта или его фрагмента, содержащего тирозин.
В еще одном своем варианте осуществления, изобретение относится к применению реагента биоспецифического распознавания, способного распознавать фосфорилированный белок FRS-2, его вариант или его фрагмент для выявления клеток, способствующих идентификации соединений, модулирующих передачу сигнала через рецептор FGF-R.
В еще одном своем варианте осуществления изобретение относится к способу идентификации клеток, пролиферация которых требует активации, в частности конститутивной активации рецептора FGF-R, и которые реагируют на ингибирование передачи сигнала через рецептор FGF-R, включающему:
а) испытание образца выделенных клеток и тканей в среде без ингибитора рецептора FGF-R и параллельного испытания образца в среде с ингибитором рецептора FGF-R при отсутствии FGF,
б) по меньшей мере частичную очистку белка FRS-2, его варианта или его фрагмента, содержащего тирозин, из указанных образцов;
в) определение статуса фосфорилирования белка FRS-2 в указанных образцах; и
д) сравнения статуса фосфорилирования образца, обработанного ингибитором, со статусом фосфорилирования образца, не обработанного ингибитором, при этом снижение фосфорилирования в присутствии ингибитора определяет клетки, подходящие для идентификации ингибиторов, которые пригодны для лечения заболевания, включающего в себя гиперактивность передачи сигнала через рецептор FGF-R.
Данный способ эффективен для выявления клеток, которые пролиферируют при FGF-зависимой или FGF-независимой, в частности конститутивной, активации рецептора FGF для пролиферации.
В еще одном своем варианте осуществления изобретение относится к применению реагента биоспецифического распознавания, способного распознавать фосфорилированный белок FRS-2, его вариант или его фрагмент, содержащий тирозин, для выявления потенциальных ингибиторов передачи сигнала посредством рецептора FGF-R, заключающемуся в определении с помощью указанного реагента статуса фосфорилирования белка FRS-2, его варианта или его фрагмента, содержащего тирозин, в биологических образцах, и, в случае обнаружения фосфорилирования, в сравнении степени фосфорилирования в присутствии и в отсутствие данного соединения, уменьшение фосфорилирования указывает на пригодность тестируемого соединения в качестве ингибитора передачи сигнала посредством рецептора FGF-R.
Все предыдущие способы, применения, реагенты, наборы и другие варианты осуществления настоящего изобретения предпочтительно позволяют выявить у пациента состояние, в частности расстройство или болезнь, которое, возможно, будет поддаваться лечению посредством модуляторов передачи сигнала через рецептор FGF-R, особенно в случае успешного определения фосфотирозина в белке FRS-2, его варианте или его фрагменте, содержащем тирозин.
Основные выше и ниже обозначенные термины, используемые в контексте настоящего описания изобретения, имеют следующее значение, если не указано иное - любое одно или несколько более общих выражений, используемых в контексте настоящего описания, в особенности в формуле, могут быть заменены, независимо от других терминов, более конкретным определением, приведенным ниже, таким образом, обозначая предпочтительный вариант осуществления изобретения:
Под клетками, проявляющими "восприимчивость к модуляции передачи сигнала, в котором участвует рецептор фактора роста фибробластов (FGF-R) или его вариант", предпочтительно подразумеваются клетки, которые поддаются лечению посредством модулятора, в особенности ингибитора, указанной передачи сигнала, и которые содержатся в биологическом образце от пациента. В данных клетках обнаружено изменение фосфорилирования белка FRS-2, его варианта или его фрагмента, содержащего тирозин, в присутствии модулятора рецептора FGF-R по сравнению с фосфорилированием в отсутствие модулятора - в особенности в том случае, когда модулятор является ингибитором, увеличивающим фосфорилирование, или более предпочтительно в случае, когда модулятор является ингибитором, снижающим фосфорилирование. Модулятор, предпочтительно ингибитор, предпочтительно является молекулой, связывающейся с рецептором FGF-R или ее вариантами и, предпочтительно, ингибирующей его (предпочтительно тирозин-специфическую) протеинкиназную активность в отношении белка FRS-2 или его варианта.
"Статус фосфорилирования" (или "степень фосфорилирования") относится к отсутствию или же к частичному или к полному присутствию фосфорилированных молекул серина, треонина и/или (предпочтительно и только) тирозина в первичной аминокислотной последовательности белка FRS-2, его варианта или его фрагмента, содержащего тирозин. Статус фосфорилирования, в соответствии с настоящим изобретением, является средством различения биологических образцов, например, взятых от пациентов, которые страдают заболеванием, например болезнью или расстройством, зависящим от (например, конститутивной) передачи сигнала через рецептор FGF-R (где может быть обнаружено присутствие фосфорилирования) от образцов, где отсутствует такая зависимость (где отмечается отсутствие фосфорилирования или только незначительное фосфорилирование).
В особенности с помощью сравнения статуса фосфорилирования биологических образцов после инкубации в присутствии и в отсутствие модулятора (в особенности, ингибитора) передачи сигнала через рецептор FGF-R можно отличить биологические образцы, в которых возможно модулирование (в особенности, ингибирование) передачи сигнала через рецептор FGF-R (и которые, таким образом, реагируют на лечение посредством данных модуляторов, в особенности, ингибиторов, и в которых, в случае с ингибиторами, при отсутствии ингибитора фосфорилирования обнаруживается фосфорилирование, уменьшающееся или исчезающее в присутствии ингибитора) от биологических образцов, где такая модуляция, в особенности ингибирование, не влияет на статус фосфорилирования), есть в случае с ингибиторами, где нет фосфорилирования как в присутствии, так и в отсутствие ингибитора или где не наблюдается никаких изменений в данном фосфорилировании по сравнению с образцами с участием или без участия ингибитора).
Наиболее предпочтительной является возможность настоящего изобретения идентифицировать клетки, которые, особенно вследствие гиперактивности и в особой степени конститутивной активации передачи сигнала через рецептор FGF-R, чрезмерно пролиферирируют, и, таким образом, в которых отмечается фосфорилирование по тирозину в белке FRS-2 или его варианте, и которые поэтому (исходя из наблюдения за статусом фосфорилирования в дальнейшем, как в присутствии, так и в отсутствие ингибитора передачи сигнала через рецептор FGF-R), и которые, возможно, будут реагировать на лечение посредством ингибитора передачи сигнала через рецептор FGF-R, что позволяет отличать их от клеток, в которых отсутствует такое фосфорилирование и в которых представляется маловероятной успешность лечения посредством ингибиторов передачи сигнала через рецептор FGF-R.
Следовательно, как правило, обнаружение фосфорилирования (в особенности фосфорилирования по тирозину) белка FRS-2, его варианта или его фрагмента, содержащего тирозин, которое также присутствует без стимуляции FGF или биологического образца, является весьма предпочтительным биомаркером в соответствии с изобретением, и все воплощения изобретения наиболее предпочтительно относятся к обнаружению клеток, проявляющих такую гиперактивность, в особенности конститутивную активность, рецептора FGF-R или его вариантов.
Если биологические образцы взяты от пациента, то статус фосфорилирования (здесь этот термин может быть заменен термином "степень фосфорилирования") и присутствие или отсутствие фосфорилирования в присутствии или в отсутствие модулятора (в особенности, ингибитора), таким образом, позволяет определить ожидаемую пользу лечения пациента посредством модулятора, в особенности ингибитора (выявленное уменьшение фосфорилирования или его отсутствие в присутствии ингибитора, а также выявленное повышение фосфорилирования в отсутствие ингибитора может свидетельствовать о целесообраз