Лечение антителами против vegf
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к онкологии, и может быть использована для лечения рака у пациента человека. Для этого пациенту вводят эффективное количество антитела против VEGF (бевацизумаб). И при этом отслеживают пациента на желудочно-кишечное прободение. Также предложены промышленный продукт и набор для лечения рака у пациента человека. Группа изобретений обеспечивает расширение арсенала противоопухолевых лекарственных средств. 4 н. и 28 з.п. ф-лы, 5 табл., 7 ил., 2 пр.
Реферат
В данной заявке декларируется приоритет предварительной заявки США No.60/474480, зарегистрированной 30 мая 2003 г., раскрытие которой включено здесь в качестве ссылки.
Область техники, к которой относится изобретение
Данное изобретение относится в целом к лечению заболеваний и патологических состояний человека. Более конкретно изобретение относится к антиангиогенной терапии рака, либо одной, либо в сочетании с другой противораковой терапией.
Известный уровень техники
Рак остается одной из наиболее смертельных опасностей для здоровья человека. В США рак каждый год поражает около 1,3 миллиона новых больных и является второй лидирующей причиной смерти после заболеваний сердца, вызывая по расчетам приблизительно 1 из 4 смертей. Предсказывается также, что рак в пределах 5 лет может опередить сердечно-сосудистые заболевания по смертности, став причиной смерти номер один. Солидные опухоли ответственны за большинство из данных смертей. Хотя существуют значительные успехи в медицинском лечении определенных видов рака, везде 5-летняя выживаемость для всех типов рака улучшилась только приблизительно на 10% в последние 20 лет. Рак, или злокачественные опухоли, метастазируют и растут быстро, неконтролируемым образом, что делает предельно трудным их своевременное выявление и лечение. Более того, рак может возникнуть почти в любой ткани организма путем злокачественной трансформации одной или нескольких нормальных клеток в ткани, и каждый тип рака, происходящий из конкретной ткани, отличается от других.
Имеющиеся в настоящее время способы лечения рака являются относительно неизбирательными. Хирургическим путем удаляется пораженная ткань; радиотерапия вызывает уменьшение солидных опухолей; и химиотерапия уничтожает быстро делящиеся клетки. Химиотерапия ведет, в частности, к многочисленным побочным эффектам, в некоторых случаях настолько тяжелым, что это ограничивает дозу, которая может быть дана и, следовательно, мешает использованию потенциально эффективных лекарств. Более того, при раке часто развивается резистентность к химиотерапевтическим препаратам.
Таким образом, существует срочная потребность в специфических и более эффективных способах лечения рака.
Ангиогенез представляет собой важное клеточное событие, при котором клетки эндотелия сосудов пролиферируют, удаляются и реорганизуются для формирования новых сосудов из предсуществующей сосудистой сети. Существуют убедительные доказательства того, что развитие сосудов для кровоснабжения существенно для нормальных и патологических пролиферативных процессов (Folkman и Klagsbrun (1987) Science 235:442-447). Доставка кислорода и питательных веществ, а также удаление продуктов катаболизма представляют собой лимитирующие скорость стадии для большинства ростовых процессов, происходящих в многоклеточных организмах. Таким образом, обычно предполагается, что участие сосудов необходимо не только для развития и дифференцировки органов в эмбриогенезе, но также для заживления ран и репродуктивных функций у взрослого.
Ангиогенез также вовлечен в патогенез различных нарушений, включая, но не ограничиваясь этим, опухоли, пролиферативные ретинопатии, связанную с возрастом атрофию кожи, ревматоидный артрит (RA) и псориаз. Ангиогенез существенен для роста большинства первичных опухолей и их последующего метастазирования. Опухоли могут поглощать достаточное количество питательных веществ и кислорода путем простой диффузии до их размера в 1-2 мм, с этого момента их дальнейший рост требует развития сосудов. Данный процесс, как считается, включает вовлечение прилегающей зрелой сосудистой сети хозяина в прорастание новых капиллярных кровеносных сосудов, которые растут в направлении опухолевой массы и затем инфильтрируют ее. Кроме того, ангиогенез опухоли включает вовлечение циркулирующих эндотелиальных клеток-предшественников из костного мозга для стимуляции неоваскуляризации. Kerbel (2000) Carcinogenesis 21:505-515; Lynden et al. (2001) Nat. Med. 7:1194-1201.
В то время как индукция новых кровеносных сосудов рассматривается как преобладающий способ ангиогенеза опухоли, последние данные показали, что некоторые опухоли могут расти с помощью кооптирования существующих кровеносных сосудов хозяина. Кооптированная васкуляризация затем регрессирует, ведя к регрессии опухоли, что в конечном итоге является обратимым за счет ангиогенеза, индуцируемого гипоксией по краю опухоли. Holash et al. (1999) Science 284:1994-1998.
Ввиду существенной физиологической и патологической важности ангиогенеза много работ было посвящено выяснению факторов, способных регулировать данный процесс. Предполагается, что процесс ангиогенеза регулируется за счет баланса между про- и антиангиогенными молекулами и он нарушается при различных заболеваниях, особенно при раке. Carmeliet и Jain (2000) Nature 407:249-257.
Фактор роста клеток эндотелия сосудов (VEGF), который также обозначают VEGF-A или фактор проницаемости сосудов (VPF), описан как ключевой регулятор как нормального, так и аномального ангиогенеза. Ferrara и Davis-Smyth (1997) Endocrine Rev. 18:4-25; Ferrara (1999) J. Mol. Med. 77:527-543. По сравнению с другими факторами роста, которые вносят вклад в процессы образования сосудов, VEGF является уникальным по своей высокой специфичности в отношении эндотелиальных клеток сосудистой системы. VEGF важен для эмбрионального васкулогенеза и ангиогенеза. Carmeliet et al. (1996) Nature 380:435-439; Ferrara et al. (1996) Nature 380:439-442. Более того, VEGF требуется для циклической пролиферации кровеносных сосудов в женском репродуктивном тракте и для роста костей и образования хряща. Ferrara et al. (1998) Nature Med. 4:336-340; Gerber et al. (1999) Nature Med. 5:623-628.
Являясь ангиогенным фактором при ангиогенезе и васкулогенезе, VEGF, кроме того, в качестве плейотропного ростового фактора оказывает множественные биологические эффекты при других физиологических процессах, таких как выживание эндотелиальных клеток, проницаемость сосудов и вазодилатация, хемотаксис моноцитов и приток кальция. Ferrara и Davis-Smyth (1997), выше. Более того, в последних исследованиях сообщалось о митогенных эффектах VEGF на некоторые не эндотелиальные типы клеток, такие как эпителиальные пигментные клетки сетчатки, клетки протоков поджелудочной железы и швановские клетки. Guerrin et al. (1995) J. Cell Physiol. 164:385-394; Oberg-Welsh et al. (1997) Mol. Cell. Endocrinol. 126:125-132; Sondell et al. (1999) J. Neurosci. 19:5731-5740.
Существенные доказательства свидетельствуют также о критической роли VEGF в развитии состояний или заболеваний, которые включают патологический ангиогенез. мРНК VEGF гиперэкспрессируется большинством исследованных опухолей человека (Berkman et al. J.Clin. Invest 91:153-159 (1993); Brown et al. Human Pathol. 26:86-91 (1995); Brown et al. Cancer Res. 53:4727-4735 (1993); Mattern et al. Brit. J. Cancer. 73:931-934 (1996); и Dvorak et al. Am J. Pathol. 146:1029-1039 (1995)). Концентрация VEGF в жидкостях глаза также высоко коррелирует с наличием активной пролиферации кровеносных сосудов у больных с диабетической и другими связанными с ишемией ретинопатиями (Aiello et al. N. Engl. J. Med. 331:1480-1487 (1994)). Более того, последние исследования продемонстрировали локализацию VEGF в хороидальных неоваскулярных мембранах у больных, страдающих AMD (Lopez et al. Invest. Ophtalmo. Vis. Sci. 37:855-868 (1996)).
Учитывая его центральную роль в стимуляции опухолевого роста, VEGF является привлекательной мишенью для терапевтического воздействия. Действительно, для лечения неопластических заболеваний в настоящее время разрабатываются разнообразные терапевтические стратегии, направленные на блокаду VEGF или системы проведения сигнала его рецепторами. Rosen (2000) Oncologist 5:20-27; Ellis et al. (2000) Oncologist 5:11-15; Kerbel (2001) J. Clin. Oncol. 19:45S-51S. До сих пор блокада VEGF/рецептора VEGF моноклональными антителами и ингибирование проведения сигнала рецепторами с помощью ингибиторов тирозинкиназ являются наиболее изученными подходами. Исследуются также рибозимы VEGFR-1, конъюгаты токсинов VEGF и растворимые рецепторы VEGF.
Антитело против VEGF «бевацизумаб (BV)», также известное как «rhuMAb VEGF» или «AvastinTM», представляет собой рекомбинантное гуманизированное моноклональное антитело против VEGF, созданное в соответствии с Presta et al. (1997) Cancer Res. 57:4593-4599. Оно включает мутантные области рамки считывания IgG1 человека и антигенсвязывающие области, определяющие комплементарность, от моноклонального антитела A.4.6.1 против hVEGF мыши, что блокирует связывание VEGF человека со своими рецепторами. Приблизительно 93% аминокислотной последовательности бевацизумаба, включая большую часть областей рамки считывания, происходит от IgG1 человека и приблизительно 7% последовательности происходит от антитела A4.6.1 мыши. Бевацизумаб имеет молекулярную массу приблизительно 149000 дальтон и является гликозилированным. Бевацизумаб исследуется клинически для лечения различных типов рака, и некоторые ранние стадии испытаний продемонстрировали многообещающие результаты. Kerbel (2001) J. Clin. Oncol. 19:45S-51S; De Vore et al. (2000) Proc. Am. Soc. Clin. Oncol. 19:485a; Johnson et al. (2001) Proc. Am. Soc. Clin. Oncol. 20:315a; Kabbinavar et al. (2003) J. Clin. Oncol. 21:60-65.
Краткое изложение сущности изобретения
Настоящее изобретение касается способов применения антитела против VEGF для лечения заболеваний и патологических состояний. В частности, в изобретении предлагается эффективный подход к лечению рака, частично основанный на неожиданных результатах о том, что добавление антитела против VEGF к стандартной химиотерапии ведет к статистически значимым и клинически выраженным улучшениям у больных раком.
Соответственно, в одном аспекте в изобретении предлагается способ лечения рака у больного человека, включающий введение больному эффективных количеств антитела против VEGF и антинеопластической композиции, где указанная антинеопластическая композиция включает, по меньшей мере, один химиотерапевтический агент.
Рак, поддающийся лечению с помощью настоящего изобретения, включает, но не ограничивается этим, карциному, лимфому, бластому, саркому и лейкоз или лимфоидные злокачественные новообразования. Более конкретные примеры таких типов рака включают плоскоклеточный рак, рак легких (включая мелкоклеточный рак легких, немелкоклеточный рак легких, аденокарциному легких и плоскоклеточную карциному легких), рак брюшной полости, гепатоцеллюлярный рак, рак желудка или отделов, относящихся к желудку (включая рак желудочно-кишечного тракта), рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак ободочной кишки, колоректальный рак, карциному эндометрия или матки, карциному слюнных желез, рак почки или относящийся к почке, рак печени, рак простаты, рак вульвы, рак щитовидной железы, карциному печени и различные типы рака головы и шеи, а также B-клеточную лимфому (включая низко злокачественную/фолликулярную не-ходжкинскую лимфому (NHL); мелколимфоцитарную (SL) NHL; среднезлокачественную/фолликулярную NHL; среднезлокачественную, диффузную NHL; высокозлокачественную иммунобластную NHL; высокозлокачественную лимфобластную NHL; высокозлокачественную мелкоклеточную с нерасщепленными ядрами NHL; массированное заболевание NHL; оболочечноклеточную лимфому; лимфому, связанную со СПИДом; и макроглобулинемию Вальденстрома); хронический лимфоцитарный лейкоз (CLL); острый лимфобластный лейкоз (ALL); лейкозный ретикулоэндотелиоз; хронический миелобластный лейкоз; и пострансплантационное лимфопролиферативное нарушение (PTLD), а также аномальную пролиферацию сосудов, связанную с факоматозом, отеком (таким как связанный с опухолями мозга), и синдром Мейга. Предпочтительно, рак выбран из группы, состоящей из рака молочной железы, колоректального рака, ректального рака, немелкоклеточного рака легких, не-ходжкинской лимфомы (NHL), почечноклеточного рака, рака простаты, рака печени, рака поджелудочной железы, саркомы мягких тканей, саркомы Капоши, карциноидной опухоли, рака головы и шеи, меланомы, рака яичников, мезотелиомы и множественной миеломы. Более предпочтительно, рак представляет собой колоректальный рак. Злокачественные состояния, поддающиеся лечению по изобретению, включают метастатический рак. Способ настоящего изобретения особенно подходит для лечения васкуляризированных опухолей.
Любой химиотерапевтический агент, проявляющий противораковую активность, может быть применен в соответствии с настоящим изобретением. Предпочтительно химиотерапевтический агент выбран из группы, состоящей из алкилирующих агентов, антиметаболитов, аналогов фолиевой кислоты, аналогов пиримидина, аналогов пурина и относящихся к этому ингибиторов, алкалоидов барвинка, токсинов эпиподофилла, антибиотиков, L-аспарагиназы, ингибитора топоизомеразы, интерферонов, координационных комплексов платины, замещенной антрацендионом мочевины, производных метилгидразина, супрессанта коры надпочечников, адренокортикостероидов, прогестинов, эстрогенов, антиэстрогена, андрогенов, антиандрогена и аналога гонадотропин-рилизинг гормона. Более предпочтительно химиотерапевтический агент выбран из группы, состоящей из 5-фторурацила (5-FU), лейковорина (LV), иринотекана, оксалиплатина, капецитабина, паклитаксела и доксетаксела. Два или более химиотерапевтических агента могут быть применены в коктейле при введении в сочетании с введением антитела против VEGF. Одна предпочтительная сочетанная химиотерапия представляет собой химиотерапию на основе фторурацила, включающую 5-FU и один или более другие химиотерапевтический(ие) агент(ы). Подходящие режимы дозировки сочетанной химиотерапии известны в данной области техники и описаны, например, в Saltz et al. (1999) Proc ASCO 18:233a и Douillard et al. (2000) Lancet 355:1041-7.
В одном аспекте в настоящем изобретении предлагается способ увеличения продолжительности выживания у человека, больного раком, включающий введение больному эффективных количеств композиции антитела против VEGF и антинеопластической композиции, где указанная антинеопластическая композиция включает, по меньшей мере, один химиотерапевтический агент, в результате чего совместное введение антитела против VEGF и антинеопластической композиции эффективно увеличивает продолжительность выживания.
В другом аспекте в настоящем изобретении предлагается способ увеличения безрецидивного периода выживания у человека, больного раком, включающий введение больному эффективных количеств композиции антитела против VEGF и антинеопластической композиции, где указанная антинеопластическая композиция включает, по меньшей мере, один химиотерапевтический агент, в результате чего совместное введение антитела против VEGF и антинеопластической композиции эффективно увеличивает продолжительность безрецидивного периода выживания.
Далее, в настоящем изобретении предлагается способ лечения группы людей, больных раком, включающий введение больному эффективных количеств композиции антитела против VEGF и антинеопластической композиции, где указанная антинеопластическая композиция включает, по меньшей мере, один химиотерапевтический агент, в результате чего совместное введение антитела против VEGF и антинеопластической композиции эффективно увеличивает показатель ответной реакции в группе больных.
В еще одном аспекте в настоящем изобретении предлагается способ увеличения продолжительности ответа у человека, больного раком, включающий введение больному эффективных количеств композиции антитела против VEGF и антинеопластической композиции, где указанная антинеопластическая композиция включает, по меньшей мере, один химиотерапевтический агент, в результате чего совместное введение антитела против VEGF и антинеопластической композиции эффективно увеличивает продолжительность ответа.
В изобретении также предлагается способ лечения больного человека, предрасположенного к колоректальному раку или с его диагнозом, включающий введение больному эффективных количеств антитела против VEGF. Колоректальный рак может быть метастатическим. Лечение антителом против VEGF может дополнительно сочетаться со стандартной для колоректального рака химиотерапией, такой как режим Saltz (5-FU/LV/иринотекан), описанный Saltz et al. (1999).
В одном предпочтительном осуществлении в изобретении предлагается способ лечения больного человека или группы больных людей с метастатическим колоректальным раком, включающий введение больному эффективных количеств композиции антитела против VEGF и антинеопластической композиции, где указанная антинеопластическая композиция включает, по меньшей мере, один химиотерапевтический агент, в результате чего совместное введение антитела против VEGF и антинеопластической композиции ведет к статистически значимому и клинически выраженному улучшению у больного, подвергаемого лечению, измеренному по продолжительности выживания, безрецидивного периода, показателю ответной реакции или продолжительности ответа. Предпочтительно, чтобы антинеопластическая композиция представляла собой схему сочетаний на основе фторурацила. Более предпочтительно, чтобы схема сочетаний включала S-FU+лейковорин, 5-FU+лейковорин+иринотекан (IFL) или 5-FU+лейковорин+оксалиплатин (FOLFOX).
В изобретении предлагается промышленный продукт, включающий контейнер, композицию в контейнере, включающую антитело против VEGF, и вкладыш-инструкцию по использованию композиции для введения больному раком композиции антитела против VEGF и антинеопластической композиции, включающей, по меньшей мере, один химиотерапевтический агент.
В изобретении также предлагается набор для лечения рака у больного, включающий упаковку, содержащую композицию антитела против VEGF, и инструкции по использованию композиции антитела против VEGF и антинеопластической композиции, включающей, по меньшей мере, один химиотерапевтический агент, для лечения рака у больного.
Краткое описание фигур
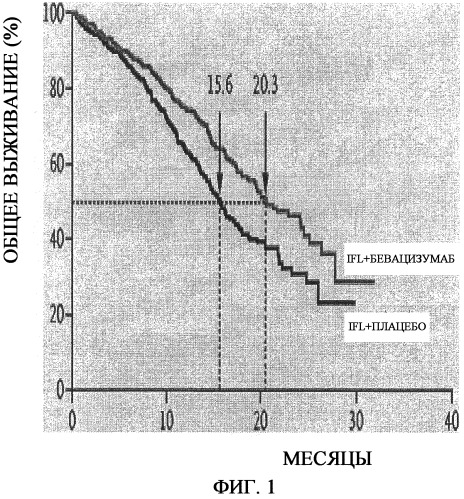
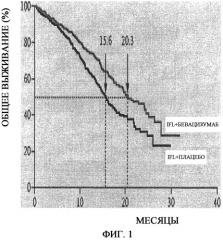
На фиг.1 представлено определение выживаемости по Каплану-Мейеру. Медиана продолжительности выживаемости (указанная пунктирными линиями) составляла 20,3 месяцев в группе, получавшей иринотекан, фторурацил и лейковорин (IFL) плюс бевацизумаб, по сравнению с 15,6 месяцами у группы, получавшей IFL плюс плацебо, что соответствует отношению опасности смерти 0,66 (P<0,001).
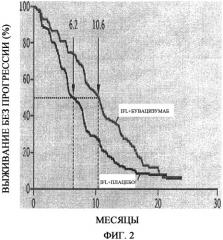
На фиг.2 представлено определение безрецидивного периода выживаемости по Каплану-Мейеру. Медиана продолжительности безрецидивного выживания (указанная пунктирными линиями) составляла 10,6 месяцев в группе, получавшей иринотекан, фторурацил и лейковорин (IFL) плюс бевацизумаб, по сравнению с 6,2 месяцами у группы, получавшей IFL плюс плацебо, что соответствует отношению опасности смерти 0,54 (P<0,001).
На фиг. 3A-3C представлен анализ продолжительности выживаемости в различных подгруппах больных, разделенных по основным характеристикам.
На фиг. 4 представлено определение выживаемости по Каплану-Мейеру при сравнении группы, получавшей 5-FU/LV плюс плацебо, c группой, получавшей 5-FU/LV плюс бевацизумаб (BV).
На фиг. 5 представлено определение безрецидивного периода выживаемости по Каплану-Мейеру при сравнении группы, получавшей 5-FU/LV плюс плацебо, c группой, получавшей 5-FU/LV плюс бевацизумаб (BV).
Подробное описание
предпочтительных вариантов осуществления
I. Определения
Термины «VEGF» и «VEGF-A» применяются взаимозаменяемо для обозначения фактора роста клеток сосудистого эндотелия из 165 аминокислот и относящихся к нему факторов роста клеток сосудистого эндотелия из 121, 189 и 206 аминокислот, как описано Leung et al. Science, 246:1306 (1989) и Houck et al. Mol. Endocrin., 5:1806 (1991), вместе с их существующими в природе аллельными вариантами и формами процессинга. Термин «VEGF» применяется также для обозначения укороченных форм полипептида, включающих аминокислоты с 8 по 109 или с 1 по 109 из 165 аминокислот фактора роста клеток сосудистого эндотелия человека. Ссылка на любую из таких форм VEGF может быть найдена в настоящей заявке, например, под обозначением “VEGF(8-109)”, “VEGF(1-109)” или “VEGF165”. Положения аминокислот «укороченного» нативного VEGF нумеруются, как указано в нативной последовательности. Например, положение 17 аминокислоты (метионин) в укороченном нативном VEGF также представляет собой положение 17 (метионин) в нативном VEGF. Укороченный нативный VEGF обладает связывающим сродством для KDR и рецепторов Flt-1, сравнимым с нативным VEGF.
«Антитело против VEGF» представляет собой антитело, которое связывается с VEGF со значительным сродством и специфичностью. Предпочтительно, чтобы антитело против VEGF изобретения могло быть использовано в качестве терапевтического агента для направленности и вмешательства в заболевания или состояния, в которые вовлечена активность VEGF. Антитело против VEGF обычно не должно связываться ни с другими гомологами VEGF, такими как VEGF-B или VEGF-C, ни с другими факторами роста, такими как PIGF, PDGF или bFGF. Предпочтительное антитело против VEGF является моноклональным антителом, которое связывается с тем же эпитопом, что и моноклональное антитело A4.6.1, продуцируемое гибридомой ATCC HB 10709. Более предпочтительно, чтобы антитело против VEGF представляло собой рекомбинантное моноклональное гуманизированное антитело против VEGF, созданное в соответствии с Presta et al. (1997) Cancer Res. 57:4593-4599, включая, но не ограничиваясь этим, антитело, известное как бевацизумаб (BV; AvastinTM).
«Антагонист VEGF» относится к молекуле, способной нейтрализовать, блокировать, ингибировать, аннулировать, снижать или вмешиваться в активность VEGF, включая его связывание с одним или более рецепторов VEGF. Антагонисты VEGF включают антитела против VEGF и их антигенсвязывающие фрагменты, рецепторные молекулы и производные, которые специфически связываются с VEGF, тем самым препятствуя его связыванию с одним или более рецепторами, антитела против рецептора VEGF и антагонисты рецепторов VEGF, такие как низкомолекулярные ингибиторы VEGFR-тирозинкиназ.
В настоящем описании и формуле изобретения нумерация остатков в тяжелой цепи иммуноглобулина соответствует индексу EU, как в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991), определенно включенного здесь в качестве ссылки. «Индекс EU, как в Kabat» относится к нумерации остатков антитела IgG1 EU человека.
«Нативная последовательность» полипептида включает полипептид, обладающий той же последовательностью аминокислот, что и полипептид природного происхождения. Таким образом, нативная последовательность полипептида может обладать аминокислотной последовательностью полипептида, существующего в природе любого млекопитающего. Такие нативные последовательности полипептида могут быть выделены из природных источников или могут быть получены рекомбинантным или синтетическим способами. Термин «нативная последовательность» полипептида конкретно охватывает существующие в природе укороченные или секретируемые формы полипептида (например, последовательность внеклеточного домена), существующие в природе варианты форм (например, формы альтернативного сплайсинга) и существующие в природе аллельные варианты полипептида.
Полипептидный «вариант» обозначает биологически активный полипептид, имеющий, по меньшей мере, приблизительно 80% идентичности аминокислотной последовательности с нативной последовательностью полипептида. Такие варианты включают, например, полипептиды, в которых один или более аминокислотных остатков добавлены или удалены на N- или C-конце полипептида. Обычно вариант должен иметь, по меньшей мере, приблизительно 80% идентичности аминокислотной последовательности, более предпочтительно, по меньшей мере, приблизительно 90% идентичности аминокислотной последовательности и даже более предпочтительно, по меньшей мере, приблизительно 95% идентичности аминокислотной последовательности с нативной последовательностью полипептида.
Термин «антитело» применяют в широком смысле, и он включает моноклональные антитела (включая полноразмерные или интактные моноклональные антитела), поликлональные антитела, мультивалентные антитела, мультиспецифичные антитела (например, биспецифичные антитела) и фрагменты антител (смотри ниже), до тех пор, пока они проявляют желаемую биологическую активность.
Если не указано иначе, выражение «мультивалентное антитело» применяют в данном описании для обозначения антитела, включающего три или более антигенсвязывающих сайта. Мультивалентное антитело предпочтительно конструируют как имеющее три или более антигенсвязывающих сайтов, и это обычно не нативная последовательность антитела IgM или IgA.
«Фрагменты антител» включают только часть интактного антитела, обычно включая антигенсвязывающий сайт интактного антитела и, таким образом, сохраняя способность связывать антиген. Примеры фрагментов антител, охватываемых настоящим изобретением, включают: (i) Fab фрагмент, имеющий домены VL, CL, VH и CH1; (ii) Fab' фрагмент, который представляет собой Fab фрагмент, имеющий один или более цистеиновых остатков на С-конце домена CH1; (iii) Fd фрагмент, имеющий домены VH и CH1; (iv) Fd' фрагмент, имеющий домены VH и CH1 и один или более цистеиновых остатков на С-конце домена CH1; (v) Fv фрагмент, имеющий домены VL и VH одного плеча антитела; (vi) dAb фрагмент (Ward et al., Nature 341, 544-546 (1989)), который состоит из домена VH; (vii) выделенных областей CDR; (viii) F(ab')2 фрагментов, двухвалентного фрагмента, включающего два Fab' фрагмента, соединенных дисульфидным мостиком в шарнирной области; (ix) одноцепочечных молекул антител (например, одной цепи Fv; scFv) (Bird et al., Science 242:423-426 (1988); и Huston et al., PNAS (USA) 85:5879-5883 (1988)); (x) «двойные антитела» с двумя антигенсвязывающими сайтами, включающими вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в той же самой полипептидной цепи (смотри, например, европейский патент EP 404097; WO 93/11161; и Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993)); (xi) «линейные антитела», включающие пару тандемных сегментов Fd (VH-CH1-VH-CH1), которые совместно с полипептидами комплементарной легкой цепи образуют пару антигенсвязывающих областей (Zapata et al. Protein Eng. 8(10):1057-1062 (1995); и патент США No. 5641870).
Применяемый здесь термин «моноклональное антитело» относится к антителу, полученному из популяции по существу гомогенных антител, т.е. индивидуальные антитела, составляющие популяцию, являются идентичными за исключением возможных возникающих в природе мутаций, которые могут присутствовать в минорном количестве. Моноклональные антитела являются высокоспецифичными, будучи направленными против единственного эпитопа. Более того, в отличие от препаратов поликлональных антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против единственной детерминанты на антигене. Модификация «моноклональное» не была создана как требующая получения антитела каким-либо конкретным способом. Например, моноклональные антитела, применяемые в соответствии с настоящим изобретением, могут быть получены с помощью гибридомного способа, впервые описанного Kohler et al., Nature 256:495 (1975), или могут быть получены путем способов рекомбинантной ДНК (смотри, например, патент США No. 4816567). «Моноклональные антитела» могут быть также выделены из фаговых библиотек антител с применением способов, описанных, например, в Clackson et al., Nature 352:624-628 (1991) or Marks et al., J. Mol. Biol. 222:581-597 (1991).
Моноклональные антитела здесь конкретно включают «гибридные» антитела, в которых часть тяжелой и/или легкой цепи является идентичной или гомологичной соответствующим последовательностям в антителах, происходящих от конкретных видов или принадлежащих к конкретному классу или подклассу антител, в то время как остаток цепи(ей) идентичен или гомологичен соответствующим последовательностям в антителах, происходящих от других видов или принадлежащих к другому классу или подклассу антител, то же относится к фрагментам антител, до тех пор пока они проявляют желаемую биологическую активность (патент США No. 4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)).
«Приближенные к человеческим», или «гуманизированные» формы антител не человека (например, мыши) представляют собой гибридные антитела, которые содержат минимальную часть последовательности иммуноглобулина не от человека. Главным образом гуманизированные антитела представляют собой иммуноглобулины человека (антитело реципиента), в которых остатки из гипервариабельной области реципиента заменены остатками из гипервариабельной области видов, отличных от человека (антитело донора), таких как мышь, крыса, кролик или примат, не являющийся человеком, имеющими желаемую специфичность, аффинность и емкость. В некоторых случаях остатки области рамки считывания (FR) иммуноглобулина человека заменяют соответствующими остатками не от человека. Более того, гуманизированные антитела могут включать остатки, которые не найдены в антителе реципиента или в антителе донора. Данные модификации делаются для дополнительного усовершенствования создания антитела. В целом гуманизированное антитело должно включать по существу все из, по меньшей мере, одного и обычно двух вариабельных доменов, в которых все или по существу все из гипервариабельных петель соответствуют таковым от иммуноглобулина, не относящегося к человеку, и все или по существу все из FRs относятся к последовательности иммуноглобулина человека. Гуманизированное антитело необязательно должно также включать, по меньшей мере, часть константной области иммуноглобулина (Fc), обычно таковую от иммуноглобулина человека. Для дополнительных подробностей смотри Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992).
«Антитело человека» представляет собой такое, которое обладает аминокислотной последовательностью, соответствующей таковой антитела, продуцируемого человеком, и/или создано с применением любого из способов для создания антител человека, как раскрывается здесь. Данное определение антитела человека конкретно исключает гуманизированное антитело, включающее антигенсвязывающие остатки не от человека. Антитела человека могут быть получены с применением различных способов, известных в данной области техники. В одном осуществлении антитело человека выбрано из библиотеки фагов, где библиотека фагов экспрессирует антитела человека (Vaughan et al. Nature Biotechnology 14:309-314 (1996): Sheets et al. PNAS (USA) 95:6157-6162 (1998)); Hoogenboom и Winter, J. Mol. Biol., 227:381 (1991); Marks et al., J. Mol. Biol., 222:581 (1991)). Антитела человека могут быть также созданы путем введения локусов иммуноглобулина человека в трансгенных животных, например мышей, у которых эндогенные гены иммуноглобулина были частично или полностью инактивированы. При нагрузке наблюдается продукция антитела человека, которое имеет близкое сходство с имеющимся у людей во всех отношениях, включая реорганизацию гена, сборку и репертуар антител. Данный подход описан, например, в патентах США 5545807; 5545806; 5,569,825; 5625126; 5633425; 5661016, и в следующих научных публикациях: Marks et al., Bio/Technology 10: 779-783 (1992); Lonberg et al., Nature 368: 856-859 (1994); Morrison, Nature 368:812-13 (1994); Fishwild et al., Nature Biotechnology 14: 845-51 (1996); Neuberger, Nature Biotechnology 14: 826 (1996); Lonberg и Huszar, Intern. Rev. Immunol. 13:65-93 (1995). Альтернативно, антитело человека может быть получено путем иммортализации В-лимфоцитов человека, продуцирующих антитело, направленное против антигена-мишени (такие В-лимфоциты могут быть получены от индивидуума или могут быть проиммунизированы in vitro). Смотри, например, Cole et al., Monoclonal Antibodies и Cancer Therapy, Alan R. Liss, p. 77 (1985); Boerner et al., J. Immunol., 147 (1):86-95 (1991); и патент США No. 5750373.
Антитело со «зрелой аффинностью» представляет собой антитело с одним или более изменений в одной или более его CDRs, что ведет к улучшению аффинности антитела в отношении антигена по сравнению с родительским антителом, которое не обладает таким(ми) изменением(ями). Предпочтительные антитела со зрелой аффинностью должны иметь наномолярную или даже пикомолярную аффинность в отношении антигена-мишени. Антитела со зрелой аффинностью получают с помощью способов, известных в данной области техники. Marks et al. Bio/Technology 10:779-783 (1992) описывает созревание аффинности путем перестановки доменов VH и VL. Случайный мутагенез CDR и/или остатков рамки считывания описывается: Barbas et al. Proc Nat. Acad. Sci, USA 91:3809-3813 (1994); Schier et al. Gene 169:147-155 (1995); Yelton et al. J. Immunol. 155:1994-2004 (1995); Jackson et al., J. Immunol. 154(7):3310-9 (1995); и Hawkins et al, J. Mol. Biol. 226:889-896 (1992).
«Выделенный» полипептид представляет собой полипептид, который идентифицирован и отделен или получен из компонента своего природного окружения. Загрязняющие компоненты его природного окружения представляют собой материалы, которые будут препятствовать диагностическому или терапевтическому применению полипептида, и могут включать ферменты, гормоны и другие белковые или не белковые растворы. В предпочтительных осуществлениях полипептид должен быть очищен (1) до более 95% по массе полипептида при определении методом Лоури и наиболее предпочтительно до более 99% по массе, (2) до степени, достаточной для получения, по меньшей мере, 15 остатков N-конца или внутренней аминокислотной последовательности при применении секвенатора с роторным стаканом, или (3) до гомогенности с помощью ПААГЭ с ДДС-Na при восстанавливающих или невосстанавливающих условиях с применением Кумасси синего или, предпочтительно, окраски серебром. Выделенный полипептид включает полипептид in situ в рекомбинантных клетках, так как, по меньшей мере, один компонент природного окружения полипептида не будет присутствовать. Обычно, однако, выделенный полипептид должен быть получен с помощью, по меньшей мере, одной стадии очистки.
«Функциональный антигенсвязывающий сайт» антитела представляет собой такой, который способен связывать антиген-мишень. Антигенсвязывающее сродство антигенсвязывающего сайта необязательно так сильно, как родительского антитела, из которого происходит антигенсвязывающий сайт, но способность связывать антиген должна быть измеримой при применении одного или различных способов, известных для оценки связывания антитела с антигеном. Более того, здесь не требуется, чтобы антигенсвязывающее сродство каждого из антигенсвязывающих сайтов мультивалентного антитела было количественно тем же самым. Для мультимерных антител здесь количество функциональных антигенсвязывающих сайтов может быть оценено с применением анализа с помощью ультрацентрифугирования, как описано в примере 2 ниже. В соответствии с данным способом анализа различные отношения антиген-мишень и мультимерное антитело объединяются в разных отношениях и рассчитывается средняя молекулярная масса комплексов, предполагающая различное число функциональных связывающих сайтов. Данные теоретические величины сравнивают с действительными экспериментальными величинами, полученными для того, чтобы оценить число функциональных связывающих сайтов.
Антитело, имеющее «биологическую особенность» обозначенного антитела, представляет собой антитело, которое обладает одной или более биологических особенностей данного антитела, которые отличают его от других антител, связывающихся с тем же антигеном.
Для скрининга антител, которые связываются с эпитопом на антигене, связанном интересующим антителом, может быть применен общепринятый тест перекрестного блокирования, такой как описанный в Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow и David Lane (1988).
«Антитело-агонист» представляет собой антитело, которое связывается с рецептором и активирует его. Обычно способность антитела-агониста к активации рецептора должна быть, по меньшей мере, качественно сходной (и может быть по существу количественно сходной) с нативным лигандом агонистом рецептора. Примером антитела-агониста является такое, которое связывается с рецептором суперсемейства рецепторов TNF и индуцирует апоптоз клеток, экспрессирующих рецептор TNF. Тесты для определения индукции апоптоза описаны, например, в WO98/51793 и WO99/37684, обе из которых особо включены здесь в качестве ссылки.
«Нарушение» представляет собой любое состояние, которое должно улучшиться при лечении антителом. Оно включает хронические и острые нарушения или заболевания, включая те патологические состояния, которые предрасполагают млекопитающего к рассматриваемому нарушению. Неограничивающие примеры нарушений, подвергаемых здесь лечению, включают доброкачественные и злокачественные опухоли; лейкозы и злокачественные новообразования лимфоидной системы; нарушения нейронов, глии, астроцитов, гипоталамуса и другие нарушения желез, макрофагов, эпителия, стромальных клеток и бластоцеля; и воспалительные, ангиогенные и иммунологические нарушения.
Термин «терапевтически эффективное количество» относится к количеству лекарства, эффективному для л