2-арилпропионовые кислоты и производные, и фармацевтические композиции, содержащие указанные соединения
Иллюстрации
Показать всеНастоящее изобретение относится к соединению формулы (I), где R1 выбирают из H и CH3; R2 выбирают из H и линейного C1-C4-алкила; Х означает ОН или остаток формулы NHR3, где R3 выбирают из H, OH, С1-С5-алкила, С3-С6-циклоалкила, С1-С5-алкокси; неразветвленного или разветвленного С1-С6-алкила, замещенного карбокси-(СООН) группой; остатка формулы SO2R4, где R4 означает С1-С2-алкил, С3-С6-циклоалкил, С1-С3-галогеналкил; Y означает гетероатом, выбранный из S, О и N; Z означает остаток, выбранный из галогена, линейного или разветвленного С1-С4-алкила, гидрокси, амино, С1-С4-ациламино, галоген-С1-С3-алкила, линейного или разветвленного С1-С8-алкансульфонамида, и фармацевтически приемлемым солям указанного соединения. Изобретение также относится к способу получения соединений формулы (I). Соединения применяют для предупреждения и лечения повреждения тканей в составе фармацевтической композиции. Данное изобретение касается применения соединений в лечении таких болезней, как транзиторная ишемия головного мозга, буллезный пемфигоид, ревматоидный артрит, идиопатический фиброз, гломерулонефрит и поражения, вызванные ишемией и реперфузией. Технический результат - (R,S)-2-арилпропионовые кислоты и их соответствующие производные, полезные для профилактики и лечения повреждения тканей, вызванного усиленным рекрутингом полиморфно-ядерных нейтрофилов (ПМЯ-лейкоцитов) на участках воспаления. 4 н. и 7 з.п. ф-лы, 2 табл., 46 пр.
Реферат
Краткое описание изобретения
Данное изобретение касается (R,S)-2-арилпропионовых кислот и соответствующих производных, отдельного (S)-энантиомера и фармацевтических композиций, содержащих указанные соединения, полезных для предупреждения и лечения повреждения тканей, вызванного усиленным рекрутингом полиморфно-ядерных нейтрофилов (ПМЯ-лейкоцитов) на участках воспаления.
Существующий уровень техники
Особые клетки крови (макрофаги, гранулоциты, нейтрофилы, полиморфно-ядерные) отвечают на химические стимулы, мигрируя вдоль градиента концентрации стимулирующего агента посредством процесса, называемого хемотаксис. Хемокины составляют большое семейство хемотаксических цитокинов, проявляющих свое действие через взаимодействие с рецепторами, принадлежащими семейству 7TM-GPCRs. Система хемокинов крайне важна для регулирования и контроля основного гомеостатического и воспалительного движения лейкоцитов. Функциональные последствия активации рецепторов хемокинов включают миграцию, дегрануляцию лейкоцитов, транскрипцию генов, митогенный и апоптотический эффекты.
Известны другие хемотаксические факторы, не относящиеся к семейству GPCRs, включающие продукты распада комплемента C5a, некоторые N-формилпептиды, генерированные в результате лизиса бактериальной поверхности, или пептиды синтетического происхождения, такие как формилметиониллейцилфенилаланин (f-MLP) и, в основном, различные цитокины, включающие интерлейкин-8 (CXCL8).
CXCL8 (интерлейкин-8) является эндогенным хемотактическим фактором, продуцируемым большинством ядросодержащих клеток, таких как фибробласты, макрофаги, эндотелиальные и эпителиальные клетки. К семейству такого хемотаксического фактора принадлежат ряды CXCL8-подобных хемокинов [GRO α, β, γ и NAP-2], которые связываются с CXCL8-рецепторами CXCR1 и CXCR2 (Chang et al., J. Immunol., 148, 451, 1992). Нейтрофилы представляют собой первую линию защиты против бактериальной инфекции вследствие способности указанных клеток мигрировать из периферической крови через эндотелиальные соединения и тканевые матрицы к местам действия (то есть по направлению градиентов концентрации хемотаксического фактора), где действуют, атакуя микроорганизмы, удаляя поврежденные клетки и восстанавливая ткани (M.A. Goucerot-Podicalo et al., Pathol. Biol (Paris), 44, 36, 1996).
При некоторых патологических состояниях, характеризующихся усиленным рекрутингом нейтрофилов, более серьезное повреждение ткани на месте связано с инфильтрацией нейтрофилов. Широко продемонстрирована роль активации нейтрофилов в оценке повреждения, связанного с постишемической реперфузией и легочной гипероксией. Экспериментальными моделями [N. Sekido et al., Nature, 365, 654, 1993 и T. Matsumoto et al., Lab. Investig., 77, 119, 1997] и клиническими исследованиями (A Mazzone et al., Recent Prog. Med., 85, 397, 1994; G. Receipts et al., Atheroscl., 91, 1, 1991) обнаружена прямая корреляция между клеточным повреждением и степенью инфильтрации ПМЯ-лейкоцитов, где CXCL8 является наиболее специфическим и сильным активатором.
Показана специфическая роль CXCL8 в вызывании повреждения после постишемической реперфузии у пациентов с острым инфарктом миокарда (Y. Abe et al., Br. Heart J., 70, 132, 1993). Экспериментальными исследованиями обнаружены рекрутинг и инфлюкс в пораженный головной мозг васкулярных лейкоцитов, в основном ПМЯ, в ранний постишемический период и, в поздний, моноцитов/макрофагов, экспрессия провоспалительных цитокинов, хемокинов и адгезивных молекул (U. Dirnagl et al., Trends Neurosci., 22, 391, 1999). Активированные ПМЯ участвуют в повреждении мозга, вызывая микроваскулярную окклюзию и продуцирование токсических медиаторов, таких как цитокины, реакционноспособный кислород и метаболиты азота, и липидные медиаторы (V. Witko-Sarsat et al., Lab. Invest., 80, 617, 2000). Роль ПМЯ-инфильтрации в развитии вызванного ишемией поражения и принципы снижения ПМЯ-аккумуляции изучены с помощью моделей транзиторной ишемии головного мозга на животных (N. Jiang et al., Brain Res., 788, 25, 1998). Было выдвинуто предположение, что ПМЯ-хемоатрактантные CXC хемокины, включая CXCL8, вовлечены в церебральную постишемическую аккумуляцию и активацию лейкоцитов (R.M. Ransohoff et al., Trends Neurosci., 21, 154, 1998). Действительно, сообщается о системных увеличениях CXCL8 у пациентов с ишемическим инсультом и аналогичное транзиторное увеличение в CINC, CXCL8-подобном хемокине нейтрофилов крыс, родственном с CXCL8 у людей, обнаружено на ишемических участках головного мозга (Y. Yamasaki et al., Stroke, 16, 318, 1995). Некоторые исследования нейропротекции с использованием подхода, основанного на применении антител против CXCL8, оказались успешны на кролике и крысе, что подтверждает потенциальную возможность направленной на CXCL8 терапии при ишемии головного мозга (T. Matsumoto et al., Lab. Invest., 77, 119, 1997, Y. Yamasaki et al., Brain Res., 759, 103, 1997, S. Yamagami et al., J. Leukoc. Biol, 65, 744, 1999).
Направленность на хемокины и/или соответствующие рецепторы является также перспективным подходом при лечении хронических воспалительных нарушений, таких как ревматоидный артрит (RA), воспалительные заболевания кишечника, рассеянный склероз и отторжения трансплантата. Комплексная сетчатая структура адгезивных молекул и хемокинов координирует миграцию клеток, согласованным действием индуцируя воспалительную реакцию, отдельные исследования посвящены изучению роли рецепторов хемокинов в патогенезе хронических заболеваний (JJ. Haringman et al, Ann. Rheum. Dis., 63, 1186, 2004).
Сообщается также о вовлечении различных хемокинов в патогенез некоторых дерматозов, таких как буллезный пемфигоид (BP), болезнь, вызывающая образование субэпидермальных пузырей, связанная с продуцированием аутоантител к гемидесмосомальному аутоантигену BP 180 KD (BP 180). В том числе CXCL8 вовлечен в воспалительный процесс как человеческого, так и экспериментального мышиного BP. Высокие уровни CXCL8 обнаружены в повреждениях кожи или сыворотке пациентов с BP и, в экспериментальной модели BP на мышах, инъекции CXCL8 способствуют образованию пузырей у C5-мышей или мышей с дефицитом тучных клеток, в противном случае устойчивых к индуцированию пузырей (Z. Liu et al., J. Clin. Invest., 95, 1539, 1995). Дополнетельно продемонстрировано, что антитела к BP180 опосредуют зависимое от дозы и времени высвобождение CXCL8 из культивированных нормальных эпидермальных кератиноцитов (E. Schmidt et al., J. Invest. Dermatol. 115, 842, 2000).
Как сообщается, биологическая активность CXCL8 опосредуется взаимодействием CXCL8 с CXCR1 и CXCR2 рецепторами мембраны клетки, принадлежащими к семейству из семи трансмембранных рецепторов и экспрессированными на поверхности нейтрофилов человека и некоторых типов T-клеток (L. Xu et al., J. Leukocyte Biol., 57, 335, 1995). Хотя известно, что активация CXCR1 играет решающую роль в опосредованном CXCL8 хемотаксисе, недавно было выдвинуто предположение, что активация CXCR2 может играть патофизиологическую роль в хронических воспалительных заболеваниях.
RA является хроническим системным воспалительным нарушением, которое поражает преимущественно суставы, вызывая пролиферативный синовит, который часто развивается до разрушения суставного хряща и неподвижности суставов. Активированные T-клетки, моноциты/макрофаги и нейтрофилы (PMN) являются преимущественным типом клеток, вовлеченных в синовиальное воспаление. Проникновение лейкоцитов через эндотелиальный барьер в синовиальную ткань и синовиальную жидкость считается решающим событием в патогенезе RA (Z. Szekanecz et al., J. Invest. Med., 44, 124, 1996). Повышенная направленная миграция клеток объясняется повышенной экспрессией провоспалительных медиаторов (цитокинов и хемокинов) и адгезивных молекул (Z. Szekanecz et al., Sem. Immunol., 15, 15, 2003). В частности, некоторые хемотаксические цитокины непосредственно вовлечены в рекрутинг и активацию ПМЯ- и мононуклеарных клеток во время развития RA. Специфическая патогенная роль CXCL8, CXCL5, CXCL1 и CXCL6 в синовите RA наглядно продемонстрирована и явно связана со специфической ролью хемокинов CXC в рекрутинге нейтрофилов, а также в промотировании ангиогенеза. На сегодняшний день, некоторые изучения основаны на концепции, что CXCL8 и CXCL1 являются основными медиаторами воспаления и разрушение суставов при RA и повышенные уровни указанных хемокинов обнаружены в синовиальных тканях и жидкостях пациентов с RA (A.E. Koch et al., J. Immunol., 147, 2187, 1991). Подобные данные получены в некоторых моделях на животных и в модели острого артрита, вызванного инъекцией в коленный сустав кролика LPS или кристаллов урата мононатрия, рекрутинг ПМЯ блокировали обработкой нейтрализующим специфическим антителом к CXCL8 с одновременной защитой от опухания суставов и повреждения тканей (P. L. Podolin et al., J. Immunol. 169, 6435, 2002). В противоположность реагентам, нейтрализующим активность отдельного хемокина, антагонист мультилигандного рецептора, такого как CXCR2, может блокировать активность всех медиаторов, действующих через рецептор, частично преодолевая избыточность системы и, таким образом, индуцируя более сильные биологические эффекты (KJ. Katschke et al., Arthritis Rheum., 44,1022, 2001).
Исследования вклада отдельных (S)- и (R)-энантиомеров кетопрофена в противовоспалительную активность рацемата и роли указанных энантиомеров в модуляции хемокина показывают (P. Ghezzi et al., J. Exp. Pharm. Ther., 287, 969, 1998), что два энантиомера и соответствующие соли могут ингибировать дозозависимым образом хемотаксис и рост внутриклеточной концентрации ионов Ca2+, индуцируемый CXCL8 на ПМЯ-лейкоцитах (EP0935961). Впоследствии было показано (C. Bizzarri et al., Biochem. Pharmacol. 61, 1429, 2001), что кетопрофен вносит свою долю в ингибирующую активность биологической активности CXCL8 по отношению к другим молекулам, принадлежащим к классу противовоспалительных нестероидных препаратов (NSAIDs), таких как флурбипрофен и ибупрофен. Рацемические смеси, (R-) и (S)-энантиомеры 2-арилпропионовой кислоты, являются ингибиторами индуцированного CXCL8 хемотаксиса ПМЯ и ПМЯ-дегрануляции (WO 03/043625), не проявляя активность в отношении COXs. Соединения по изобретению, как рацемические смеси, так и (S)-энантиомеры, хотя и лишены какой-либо активности в отношении COXs, но, замещенные в 4-положении фенильного кольца замещенными гетероциклами, такими как 2-аминотиазолы или 2-аминооксазолы, значительно более эффективны в ингибировании индуцированного CXCL8 хемотаксиса (активны в низком наномолярном диапазоне) по сравнению с ранее описанными соединениями (активными в микромолярном диапазоне). (R)-амиды и (R)-сульфонамиды (WO 01/58852 и WO 00/24710) описаны как эффективные ингибиторы индуцированного CXCL8 хемотаксиса ПМЯ.
Авторами неожиданно было обнаружено, что также (S)-амиды и (S)-сульфонамиды, производные 2-арилпропионовых кислот, соответственно замещенные в 4-положении фенильного кольца замещенными гетероциклами, такими как 2-аминотиазолы или 2-аминооксазолы, вносят свою долю в хорошую биологическую активность в ингибировании индуцированного CXCL8 хемотаксиса ПМЯ.
Подробное описание изобретения
Новые молекулы принадлежат к новому классу 2-арилпропионовых кислот и производных, замещенных в 4-положении 2-аминогетероциклами. При введении заместителей, указанных ниже, соединения формулы (I), а также (S)-амиды и (S) сульфонамиды, полученные из исходных карбоновых кислот, являются хорошими ингибиторами индуцированного CXCL8 хемотаксиса. Данная особенность является неожиданной, поскольку обычно наблюдается отсутствие ингибирующей активности в отношении CXCL8 для (S)-2-арилпропанамидов, относящихся к другим химическим классам уже заявленных соединений (WO 01/58852 и WO 00/24710).
Данное изобретение обеспечивает, таким образом, (R,S)-2-арилпропионовые кислоты и производные формулы (I):
и соответствующие отдельные (S)-энантиомеры,
и фармацевтически приемлемые соли указанных соединений,
где
R1 выбирают из
- H и CH3;
X означает OH или остаток формулы NHR3,
где
R2 выбирают из
- H и линейного C1-C4-алкила;
R3 выбирают из
- H, OH, C1-C5-алкила, C3-C6-циклоалкила, C2-C5-алкенила, C1-C5-алкокси;
- неразветвленного или разветвленного C1-C6-алкила, C3-C6-циклоалкила, C2-C6-алкенила, C1-C6-фенилалкила, замещенного карбокси-(COOH) группой;
- остатка формулы SO2R4, где R4 означает C1-C2-алкила, C3-C6-циклоалкила, C1-C3-галогеналкила;
Y означает гетероатом, выбираемый из
- S, O и N,
Z означает остаток, выбираемый из
- галогена, линейного или разветвленного C1-C4-алкила, C2-C4-алкенила, C2-C4-алкинила, C1-C4-алкокси, гидрокси, карбоксила, C1-C4-ацилокси, фенокси, циано, нитро, амино, C1-C4-ациламино, галоген-C1-C3-алкила, галоген-C1-C3-алкокси, бензоила, линейного или разветвленного C1-C8-алкансульфоната, линейного или разветвленного C1-C8-алкансульфонамида, линейного или разветвленного C1-C8-алкилсульфонилметила.
Предпочтительными соединениями по изобретению являются те соединения, в которых:
R1 означает CH3;
R2 выбирают из
- H и CH3;
X означает OH;
Y выбирают из
- S и O;
Z выбирают из
- галогена, линейного или разветвленного C1-C4-алкила, C2-C4-алкенила, C1-C4-ацилокси, фенокси, циано, нитро, галоген-C1-C3-алкила, бензоила, линейного или разветвленного C1-C8-алкансульфоната, линейного или разветвленного C1-C8-алкансульфонамида.
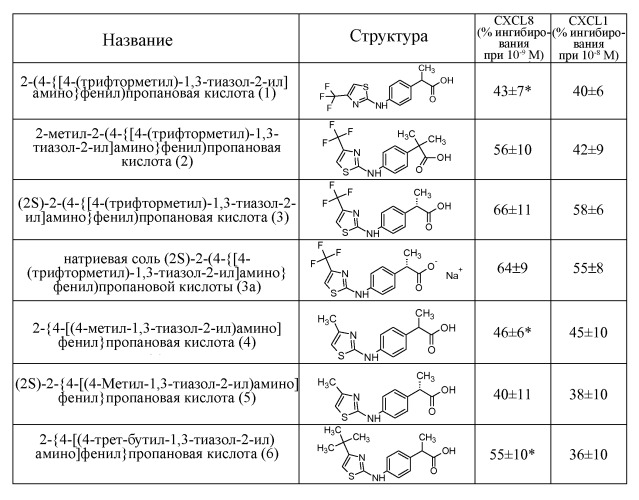
Предпочтительными соединениями по изобретению являются:
1- 2-[4-(4-трифторметилтиазол-2-ил)аминофенил]пропионовая кислота;
2- 2-метил-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановая кислота;
3- (2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановая кислота;
3a- натриевая соль (2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановой кислоты;
4- 2-{4-[(4-метил-1,3-тиазол-2-ил)амино]фенил}пропановая кислота;
5- (2S)-2-{4-[(4-метил-1,3-тиазол-2-ил)амино]фенил}пропановая кислота;
6- 2-{4-[(4-трет-бутил-1,3-тиазол-2-ил)амино]фенил}пропановая кислота;
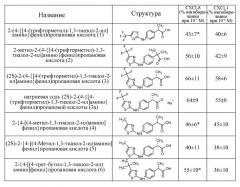
7- (2S)-2-{4-[(4-трет-бутил-1,3-тиазол-2-ил)амино]фенил}пропановая кислота;
8- 2-(4-{метил-[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановая кислота;
9- (2S)-2-(4-{метил-[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановая кислота;
10- (2S)-N-гидрокси-2-(4-{[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропанамид;
11- (2S)-N-(метилсульфонил)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропанамид;
12- (2S)-N-[(трифторметил)сульфонил]-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропанамид;
13- (2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенилпропанамид;
14- (2S)-2-(4-{метил-[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропанамид;
15- (2S)-2-{4-[(4-третбутил-1,3-тиазол-2-ил)амино]фенил}пропанамид;
16- (2R)-2-{[(2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноил]амино}пропановая кислота;
17- (2S)-3-метил-2-{[(2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноил]амино}бутановая кислота;
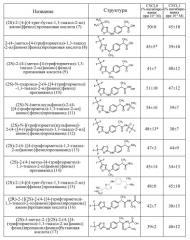
18- 2-{4-[(4-трифторметил)оксазол-2-ил]амино}фенилпропионовая кислота;
19- (2R)-2-(4-{[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропановая кислота;
20- (2S)-2-(4-{метил-[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропановая кислота;
21- (2S)-N-(метилсульфонил)-2-(4-{[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропанамид;
22- (2S)-2-(4-{[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропанамид;
23- (2S)-2-(4-{метил-[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропанамид;
24- (2S)-2-{[(2S)-2-(4-{[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропаноил]амино}пропановая кислота;
25- (2S)-N-[(1S)-2-амино-1-метил-2-оксоэтил]-2-(4-{[4-(трифторметил)-1,3-оксазол-2-ил]амино}фенил)пропанамид.
Наиболее предпочтительными соединениями из списка являются соединение 3 [(2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановая кислота] и соответствующая натриевая соль 3a.
Соединения по изобретению формулы (I) обычно выделяют в форме аддитивных солей как с органическими, так и неорганическими фармацевтически приемлемыми основаниями. Примерами таких оснований являются: гидроксид натрия, гидроксид калия, гидроксид кальция, (D,L)-лизин, L-лизин, трометамин.
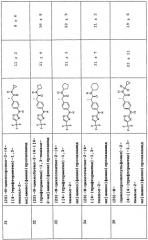
Соединения по изобретению формулы (I) оценивали in vitro на способность ингибировать хемотаксис полиморфно-ядерных лейкоцитов (называемых здесь ПМЯ) и моноцитов, индуцированных фракциями CXCL8 и GRO-α. С данной целью, для выделения ПМЯ из гепаринизированной крови человека, забранной у здоровых взрослых волонтеров, мононуклеаты удаляли осаждением на декстране (WJ. Ming et al, J. Immunol., 138, 1469, 1987). Жизнеспособность клеток определяли исключением с трипановым синим, тогда как соотношение циркулирующих полиморфно-ядерных полиморфонуклеаров оценивали по цитоцентрифугату после окрашивания с помощью Diff Quick.
В испытании на индуцированный CXCL8 хемотаксис использовали человеческий рекомбинантный CXCL8 (Pepro Tech) в качестве стимулирующего агента в хемотаксических экспериментах: лиофилизованный белок растворяли в объеме HBSS, содержащем 0,2% альбумина бычьей сыворотки (BSA), для получения основного раствора с концентрацией 10-5 М, разбавляемого HBSS до концентрации 10-9 М, для испытаний на хемотаксис.
Ингибирование индуцируемого GRO-α хемотаксиса оценивали аналогичным испытанием.
В хемотаксических экспериментах, ПМЯ инкубировали с соединениями по изобретению формулы (I) в течение 15' при 37°C в атмосфере, содержащей 5% CO2. Во время испытания на хемотаксис (W. Falket et al., J. Immunol. Methods, 33, 239, 1980) использовалине содержащие ПВП фильтры с пористостью 5 мкм и подходящие для репликации микрокамеры.
Соединения по изобретению формулы (I) оценивали при концентрации, изменяющейся в диапазоне от 10-6 до 10-10 М; для данной цели указанные соединения, добавляли при одинаковой концентрации как к нижним порам, так и верхним порам микрокамеры. Оценку способности соединений по изобретению формулы (I) ингибировать хемотаксис моноцитов человека проводили по описанной методике (J. Van Damme et al., Eur. J. Immunol., 19, 2367, 1989).
Все соединения по изобретению проявляли высокую степень селективности в отношении ингибирования индуцированного CXCL8 хемотаксиса по сравнению с хемотаксисом, индуцированным C5a
(10-6 М) или f-MLP (10-6 М).
Установлено, что соединения формулы (I), оцененные ex vivo в крови в целом по описанной методике (Patrignani et al., J. Pharmacol. Exper. Ther., 271, 1705, 1994), абсолютно неэффективны в качестве ингибиторов ферментов циклооксигеназ. Действительно, соединения по изобретению не препятствуют продуцированию PGE2 в мышиных макрофагах, стимулируемому липополисахаридами (LPS, 1 мкг/мл), при концентрации в диапазоне от 10-5 до 10-6 M.
По причине отсутствия ингибирующей активности в отношении COX у рацематов и (S)-энантиомеров описанных 2-арилпропионовых кислот и соответствующих производных, соединения по изобретению представляют собой новые примеры 2-арилпропионовых кислот и соответствующих производных с необходимыми отличительными признаками для терапевтического применения при патологиях, связанных с усиленными хемотаксисом и активацией нейтрофилов, индуцируемых CXCL8.
Таким образом, дальнейшая цель изобретения состоит в применении соединений формулы (I) в лечении заболеваний с вовлечением индуцируемого CXCL8 хемотаксиса ПМЯ человека.
Соединения по данному изобретению, в частности, полезны для предупреждения и лечения поражений, вызванных ишемией/реперфузией, в особенности в защите от функционального повреждения, вызываемого временной окклюзией средней артерии головного мозга (MCA). В частности, соединение 3a оценивали на предмет эффективности в модели транзиторной ишемии головного мозга, вызванной у крыс окклюзией средней мозговой артерии (MCA). Изучено кратковременное воздействие (24 часа) 3a на активность миелопероксидазы головного мозга (MPO), маркер ПМЯ-инфильтрации, повреждение головного мозга и неврологические расстройства. Соединение эффективно в снижении инфильтрата ПМЯ, размера инфаркта и улучшении, в значительной степени, неврологических функций.
Далее, с точки зрения экспериментального доказательства, обсуждаемого выше, и роли, выполняемой CXCL8 и агентами общего происхождения в процессах, которые включают в себя активацию и инфильтрацию нейтрофилов, соединения по изобретению являются эффективными при лечении таких хронических заболеваний, как буллезный пемфигоид, ревматоидный артрит (M. Selz et al., J. Clin. Invest., 87, 463, 1981), идиопатический фиброз (E. J. Miller, цитируемый ранее, и P. C. Carre et al., J. Clin. Invest., 88, 1882, 1991) и гломерулонефрит (T. Wada et al., J. Exp. Med., 180, 1135, 1994).
Поэтому еще одной целью данного изобретения является применение соединений формулы (I) при лечении поражений, вызванных такими заболеваниями, как ишемия и реперфузия, буллезный пемфигоид, ревматоидный артрит, идиопатический фиброз, гломерулонефрит и, в особенности, применения при лечении транзиторной ишемии головного мозга.
Фармацевтические композиции, включающие соединение по изобретению и подходящий носитель, также охватываются рамками объема данного изобретения.
Соединения по изобретению вместе с обычно используемым вспомогательным средством, носителем, разбавителем или наполнителем могут быть фактически представлены в форме фармацевтических композиций и стандартных лекарственных форм и в такой форме могут применяться в твердом виде, таком как таблетки или наполненные капсулы, или в виде жидкостей, таких как растворы, суспензии, эмульсии, эликсиры, или в виде наполненных указанными жидкостями капсул, причем все перечисленное предназначено для перорального применения, или в форме стерильных инъецируемых растворов для парентерального (в том числе подкожного) применения. Такие фармацевтические композиции и соответствующие стандартные лекарственные формы могут включать ингредиенты в общепринятых пропорциях, при наличии или отсутствии дополнительных активных соединений или действующих начал, и такие стандартные лекарственные формы могут содержать любое подходящее эффективное количество активного ингредиента, соразмерное с заданным диапазоном суточных доз для применения.
При применении в качестве фармацевтических средств кислоты по данному изобретению обычно вводят в форме фармацевтической композиции. Такие композиции могут быть получены способом, хорошо известным в фармацевтической области, и включают, по меньшей мере, одно активное соединение. Обычно соединения по данному изобретению вводят в фармацевтически эффективном количестве. Количество соединения для фактического введения обычно определяет врач с учетом конкретных обстоятельств, включающих излечиваемое состояние, выбранный способ введения, реальное вводимое соединение, возраст, массу и восприимчивость отдельного пациента, тяжесть симптомов пациента и тому подобное.
Фармацевтические композиции по изобретению можно вводить различными путями, включающими пероральный, ректальный, трансдермальный, подкожный, внутривенный, внутримышечный и интраназальный. В зависимости от предполагаемого способа доставки, соединения предпочтительно формулировать в виде либо инъецируемых, либо пероральных композиций. Композиции для перорального введения могут быть в форме нерасфасованных жидких растворов или суспензий или нерасфасованных порошков. Однако обычно композиции представляют в виде единичных дозированных форм, что способствует достижению точной дозировки. Термин "единичная дозированная форма/формы" относится к физически дискретным единицам, пригодным в качестве однократных доз для субъекта-человека и других млекопитающих, причем каждая единица содержит предварительно определенное количество активного вещества, рассчитанное для достижения требуемого терапевтического действия, в сочетании с подходящим фармацевтическим наполнителем. Типичные единичные дозированные формы включают предварительно наполненные, содержащие предварительно отмеренное количество жидких композиций ампулы или шприцы, или пилюли, таблетки, капсулы или тому подобное в случае твердых композиций. В таких композициях кислотное соединение обычно является меньшим компонентом (приблизительно от 0,1 до 50 мас. % или, предпочтительно, приблизительно от 1 до 40 мас. %), причем остальное количество составляют различные наполнители или носители и используемые в производственном процессе вспомогательные вещества, целесообразные для формирования требуемой лекарственной формы.
Жидкие формы, подходящие для перорального введения, могут включать подходящий водный или неводный наполнитель с буферами, суспендирующими и диспергирующими агентами, красящими веществами, корригентами и тому подобным. Жидкие формы, в том числе описанные ниже инъецируемые композиции, всегда хранят в отсутствие света, чтобы избежать любого каталитического действия света, такого как образование гидропероксида или пероксида. Твердые формы могут включать, например, любой из следующих ингредиентов или соединений подобного характера: связывающее вещество, такое как микрокристаллическая целлюлоза, трагакантная камедь или желатин; наполнитель, такой как крахмал или лактоза, дезинтегрирующий агент, такой как альгиновая кислота, примогель или кукурузный крахмал; смазывающее вещество, такое как стеарат магния; вещество, придающее скольжение, такое как коллоидальный диоксид кремния; подсластитель, такой как сахароза или сахарин; или корригент, такой как мята перечная, метилсалицилат или апельсиновый корригент.
Композиции для инъекций обычно основаны на инъецируемом стерильном солевом растворе, или забуференном фосфатом солевом растворе, или других инъецируемых носителях, известных из уровня техники. Как указано выше, кислотное производное формулы I в таких композициях является обычно меньшим компонентом, часто составляющим от 0,05 до 10 мас. %, причем остальное количество составляет инъецируемый носитель и тому подобное. Средняя суточная доза будет зависеть от различных факторов, таких как тяжесть заболевания и состояния пациента (возраст, пол и масса). Доза обычно варьирует от 1 мг или нескольких мг до 1500 мг соединений формулы (I) в день, такую дозу необязательно делят для нескольких введений. Благодаря низкой токсичности соединений по изобретению можно также вводить более высокие дозы на протяжении длительных периодов времени.
Описанные выше компоненты для перорально вводимых или инъецируемых композиций являются лишь репрезентативными. Дополнительные вещества, а также способы обработки и тому подобное описаны в части 8 публикации "Remington's Pharmaceutical Sciences Handbook", 18th Edition, 1990, Mack Publishing Company, Easton, Pennsylvania, которая включена здесь в качестве ссылки.
Соединения по изобретению могут также быть введены в формах замедленного высвобождения или с помощью систем доставки лекарственного средства с замедленным высвобождением. Описание характерных примеров материалов, обеспечивающих замедленное высвобождение, можно также найти во включенных материалах в указанном выше справочнике Ремингтона.
Настоящее изобретение иллюстрируется с помощью следующих примеров, которые не следует истолковывать как ограничивающие объем изобретения.
Получение соединений формулы (I) осуществляют, используя известные способы синтеза как кислот, так и родственных амидов и ацилсульфонамидов. Основными промежуточными соединениями для рацемических и (S)-энантиомерных соединений являются рацемический и (S)-энантиомерный метил-2-[4-(карбамотиоиламино)фенил]пропаноат и метил-2-[4-(карбамоиламино)фенил]пропаноат, которые превращают в соответствующие 4-гетероциклические производные, гидролизуют до карбоновой кислоты и, впоследствии, осуществляют связывание с сульфонамидами и аминами, получая соединения формулы (I).
Экспериментальная часть
Перечень обозначений
CH2Cl2: дихлорметан; CHCl3: хлороформ; Et2O: диэтиловый эфир; AcOH: уксусная кислота; THF: тетрагидрофуран (ТГФ); LiHMDS: гексаметилдисилазид лития; CDI: 1,1'-карбонилдиимдазол; SOCl2: тионилхлорид; TEA: триэтиламин.
Получение промежуточных соединений
Метил-(2S)-2-(4-аминофенил)пропаноат получают оптическим разделением коммерческой рацемической 2-(4-нитрофенил)пропановой кислоты по известной методике (Akgun H. et al, Arzneim.-Forsch./Drug Res., 46(II), 891, 1996) и последующим восстановлением нитрогруппы до амина с помощью Fe/HCl в метаноле.
Метил-2-(4-аминофенил)пропаноат получают непосредственно восстановлением 2-(4-нитрофенил)пропановой кислоты с помощью Fe/HCl в метаноле.
(S)-Метил-2-[4-(карбамотиоиламино)фенил]пропаноат
В круглодонной колбе на 500 мл, снабженной конденсатором и магнитной мешалкой, при комнатной температуре метил-(2S)-2-(4-аминофенил)пропаноат (17,5 г, 98 ммоль) растворяют в толуоле (300 мл) и к раствору медленно добавляют конц. H2SO4 (2,6 мл, 50 ммоль). Добавляют тиоцианат натрия (10,29 г, 128 ммоль) и реакционную смесь нагревают до кипения с обратным холодильником 24 ч. После охлаждения до комнатной температуры, раствор промывают насыщенным раствором NH4Cl (2×100 мл), сушат на безводным Na2SO4 и упаривают в вакууме, с получение сырого продукта, который, после очистки флэш хроматографией (смесь н-гексан/EtOAc 1/1), дает очищенный (S)-метил-2-[4-(карбамотиоиламино)фенил]пропаноат (10,7 г, 48,4 ммоль) в виде белого твердого вещества (49%).
1H-ЯМР (CDCl3): δ 8,25 (ушир.с, 1H, CSNH), 7,40 (д, 2H, J=7 Гц), 7,20 (д, 2H, J=7 Гц), 6,20 (ушир.с, 2H, CSNH2), 3,75 (м, 1H), 3,65 (с, 3H), 1,50 (д, 3H, J=7 Гц).
(S)-Метил-2-[4-(карбамоиламино)фенил]пропаноат
Следуя той же методике, что описана для (S)-метил-2-[4-(карбамотиоиламино)фенил]пропаноата, и исходя из метил-(2S)-2-(4-аминофенил)пропаноата (98 ммоль) и цианата натрия (128 ммоль), после обработки, выделяют (S)-метил-2-[4-(карбамоиламино)фенил]пропаноат в виде белого твердого вещества (59%).
1H-ЯМР (CDCl3): δ 8,90 (ушир.с, 1H, CONH), 7,55 (д, 2H, J=7 Гц), 7,20 (д, 2H, J=7 Гц), 6,50 (ушир.с, 2H, CONH2), 3,75 (м, 1H), 3,60 (с, 3H), 1,50 (д, 3H, J=7 Гц).
Метил-2-[4-(карбамотиоиламино)фенил]пропаноат
Следуя той же методике, что описана для (S)-метил-2-[4-(карбамотиоиламино)фенил]пропаноата, и исходя из метил-2-(4-аминофенил)пропаноата (98 ммоль), после обработки, выделяют метил-2-[4-(карбамоиламино)фенил]пропаноат в виде белого твердого вещества (74%).
1H-ЯМР (CDCl3): δ 8,25 (ушир.с, 1H, CSNH), 7,40 (д, 2H, J=7 Гц), 7,20 (д, 2H, J=7 Гц), 6,20 (ушир.с, 2H, CSNH2), 3,75 (м, 1H), 3,65 (с, 3H), 1,50 (д, 3H, J=7 Гц).
Метил-2-[4-(карбамоиламино)фенил]пропаноат
Следуя той же методике, что описана для (S)-метил-2-[4-(карбамотиоиламино)фенил]пропаноата, и исходя из метил-2-(4-аминофенил)пропаноата (98 ммоль) и цианата натрия (128 ммоль), после обработки, выделяют метил-2-[4-(карбамоиламино)фенил]пропаноат в виде белого твердого вещества (65%).
1H-ЯМР (CDCl3): δ 8,90 (ушир.с, 1H, CONH), 7,55 (д, 2H, J=7 Гц), 7,20 (д, 2H, J=7 Гц), 6,50 (ушир.с, 2H, CONH2), 3,75 (м, 1H), 3,60 (с, 3H), 1,50 (д, 3H, J=7 Гц).
Примеры
2-(4-{[4-(Трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановая кислота (1)
В круглодонной колбе на 250 мл, снабженной конденсатором и магнитной мешалкой, раствор метил-2-[4-(карбамотиоиламино)фенил]пропаноата (10,7 г, 48,4 ммоль) в 1,4-диоксане (200 мл) обрабатывают при комнатной температуре 3-бром-1,1,1-трифторпропан-2-оном (5 мл, 48,4 ммоль), и реакционную смесь нагревают до кипения с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, растворитель отгоняют в вакууме, остаток растворяют в CH2Cl2 (200 мл), промывают насыщенным раствором NaHCO3 (3×100 мл), сушат над безводным Na2SO4 и упаривают в вакууме с получением очищенного метил-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноата (12,8 г, 38,7 ммоль) в виде желтого масла (80%).
1H-NMR (CDCl3): δ 8,65 (с, 1H, NH), 7,30 (м, 4H), 7,05 (с, 1H), 3,75 (кв, 1H, J=7 Гц), 3,65 (с, 3H), 1,50 (д, 3H, J=7 Гц).
Раствор метил-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноата (12 г, 36,28 ммоль) в AcOH (50 мл) и 37% HCl (17,5 мл) нагревают до кипения с обратным холодильником в течение 12 ч. После охлаждения до комнатной температуры, растворитель выпаривают и сырой остаток растворяют в CH2Cl2 (200 мл) и промывают водой (3×100 мл) и насыщенным раствором соли (3×100 мл). Органический слой сушат над безводным Na2SO4 и растворитель выпаривают в вакууме. Полученное светло-желтое масло превращают в мягкую массу, обработкой в н-гексане (150 мл) в течение ночи. Очищенное соединение 1 (7,8 г, 24,67 ммоль) получают в виде белого твердого вещества путем фильтрования (68% из промежуточного сложного метилового эфира).
1H-NMR (CDCl3): δ 9,25 (ушир.с, 1H, NH), 7,40 (д, 2H, J=7 Гц), 7,25 (д, 2H, J=7 Гц), 7,00 (с, 1H), 3,80 (кв, 1H, J=7 Гц), 1,55 (д, 3H, J=7 Гц).
2-Метил-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановая кислота (2)
Смесь 2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноата (0,5 г, 1,5 ммоль) и K2CO3 (0,41 г, 3,0 ммоль) в сухом ТГФ (5 мл) барботируют трифторацетилхлоридом (3 ммоль). Реакционную смесь нагревают до кипения с обратным холодильником в течение 4 ч. После исчезновения исходного вещества и охлаждения до комнатной температуры, ТГФ выпаривают в вакууме и остаток растворяют в CH2Cl2 (10 мл) и в буферном растворе H3PO4/H2PO4 (pH 2,0, 10 мл). Смесь переносят в делительную воронку, две фазы разделяют, и органическую фазу вновь промывают тем же буфером (3×5 мл), сушат над Na2SO4 и упаривают в вакууме с получением очищенного метил-2-(4-{(трифторацетил)[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноата (0,60 гр., 1,4 ммоль) в виде прозрачного масла (94%). LiHMDS получают обработкой 1,1,1,3,3,3-гексаметилдисилазана (64 ммоль) с помощью н-BuLi (1,6 М в н-гексане, 63 ммоль) по известным методикам. К раствору LiHMDS (1,4 ммоль) в сухом ТГФ (5 мл), при T=-78°C, добавляют по каплям раствор 2-(4-{(трифторацетил)[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноата (0,60 гр., 1,4 ммоль) в сухом ТГФ (2 мл); полученную смесь оставляют перемешиваться на 1 ч, добавляют иодметан (62 мкл, 1,5 ммоль) и раствор оставляют перемешиваться при комнатной температуре в течение ночи. Добавляют Et2O (10 мл) и буферный раствор H3PO4/H2PO4 (pH 2,0, 10 мл). Фазы разделяют и водную фазу снова экстрагируют Et2O (3×5 мл); собранные органические экстракты сушат над безводным Na2SO4 и упаривают в вакууме с получением сырого продукта, который, после очистки флэш хроматографией, дает очищенный метил-2-метил-2-(4-{(трифторацетил)[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноат (0,40 гр., 0,91 ммоль) в виде желтого масла (65%).
К раствору сложного метилового эфира в ТГФ (5 мл) добавляют 1М NaOH (2,0 мл), и реакционную смесь нагревают до кипения с обратным холодильником в течение ночи. После охлаждения до комнатной температуры, смесь гасят буферным раствором H3PO4/H2PO4 (pH 2,0, 5 мл) и переносят в делительную воронку. Фазы разделяют, водную фазу снова экстрагируют CH2Cl2 (3×5 мл), собранные органические экстракты сушат над Na2SO4 и упаривают в вакууме с получением очищенного соединения 2 (0,29 г, 0,88 моль) в виде воскообразного желтого твердого вещества (97%).
1H-ЯМР (CDCl3): δ 12,20 (ушир.с, с, COOH), 9,25 (ушир.с, 1H, NH), 7,40 (д, 2H, J=7 Гц), 7,25 (д, 2H, J=7 Гц), 7,00 (с, 1H), 1,55 (с, 6H).
(2S)-2-(4-{[4-(Трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропановая кислота (3)
Следуя той же методике, что описана для 1, и исходя из (S)-метил-2-[4-(карбамотиоиламино)фенил]пропаноата (10,7 г, 48,4 ммоль), после обработки и гидролиза сложного метилового эфира, выделяют соединение 3 (12,24 г, 38,72 ммоль) в виде белого твердого вещества (80%).
[α]D = +37 (c=1,2; CH3OH); 1H-ЯМР (CDCl3): δ 9,25 (ушир.с, 1H, NH), 7,40 (д, 2H, J=7 Гц), 7,25 (д, 2H, J=7 Гц), 7,00 (с, 1H), 3,80 (кв, 1H, J=7 Гц), 1,55 (д, 3H, J=7 Гц).
(2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноат натрия (3a)
В круглодонной колбе на 100 мл, снабженной магнитной мешалкой, соединение 3 (7,26 гр., 22,9 ммоль) суспендируют в воде (30 мл) и медленно добавляют 2н NaOH (11,45 мл, 22,9 моль). Полученный темно-красный раствор перемешивают в течение 1 ч при комнатной температуре, фильтруют на фильтре 0,45 мк и сушат сублимацией. Очищенный (2S)-2-(4-{[4-(трифторметил)-1,3-тиазол-2-ил]амино}фенил)пропаноат натрия 3a (7,51 г, 22,2 ммоль) получают в виде белого твердого вещества (97%). Т.пл. 142°-145°C. [α]D = -8,7 (c=0,62; CH3OH); 1H-ЯМР (D2O): δ 9,00 (ушир.с, 1H, NH), 7,30 (м, 4H), 7,28 (с, 1H), 3,55 (кв, 1H, J=7 Гц), 1,35 (д, 3H, J=7 Гц).
2-{4-[(4-Метил-1,3-тиазол-2-ил)амино]фенил}пропановая кислота (4)
Следуя той же методике, что описана для 1, и исходя из метил-2-[4-(карбамотиоиламино)фенил]пропаноата (4,98 г, 20 ммоль) и 1-хлорпропан-2-она (2,13 мл, 26 ммоль), после обработки и гидролиза сложного метилового эфира, очищенное соединение 4 (2,5 г, 9,5 ммоль) выделяют фильтрованием (49% общий выход из метил-2-[4-(карбамотиоиламино)фенил]пропаноата).
1H-ЯМР (ДМСО