Способ определения нуклеотидной последовательности pu(5mc)gpy в заданном положении протяженной днк
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Предложенный способ предусматривает получение образцов высокоочищенной ДНК, фрагментацию выделенной ДНК эндонуклеазой рестрикции, не имеющей сайта узнавания в амплифицируемом районе, гидролиз фрагментированной ДНК метилзависимой сайт-специфической ДНК-эндонуклеазой GlaI или ее изошизомером, лигирование универсального олигонуклеотидного адаптера к гидролизованной ДНК с последующей амплификацией в реальном времени с использованием праймера и зонда, комплементарных исследуемой ДНК и гибридного праймера, 3' конец которого комплементарен не менее 3 нуклеотидам 3' конца ДНК у исследуемого места гидролиза GlaI, а оставшаяся часть комплементарна адаптерной последовательности, и составление заключения на основании флуоресцентного сигнала о наличии последовательности Pu(5mC)GPy. 3 з.п. ф-лы, 4 ил., 5 табл., 5 пр.
Реферат
Изобретение относится к биотехнологии и касается способа определения нуклеотидной последовательности (сайта) 5'-Pu(5mC)GPy-3'/3'-PyG(5mC)Pu-5' (здесь и далее 5mC - 5-метилцитозин) в заданном положении протяженной ДНК.
Метилирование ДНК является одним из основных и наиболее изученных механизмов эпигенетической регуляции активности генов высших эукариот. Метилирование CpG-островков в 5'-регуляторной области блокирует транскрипцию соответствующих генов и в норме имеет место при инактивации Х-хромосомы, а также импринтинге отдельных генов [1]. В свою очередь аберрантное метилирование сайтов PuCGPy (с образованием последовательности Pu(5mC)GPy) ДНК-метилтрансферазами человека DNMT3a и DNMT3b в регуляторных районах связывают с развитием некоторых заболеваний, в частности, онкопатологий [2, 3]. Гиперметилирование CpG-островков в регуляторных областях генов-онкосупрессоров, характерное для опухолевых тканей, сохраняется и в малигнантных клеточных линиях, полученных из этих тканей [4, 5].
Наиболее известным способом определения эпигенетического статуса участков ДНК является использование эндонуклеаз рестрикции, блокируемых метилированнием цитозиновых оснований в сайтах узнавания. Чаще всего используется пара эндонуклеаз HpaII и MspI, которые узнают тетрануклеотидную последовательность CCGG, но блокируются по-разному: MspI не расщепляет последовательность (5mC)CGG, a HpaII - C(5mC)GG [6]. В случае метилирования внутреннего CG-динуклеотида этого сайта он будет расщепляться эндонуклеазой MspI, и амплификация фрагмента ДНК происходить не будет, тогда как HpaII такой сайт не расщепляет и в ходе ПЦР будет происходить наработка фрагмента ДНК.
Недостатком способа является то, что последовательность CCGG в отличие от PuCGPy не является сайтом для аберрантного метилирования de novo, таким образом, диагностическая ценность этого способа ниже. Другие используемые для анализа эндонуклеазы рестрикции (HhaI, BstUI, AciI и т.д.) также не удобны для полноценного анализа наличия метилирования, поскольку их сайты узнавания включают в себя лишь некоторые из возможных точек метилирования ДНК эукариот и, в добавок, не имеют изошизомеров, отличающихся по чувствительности к метилированному основанию в CG-динуклеотиде (что желательно для наличия положительного контроля в экспериментах).
Альтернативой является использование для анализа статуса метилирования ДНК метилзависимых эндонуклеаз, которые специфически фрагментируют только метилированную ДНК. Недавно зарубежными исследователями в этих целях был использован фермент McrBC, который узнает последовательность R(mC)N40-2000R(mC) и расщепляет ее вблизи от одного из двух узнаваемых динуклеотидов [7-9]. В настоящее время такой подход используется только в научно-исследовательских работах и в клинической практике пока не применяется. Использование эндонуклеазы McrBC для анализа наличия метилированой ДНК имеет ряд недостатков. В частности, зависимость от двух метилированных цитозиновых оснований, удаленных на значительное расстояние друг от друга, ограничивает возможность определения наличия метилирования в произвольно выбранной области ДНК.
Применение вместо McrBC метилзависимой сайт-специфической ДНК-эндонуклеазы GlaI, сайт узнавания которой полностью соответствует продукту реакции, образующемуся при метилировании ДНК de novo клеточными метилазами DNMT3a и DNMT3b [10, 11], позволяет избавиться от данного недостатка.
Наиболее близким к заявленному способу-прототипом, является способ определения нуклеотидной последовательности Pu(5mC)GPy в заданном положении протяженной ДНК, включающий предварительный гидролиз исследуемой ДНК метилзависимой сайт-специфической ДНК-эндонуклеазой GlaI и последующую амплификацию в реальном времени с ПЦР-хелперами [12]. Использование хелперов, представляющих собой сложные олигонуклеотидные структуры, 3' половина которых комплементарна исследуемой ДНК до места предполагаемого гидролиза, а 5' конец кодирует последовательность для праймера, позволяет точно отметить место гидролиза GlaI, таким образом, наличие ПЦР сигнала однозначно говорит о наличии последовательности Pu(5mC)GPy.
Недостатками известного способа являются длительность, дороговизна и ограниченные функциональные возможности. Так, каждый раунд амплификации содержит две стадии отжига и элонгации: на первой гибридизуется хелпер и затем с него достраивается последовательность ДНК, являющаяся комплементарной к праймеру, а далее, после денатурации, гибридизуется праймер и происходит дальнейшая наработка ампликона. Так как хелпер и праймер имеют схожие структуры, то между ними происходит сильная конкуренция, для уменьшения которой необходимо тщательно подбирать соотношение праймер/хелпер и использовать в структуре хелпера единичные замены нуклеотидов на инозин. Кроме того, подобная система отличается низкой эффективностью ПЦР, длительностью времени реакции (для получения данных необходимо провести до 85 раундов ПЦР), высокой вероятностью преждевременного разложения компонентов реакционной смеси и необходимостью синтеза уникального хелпера для каждой исследуемой последовательности.
Задачей изобретения является упрощение известного способа и расширение его функциональных возможностей.
Поставленная задача достигается предлагаемым способом, заключающимся в получении образцов высокоочищенной ДНК, предварительной фрагментации выделенной ДНК эндонуклеазой рестрикции, не имеющей сайта узнавания в амплифицируемом районе, в частности TaqI; гидролизом фрагментированной ДНК метилзависимой сайт-специфической ДНК-эндонуклеазой GlaI или ее изошизомером, лигировании универсального олигонуклеотидного адаптера к гидролизованной ДНК с последующей амплификацией в реальном времени с использованием праймера и зонда, комплементарных исследуемой ДНК и гибридного праймера, 5' конец которого комплементарен не менее 3 нуклеотидам 3' конца ДНК у исследуемого места гидролиза GlaI, а оставшаяся часть комплементарна адаптерной последовательности, и составлением заключения по появлению флуоресцентного сигнала в случае наличия последовательности 5'-Pu(5mC)GPy-3'/3'-PyG(5mC)Pu-5'.
Высокоочищенную ДНК выделяют, как описано ранее в [13]. Предварительную фрагментацию ДНК проводят в реакционной смеси, содержащей ДНК и эндонуклеазу рестрикции TaqI (или ее изошизомера) в течение 2 часов при 65°C в буфере: 33 мМ трис-ацетат, pH 7,9; 10 мМ ацетат магния, 66 мМ ацетат калия, 1 мМ дитиотреитол. Затем фрагментированную ДНК расщепляют путем добавления 1-2 е.а. метилзависимой сайт-специфической ДНК-эндонуклеазы GlaI (или ее изошизомера), в реакционном буфере (20 мМ Tris-SO4, pH 8.0, 4 мМ MgCl2, 1 мМ β-меркаптоэтанол, 100 нг/мкл BSA) в течение 1 часа при 30°C с последующей инактивацией при 65°C в течение 20 минут. Далее, в реакционную смесь вносят АТФ до конечной концентрации 0,5-1,0 мМ, ПЭГ до 1-2%, β-меркаптоэтанол до 6,8-8,0 мМ, универсальный адаптер (5'-CTCCCGCCTGCTCTTTCATCG-3'/3'-ACGAGAAAGTAGC-5') до конечной концентрации 500-1000 нМ и 500-1000 е.а. высокоактивной Т4 ДНК-лигазы. Реакцию лигирования адаптера проводят в течение 15 минут при 25°C, затем лигазу термоинактивируют при 65°C в течение 20 минут. Для проведения реакции ПЦР к смеси добавляют до достижения итоговых концентраций: 50 мМ Tris-SO4, pH 9.0, 30 мМ KCl, 10 мМ сульфата аммония, 3 мМ MgCl2, 0,2 мМ, смеси дезоксирибонуклеозидтрифосфатов, 0,01% Tween-20, смесь праймеров и зонда по 0,4-0,8 мкМ каждого и 0,04-0,1 е.а./мкл Hot Start ДНК-полимеразы. Появление флуоресцентного сигнала в ходе ПЦР однозначно говорит о наличии последовательности Pu(5mC)GPy в заданном положении протяженной ДНК.
Определяющими отличительными признаками предлагаемого способа по сравнению с прототипом являются:
1. Предварительную фрагментацию ДНК осуществляют эндонуклеазой рестрикции TaqI или другой, не имеющей сайта узнавания в изучаемом регионе, что позволяет провести более полное расщепление исходной ДНК;
2. К гидролизованной ДНК лигируют универсальный олигонуклеотидный адаптер 5'-CTCCCGCCTGCTCTTTCATCG-3'/3'-CGATGAAAGAGCA-5', что позволяет упростить способ и расширить его функциональные возможности за счет того, что в процессе лигирования гидролизованной ДНК с универсальным адаптером маркируются все последовательности Pu(5mC)GPy, что позволяет анализировать любую последовательность Pu(5mC)GPy на протяженной ДНК, в том числе и несколько последовательностей одновременно (мультиплекс);
3. Амплификацию проводят с использованием праймера и зонда, комплементарных исследуемой ДНК и гибридного праймера, 3' конец которого комплементарен не менее трем нуклеотидам 3' конца ДНК от заданного места гидролиза метилзависимой сайт-специфической ДНК-эндонуклеазой, а оставшаяся часть комплементарна адаптерной последовательности, что позволяет повысить специфичность гибридизации к исследуемому району ДНК.
Изобретение иллюстрируется следующими примерами конкретного выполнения.
Пример 1. Определение последовательности Pu(5mC)GPy в плазмиде pHspAI2.
Плазмида pHspAI2 несет в себе ген метилазы M.HspAI, которая узнает последовательность 5'-GCGC-3'/3'-CGCG-5' и метилирует внутренний цитозин с образованием последовательности 5'-G(5mC)GC-3'/3'-CG(5mC)G-5'. Данная последовательность является частным случаем сайта узнавания метилзависимой ДНК-эндонуклеазы GlaI.
Предварительную фрагментацию ДНК плазмиды pHspAI2 проводили в 50 мкл реакционной смеси, включающей 5 мкг ДНК и 20 единиц эндонуклеазы рестрикции GsaI в течение 2 часов при 65°C в буфере: 33 мМ трис-ацетат, pH 7,9; 10 мМ ацетат магния, 66 мМ ацетат калия, 1 мМ дитиотреитол. В качестве контрольной ДНК использовали неметилированную плазмиду pBR322, которую подвергали предварительному гидролизу аналогичным образом ДНК-эндонуклеазой HindIII в течение 2 часов при 37°C в буфере: 10 мM трис-хлорид, pH 8,5; 10 мМ хлорид магния, 100 мМ хлорид натрия, 1 мМ дитиотреитол. Затем гидролизаты ДНК очищали фенол-хлороформной экстракцией и высаживали 96% этанолом по общепринятой методике [13], после чего осадки ДНК высушивали при комнатной температуре и растворяли в 40 мкл буфера ТЕ (10 мМ трис-HCl, pH 8,0; 1 мМ ЭДТА). Концентрацию фрагментированной ДНК измеряли при помощи спектрофотометра и доводили до концентрации 1500 копий/мкл раствором буфера ТЕ, содержащего 5 нг/мкл ДНК фага λ. В эксперимент брали 6 различных пробирок (табл.1), в каждую вносили по 15 мкл соответствующей ДНК. Пробирка 1 - эксперимент, 2-4 - использованы в качестве контроля соответствующих стадий, 5 - отрицательный контроль. Затем фрагментированную ДНК расщепляли путем добавления 1 е.а. метилзависимой сайт-специфической ДНК-эндонуклеазы GlaI, в реакционном буфере (20 мМ Tris-SO4, pH 8.0, 4 мМ MgCl2, 1 мМ β-меркаптоэтанол, 100 нг/мкл BSA) в течение 1 часа при 30°C с последующей инактивацией при 65°C в течение 20 минут. Далее, в реакционную смесь вносили АТФ до концентрации 0,5 мМ, ПЭГ до 1%, β-меркаптоэтанол до 6,8 мМ, универсальный адаптер до 500 нМ и 1000 е.а. высокоактивной Т4 ДНК-лигазы. Лигировали 15 минут при 25°C, затем термоинактивировали при 65°C в течение 20 минут. Для проведения реакции ПЦР к смеси добавляли до достижения итоговых концентраций: 50 мМ Tris-SO4, pH 9.0, 30 мМ KCl, 10 мМ сульфата аммония, 3 мМ MgCl2, 0,2 мМ смеси дезоксирибонуклеозидтрифосфатов, 0,01% Tween-20, смесь праймеров и зонда по 0,4 мкМ каждого и 0,04 е.а./мкл Hot Start ДНК-полимеразы. Структура праймеров и зонда следующая: прямой - 5'-GACACATGCAGCTCCCGGAGA-3', гибридный - 5'-CCTGCTCTTTCATCGGCCCT-3' (подчеркнута часть праймера, комплементарная исследуемой ДНК), зонд - 5'-FAM-TCTGCTCCCGGC ATCCGCTTAC AGAC-BHQ1-3'. Полученную смесь разделяли на 3 части и амплифицировали на амплификаторах ДТ-322 (ДНК-технология) либо CFX-96 (Bio-Rad) по программе: 95°C 3 мин, далее 5 циклов без детекции: 95°C 10 сек, 61°C 30 сек, 72°C 10 сек; затем 45 циклов с детекцией (канал FAM) на стадии отжига: 95°C 10 сек, 61°C 30 сек, 72°C 10 сек.
В таблице 1 представлены результаты качественного анализа наличия последовательности Pu(5mC)GPy в протяженной бактериальной ДНК.
| Таблица 1. | |||||
| Пробирка № | 1 | 2 | 3 | 4 | 5 |
| Плазмидная ДНК | pHspAI2 | pHspAI2 | pHspAI2 | pHspAI2 | pBR322 |
| Добавление GlaI | + | - | + | - | + |
| Добавление лигазы | + | + | - | - | + |
| Наличие последовательности Pu(5mC)GPy (3 повтора) | + | - | - | - | - |
| + | - | - | - | - | |
| + | - | - | - | - |
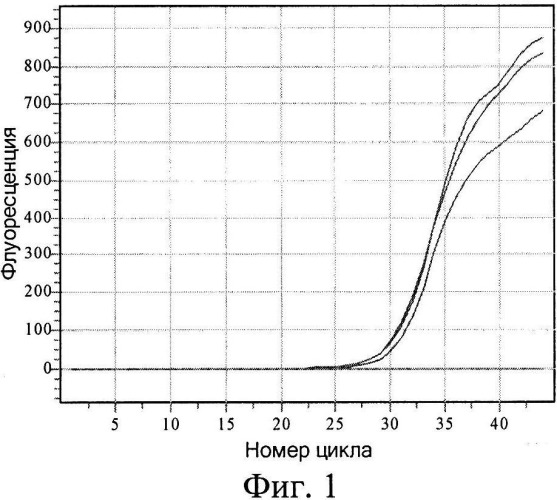
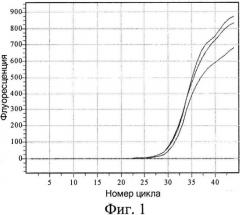
На фиг.1 показана кривая накопления продукта с модифицированной ДНК с течением времени. При этом видно, что реакция ПЦР происходит только тогда, когда к изучаемой ДНК после предварительного гидролиза GlaI лигируется адаптер, тем самым создавая условия для правильного отжига гибридного праймера (табл.1, пробирка 1). Если хотя бы одна из стадий пропущена, то наработка продукта невозможна (табл.1, пробирки 2-4), равно как и наличие неспецифической ДНК не дает ложноположительных результатов (табл.1, пробирка 5).
Пример 2. Определение последовательности Pu(5mC)GPy в первом экзоне гена-онкосупрессора CST6.
Для анализа наличия последовательности Pu(5mC)GPy была выбрана ДНК из клеток Raji (лимфома Беркитта), в которой исследуемый район гена CST6 гиперметилирован, в качестве неметилированного отрицательного контроля ДНК мыши линии А/Не.
Предварительную фрагментацию и очистку ДНК проводили аналогично примеру 1, но в качестве эндонуклеазы рестрикции, не имеющей сайта узнавания в исследуемом районе, применяли TaqI в буфере: 33 мМ трис-ацетат, pH 7,9; 10 мМ ацетат магния, 66 мМ ацетат калия, 1 мМ дитиотреитол. Для анализа использовали ДНК в концентрации 1500 копий/мкл без дополнительного добавления ДНК фага λ. Последующее расщепление и дотирование полученных фрагментов также проводили в условиях, описанных в примере 1, но с увеличенными концентрациями реактивов при лигировании. Конечные концентрации составили: АТФ 1 мМ, ПЭГ 2%, β-меркаптоэтанол 8 мМ, универсальный адаптер 1000 нМ и использовали 1000 е.а. высокоактивной Т4 ДНК-лигазы в реакцию. ПЦР осуществляли, как описано в примере 1, за исключением того, что использовали ДНК-праймеры: прямой - 5'-GC ATGGTCGGAGAACTCC-3', гибридный - 5'-CTGCTCTTTCATCGGCCGC-3' (подчеркнута часть праймера, комплементарная исследуемой ДНК) и зонд - 5'-FAM-CTTCTGC ACCTGCGGGTCGT-BHQ1-3'.
В таблице 2 представлены результаты анализа наличия последовательности Pu(5mC)GPy в первом экзоне гена-онкосупрессора CST6.
| Таблица 2. | ||||||||
| Пробирка № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| ДНК | Raji | Мышь | ||||||
| Добавление GlaI | + | - | - | + | + | - | - | |
| Добавление лигазы | + | - | + | - | + | - | + | - |
| Наличие последовательности Pu(5mC)GPy (3 повтора) | + | - | - | - | - | - | - | - |
| + | - | - | - | - | - | - | - | |
| + | - | - | - | - | - | - | - |
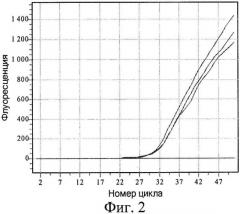
На фиг.2 показана кривая накопления продукта с модифицированной ДНК Raji с течением времени. Аналогично примеру 1, реакция ПЦР происходит только тогда, когда к изучаемой ДНК после предварительного гидролиза GlaI лигируется адаптер, тем самым создавая условия для правильного отжига гибридного праймера (табл.2, пробирка 1). В случае с геномной ДНК человека пропуск одной или нескольких стадий также препятствует наработке продукта (табл.2, пробирки 2-4). Неметилированная ДНК эукариотическая ДНК не дает ложноположительных результатов независимо от пропущенных стадий (табл.2, пробирки 5-8).
Пример 3. Определение последовательности Pu(5mC)GPy в первом экзоне гена-онкосупрессора RARB.
Для анализа наличия последовательности Pu(5mC)GPy была выбрана ДНК из клеток Raji (лимфома Беркитта), в которой гиперметилирована исследуемая область гена RARB, в качестве отрицательного контроля неспецифической ДНК была выбрана ДНК мыши линии А/Не и плазмида pHspAI2.
Предварительную фрагментацию и очистку ДНК проводили аналогично примеру 1, но в качестве эндонуклеазы рестрикции, не имеющей сайта узнавания в исследуемом районе, применяли TaqI в буфере: 33 мМ трис-ацетат, pH 7,9; 10 мМ ацетат магния, 66 мМ ацетат калия, 1 мМ дитиотреитол. Для анализа использовали ДНК в концентрации 1500 копий/мкл. Последующее расщепление и лигирование полученных фрагментов также проводили в условиях, описанных в примере 1, но с отличиями: в случае с ДНК человека и мыши не добавляли ДНК фага λ, а в реакцию брали 2 е.а. эндонуклеазы рестрикции GlaI.
ПЦР осуществляли, как описано в примере 1, за исключением того, что использовали следующие ДНК-праймеры: прямой - 5'-ТТС AGAGGC AGGAGGGTCTATTC-3', гибридный - 5'-CCTGCTCTTTCATCGGTTCTCG-3' (подчеркнута часть праймера, комплементарная исследуемой ДНК) и зонд - 5'-FAM-TCCCAGTCCTCAAACAGCTCGCATGG-BHQ1-3'. Также были повышены концентрации праймеров и зонда до 0,8 мкМ каждого и Hot Start ДНК-полимеразы до 0,1 е.а./мкл
В таблице 3 представлены результаты анализа наличия последовательности Pu(5mC)GPy в первом экзоне гена-онкосупрессора RARB.
| Таблица 3. | ||||||||||||
| Пробирка № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| ДНК | Raji | Мышь | pHspAI2 | |||||||||
| Добавление GlaI | + | + | - | - | + | + | - | - | + | + | - | - |
| Добавление лигазы | + | - | + | - | + | - | + | - | + | - | + | - |
| Наличие последовательности Pu(5mC)GPy (3 повтора) | + | - | - | - | - | - | - | - | - | - | - | - |
| + | - | - | - | - | - | - | - | - | - | - | - | |
| + | - | - | - | - | - | - | - | - | - | - | - |
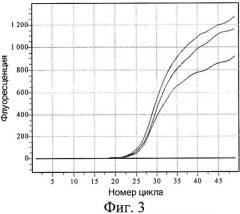
На фиг.3 показана кривая накопления продукта с модифицированной ДНК Raji с течением времени. Аналогично примеру 1, реакция ПЦР происходит только тогда, когда к изучаемой ДНК после предварительного гидролиза GlaI лигируется адаптер, тем самым создавая условия для правильного отжига гибридного праймера (табл.3, пробирка 1). В случае с геномной ДНК человека пропуск одной или нескольких стадий также препятствует наработке продукта (табл.3, пробирки 2-4). Неспецифическая эукариотическая и бактериальная ДНК не дает ложноположительных результатов независимо от пропущенных стадий (табл.3, пробирки 5-12).
Пример 4. Применение изошизомера GlaI для определения последовательности Pu(5mC)GPy в первом экзоне гена-онкосупрессора RARB.
Для анализа наличия последовательности Pu(5mC)GPy была выбрана ДНК из клеток Raji (лимфома Беркитта), в которой гиперметилирована исследуемая область гена RARB и в качестве отрицательного контроля неспецифической ДНК была выбрана ДНК мыши линии А/Не.
Предварительную фрагментацию и очистку ДНК проводили аналогично примеру 1, но в качестве эндонуклеазы рестрикции, не имеющей сайта узнавания в исследуемом районе, применяли TaqI в буфере: 33 мМ трис-ацетат, pH 7,9; 10 мМ ацетат магния, 66 мМ ацетат калия, 1 мМ дитиотреитол. Для анализа использовали ДНК в концентрации 1500 копий/мкл без дополнительного добавления ДНК фага λ. Последующее расщепление и лигирование полученных фрагментов также проводили в условиях, описанных в примере 1, но для специфического гидролиза метилированной ДНК использовали изошизомер GlaI метилзависимую ДНК-эндонуклеазу MoxI. ПЦР осуществляли, как описано в примере 1, с праймерами и зондом из примера 3.
В таблице 4 представлены результаты анализа наличия последовательности Pu(5mC)GPy в первом экзоне гена-онкосупрессора RARB.
| Таблица 4. | ||||||||
| Пробирка № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| ДНК | Raji | Мышь | ||||||
| Добавление GlaI | + | - | - | + | + | - | - | |
| Добавление лигазы | + | - | + | - | + | - | + | - |
| Наличие последовательности Pu(5mC)GPy (3 повтора) | + | - | - | - | - | - | - | - |
| + | - | - | - | - | - | - | - | |
| + | - | - | - | - | - | - |
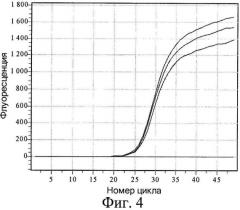
На фиг.4 показана кривая накопления продукта с модифицированной ДНК Raji с течением времени. Аналогично примеру 1, реакция ПЦР происходит только тогда, когда к изучаемой ДНК после предварительного гидролиза MoxI лигируется адаптер, тем самым создавая условия для правильного отжига гибридного праймера (табл.4, пробирка 1). В случае с геномной ДНК человека пропуск одной или нескольких стадий также препятствует наработке продукта (табл.4, пробирки 2-4). Неспецифическая мышиная ДНК не дает ложноположительных результатов независимо от пропущенных стадий (табл.4, пробирки 5-8).
Пример 5. Определение минимального количества детектируемых последовательностей Pu(5mC)GPy в геномной ДНК Raji.
Предварительную фрагментацию и очистку ДНК проводили аналогично примеру 1, но в качестве эндонуклеазы рестрикции, не имеющей сайта узнавания в исследуемом районе, применяли TaqI в буфере: 33 мМ трис-ацетат, pH 7,9; 10 мМ ацетат магния, 66 мМ ацетат калия, 1 мМ дитиотреитол. Для анализа использовали ДНК в концентрациях 1500, 750, 300, 100, 50, 25, 10, 5, 2,5; 1,6; 0,8; 0,4; и 0,2 копий/мкл (табл.5, пробирки 1-13). Для создания нуклеотидной нагрузки добавляли к образцам ДНК фага X до концентрации 10 нг/мкл. Последующее расщепление и лигирование полученных фрагментов проводили в условиях, описанных в примере 1. ПЦР осуществляли, как описано в примере 1, с праймерами и зондом из примера 3.
В таблице 5 представлены результаты анализа наличия последовательности Pu(5mC)GPy в протяженной геномной ДНК человека при различных концентрациях.
| Таблица 5. | ||||||||||||||
| Пробирка № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| Концентрация исходной ДНК Raji (копий/мкл) | ||||||||||||||
| 1500 | 750 | 300 | 100 | 50 | 25 | 10 | 5 | 2,5 | 1,6 | 0,8 | 0,4 | 0,2 | 0 | |
| Количество последовательностей Pu(5mC)GPy на 1 лунку ПЦР | ||||||||||||||
| 7500 | 3750 | 1500 | 500 | 250 | 125 | 50 | 25 | 12,5 | 8 | 4 | 2 | 1 | 0 | |
| Детекция последовательности Pu(5mC)GPy (3 повтора) | ||||||||||||||
| + | + | + | + | + | + | + | + | + | + | + | + | - | - | |
| + | + | + | + | + | + | + | + | - | - | + | - | + | - | |
| + | + | + | + | + | + | + | + | + | - | - | - | - |
Из таблицы 5 видно, что предлагаемый способ обладает высокой специфичностью и позволяет выявлять до единичных количеств последовательностей Pu(5mC)GPy в изучаемом препарате.
Использование заявляемого способа позволит более полно и чувствительно определять последовательность Pu(5mC)GPy в образцах ДНК, а также сократить время анализа, удешевить способ за счет применения универсального адаптера для всех последовательностей Pu(5mC)GPy в протяженной ДНК, и расширить его функциональные возможности за счет анализа любой последовательности Pu(5mC)GPy, в том числе и нескольких последовательностей одновременно (мультиплекс).
Источники информации
1. Deaton A.M., Bird A. CpG islands and the regulation of transcription // Genes Dev. - 2011. - Vol.25. - P.1010-1022.
2. Handa V., Jeltsch A. Profound sequence preference of Dnmt3a and Dnmt3b mammalian DNA methytransferases shape the human epigenome // J. Mol. Biol. - 2005. - Vol.348. P.1103-1112.
3. Estecio M., Issa J.P. Dissecting DNA hypermethylation in cancer // FEBS Letters. - 2011. - Vol.585. - P.2078-2086.
4. Киселева Н.П., Лихтенштейн A.B. Эпигенетические изменения в опухолевых клетках. Роль метилирования ДНК в канцерогенезе. Канцерогенез. / Под ред. Д.Г. Заридзе. - М.: Медицина, 2004. - С.191-203.
5. de Caseres I.I., Cairus P. Methylated DNA sequences for early cancer detection, molecular classification and chemotherapy response prediction // Clin. Transl. Oncol. - 2007. - Vol.9. - P.429-437.
6. Zilberman D., Henikoff S. Genome-wide analysis of DNA methylation patterns. Development. 2007. 134:3959-3965.
7. Yamada Y., Watanabe H., Miura F., Soejima H., Uchiyama M., Iwasaka Т., Mukai Т., Sakaki Y., Ito T. A comprehensive analysis of allelic methylation status of CpG islands on human chromosome 21q. Genome Res. 2004. 14:247-266.
8. Oakes C.C., La Salle S., Robaire В., Trasler J.M. Evaluation of a quantitative DNA methylation analysis technique using methylation-sensitive/dependent restriction enzymes and real-time PCR. Epigenetics. 2006. 1:146-152.
9. Hublarova P., Hrstka R., Rotterova P., Rotter L., Coupkova M., Badal V., Nenutil R., Vojtesek B. 2009. Prediction of human papilomavirus 16 Е6 gene expression and cervical intraepithelial neoplasia progression by methylation status. Int. J. Gyn. Cancer, 19, 321-325.
10. Чернухин B.A., Наякшина Т.Н., Абдурашитов М.А., Томилова Ю.Э., Мезенцева Н.В., Дедков B.C., Михненкова Н.А., Гончар Д.А., Дегтярев С.Х. Новая эндонуклеаза рестрикции GlaI узнает метилированную последовательность 5'-G(5mC)^GC-3'. Биотехнология, 2006, 4: 31-35.
11. Tarasova G.V., Nayakshina T.N., Degtyarev S.Kh. Substrate specificity of new methyl-directed DNA endonuclease GlaI. BMC Molecular Biology, 2008, 9:7.
12. Rand KN, Young GP, Ho T, Molloy PL. Sensitive and selective amplification of methylated DNA sequences using helper-dependent chain reaction in combination with a methylation-dependent restriction enzymes. Nucleic Acids Res. 2013 January; 41(1): e15.
13. Sambrook J., Russel D. Molecular cloning: a laboratory manual. 3rd ed. - New York: Cold Spring Harbor Laboratory Press, 2001. - 2222 p.
1. Способ определения нуклеотидной последовательности Pu(5mC)GPy в заданном положении протяженной ДНК, включающий выделение высокоочищенной ДНК, гидролиз фрагментированной ДНК метилзависимой сайт-специфической ДНК-эндонуклеазой GlaI с последующей амплификацией в реальном времени и составлением заключения о наличии последовательности Pu(5mC)GPy по появлению флуоресцентного сигнала, отличающийся тем, что выделенную ДНК предварительно фрагментируют ДНК-эндонуклеазой рестрикции, не имеющей сайта узнавания в амплифицируемом районе, а к гидролизованной ДНК лигируют универсальный олигонуклеотидный адаптер 5'-CTCCCGCCTGCTCTTTCATCG-3'/3'-CGATGAAAGAGCA-5' с последующей амплификацией в реальном времени с использованием праймера и зонда, комплементарных исследуемой ДНК и гибридного праймера, 3' конец которого комплементарен не менее трем нуклеотидам 3' конца ДНК от заданного места гидролиза метилзависимой сайт-специфической ДНК-эндонуклеазой, а оставшаяся часть комплементарна адаптерной последовательности.
2. Способ по п.1, отличающийся тем, что фрагментацию выделенной ДНК проводят эндонуклеазой рестрикции TaqI, GsaI, НаеIII, либо любой другой, не имеющей сайта узнавания в амплифицируемом районе.
3. Способ по п.1, отличающийся тем, что гидролиз фрагментированной ДНК - осуществляют метилзависимой сайт-специфической ДНК-эндонуклеазой GlaI или ее изошизомером.
4. Способ по п.1, отличающийся тем, что адаптер используют в концентрации 500-1000 нМ.