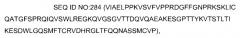Cd37-иммунотерапевтическая комбинированная терапия и ее применения
Иллюстрации
Показать всеГруппа изобретений относится к способам уменьшения количества В-клеток или лечения заболевания или расстройства, связанного с патологической активностью В-клеток. Для этого индивиду вводят терапевтически эффективное количество CD37-специфичной связывающей молекулы и терапевтически эффективное количество ингибитора mTOR или PI3K. Также предложены композиция и набор для лечения неходжкинской лимфомы. Группа изобретений обеспечивает синергический эффект при введении CD37-специфичных связывающих молекул(SMIP) в сочетании с ингибиторами mTOR или ингибиторами PI3K для лечения или профилактики связанного с B-клетками гиперпролиферативного заболевания. 3 н. и 33 з.п. ф-лы, 9 ил., 4 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Настоящая заявка притязает на приоритет согласно 35 U.S.C. §119(e) на основании предварительной заявки на выдачу патента США No. 61/114385, поданной 13 ноября 2008, при этом указанная предварительная заявка включена в настоящее описание в виде ссылки в полном объеме.
УКАЗАНИЕ, КАСАЮЩЕЕСЯ СПИСКА ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Список последовательностей, прилагаемый к настоящей заявке, представлен в текстовом формате вместо бумажной копии и при этом включен в описание в виде ссылки. Название текстового файла, содержащего список последовательностей 910180_418PC_SEQUENCE_LISTING.txt. Текстовый файл имеет размер 324 KB, создан 14 ноября 2009 и представлен в электронном виде через EFS-Web одновременно с подачей описания.
УРОВЕНЬ ТЕХНИКИ
Область техники, к которой относится изобретение
Настоящее описание, в общем, относится к композициям и способам лечения B-клеточных расстройств и более конкретно к применению CD37-специфичных связывающих молекул в сочетании с ингибиторами mTOR или фосфатидилинозитол-3-киназы (PI3K), включая их композиции, которые действуют синергетически при лечении или профилактике связанных с B-клетками гиперпролиферативных заболеваний, таких как лимфома, карцинома, миелома или тому подобные.
Описание области техники
Иммунная система человека обычно защищает организм от проникновения чужеродных веществ и патогенов. Одним из компонентов иммунной системы являются B-лимфоциты, также называемые B-клетками, которые продуцируют антитела, которые защищают организм в результате связывания и, в некоторых случаях, опосредования распада чужеродного вещества или патогена. Однако в некоторых случаях функции иммунной системы могут нарушаться, что приводит к заболеванию. Например, существует множество злокачественных опухолей, аутоиммунных заболеваний и воспалительных заболеваний, в которые вовлечена неконтролируемая пролиферация B-клеток.
B-клетки можно идентифицировать по молекулам на их клеточной поверхности, таким как CD37. CD37 является высоко гликозилированным белком с молекулярной массой 40-52 кДа, который относится к тетраспаниновому трансмембранному семейству антигенов клеточной поверхности, которые в высокой степени экспрессируются на нормальных продуцирующих антитела B-клетках, но не экспрессируются на пре-B-клетках или плазматических клетках. Кроме нормальных B-клеток почти все злокачественные новообразования B-клеточного происхождения являются позитивными по экспрессии CD37, включая хронический лимфоцитарный лейкоз (CLL), неходжкинскую лимфому (NHL) и лейкоз ворсистых клеток (Moore et al., J. Pathol. 152: 13 (1987); Merson and Brochier, Immunol. Lett. 19: 269 (1988); и Faure et al., Am. J. Dermatopathol. 12: 122 (1990)).
Разработано несколько CD37-специфичных способов иммунотерапии. Мышиное моноклональное IgG1-антитело, специфичное для CD37, MB-1, метили 131I и тестировали в клиническом испытании при лечении NHL (смотри Press et al., J. Clin. Oncol. 7:1027 (1989); Bernstein et al., Cancer Res. (Suppl.) 50:1017 (1990); Press et al., Front. Radiat. Ther. Oncol. 24:204 (1990); Press et al., Adv. Exp. Med. Biol. 303:91 (1991) and Brown et al., Nucl. Med. Biol. 24:657 (1997)).
У антитела MB-1 отсутствуют Fc-эффекторные функции, такие как зависимая от антител клеточная цитотоксичность (ADCC), и «голое» антитело MB-1 не ингибировало рост опухоли в модели ксенотрансплантата in vivo (Buchsbaum et al., Cancer Res. 52: 6476 (1992)). Кроме того, иммуноконъюгат, содержащий адриамицин, связанный с G28-1, другим мышиным моноклональным анти-CD37, вводили мышам, и показано, что интернализуется с внутриклеточным высвобождением адриамицина (смотри Braslawsky et al., Cancer Immunol. Immunother. 33: 367 (1991)). Сконструированный слитый белок, названный малым модульным иммунофармацевтическим продуктом (SMIPTM), направленный к CD37, в настоящее время проходит испытания на человеке (смотри, например, публикации заявок на выдачу патента США 2003/0133939 и 2007/0059306; публикацию PCT № WO 2009/126944).
Хотя было проведено всестороннее исследование основанной на антителах терапии, в данной области сохраняется потребность в альтернативных или улучшенных композициях и способах лечения ассоциированных с B-клетками расстройств или заболеваний.
СУЩНОСТЬ ИЗОБЕРТЕНИЯ
Настоящее изобретение относится к способам, композициям и наборам для применения CD37-специфичных связывающих молекул в сочетании с ингибиторами mTOR или PI3K для уменьшения количества B-клеток или лечения заболевания или расстройства, ассоциированного с аномальной активностью B-клеток.
В одном аспекте настоящее изобретение относится к способу уменьшения количества B-клеток или лечения заболевания или расстройства, ассоциированного с аномальной активностью B-клеток, у субъекта, у которого имеется или предполагается наличие заболевания или расстройства, включающему в себя лечение (т.е. введение) субъекту терапевтически эффективного количества CD37-специфичной связывающей молекулы и терапевтически эффективного количества ингибитора mTOR или PI3K. Предлагаются и описаны в настоящей публикации дополнительные способы по пунктам 2-20.
В другом аспекте настоящее изобретение относится к набору для лечения неходжкинской лимфомы, содержащему: (a) стандартную дозу CD37-специфичной связывающей молекулы и (b) стандартную дозу ингибитора mTOR или PI3K. Предлагаются и описаны в настоящей публикации дополнительные наборы по пункту 22.
В другом аспекте настоящее изобретение относится к композиции, содержащей: (a) CD37-специфичную связывающую молекулу и (b) ингибитор mTOR или фосфатидилинозитол-3-киназы (PI3K). Предлагаются и описаны в настоящей публикации дополнительные композиции по пунктам 24-36.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг. 1 показано влияние сочетания CAS-024 и рапамицина на рост клеток Rec-1. Обе молекулы использовали в эквимолярных концентрациях.
На фиг. 2 показано влияние сочетания CAS-024 и рапамицина на рост клеток SU-DHL-6. Обе молекулы использовали в эквимолярных концентрациях.
На фиг. 3A и 3B показаны графики комбинационного индекса (CI) для линий клеток Rec-1 и SU-DHL-6. Значения CI иллюстрируют взаимодействие CAS-024 и рапамицина, указанное на графике против (A) уровней эффекта и (B) среднего CI±95% доверительный интервал для полного диапазона эффекта.
На фиг. 4 показано влияние сочетания CAS-024 и темсиролимуса на рост клеток SU-DHL-6. Обе молекулы использовали в эквимолярных концентрациях.
На фиг. 5 показано влияние сочетания CAS-024 и темсиролимуса на рост клеток Rec-1. Обе молекулы использовали в эквимолярных концентрациях.
На фиг. 6 показаны графики CI сочетания CAS-024 с темсиролимусом для линии клеток SU-DHL-6 против уровней эффекта.
На фиг. 7 показаны графики CI сочетания CAS-024 с темсиролимусом для линии клеток Rec-1 против уровней эффекта.
На фиг. 8 показаны графики CI сочетания CAS-024 с темсиролимусом для линий клеток Rec-1 и SU-DHL-6. Значения CI представляют собой средний CI±95% доверительный интервал для полного диапазона эффекта.
Фиг. 9 представляет собой график CI для сочетания CAS-024 с LY294002 в случае линии клеток SU-DHL-6 против уровней эффекта. Значения представляют собой среднее из трех независимых экспериментов.
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее изобретение относится к композициям и способам комбинированного применения CD37-специфичных связывающих молекул и ингибиторов mTOR или PI3K для уменьшения количества B-клеток, которые ассоциированы с некоторыми заболеваниями или расстройствами, такими как злокачественная опухоль. Неожиданный результат применения такого сочетания заключается в том, что такие соединения действуют синергетически, что приводит к более сильному снижению количества B-клеток. В связанном аспекте настоящее изобретение относится к способам лечения индивидуума, у которого имеется или у которого предполагается наличие заболевания, ассоциированного с аномальной активностью B-клеток, такого как B-клеточная лимфома, например, B-клеточная неходжкинская лимфома (NHL) или B-клеточный лейкоз, такой как хронический лимфоцитарный лейкоз или тому подобные.
Перед тем, как приступить к более подробному изложению настоящего изобретения, для его понимания может быть полезным знакомство с определениями некоторых терминов, используемых в настоящем описании. Дополнительные определения изложены на протяжении данного описания.
Следует понимать, что в настоящем описании любой диапазон концентраций, диапазон значений в процентах, диапазон отношений или область целых значений включает любое целое число в указанном диапазоне и в соответствующих случаях его дробную часть (такую как одна десятая и одна сотая целого числа), если не указано иное. Также следует понимать, что любой диапазон чисел, указанный в настоящем описании, относящийся к любому физическому признаку, такому как субъединицы полимера, размер или плотность, включает любое целое число в указанном диапазоне, если не оговорено особо. В используемом в настоящем описании смысле «примерно» означает ±20% от указанного диапазона, значения или структуры, если не указано иное. Следует понимать, что термины в единственном числе в используемом в настоящем описании смысле относятся к «одному или нескольким» из указанных компонентов. Следует понимать, что использование альтернативы (например, «или») означает любой один, оба или любое сочетание альтернативных вариантов. В используемом в настоящем описании смысле термины «включают» и «содержат» используют как синонимы. Кроме того, следует понимать, что отдельные соединения или группы соединений, полученные в результате различных сочетаний структур и заместителей, описанные в настоящей публикации, раскрыты в настоящем описании в такой же степени, как в том случае, когда каждое соединение или группа соединений указана отдельно. Таким образом, выбор конкретных структур или конкретных заместителей входит в объем настоящего изобретения.
«Связывающий домен» или «связывающая область» согласно настоящему изобретению может представлять собой, например, любой белок, полипептид, олигопептид или пептид, который обладает способностью специфично узнавать и связываться с биологической молекулой (например, CD37) или комплексом, содержащим больше одной одинаковых или разных молекул, или совокупностью или агрегатом. Примеры связывающих доменов включают вариабельные области одноцепочечных антител (например, доменные антитела, sFv, scFv, Fab). Известно множество анализов для идентификации связывающих доменов согласно настоящему изобретению, которые специфично связывают конкретную мишень, включая Вестерн-блот, ELISA или анализ Biacore®.
Связывающие домены и их слитые белки согласно настоящему изобретению могут быть способны к связыванию в требуемой степени, включая «специфичное или избирательное связывание», с мишенью, при незначительном связывании других компонентов, присутствующих в тестируемом образце, если они связывают молекулу-мишень с аффинностью или Ka (т.е., константой равновесной ассоциации конкретного равновесия связывания в единицах 1/M), например, больше или равной примерно 105 М-1, 106 М-1, 107 М-1, 108 М-1, 109 М-1, 1010 М-1, 1011 М-1, 1012 М-1 или 1013 М-1. «Высоко аффинные» связывающие домены относятся к таким связывающим доменам, которые имеют Ka, составляющую, по меньшей мере, 107 М-1, по меньшей мере 108 М-1, по меньшей мере 109 М-1, по меньшей мере 1010 М-1, по меньшей мере 1011 М-1, по меньшей мере 1012 М-1, по меньшей мере 1013 М-1 или выше. Термин «низко аффинные» связывающие домены относится к таким связывающим доменам, которые имеют Ka до 107 М-1, до 106 М-1 до 105 М-1 или меньше. Альтернативно аффинность может быть определена в виде равновесной константы диссоциации (Kd) для конкретного взаимодействия при связывании в единицах М (например, от 10-5 М до 10-13 М). Аффинности полипептидов связывающих доменов и слитых белков согласно настоящему изобретению легко можно определить, используя обычные методики (смотри, например, Scatchard et al. (1949) Ann. N.Y. Acad. Sci. 51: 660, и патенты США № 5283173, 5468614 или эквивалент).
Термин «CD37-специфичная связывающая молекула» относится к белку, полипептиду, олигопептиду или пептиду, которые преимущественно связываются с белковым антигеном CD37 человека (смотри, например, номера доступа в GenBank EAW52467.1, EAW52468.1, BAG62633.1, BAH14719.1, BAG62877.1, NP 001765.1 и NP 001035120.1), по сравнению с другими белками и связываются с Ka, по меньшей мере, примерно 106 М-1 (например, по меньшей мере, примерно 107 М-1, 108 М-1, 109 М-1, 1010 М-1, 1011 М-1, 1012 М-1 или 1013 М-1).
Термин «CD37-специфичный связывающий домен» относится к части или домену CD37-специфичной связывающей молекулы, непосредственно отвечающему за связывание CD37. CD37-специфичный связывающий домен сам по себе (т.е., без любой другой части CD37-специфичной связывающей молекулы) связывается с CD37 с Ka, составляющей, по меньшей мере, примерно 106 М-1 (например, по меньшей мере, примерно 107 М-1, 108 М-1, 109 М-1, 1010 М-1, 1011 М-1, 1012 М-1 или 1013 M-1). CD37-специфичный связывающий домен сам по себе может быть достаточным в качестве CD37-специфичной связывающей молекулы. Примеры CD37-специфичных связывающих доменов включают CD37-специфичные фрагменты scFv и Fab, которые могут быть основаны на вариабельных доменах или CDR анти-CD37-антитела, таких как вариабельные домены или CDR из моноклональных антител G28-1, IPO24, WR17, MB371, HH1 или HD28.
Каждый из терминов, понятных специалистам в области методики антител, приведен в значении, принятом в данной области, если в настоящем описании специально не определено иное. Известно, что антитела имеют антигенсвязывающие вариабельные домены, шарнирную область и константные области, которые опосредуют эффекторную функцию. Термин «антитело» относится к интактному антителу, содержащему, по меньшей мере, две тяжелых (H) цепи и две легких (L) цепи, связанные между собой дисульфидными связями, в также к антигенсвязывающей части интактного антитела, которая обладает или сохраняет способность связывать молекулу-мишень. Моноклональное антитело или его антигенсвязывающая часть может быть нечеловеческим, химерным, гуманизированным или человеческим. Обзор структуры и функций иммуноглобулинов можно найти, например, в публикации Harlow et al., Eds., Antibodies: A Laboratory Manual, Chapter 14 (Cold Spring Harbor Laboratory, Cold Spring Harbor, 1988).
Например, термины «VL» и «VH» относятся к вариабельному связывающему домену легкой и тяжелой цепи антитела, соответственно. Вариабельные связывающие домены состоят из дискретных хорошо охарактеризованных подобластей, известных как «определяющие комплементарность области» (CDR) и «каркасные области» (FR). Более конкретно, каждый VH- и VL-домен антитела состоит из трех CDR и четырех FR, расположенных от аминоконца к карбоксильному концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
Вариабельные домены тяжелой и легкой цепи могут быть слиты вместе линкерной аминокислотной последовательностью с образованием «одноцепочечного вариабельного фрагмента» (scFv). «Линкер вариабельных доменов» представляет собой аминокислотную последовательность длиной примерно от 5 до 35 аминокислот (например, (GlynSer)m, где n и m означают целые числа, независимо выбранные из 1-6, предпочтительно n равно 4 и m равно 3, 4 или 5), расположенную между и связывающую вариабельный домен тяжелой цепи с вариабельным доменом легкой цепи или связывающую вариабельный домен легкой цепи с вариабельным доменом тяжелой цепи, которая обеспечивает спейсерную функцию, совместимую с взаимодействием двух вариабельных доменов, так что полученный в результате полипептид сохраняет аффинность специфичного связывания с той же молекулой-мишенью, что и молекула-мишень антитела, имеющего такие же вариабельные области легкой и тяжелой цепи.
Антитела имеют шарнирную последовательность, которая обычно расположена между Fab-частью и константной областью (но нижняя область шарнира может включать в себя аминоконцевую часть константной области). В качестве исходного условия шарнир иммуноглобулина действует как гибкий спейсер, позволяя Fab-части свободно перемещаться в пространстве. Согласно кристаллическим исследованиям шарнирный домен IgG можно функционально и структурно подразделить на три области: верхнюю, центральную или среднюю и нижнюю области шарнира (Shin et al. (1992) Immunol. Rev. 130: 87). Примерами верхней области шарнира являются последовательности EPKSCDKTHT (SEQ ID NO: 263), которая найдена в IgG1, ERKCCVE (SEQ ID NO: 270), которая найдена в IgG2, ELKTPLGDTTHT (SEQ ID NO: 271) или EPKSCDTPPP (SEQ ID NO: 272), которые найдены в IgG3, и ESKYGPP (SEQ ID NO: 273), которая найдена в IgG4. Примерами средней или центральной областей шарнира является последовательность CPPCP (SEQ ID NO: 274), которая найдена в IgG1 и IgG2, CPRCP (SEQ ID NO: 275), которая найдена в IgG3, и CPSCP (SEQ ID NO: 276), которая найдена в IgG4. В то время как каждое из IgG1-, IgG2- и IgG4-антител, по-видимому, имеет один верхний и средний шарнир, IgG3 имеет четыре шарнира в тандеме - один представлен последовательностью ELKTPLGDTTHTCPRCP (SEQ ID NO: 277) и три EPKSCDTPPPCPRCP (SEQ ID NO: 278).
В IgA- и IgD-антителах, по-видимому, отсутствует IgG-подобная центральная область, и IgD, по-видимому, имеет две верхних области шарнира в тандеме (смотри, например, ESPKAQASSVPTAQPQAEGSLAKATTAPATTRNT, SEQ ID NO: 279, и GRGGEEKKKEKEKEEQEERETKTP, SEQ ID NO: 280). Примеры верхних областей шарнира дикого типа, найденные в IgA1- и IgA2-антителах, представляют собой последовательности VPSTPPTPSPSTPPTPSPS (SEQ ID NO: 281) и VPPPPP (SEQ ID NO: 282), соответственно. Напротив, в IgE- и IgM-антителах отсутствует типичная шарнирная область, и вместо этого они имеют CH2-домен с шарнироподобными свойствами. Примеры последовательностей, подобных верхней области шарнира CH2 дикого типа IgE и IgM, приведены в виде последовательности
и последовательности
соответственно.
В используемом в настоящем описании смысле «шарнирная область иммуноглобулина дикого типа» относится к встречающимся в природе аминокислотным последовательностям верхнего и среднего шарнира, расположенными между и связывающими домены CH1 и CH2 (в случае IgG, IgA и IgD) или расположенными между и связывающими доменые CH1 и CH3 (в случае IgE и IgM), находящиеся в тяжелой цепи антитела.
В используемом в настоящем описании смысле «измененная шарнирная область иммуноглобулина» относится к (a) шарнирной области иммуноглобулина дикого типа, имеющей до 30% изменений аминокислот (например, до 25%, 20%, 15%, 10% или 5% аминокислотных замен или делеций), или (b) части шарнирной области иммуноглобулина дикого типа, имеющей длину примерно от 5 аминокислот (например, примерно от 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 аминокислот) до примерно 120 аминокислот (предпочтительно имеющей длину примерно от 10 до примерно 40 аминокислот или примерно от 15 до примерно 30 аминокислот, или примерно от 15 до примерно 20 аминокислот, или примерно от 20 до примерно 25 аминокислот), которая имеет примерно до 30% изменений аминокислот (например, примерно до 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2% или 1% аминокислотных замен или делеций или их сочетания), и имеет центральную область шарнира IgG, которая указана в виде последовательностей SEQ ID NO: 274-276.
Кроме того, антитела содержат константные области. Термин «CL» относится к «константной области легкой цепи иммуноглобулина» или «константной области легкой цепи», т.е., константной области легкой цепи антитела. Термин «CH» относится к «константной области тяжелой цепи иммуноглобулина» или «константной области тяжелой цепи», которая дополнительно делится, в зависимости от изотипа антитела, на домены CH1, CH2 и CH3 (IgA, IgD, IgG) или CH1, CH2, CH3 и CH4 (IgE, IgM). Часть доменов константной области составляет Fc-область (область «кристаллизуемого фрагмента») антитела и отвечает за эффекторные функции (такие как зависимая от антител опосредованная клетками цитотоксичность (ADCC), зависимый от антител клеточный фагоцитоз (ADCP), комплементзависимая цитотоксичность (CDC) и связывание комплемента), связывание с Fc-рецепторами (например, CD16, CD32, FcRn), длительное время полужизни in vivo, связывание белка A и возможно даже перенос через плаценту (смотри Capon et al. (1989) Nature 337: 525).
Примеры доменов CH2 человека дикого типа указаны в виде последовательностей SEQ ID NO: 285-293, домены CH3 человека дикого типа указаны в виде последовательностей SEQ ID NO: 294-302, и домены CH4 человека дикого типа указаны в виде последовательностей SEQ ID NO: 303 и 304. «Измененная константная область иммуноглобулина» относится к константной области иммуноглобулина, идентичность последовательности которой с константной областью дикого типа, составляет, по меньшей мере, 75% (например, 80%, 82%, 84%, 86%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 99,5%). Например, «измененная область CH2 иммуноглобулина» или «измененная область CH2» относится к области CH2, идентичность последовательности которой с областью CH2 иммуноглобулина дикого типа (например, CH2 человека) составляет, по меньшей мере, 75% (например, 80%, 82%, 84%, 86%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 99,5%). Подобным образом «измененная область CH3 иммуноглобулина» или «измененная область CH3» относится к области CH3, идентичность последовательности которой с областью CH3 иммуноглобулина дикого типа (например, CH3 человека) составляет, по меньшей мере, 75% {например, 80%, 82%, 84%, 86%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 99,5%).
«Идентичность последовательностей» в используемом в настоящем описании смысле относится к процентному содержанию аминокислотных остатков в одной последовательности, которые идентичны аминокислотным остаткам в другой эталонной полипептидной последовательности после выравнивания последовательностей и при необходимости введения пробелов, чтобы достичь максимальной идентичности последовательностей в процентах, и не учитывая любые консервативные замены в качестве части идентичности последовательностей. Значения идентичности последовательностей в процентах получают с применением компьютерной программы NCBI BLAST2.0, как определено в публикации Altschul et al. (1997) «Gapped BLAST and PSI-BLAST: a new generation of protein database search programs», Nucleic Acids Res. 25: 3389-3402, используя значения параметров, установленные по умолчанию.
В некоторых вариантах измененная область или домен иммуноглобулина содержит только консервативные аминокислотные замены домена иммуноглобулина дикого типа. В некоторых других вариантах измененный домен иммуноглобулина содержит только неконсервативные аминокислотные замены домена иммуноглобулина дикого типа. В других вариантах измененный домен иммуноглобулина содержит как консервативные, так и неконсервативные аминокислотные замены.
Термин «консервативная замена» понимают в данной области как замену одной аминокислоты другой аминокислотой, которая обладает сходными свойствами. Примеры консервативных замен хорошо известны в данной области (смотри, например, публикацию PCT № WO 97/09433, стр. 10; Lehninger, Biochemistry, Second Edition; Worth Publishers, Inc. NY:NY (1975), pp.71-77; Lewin, Genes IV, Oxford University Press, NY and Cell Press, Cambridge, MA (1990), p. 8). В некоторых вариантах консервативная замена включает замену лейцина на серин.
«Производное» в используемом в настоящем описании смысле относится к химически или биологически модифицированному варианту соединения, который структурно подобен исходному соединению и (фактически или теоретически) может быть получен из такого исходного соединения. В общем, «производное» отличается от «аналога» тем, что исходное соединение может быть первичным материалом для создания «производного», тогда как для создания «аналога» в качестве первичного материала не обязательно использование исходного соединения.
«Низкомолекулярный модульный иммунофармацевтический (SMIPTM) белок или полипептид» относится к одноцепочечному слитому белку, который содержит в направлении от амино-конца к карбоксильному концу: (i) связывающий домен, который специфично связывает молекулу-мишень, (ii) линкерный полипептид {например, шарнир иммуноглобулина или его производное) и (iii) (a) полипептид CH2 иммуноглобулина и полипептид CH3 иммуноглобулина IgG, IgA или IgD, или (b) полипептид CH3 иммуноглобулина и полипептид CH4 иммуноглобулина IgM или IgE (смотри, публикации патентов США № 2003/0133939, 2003/0118592 и 2005/0136049; и публикацию PCT № WO 2005/017148).
«Белок PIMS» является молекулой, обратной SMIP, в которой связывающий домен расположен на карбоксильном конце слитого белка. Конструкции и способы получения белков PIMS описаны в публикации PCT № WO 2009/023386 и в публикации заявки на выдачу патента США № US 2009/0148447, и описание таких конструкций, которые содержат CD37-связывающий домен, включено в настоящее описание в виде ссылки. Примером молекулы PIMS является одноцепочечный полипептид, содержащий в направлении от амино-конца к карбоксильному концу константную подобласть, полученную из антитела (например, область, которая содержит CH2-домен и CH3-домен), линкерный пептид (например, область «стебля» молекулы CD или ее функциональный вариант) и связывающий домен (например, CD37). В некоторых вариантах PIMS дополнительно содержит второй линкерный пептид, расположенный с амино-конца по отношению к константной подобласти (например, область шарнира иммуноглобулина), который может быть таким же или другим, отличным от линкерного пептида между константной подобластью и связывающим доменом.
«Белок SCORPION» представляет собой слитый белок, содержащий два связывающих домена, которые включают в себя вариабельные области иммуноглобулина или подобных иммуноглобулину молекул. Конструкции и способы получения белков SCORPION описаны в публикации PCT № WO 2007/146968 и в публикации заявки на выдачу патента США № US 2009/0175867, и описание таких конструкций, которые могут содержать CD37-связывающий домен, включено в настоящее описание в виде ссылки. Примером белка SCORPION является одноцепочечный поливалентный или полиспецифичный связывающий белок с эффекторной функцией, содержащий в направлении от амино-конца к карбоксильному концу: (a) первый связывающий домен, содержащий вариабельные области иммуноглобулина или подобной иммуноглобулину молекулы, (b) первый линкерный пептид, (c) константную подобласть иммуноглобулина, обеспечивающую эффекторную функцию, (d) второй линкерный пептид и (e) второй связывающий домен, содержащий вариабельные области иммуноглобулина или подобной иммуноглобулину молекулы. В некоторых вариантах первый и второй связывающие домены связываются с одной и той же мишенью (например, CD37). В некоторых других вариантах первый и второй связывающие домены связывают разные мишени.
В используемом в настоящем описании смысле, если не указано иное, положение аминокислотного остатка в вариабельной области молекулы иммуноглобулина или в слитом белке, содержащем области или домены иммуноглобулина, пронумерованы согласно правилу нумерации Кабата (Kabat, Sequences of Proteins of Immunological Interest, 5th ed. Bethesda, MD: Public Health Service, National Institutes of Health (1991)), и положение аминокислотного остатка в константной области молекулы иммуноглобулина пронумеровано согласно номенклатуре EU (Ward et al., 1995 Therap. Immunol. 2: 77-94; Kabat, выше).
«Ассоциированное с B-клетками расстройство или заболевание» или «заболевание или расстройство, ассоциированное с аномальной активностью B-клеток» относится к заболеванию или расстройству, ассоциированному с (например, вызывающему или возникающему в результате) аномальной активностью B-клеток или активностью, которая отклоняется от нормального, характерного или ожидаемого течения. Например, ассоциированное с B-клетками расстройство или заболевание может включать не соответствующую норме пролиферацию B-клеток, которые имеют поврежденную или дефектную ДНК или другие клеточные компоненты. Аномальная активность B-клеток может включать пролиферацию клеток, характеризуемую несоответствующими высокими уровнями деления B-клеток, несоответствующими низкими уровнями апоптоза B-клеток или и тем и другим признаками. При таких заболеваниях может происходить аномальная пролиферация B-клеток в одном месте или в нескольких местах, и могут присутствовать группы B-клеток или ткань (ткани) либо канцерогенные, либо неканцерогенные, доброкачественные или злокачественные. Ассоциированное с B-клетками расстройство или заболевание также может включать аномальную продукцию антител, например, продукцию аутоантител, или сверхпродукцию антител, когда более желательны нормальные уровни их продукции. Также в настоящем изобретении предполагается, что аномальная активность B-клеток может возникать в некоторых субпопуляциях B-клеток, и не наблюдаться в других субпопуляциях, или может вызывать неподходящую стимуляцию T-клеток, например, в результате неподходящей презентации антигена T-клеткам или другим B-клеточным путем.
«Лечение» или «осуществление лечения» относится либо к терапевтическому лечению, либо профилактическому/превентивному лечению. Терапевтическое лечение может улучшать, по меньшей мере, один симптом заболевания у пациента, получающего лечение, или может задерживать ухудшение в случае прогрессирующего заболевания у пациента или предотвращать появление дополнительных ассоциированных симптомов или заболеваний или способствовать любому сочетанию указанных выше эффектов.
«Терапевтически эффективное количество (или доза)» или «эффективное количество (или доза)» специфично связывающей молекулы {например, CD37-специфичной связывающей молекулы) или соединения (например, ингибитора mTOR, ингибитора PI3K) относится к такому количеству соединения или сочетания соединений, которое достаточно для того, чтобы получить результат в виде улучшения одного или нескольких симптомов заболевания, подвергаемого лечению, задержки ухудшения в случае прогрессирующего заболевания или предотвращения появления дополнительных ассоциированных симптомов или заболеваний или любого их сочетания.
«Субъектом, у которого имеется или у которого предполагается наличие заболевания, ассоциированного с аномальной активностью B-клеток» является субъект (человек или другое животное), у которого заболевание или симптом расстройства может быть вызван аномальной активностью B-клеток или пролиферацией B-клеток, может быть усилен аномальной активностью B-клеток или может быть облегчен в результате регуляции B-клеточной активности. Примерами таких заболеваний являются B-клеточное злокачественное новообразование или B-клеточная злокачественная опухоль (например, B-клеточная лимфома, B-клеточный лейкоз или B-клеточная миелома), заболевание, характеризуемое продукцией аутоантител (например, аутоиммунные заболевания) или воспалением, или заболевание, характеризуемое несоответствующей стимуляцией T-клеток, вызванной неподходящей презентацией T-клеткам антигена B-клетками или вызванной другими путями, в которые вовлечены B-клетки.
CD37-специфичные связывающие молекулы
CD37-специфичные связывающие молекулы, применимые для комбинированной терапии, описанной в настоящей публикации, содержат CD37-специфичный связывающий домен. CD37-специфичный связывающий домен может быть использован отдельно или в встроенным в каркас, включая применение в форме анти-CD37-антитела или его антигенсвязывающего фрагмента, Fab-части или (Fab)2-части анти-CD37-антитела, одноцепочечного Fv (scFv) против CD37, анти-CD37-SMIP-белка, анти-CD37-PIMS-белка, анти-CD37-SCORPION-белка или тому подобной.
Основанные на иммуноглобулине CD37-специфичные связывающие домены, применимые в настоящем изобретении, включают домены, известные в данной области, которые описаны в настоящей публикации, или домены, созданные различными способами, известными в данной области (смотри, например, патенты США № 6291161 и 6291158). Например, CD37-специфичные связывающие домены можно идентифицировать с помощью скрининга фаговой Fab-библиотеки в отношении Fab-фрагментов, которые специфично связываются с CD37 (смотри Hoet et al. (2005) Nature Biotechnol. 23: 344). Дополнительно можно использовать традиционные методики создания гибридом, такие как использование CD37 в качестве иммуногена в обычных системах (например, мыши, HuMAb-мышь®, TC-мышьTM, KM-мышь®, ламы, овцы, цыплята, крысы, хомячки, кролики и т.д.), для разработки анти-CD37-антител, имеющих представляющие интерес CD37-специфичные связывающие домены.
Источниками других связывающих доменов являются вариабельные домены CD37-специфичных антител различных видов (которые могут быть использованы в формате антител, sFv, scFv, Fab или растворимый VH-домен или доменные антитела), включая человека, грызунов, птиц и овец. Дополнительными источниками связывающих доменов являются вариабельные домены антител из других видов, таких как верблюдовые (верблюды, дромадеры или ламы (Ghahroudi etal. (1997) FEBS Letters 414:521; Vincke et al. (2009) J. Biol. Chem. 284:3273; and Hamers-Casterman et al. (1993) Nature, 363:446; and Nguyen et al. (1998) J. Mol. Biol., 275:413), акулы-няньки (Roux et al. (1998) Proc. Natl. Acad. Sci. (USA) 95: 11804), пятнистые химеры (Nguyen et al. (2002) Immunogenetics, 54: 39) или миноги (Herrin et al., (2008) Proc. Natl. Acad. Sci. (USA) 105: 2040 и Alder et al. (2008) Nature Immunol. 9: 319). Такие антитела, очевидно, могут образовывать антигенсвязывающие области с использованием только вариабельной области тяжелой цепи, т.е. такие функциональные антитела являются гомодимерами только тяжелых цепей (называемыми «антителами на основе тяжелых цепей») (Jespers et al. (2004) Nature Biotechnol. 22:1161; Cortez-Retamozo et al. (2004) Cancer Res. 64:2853; Baral et al. (2006) Nature Med. 12:580, and Barthelemy et al. (2008) J. Biol. Chem. 283:3639).
Другими альтернативными источниками CD37-специфичных связывающих доменов являются последовательности, которые кодируют библиотеки случайных пептидов, или последовательности, которые кодируют сконструированное разнообразие аминокислот в областях петель альтернативных, не относящихся к антителам каркасов, таких как домены фибриногена (смотри, например, Weisel et al. (1985) Science 230: 1388), домены Кунитца (смотри, например, патент США № 6423498), белки с повторами анкирина (Binz et al. (2003) J. Mol. Biol. 332: 489 и Binz et al. (2004) Nature Biotechnology 22: 575), связывающие домены фибронектина (Richards et al. (2003) J. Mol. Biol. 326:1475; Parker et al. (2005) Protein Eng. Des. Sel. 18:435 and Hackel et al. (2008) J. Mol. Biol. 381:1238), минибелки с цистеиновыми узлами (Vita et al. (1995) Proc. Natl. Acad. Sci. (USA) 92: 6404; Martin et al. (2002) Nature Biotechnol. 21: 71 и Huang et al. (2005) Structure 13: 755), тетратрикопептидные повторяющиеся домены (Main et al. (2003) Structure 11: 497 и Cortajarena et al. (2008) ACS Chem. Biol. 3: 161), богатые лейцином повторяющиеся домены (Stumpp et al. (2003) J. Mol. Biol. 332: 471), домены липокалина (смотри, например, публикацию PCT № WO 2006/095164, Beste et al. (1999) Proc. Natl. Acad. Sci. (USA) 96: 1898 и Schonfeld et al. (2009) Proc. Natl. Acad. Sci. (USA) 106: 8198), V-подобные домены (смотри, например, публикацию заявки на выдачу патента США № 2007/0065431), лектиновые домены C-типа (Zelensky and Gready (2005) FEBS J. 272: 6179; Beavil et al. (1992) Proc. Natl. Acad. Sci. (USA) 89: 753 и Sato et al. (2003) Proc. Natl. Acad. Sci. (USA) 100: 7779), mAb2 или FcabTM (смотри, например, публикации PCT № WO 2007/098934; WO 2006/072620), или тому подобные (Nord at al. (1995) Protein Eng. 8:601; Nord et al. (1997) Nature Biotechnol. 15:772; Nord et al. (2001) Eur. J. Biochem. 268:4269; and Binz et al. (2005) Nature Biotechnol. 23:1257).
В некоторых вариантах CD37-специфичный связывающий домен содержит VH-домен, полученный из или основанный на VH моноклонального анти-CD37-антитела. В следующих вариантах CD37-специфичный связывающий домен содержит VL-домен, полученный из или основанный на VL моноклонального анти-CD37-антитела. В следующих вариантах CD37-специфичый связывающий домен содержит VH-домен и VL-домен, полученный из или основанный на VH и VL, соответственно, из одного моноклонального анти-CD37-антитела или, по меньшей мере, из двух разных моноклональных анти-CD37-антител. В предпочтительном варианте домены VH и VL получены из моноклонального антитела G28-1 (SEQ ID NO: 241 и 236, соответственно) или из моноклонального антитела или SMIP-белка CAS-024 (SEQ ID NO: 245 и 238, соответственно).
В некоторых вариантах CD37-специфичный связывающий домен содержит домены VH и VL, каждый из которых независимо модифицирован так, чтобы он содержал одну или несколько (например, 2, 3, 4, 5, 6, 7, 8, 9, 10) инсерций аминокислот, одну или несколько (например, 2, 3, 4, 5, 6, 7, 8, 9, 10) делеций аминокислот, одну или несколько (например, 2, 3, 4, 5, 6, 7, 8, 9, 10) аминокислотных замен (например, консервативных аминокислотных замен) или их сочетание, по сравнению с доменами VH и VL дикого типа, соответственно, исходного моноклонального анти-CD37-антитела или антител. Инсерция(ии), делеция(ии) или замена(ны) могут быть где угодно в домене VH, домене VL или обоих доменах, включая изменения на амино-конце или карбоксильном конце или на обоих концах каждого или обоих доменов, при условии, что каждый CDR содержит нулевые изменения или не больше одного, двух или трех изменений, и при условии, что CD37-связывающий домен, содержащий модифицированный VH-домен, VL-домен или оба домена, может специфично связывать CD37 с аф