Способ скрининга с использованием фактора, являющегося мишенью для талидомида
Иллюстрации
Показать всеИзобретение относится к способу скрининга нетератогенного вещества, который включает приведение испытуемого вещества в контакт с цереблоном или фрагментом цереблона, оценку способности испытуемого вещества связываться с цереблоном или фрагментом цереблона и отбор испытуемого вещества, не связывающегося с цереблоном или фрагментом цереблона, или испытуемого вещества, характеризующегося более низкой способностью связываться с цереблоном или фрагментом цереблона по сравнению с талидомидом. 2 н. и 6 з.п. ф-лы, 19 ил., 8 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу скрининга нетератогенного вещества, такого как лекарственное средство, фармацевтическая добавка, пищевой продукт, пищевая добавка и, в частности, нетератогенного производного талидомида, а также к способу скрининга антагониста талидомида с использованием цереблона (может быть обозначен аббревиатурой CRBN), являющегося мишенью для талидомида, или фрагмента CRBN. Настоящее изобретение также относится к мутированному CRBN, который почти не связывается с талидомидом, но сохраняет функцию компонента убихитинлигазного комплекса, к нуклеиновой кислоте, кодирующей мутированный CRBN, и к животному, отличному от человека, которому вводят указанную нуклеиновую кислоту с целью экспрессии.
Уровень техники
Талидомид, который в конце 1950-х годов и в начале 1960-х годов продавался в качестве седативного средства в более чем 40 странах, врачи часто прописывали беременным женщинам от утреннего недомогания. До того как было выявлено тератогенное действие данного средства и прекращено его применение, родились десятки тысяч или более детей с врожденными дефектами (пороками развития), включая мертворождение (приведенные литературные источники 1-3). У женщин, находившихся на третьей - восьмой неделе беременности, которые принимали талидомид, рождались дети с такими врожденными дефектами, как нарушение развития конечностей, ушей, сердца и желудочно-кишечного тракта, получившими название эмбриопатия, вызванная талидомидом (приведенные литературные источники 1-3). В частности, особенно часто встречаются дефекты развития конечностей и ушей. Дефект развития конечностей, известный как фокомелия, характеризуется укорачиванием ног и рук. Дефектом развития ушей является анотия, микротия и тугоухость. Несмотря на значительные усилия, направленные на установление причин данного явления, до сих пор мало известно о том, как возникают указанные дефекты развития. Ранее выполненные исследования позволили предположить, что возможной причиной тератогенного действия может быть вызываемый талидомидом окислительный стресс и его негативное воздействие на развитие кровеносных сосудов (приведенные литературные источники 4 и 5). Однако до сих пор не найдены ответы на некоторые важные вопросы, в частности, не известно, какие молекулы являются прямыми мишенями для талидомида и каким образом указанные мишени опосредуют вызываемое талидомидом тератогенное действие.
В настоящее время стало известно, что белок, именуемый CRBN, вызывает у людей легкую форму олигофрении (не являющийся патентом документ 1 и приведенный литературный источник 11). Хотя в научной литературе было отмечено, что указанный белок также связывается с белком, именуемым поврежденным ДНК-связывающим белком 1 (DDB1) (не являющийся патентом документ 2 и приведенный литературный источник 12), ранее не была выявлена его связь с талидомидом.
Список ссылок
Документ, не являющийся патентом
Не являющийся патентом документ 1: J.J. Higgins, J. Pucilowska, R.Q. Lombardi, J.P. Rooney, Neurology 63, 1927 (2004).
Не являющийся патентом документ 2: S. Angers et al., Nature 443, 590 (2006).
Сущность изобретения
Задачи, решаемые настоящим изобретением
В последнее время талидомид стал более широко применяться для лечения множественной миеломы и нодозной эритемы, которая является определенным типом лепры, сопровождающейся болью (приведенные литературные источники 2, 3, 6 и 7). Хотя детальный механизм такого воздействия остается неясным, известно, что талидомид оказывает благоприятное воздействие на указанные заболевания. Однако из-за серьезной проблемы, связанной с тератогенным действием, талидомид применяется только под строгим контролем (приведенный литературный источник 8), поэтому весьма желательно устранить тератогенное действие талидомида, что позволит расширить применение указанного лекарственного средства благодаря его благоприятному воздействию.
Настоящее изобретение было сделано с учетом вышеописанного уровня техники, и целью настоящего изобретения является создание нетератогенного лекарственного средства, являющегося альтернативой талидомиду, которое сохраняет благоприятное фармакологическое действие указанного лекарственного средства.
Способ решения поставленных задач
Авторы настоящего изобретения провели всестороннее исследование для достижения вышеуказанной цели. В результате выполненного исследования было установлено, что талидомид оказывает тератогенное действие в результате связывания с CRBN и ингибирования активности убихитин-лигазного комплекса, содержащего CRBN в качестве компонента. Как было описано ранее, известно, что CRBN является предполагаемой причиной возникновения у людей легкой формы олигофрении и что CRBN связывается с DDB1; однако до сих пор полностью не известна взаимосвязь между CRBN и талидомидом. В свете вышеизложенного, во время подачи настоящей заявки совершенно невероятным было открытие того, что CRBN является мишенью, опосредующей вызываемое талидомидом тератогенное действие.
На основании сделанного открытия можно прогнозировать тератогенное действие производного талидомида путем оценки сродства связывания данного соединения с CRBN.
В более широком понимании данное открытие позволяет прогнозировать тератогенное действие, подобное талидомиду, не только у производных талидомида, но также у всех испытуемых веществ путем исследования их способности связываться с CRBN.
Кроме того, авторы настоящего изобретения обнаружили, что аминокислотные остатки от положения 339 до положения 442 от N-конца CRBN человека представляют собой область связывания талидомида с CRBN человека, при этом замена тирозина в положении 384 и триптофана в положении 386 от N-конца аланином уменьшает способность CRBN связываться с талидомидом, но сохраняет его функцию в качестве компонента убихитин-лигазного комплекса.
В основе настоящего изобретения лежат вышеуказанные открытия.
То есть настоящее изобретение относится к нижеследующим объектам [1]-[11].
[1] Способ скрининга нетератогенного вещества, который включает приведение испытуемого вещества в контакт с цереблоном или фрагментом цереблона, оценку способности испытуемого вещества связываться с цереблоном или фрагментом цереблона и отбор испытуемого вещества, не связывающегося с цереблоном или фрагментом цереблона, или испытуемого вещества, характеризующего более низкой способностью связываться с цереблоном или фрагментом цереблона по сравнению с талидомидом.
[2] Способ скрининга нетератогенного вещества по п.[1], в котором испытуемое вещество представляет собой лекарственное средство.
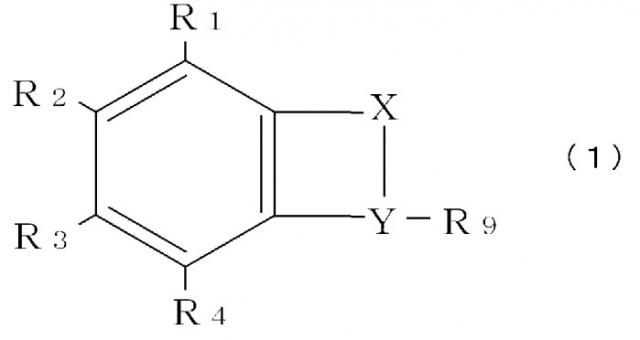
[3] Способ скрининга нетератогенного вещества по п.[1] или [2], в котором испытуемое вещество является производным талидомида, выраженным общей формулой (1):
Формула 1
где соединение, в котором Х означает R5-R7 и Y означает R6-R8, именуется соединением (А), соединение, в котором Х означает R5 и Y означает R6-R8, именуется соединением (В) и соединение, в котором Х означает R5 и Y означает R8, именуется соединением (С);
каждый элемент R1, R2, R3 и R4 может быть выбран из -Н; -ОН; =О; алкана, алкена и алкина с линейной или разветвленной цепью; циклического алкана, алкена и алкина; комбинации циклического и нециклического алкана, алкена и алкина; спирта, альдегида, кетона, карбоновой кислоты, сложного эфира или простого эфира, объединяющего кольцевую и некольцевую структуру, или комбинации циклических/ нециклических частей; аза; амино; -MOn или -O-MOn [где М=N и n=2; М=S и n=2 или 3; М=Р и n=1-3]; и галогена; и
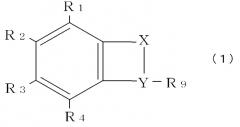
каждый элемент R5, R6, R7 и R8 независимо выбирают из группы формулы (2):
Формула 2
и -О- (где Z является необязательным элементом и имеет такие же значения, что и вышеописанный элемент R1); и R10 имеет такие же значения, что и вышеописанный элемент R1, или (когда Z отсутствует) R10=О;
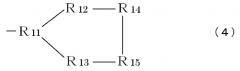
R9 означает часть, имеющую формулу (3), (4), (5), (6) или (7):
Формула 3
Формула 4
Формула 5
Формула 6
где каждый элемент R11-R17 (независимо) имеет такие же значения, что и вышеописанный элемент R5, или
Формула 7
где каждый элемент R18, R19 и R20 независимо выбирают из Н, -СН3, -СООН, -CONH2, -(CH2)n-COOH, -(CH2)n CONH2, где n=1-4.
[4] Способ скрининга нетератогенного вещества по любому из пп.[1]-[3], в котором фрагмент цереблона содержит аминокислотную последовательность от положения 339 до положения 442 от N-конца аминокислотной последовательности, показанной в SEQ ID NO:7, при этом в остальной части аминокислотной последовательности SEQ ID NO:7 заменяют, удаляют и/или добавляют один или более аминокислотных остатков.
[5] Способ скрининга нетератогенного вещества по любому из пп.[1]-[4], в котором цереблон или фрагмент цереблона иммобилизован на носителе.
[6] Способ скрининга нетератогенного вещества по п.[3], в котором производное талидомида обладает фармакологическим действием талидомида или известного производного талидомида.
[7] Способ скрининга антагониста тератогенного вещества, который включает стадию введения испытуемого вещества в соприкосновение с цереблоном или фрагментом цереблона, оценку способности испытуемого вещества связываться с цереблоном или фрагментом цереблона и отбор испытуемого вещества, связывающегося с цереблоном или фрагментом цереблона, и стадию выбора из веществ, отобранных на вышеуказанной стадии, вещества, способного уменьшать i) тератогенное действие или ii) ингибирующее действие, оказываемое на активность убихитин-лигазного комплекса, содержащего цереблон.
[8] Способ скрининга антагониста тератогенного вещества по п.[7], в котором цереблон или фрагмент цереблона иммобилизован на носителе.
[9] Мутированный цереблон, включающий следующую замену аминокислотных остатков (а) и/или (b):
(а) замену тирозина в положении 384 от N-конца цереблона человека или эквивалентной аминокислоты аланином;
(b) замену триптофана в положении 386 от N-конца цереблона человека или эквивалентной аминокислоты аланином.
[10] Нуклеиновая кислота, кодирующая мутированный цереблон по п.[9].
[11] Животное, отличное от человека, устойчивое к вызываемому талидомидом тератогенному действию, которое содержит в качестве гена введенную нуклеиновую кислоту по п.[10] и экспрессирует указанный ген.
Преимущества изобретения
Нетератогенное вещество, полученное способом скрининга по настоящему изобретению, позволяет прогнозировать наличие или отсутствие тератогенного действия, подобного вызываемому талидомидом, при этом указанное нетератогенное производное талидомида может быть использовано в качестве лекарственного средства, являющегося альтернативой талидомиду. Кроме того, антагонист талидомида, полученный способом скрининга по настоящему изобретению, позволяет снизить риск возникновения тератогенного действия талидомида.
Животное, содержащее в качестве гена введенную нуклеиновую кислоту, кодирующую мутированный CRBN по настоящему изобретению, и экспрессирующее указанный ген, обладает устойчивостью к вызываемому талидомидом тератогенному действию и, таким образом, может быть использовано для оценки фармакологического действия талидомида и подобных веществ.
Краткое описание чертежей
[Фиг.1] На фиг.1 показана способность талидомида (thal) связываться с CRBN и DDB1. (А) Талидомид-связывающие белки были выделены из экстрактов клеток HeLa с использованием гранул, содержащих иммобилизованный талидомид (+), или контрольных гранул (-). Связанные белки элюировали, добавляя талидомид. Элюированные белки подвергали электрофорезу и окрашивали серебром (верхний блок). Звездочкой (*) отмечено неспецифическое связывание. Связанные белки были идентифицированы как CRBN и DDB1 методом тандемной масс-спектрометрии и вестерн-блоттинга. При добавлении к экстракту 0,3 мМ талидомида до инкубации с гранулами выход указанных белков уменьшался. (В) Чтобы определить, какой белок, CRBN или DDB1, связан с гранулами, содержащими иммобилизованный талидомид, очищенный рекомбинантный CRBN с FLAG-меченной антигенной детерминантой (CRBN-FLAG) и DDB1 с V5- и His-меченной антигенной детерминантой (DDB1-V5-His) смешивали с гранулами, содержащими иммобилизованный талидомид. Связанные белки обнаруживали методом вестерн-блоттинга. В результате выполненного эксперимента было установлено, что белок, связанный с гранулами, представляет собой CRBN. (С) CRBN-FLAG и DDB1-V5-His одновременно или независимо экспрессировали в клетках Sf9 и осаждали методом иммунопреципитации антителом против FLAG. Осажденный белок подвергали электрофорезу и окрашивали кумассии. В результате выполненного эксперимента был обнаружен DDB1.
[Фиг.2] На фиг.2 показано образование комплекса Е3 белками CRBN, DDB1 и куллином 4А (Cul4A). (А) FH-CRBN с FLAG- и гемагглютинин (НА)-меченной антигенной детерминантой и DDB1-V5-His коэкспрессировали в клетках HeLa и подвергали иммунному окрашиванию. DAPI означает 4'6-диамидино-2-фенилиндол. CRBN и DDB1 были локализованы главным образом в ядре, а также в цитоплазме. (В) Экстракты клеток 293Т, устойчиво экспрессирующих FH-CRBN, или контрольные клетки (псевдотрансфецированные клетки) осаждали методом иммунопреципитации антителом против FLAG и исследовали методом вестерн-блоттинга. В результате выполненного эксперимента DDB1, Cul4A и Roc1 были осаждены вместе с FH-CRBN. (С) Клетки 293Т котрансфецировали указанным количеством векторов экспрессии FH-CRBN и DDB2. Иммунопреципитаты исходного белка и FLAG-специфического белка обнаруживали методом вестерн-блоттинга (IB). Количество DDB1, осажденного вместе с CRBN, уменьшалось в присутствии возрастающих количеств коэкспрессированного DDB2. (D) Клетки 293Т, устойчиво экспрессирующие FH-CRBN, трансфецировали Cul4A или контрольной миРНК и обрабатывали MG132. Указанные клетки лизировали буфером RIPA. Клеточный лизат осаждали методом иммунопреципитации антителом против FLAG и исследовали методом вестерн-блоттинга с использованием антитела против убихитина (Ub). Аутоубихитинирование CRBN было обнаружено в присутствии MG132 и было аннулировано миРНК Cul4A. (Е) Клетки 293Т, устойчиво экспрессирующие FH-CRBN (WT, дикого типа) или мутант CRBN, не связывающийся с DDB1 (ΔMid, делеция аминокислот 187-260), обрабатывали MG132 и исследовали так же, как показано на фиг.(D). Убихитинирование ΔMid было меньше по сравнению с CRBN дикого типа.
[Фиг.3] На фиг.3 показано ингибирование талидомидом функции CRBN. (А) Схематическое изображение CRBN и его мутанта с делецией. Звездочками отмечены положения замен аланином. (В) GST-CRBN дикого типа или мутантный белок смешивали с гранулами, содержащими иммобилизованный талидомид, и связанные мутанты CRBN окрашивали серебром. Были связаны CRBN дикого типа и мутантный белок, экспрессирующий 104 С-концевых аминокислотных остатка CRBN. Положение непроцессированный GST-гибридизированных белков отмечено стрелками. (С) Экстракты, полученные из клеток 293Т, сверхэкспрессирующих FH-CRBN и его мутанты, смешивали с гранулами, содержащими иммобилизованный талидомид, и связанные мутанты CRBN обнаруживали методом вестерн-блоттинга. Мутанты CRBN с заменой в двух положениях, Y384A и W386A, не связывались с талидомидом. Кроме того, мутанты CRBN с двумя заменами YW/AA обладали чрезвычайно низкой активностью связывания с талидомидом. (D) CRBN-V5-His (дикого типа) и его мутант FH-CRBN YW/AA котрансфецировали в клетки HeLa и подвергали иммунному окрашиванию. DAPI означает 4'6-диамидино-2-фенилиндол. Субклеточная локализация мутанта не отличалась от CRBN дикого типа. (Е) Клетки 293Т, экспрессирующие FH-CRBN YW/AA осаждали методом иммунопреципитации антителом против FLAG и исследовали методом вестерн-блоттинга. CRBN YW/AA был осажден вместе с DDB1, Cul4A и Roc1. (F и G) Клетки 293Т, устойчиво экспрессирующие FH-CRBN (дикого типа) или FH-CRBN YW/AA исследовали так же, как показано на фиг.2Е. Как показано на фиг.(G), клетки обрабатывали талидомидом в указанной концентрации в течение 4 часов и затем собирали. Аутоубихитинирование CRBN под действием MG132 было подавлено в результате предварительной обработки талидомидом, в то время как талидомид не влиял на аутоубихитинирование CRBN YW/AA.
[Фиг.4] На фиг.4 показаны дефекты развития у рыбки данио-рерио и подавление комплекса CRBN в результате обработки талидомидом. (А и В) Эмбрионы данио-рерио развивались в среде, содержащей талидомид в указанной концентрации. В обработанных талидомидом эмбрионах было нарушено развитие грудного плавника и слуховых пузырьков. (C-F) В эмбрионы на одноклеточной стадии развития вводили антисмысловой морфолиноолигонуклеотид zcrbn (zcrbn AMO) с мРНК zcrbn или без мРНК zcrbn. Эмбрионы, в которые был введен zcrbn AMO, характеризовались специфическими дефектами развития грудного плавника и слуховых пузырьков, при этом в фенотипах, в которые была введена мРНК zcrbn, указанные дефекты отсутствовали. (G-I) Как указано, в эмбрионы на одноклеточной стадии развития вводили zcul4a AMO с мРНК zcul4a или без мРНК zcu14a. Введение zcul4a AMO вызывало аналогичные дефекты слуховых пузырьков и грудного плавника, при этом в фенотипах, в которые была введена мРНК zcul4a, указанные дефекты отсутствовали. (А и С) Эмбрионы фиксировали через 75 часов после оплодотворения (hpf) и окрашивали альциановым синим. В верхних блоках показан вид эмбрионов сверху и в нижних блоках показано увеличенное изображение грудных плавников. Грудные плавники указаны стрелками. (В, Е и Н). Увеличенное изображение слуховых пузырьков у эмбрионов через 30 часов после оплодотворения. (D и G) Эмбрионы через 48 часов после оплодотворения гибридизировали с антисмысловым зондом к фактору роста фибробластов 8а (fgf8a) и гену sonic hedgehog (shh). Увеличенное изображение почки плавника. Удаление zcrbn или zcul4a вызывало уменьшение экспресии fgf8a, при этом дефекты развития в указанных фенотипах были устранены при совместном введении мРНК zcrbn или zcul4a. Такое введение оказывало незначительное влияние на экспрессию shh. (F и I) Размер слуховых пузырьков через 30 часов после оплодотворения показан на графиках в сравнении с необработанным образцом (***р<0,001, uninj, введение или обработка не производились).
[Фиг.5] На фиг.5 показано уменьшение вызываемого талидомидом тератогенного действия в результате экспрессии мутированного CRBN. В эмбрионы на одноклеточной стадии развития вводили мРНК zcrbn (дикого типа) или мРНК zcrbn YW/AA. Эмбрионы развивались в присутствии или отсутствии талидомида. (А) Показано увеличенное изображение слуховых пузырьков через 27 часов после оплодотворения. (В) Размер слуховых пузырьков у эмбрионов через 30 часов после оплодотворения относительно размера эмбрионов. *p<0,05, **р<0,01. Обработка талидомидом эмбрионов, сверхэкспрессирующих zcrbn YW/AA, не влияла на размер слуховых пузырьков. (С и D) Эмбрионы через 48 часов после оплодотворения гибридизировали in situ с антисмысловыми зондами к fgf8 или shh. На фигурах показано увеличенное изображение почек плавников. uninj, введение не производилось. У эмбрионов, обработанных талидомидом, экспрессия fgf8a была значительно уменьшена, при этом экспрессия fgf8a была восстановлена в результате введения мРНК zcrbn YW/AA.
[Фиг.6] Схема иммобилизации талидомида на гранулах FG. (А и В) Структура талидомида и его производного FR259625. (С) Показана схема иммобилизации талидомида на гранулах FG.
[Фиг.7] На фиг.7 показана очистка талидомидсвязывающих факторов из клеток разных типов. Экстракты, полученные из указанных линий клеток, очищали при помощи аффинной хроматографии с использованием гранул, содержащих иммобилизованный талидомид. Элюированные фракции анализировали методом вестерн-блоттинга с использованием антитела против DDB1 и антитела против CRBN. К экстрактам добавляли 0,3 мМ талидомида до инкубации с гранулами. CRBN и DDB1 выделяли в виде талидомид-связывающих белков из клеток разных типов.
[Фиг.8] На фиг.8 оказана способность DDB1 связываться с CRBN. Экстракты из линии клеток 293Т, устойчиво экспрессирующих FH-CRBN, или контрольных клеток (псевдотрансфецированных клеток) осаждали методом иммунопреципитации антителом против FLAG, анализировали методом SDS-PAGE и окрашивали серебром. В результате выполненного эксперимента были осаждены DDB1 и CRBN. DDB1 был осажден вместе с CRBN.
[Фиг.9] На фиг.9 показано убихитинирование CRBN in vitro. Комплекс FH-CRBN, выделенный из клеток 293Т, устойчиво экспрессирующих FH-CRBN, инкубировали с GST-убихитином, Uba1 (соответствует Е1), UbcH5b (соответствует Е2) и АТР или без указанных веществ и аликвоты реакционных растворов исследовали методом вестерн-блоттинга с использованием указанных антител. Из контрольных клеток выделяли псевдокомплекс. Аутоубихитинирование имело место в присутствии комплекса CRBN.
[Фиг.10] На фиг.10 показана взаимосвязь между удалением DDB1 и уровнями белка CRBN. Клетки 293Т трансфецировали DDB1 или контрольной миРНК и полученные лизаты смешивали с гранулами, содержащими иммобилизованный талидомид. Исходные или связанные белки анализировали методом вестерн-блоттинга с использованием антитела против DDB1 или против CRBN. Удаление DDB1 вызывает значительное снижение уровней белка CRBN.
[Фиг.11] На фиг.11 показана взаимосвязь между мутантами CRBN с делецией и образованием комплекса убихитина. (А) Схематическое изображение CRBN и его мутанта с делецией. (В) FH-CRBN (дикого типа) и его мутанты экспрессировали в клетках 293Т и осаждали методом иммунопреципитации антителом против FLAG. CRBN и его мутант и связанный с ними эндогенный DDB1 обнаруживали методом вестерн-блоттинга. В результате выполненного экперимента было установлено, что делеция аминокислот от положения 187 до положения 260 CRBN (ΔMid) аннулировала взаимодействие с DDB1. (С) CRBN и ΔMid, мутант с отсутствием аминокислот от положения 187 до положения 260, экспрессировали в клетках 293Т. После иммунопреципитации антителом против FLAG белки DDB1 и Cul4A, связанные с CRBN или ΔMid, анализировали методом вестерн-блоттинга. ΔMid был неспособен образовывать комплекс с DDB1 и Cul4a.
[Фиг.12] На фиг.12 показано сохранение CRBN в процессе эволюции. Был произведен сравнительный анализ аминокислотных последовательностей ортологов CRBN из пяти видов. В рамках указаны аминокислоты, полностью сохранившиеся в указанных видах. Стрелкой показана талидомид-связывающая область, установленная в результате анализа мутанта с делецией, при этом звездочками обозначены аминокислоты, имеющие важное значение для связывания талидомида (Y384 и W386). См. фиг.3.
[Фиг.13] На фиг.13 показана экспрессия zcrbn и zcul4a в эмбрионах данио-рерио. Экспрессию zcrbn и zcu14a в эмбрионах через 48 часов после оплодотворения исследовали путем полной гибридизации in situ. (А) zcrbn высокоэкспрессирован в сосудистой сети головы, грудных плавниках и головном мозге. Вид сбоку. (В) Экспрессия zcrbn в слуховых пузырьках (OV, показаны стрелками) через 48 часов после оплодотворения. Вид сверху. (С) Увеличенное изображение экспрессии zcrbn в грудных плавниках эмбрионов через 48 часов после оплодотворения. Высокие уровни экспрессии имеют место в проксимальной мезенхиме (pm), и слабая экспрессия наблюдается в мигрирующей мезенхиме (mm). (D) zcul4a высокоэкспрессирован в переднем мозге, среднем мозге, заднем мозге и грудных плавниках через 48 часов после оплодотворения. (Е) Экспрессию fgf8 в эмбрионах через 48 часов после оплодотворения исследовали в качестве контрольного образца. fgf8 экспрессирован на границе между средним и задним мозгом и в заднем мозге. Масштаб 0,2 мм.
[Фиг.14] На фиг.14 представлены результаты биохимического анализа zcrbn. (А) Экстракт клеток 293Т, устойчиво экспрессирующих FH-zcrbn, смешивали и инкубировали с гранулами, содержащими талидомид. Связанные белки элюировали талидомидом и элюат анализировали методом вестерн-блоттинга. zcrbn был связан с талидомидом. (В) Лизат клеток 293Т, сверхэкспрессирующих FH-zcrbn, осаждали методом иммунопреципитации антителом против FLAG и обнаруживали DDB1 методом вестерн-блоттинга. Было установлено, что эндогенный DDB1 человека связывается с FH-zcrbn. (С) Лизат FLAG-zcrbn (дикого типа) или FLAG-zcrbn YW/AA, сверхэкспрессированного в клетках 293Т, смешивали с гранулами, содержащими талидомид. Для выполнения количественного анализа исходный белок и элюированную фракцию анализировали в разных количествах методом вестерн-блоттинга. Талидомид слабо связывался с zcrbn YW/AA.
[Фиг.15] На фиг.15 представлено схематическое изображение модели молекулярного механизма тератогенного действия талидомида. CRBN, являющийся компонентом убихитин-лигазного комплекса Е3, обычно выполняет функцию регулирования многочисленных процессов развития, таких как образование конечностей и слуховых пузырьков, в результате убихитинирования неизвестных субстратов (верхняя схема). Талидомид связывается с CRBN и ингибирует функцию, выполняемую комплексом Е3 (нижняя схема). Аберрантная аккумуляция его субстратов вызывает многочисленные дефекты развития, такие как короткие конечности и маленькие слуховые пузырьки, частично вследствие уменьшения экспрессии fgf8.
[Фиг.16] На фиг.16 показано связывание фталимида с CRBN и DDB1. Экстракты клеток 293Т смешивали с гранулами, содержащими иммобилизованный талидомид. Связанные белки элюировали талидомидом или равным количеством фталимида и элюированные фракции анализировали методом вестерн-блоттинга.
[Фиг.17] На фиг.17 представлены структурные формулы производных талидомида, у которых исследовали сродство связывания с CRBN.
[Фиг.18] На фиг.18 показано связывание производных талидомида с CRBN. Экстракты клеток 293Т смешивали с гранулами, содержащими иммобилизованный талидомид. Связанные белки элюировали производными талидомида. Связанные белки промывали и элюировали производными талидомида. Элюированную фракцию анализировали методом вестерн-блоттинга. Термин ”наполнитель”, использованный на данной фигуре, означает ДМСО. Термин ”фракция, подвергнутая кипячению в SDS” означает фракцию, в которой связанные белки были отсоединены путем нагревания гранул при 98,5°С в буфере, содержащем 2% SDS. CRBN был элюирован талидомидом и глутаримидом и не был элюирован фталимидом и 5-гидрокси(2,6-диизопропилфенил)-1Н-изоиндол-1,3-дионом (5НРР-33).
[Фиг.19] На фиг.19 показаны клетки множественной миеломы Kms12 после обработки талидомидом и 5НРР-33. Клетки KMS-12 инкубировали с талидомидом или 5НРР-33 (100 мкМ) в течение 48 часов при 37°С в 5% СО2. Для определения числа живых клеток в культуральную среду добавляли реагент для подсчета клеток SF (Nacalai Tesque, Inc.) и оставляли на 2 часа в конце инкубации, выполняемой в течение 48 часов. Измеряли оптическую плотность при 450 нм. Было установлено, что 5НРР-33 в значительной степени подавлял рост миеломных клеток.
Лучший вариант осуществления изобретения
Ниже представлено подробное описание настоящего изобретения.
(1) Способ скрининга нетератогенного вещества
Способ скрининга нетератогенного вещества по настоящему изобретению включает приведение испытуемого вещества в контакт с CRBN или фрагментом CRBN, оценку способности испытуемого вещества связываться с CRBN или фрагментом CRBN и отбор испытуемого вещества, не связывающегося с CRBN или фрагментом CRBN, или испытуемого вещества, проявляющего более низкую способность связываться с CRBN или фрагментом CRBN по сравнению с талидомидом.
Испытуемое вещество, характеризующееся более низкой способностью связываться с CRBN и его фрагментом по сравнению с талидомидом, можно отобрать, например, в результате выполнения контрольного эксперимента с использованием талидомида вместо испытуемого вещества и сравнения связывающей способности испытуемого вещества с аналогичным показателем талидомида.
CRBN считается молекулой-мишенью, опосредующей вызываемое талидомидом тератогенное действие. Поэтому можно предположить, что вещество, которое не связывается с CRBN, или вещество, характеризующееся более низкой связывающей способностью по сравнению с талидомидом, не оказывает тератогенного действия, присущего талидомиду, или оказывает более слабое тератогенное действие.
Хотя испытуемое вещество не имеет каких-либо конкретных ограничений, желательно, чтобы такое вещество было пригодно для введения человеку или других животным, и примеры таких веществ включают лекарственное средство, фармацевтическую добавку, пищевой продукт, пищевую добавку или химическое соединение, содержащееся в указанных веществах.
Производные талидомида имеют важное значение для получения лекарственных средств.
Примеры производного талидомида включают соединение, выраженное нижеследующей общей формулой (1):
Общая формула (1)
Формула 8
где соединение, в котором Х означает R5-R7 и Y означает R6-R8, именуется соединением (А), соединение, в котором Х означает R5 и Y означает R6-R8, именуется соединением (В) и соединение, в котором Х означает R5 и Y означает R8, именуется соединением (С);
каждый элемент R1, R2, R3 и R4 может быть выбран из -Н; -ОН; =О; алкана, алкена и алкина с линейной или разветвленной цепью; циклического алкана, алкена и алкина; комбинации циклического и нециклического алкана, алкена и алкина; спирта, альдегида, кетона, карбоновой кислоты, сложного эфира или простого эфира, объединяющего кольцевую и некольцевую структуру, или комбинации циклических/ нециклических частей; аза; амино; -MOn или -O-MOn [где М=N и n=2; М=S и n=2 или 3; М=Р и n=1-3]; и галогена;
каждый элемент R5, R6, R7 и R8 независимо выбирают из группы формулы (2):
Формула 9
и -О- (где Z является необязательным элементом и имеет такие же значения, что и вышеописанный элемент R1); и R10 имеет такие же значения, что и вышеописанный элемент R1, или (когда Z отсутствует) R10=О;
R9 означает часть, имеющую формулу (3), (4), (5), (6) или (7):
Формула 10
Формула 11
Формула 12
Формула 13
где каждый элемент R11-R17 (независимо) имеет такие же значения, что и вышеописанный элемент R5, или
Формула 14
где каждый элемент R18, R19 и R20 независимо выбирают из Н, -СН3, -СООН, -CONH2, -(CH2)n-COOH, -(CH2)nCONH2, где n=1-4.
Было установлено, что из производных талидомида 5-гидрокси(2,6-диизопропилфенил)-1Н-изоиндол-1,3-дион (5НРР-33) обладает чрезвычайно низкой способностью связываться с цереблоном при сохранении фармакологического действия, такого как ингибирование роста миеломных клеток человека.
Предпочтительным производным талидомида представляет собой производное, обладающее фармакологическим действием талидомида или известных производных талидомида.
В научной литературе были указаны следующие фармакологические действия талидомида: (i) подавление вызываемого bFGF развития кровеносных сосудов; (ii) подавление продуцирования TNF-α LPS-стимулированными моноцитами человека и продуцирования IL-6 при сокультивировании опухолевых клеток, таких как миеломные клетки человека, и стромальных клеток костного мозга человека; (iii) увеличение числа естественных клеток-киллеров в периферической крови больных множественной миеломой, усиление продуцирования IL-2 и INF-γ после стимуляции Т-клеточного рецептора и стимуляция IL-2-зависимой пролиферации Т-клеток; и (iv) индукция апоптоза и ингибирование роста опухолевых клеток, таких как миеломные клетки человека.
Кроме того, примеры профилактического или терапевтического действия талидомида включают седативный эффект, лепру (в частности, нодозную эритему), реакцию ”трансплантат против хозяина”, множественную миелому, солидный рак, системную красную волчанку, рассеянный склероз, болезнь Бехчета и воспалительное заболевание кишечника (болезнь Крона и неспецифический язвенный колит). Примеры фармакологического действия известных производных талидомида включают терапевтические воздействие леналидомида на множественную миелому и миелодисплазию (MDS) и терапевтическое воздействие помалидомида на множественную миелому и миелофиброз.
CRBN является известным белком, и в базе данных опубликована также последовательность оснований гена, кодирующего CRBN (ген CRBN). Например, последовательности оснований гена CRBN человека, мыши, крысы и данио-рерио зарегистрированы в Entrez Gene соответственно под идентификатором гена: 51185, идентификатором гена: 58799, идентификатором гена: 297498 и идентификатором гена: 445491. Могут быть использованы CRBN и ген CRBN, выделенные естественным путем, а также мутированный CRBN, состоящий из аминокислотной последовательности природного CRBN с делецией, заменой или добавлением одного или нескольких мутантов CRBN, способных образовывать активный убихитин-лигазный комплекс, и ген, кодирующий указанный мутированный CRBN.
Авторы настоящего изобретения выявили талидомид-связывающую область в CRBN человека. Поэтому даже при использовании вместо CRBN фрагмента CRBN, содержащего талидомид-связывающую область, все же необходимо определить связывающую способность такого фрагмента. Примеры талидомид-связывающей области включают область, состоящую из 104 С-концевых аминокислот CRBN человека. В CRBN, выделенном из организмов, отличных от человека, в качестве талидомид-связывающей области может быть использована область, соответствующая вышеуказанной области, состоящей из 104 С-концевых аминокислот (то есть область, совместимая с областью, состоящей из 104 С-концевых аминокислот CRBN человека, при выполнении сравнительного анализа на основании идентичности аминокислот).
Примеры фрагмента CRBN включают фрагмент CRBN, содержащий N-концевую аминокислотную последовательность от остатка 339 до остатка 442, показанную в SEQ ID NO:7, и остальную часть аминокислотной последовательности SEQ ID NO:7, в которой произведена замена, делеция и/или добавление одного или нескольких аминокислотных остатков, и фрагмент CRBN, выделенный из разных организмов, который соответствует вышеуказанному фрагменту CRBN человека. Кроме того, CRBN и фрагменты CRBN могут быть получены в виде гибридного белка путем добавления других белков.
Несмотря на то, что CRBN или фрагмент CRBN, использованные в настоящем изобретении, могут представлять собой любой вышеуказанный CRBN, выделенный из разных организмов, мутированный CRBN и фрагменты указанных CRBN, в соответствии с целью настоящего изобретения, включающей получение производных талидомида, не оказывающих тератогенного воздействия на человека, желательно использовать CRBN человека или фрагмент CRBN человека.
CRBN и фрагмент CRBN предпочтительно иммобилизуют на носителе. Хотя носитель не имеет каких-либо конкретных ограничений, если он позволяет иммобилизовать CRBN и фрагмент CRBN, желательно использовать материал в виде частиц, а также магнитный носитель. Примеры предпочтительного носителя включают магнитные наногранулы, покрытые органическим полимером. Хотя диаметр частиц магнитных наногранул, покрытых органическим полимером, не имеет каких-либо конкретных ограничений, желательно использовать частицы с диаметром 1-500 нм, более предпочтительно 20-300 нм. Примеры органического полимера включают GMA, сополимер GMA и стирола, полиметакриловую кислоту и полиакриловую кислоту. Конкретные примеры магнитных наногранул, покрытых органическим полимером, включают гранулы SG (Kawaguchi et al. Nucleic Acids Research 1989, 17: 6229 to 6240), гранулы FG (Nishio et al., Colloids and Surfaces B: Biointerfaces 2008, 64: 162 to 169), гранулы Dyna, гранулы Adem и гранулы Nanomag.
Способность производного талидомида связываться с CRBN можно определить стандартным методом, например, при помощи резонанса поверхностных плазмонов с использованием прибора BIAcore или изотермической титрационной калориметрии (ITC).
Хотя способ скрининга по настоящему изобретению не имеет каких-либо конкретных ограничений, если он позволяет определить способность испытуемого вещества связываться с CRBN