Способ получения 1-(1-адамантил)-3,4,5-тринитро-1н-пиразола
Иллюстрации
Показать всеИзобретение относится к химии производных адамантана, а именно к способу получения 1-(1-адамантил)-3,4,5-тринитро-1H-пиразола, приведенной ниже формулы, который может являться исходным соединением для синтеза терапевтически активных веществ. Предложенный способ получения 1-(1-адамантил)-3,4,5-тринитро-1H-пиразола заключается в присоединении к производному адамантана гетероорганического соединения, выдерживании реакционной смеси при температуре кипения растворителя в течение 3 ч, последующем выделении и перекристаллизации продукта. Причем реакционную смесь предварительно выдерживают в течение 1 ч при 0°С, а выделение продукта проводят отгонкой растворителя. При этом в качестве производного адамантана используют 1,3-дегидроадамантан, в качестве гетероорганического соединения - 3,4,5-тринитро-1H-пиразол, а в качестве растворителя - диэтиловый эфир при мольном соотношении 1,3-дегидроадамантана и 3,4,5-тринитро-1H-пиразола, равном 1:1. Техническим результатом является технологичный способ получения 1-(1-адамантил)-3,4,5-тринитро-1H-пиразола с высоким выходом целевого продукта.
Реферат
Изобретение относится к химии производных адамантана, а именно к новому способу получения 1-(1-адамантил)-3,4,5-тринитро-1H-пиразола формулой:
который может являться исходным соединением для синтеза терапевтически активных веществ.
Имеется большое число публикаций, подтверждающих различные виды биологической активности у соединений, содержащих в своей структуре пиразольный фрагмент.
В литературе описаны несколько содержащих адамантан производных пиразола, уже нашедших непосредственное применение.
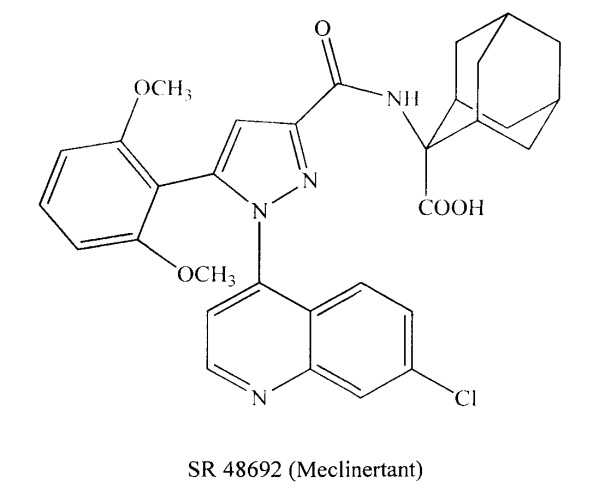
К таким соединениям принадлежат SR 48692 (Meclinertant) и SR 192948A, антагонисты рецепторов нейротензина. [Biochemical and pharmacological profile of a potent and selective nonpeptide antagonist of the neurotensin receptor. D.Gully, M.Canton, R.Boigegrain, F.Jeanjean, J.C.Molimard, M.Poncelet, C.Gueudet, M.Heauime, R.Leyris, A.Brouard. // Proc. Natl. Acad. Sci. U.S.A., 1993, January 1; 90(1): 65-69.].
Данные соединения активно исследуются как перспективные противоопухолевые препараты, нейролептики. [Rebecca M.Myers, James W.Shearman, Matthew O.Kitching, Antonio Ramos-Montoya, David E.Neal, and Steven V.Ley. Cancer, Chemistry, and the Cell: Molecules that Interact with the Neurotensin Receptors. // ACS Chemical Biology, Vol.4, №.7, 503-525, 2009.].
SR 142948A. Это селективный антагонист NTR1 142948A может рассматриваться как представитель второго поколения мощных, избирательных, непептидных антагонистов NTRs. Он имеет биодоступность, пересекает гематоэнцефалический барьер и имеет долгосрочные последствия от применения. Кроме того, в отличие от SR 48692 он препятствует переохлаждению и антиноцицептивным последствиям от централизованного введения NT (нейротензина), предполагают, что SR 142948A, возможно, взаимодействует с NTR подтипами. SR 142948A является более мощным, чем SR 48692 в большинстве in vitro и в естественных моделях, в частности, в пробах связывания с человеческими рецепторами. SR 142948A антагонизирует классическим vitroNT эффектам, т.е. образованию инозитол монофосфата в НТ 29 клеток (IC50=3,9 нм) или внутриклеточной мобилизации кальция в клетках яичников китайского хомяка, трансфицированных с человеческими рецепторами. Таким образом, SR 142948А сохраняет свойства соединения SR 48692 (нет существенной активности агонистов, биодоступности, длительность действия и хорошего доступа к мозгу), показывает более широкий спектр активности, чем SR 48692 (вероятно, из-за торможения NT подтипов рецепторов). [Gully, D., Labeeuw, В., Boigegrain, R., Oury-Donat, F., Bachy, A., Poncelet,M., Steinberg, R., Suaud-Chagny, M.F., Santucci, V., Vita, N., Peccu, F., Labbe '-Jullie', C., Kitagbi, P., Soubrie', Le Fur, G., Maffrand, J.-P. Biochemical and pharmacological activities of SR 142948А, a new potent neurotensin receptor anatagonist. // J.Pharm. Exp. Ther., 1996, 280, 802-812; Labeeuw Bernard, Gully Danielle, Jeanjean Francis, Molimard Jean-Charles, Boigegrain Robert. 1-Phenylpyrazole-3-carboxamides acting on neurotensin receptors. Patent WO 96/32382, 1996.].
Описано применение соединений SR 48692 и SR 142948А как потенциальных антагонистов на нейротензин NT2 рецепторов. Оба соединения, после связывания с рецептором нейротензин NT2, повышают образование инозитол фосфатов (IP) с последующей мобилизацией ионов [Са2+], вызывают высвобождение арахидоновой кислоты, а также стимулируют активность митоген-активированной протеин киназы (МАРК). Данные виды активности антагонизируются нейротензином и левокабастином в зависимости от концентрации. [Vita, N., Oury-Donat, F., Chalon, P., Guillemot, M., Kaghad, M., Bachy, A., Thumeyssen, О., Garci 'a, S., Poinot-Chazel, С., Casellas, P., Keane, Р., Le Fur, G., Maffrand, J.-P., Soubrie', P., Caput, D., Ferrara, P. Neurotensin is an antagonist of the human neurotensin NT2 receptor expressed in Chinese hamster ovary cells. // Eur. J. Pharmacol., 1998, 360, 265-272.].
1-R1-3-R3-4-(1-Адамантилкарбамоил)-5-R2-пиразолы описаны как ингибиторы 11β-гидроксистероидной дегидрогеназы. [Kevin William Anderson, Nader Fotouhi, Paul Gillespie, Robert Alan Goodnow, Kevin Richard Guertin, Nancy-Ellen Haynes, Michael Paul Myers, Sherrie Lynn Pietranico-Cole, Lida Qi, Pamela Lorren Rossman, Nathan Robert Scott, Kshitij Chhabilbhai Thakkar, Jefferson Wright Tilley, Qiang Zhang. Adamantyl-pyrazole carboxamides as inhibitors of 11β-hydroxysteroid dehydrogenase. // US 20070225280 A1.] Подобным действием обладают препараты схожей структуры:
4-[4-(1-Адамантилкарбамоил)-5-трет-бутил-пиразол-1-ил] бензойная кислота и ее метиловый эфир исследуются как перспективные ингибиторы 11β-гидроксистероидной дегидрогеназы 1 типа энзима (11BHSD1). [Packer Martin, Scott James, Stocker Andrew, Whitamore Paul Robert Owen. 4-[4-(2-adamantylcarbamoyl)-5-tert-butyl-pyrazol-1-yl]benzoic acid - 465 // WO 2009/060232 A1.]
Доказана противовирусная активность 5-(1-адамантил)-1H-пиразола на вирусах гриппа (FVP, strain A/rostock/34(H7Nl)) и герпеса (type I(HSV-I, strain 1C)). [Бореко E.И., Павлова Н.И., Макарова Н.В., Владыко Г.В., Моисеев И.К., Земцова М.Н. Николаева С.Н. Противовирусная активность адамантансодержащих гетероциклов // Химико-фармацевтический журнал, 2002. - №1. - С.5-7.].
Описана активность адамант-1-илпиразолов против вируса гриппа A/Puerto Rico/8/34 (H1N1). [Vladimir V. Zarubaev, Efim L. Golod, Pavel M. Anfimov, Anna A. Shtro, Victor V. Saraev, Alexey S. Gavrilov, Alexander V. Logvinov, Oleg I. Kiselev. Synthesis and anti-viral activity of azolo-adamantanes against influenza A virus. // Bioorg. Med. Chem., 2010, 18, 839-848.].
Существуют несколько основных направлений в способах получения N-адамант-1-илсодержащих пиразолов.
Непосредственное взаимодействие N-незамещенного пиразола с галоген- , гидрокси- и другими производными адамантана.
Известен способ получения адамантилсодержащих производных пиразола окислительным алкилированием пиразолов 1-иодадамантаном в диоксане при 90°С, окислитель йодноватый ангидрид (I2O5). Выход N-адамантилпиразола составляет 11-18%. [В.Г.Цыпин, М.С.Певзнер, Е.Л.Голод. Окислительное алкилирование азолов. VII. Адамантилирование азолов в условиях окислительного генерирования 1-адамантильных карбокатионов. // ЖОрХ. - 2001. - Т.37. - Вып №12. - с.1843-1847.].
К недостаткам данного способа можно отнести: низкие выходы адамант-1-илсодержащих пиразолов, сильную зависимость реакции адамантилирования от основности исходного азола, высокую температуру реакции, необходимость применения окислителя; протекание двух параллельных реакций (в диоксане 1-йодадамантан реагирует с йодноватым ангидридом и в отсутствие гетероароматического субстрата образуется смесь 1-адамантанола (выход 53%) и 1,1'-диадамантилового эфира (выход 9%)). По данному способу не получают адамант-1-илсодержащих пиразолов заявляемой структуры.
Известен способ получения N-адамант-1-илсодержащих пиразолов взаимодействием lH-пиразолов с 1-бромадамантаном при повышенной температуре. [Pilar Cabildo, Rosa Maria Claramunt, Isabelle Forfary, Jose Elguero. Regioselective adamantylation of N-unsubstituted pyrazole derivatives // Tetrahedron Letters, 1994, Vol.35, No. 1, pp 183-184.].
Основными недостатками этого способа являются высокая температура реакции 120-240°С, а также необходимость применение автоклава. По данному способу не получают адамант-1-илсодержащих пиразолов заявляемой структуры.
Известен способ получения N-адамант-1-илсодержащих пиразолов при взаимодействии 1-бромадамантана с 1-аминопиразолом при температуре 160-170°С в течение 2 ч, реакция приводит N- и С-адамантилсодержащим пиразолам: 1-(1-адамантил)-3(5)-амино-1H-пиразол (40%), 1,4-ди(1-адамантил)-3-амино-1H-пиразол (30%). Получаемый N-адамантилпиразол находится в виде двух изомеров 3(5)-положения аминогруппы с суммарным выходом 70%. [Dionisia Sanz, Rosa Ma. Claramunt, Jose Elguero, Loreto Salazar, Modesta Espada. Rearrangement of 1-amino- and 1-alkylamino-pyrazoles to 5-aminopyrazotes. // Journal of the Chemical Society, Perkin Transactions 1, 1990, p.809-810.].
К недостаткам данного способа можно отнести необходимость применения достаточно высокой температуры 160-170°С, низкую селективность реакции, описано только использование в реакции 1-амино-1H-пиразола и получение из него 1-(1-адамантил)-3(5)-амино-1H-пиразола и 1-(1-адамантил)-3-амино-4-(1-адамантил)-1H-пиразола. По данному способу не получают адамант-1-илсодержащих пиразолов заявляемой структуры.
Существует способ получения N-адамантилпиразола с применением в качестве адамантилирующего агента 1-адамантанола, подобная реакция является кислотно-катализируемой.
При применении в качестве катализатора 85%-ной H2SO4 в случае 3-карбокси-4-нитро-1H-пиразола ( p K B H + -4,8) при 20-22°С через 72 ч образуется 1-(1-адамантил)-3-карбокси-4-нитро-1H-пиразол с выходом 60%, в случае 5-метил-3,4-динитро-1H-пиразола ( p K B H + -8,1) был получен с выходом 25% 1-(1-адамантил)-5-метил-3,4-динитро-1H-пиразол. Более основные пиразолы в этих условиях не реагируют. Выход 25-60%. Применение менее концентрированной серной кислоты 72% дает возможность протеканию реакции адамантилирования 4-нитропиразола ( p K B H + -2,0) и 3-метил-4-нитропиразола ( p K B H + -1,27) в течение 7 дней при 18-20°С со значительным выходом (реакция протекает не полностью). Представленные данные иллюстрируют возможность применения серной кислоты для адамантилирования азолов с p K B H + ниже -2,0. Применение для проведения реакции системы H3PO4-AcOH при температуре 60°С за 3 ч в случае с 4-бром-3-карбокси-1H-пиразолом ( p K B H + -2,2) приводит к соответствующему N-адамантилзамещенному пиразолу с выходом 70%. Более основные 3,5-диметил-4-нитро-1H-пиразол ( p K B H + -0,45) и особенно 4-хлор-1H-пиразол ( p K B H + 0,59) реагируют значительно дольше - 4-8 ч с выходом N-адамантилпиразолов 60% и 47% соответственно. 3,5-Диметил-1H-пиразол ( p K B H + 4,06) с 1-адамантанолом вообще не реагирует. Авторами данной работы значения основности азолов были рассчитаны самостоятельно на основании внесения поправок на заместители в незамещенный 1H-пиразол. [А.С.Гаврилов, Е.Л.Голод, В.В.Качала, Б.И.Уграк. Адамантилазолы. Кислотно-катализируемое адамантилирование пиразолов. // ЖОрХ, 2001., Т.37., №12., с.1822-1836.].
К недостаткам данного способа можно отнести необходимость применения сильно кислых сред, большую продолжительность реакции, большие ограничения по основности исходных азолов (время реакция значительно возрастает и снижается выход, либо реакции не протекает). По данному способу не получают адамант-1-илсодержащих пиразолов заявляемой структуры.
Известен способ получения N-адамантилсодержащих пиразолов реакцией 1,3-дегидроадамантана с N-незамещенным 1H-пиразолом при нагревании до 100°С в массе исходных реагентов при соотношении 1:1 в течение 4,5-5 ч с выходом 70,3-90,2%. [Пат.2280032. Российская Федерация, МПК C07D 233/58 и др. Способ получения адамант-1-илсодержащих азолов / Г.М.Бутов, В.М.Мохов, Г.Ю.Паршин, О.А.Панюшкина; заявитель и патентообладатель ВолгГТУ. - 2006. RU 2005100224/04C1.].
К недостаткам данного способа следует отнести сравнительно более высокую температуру реакции, чем у заявляемого способа, что имеет значение в случае термически неустойчивых соединений (3,4,5-тринитро-1Н-пиразол и его N-алкилзамещенные производные [Р.Ravia, Girish M. Goreb, Amn К. Sikderb, Surya P. Tewaria. Thermal decomposition kinetics of 1-methyl-3,4,5-trinitropyrazole // Thermochimica Acta, Vol.528, 20 January 2012, p.53-57.]), в случае галогензамещенных пиразолов более низкая температура препятствует отщеплению галогена. По данному способу не получают адамант-1-илсодержащих пиразолов заявляемой структуры.
Вторым описываемым в литературе направлением получения N-адамантилпиразолов является циклизация, по реакции гидразинов с 1,3-дикарбонильными и непредельными соединениями (алкенами).
Известен способ получения N-адамантилпиразола при взаимодействии 1-адамантилгидразина с нитрилом β-аминокротоновой кислоты в течение 12 ч в этаноле при кипячении, по которому был получен с выходом 40% 1-(1-адамантил)-5-амино-3-метил-1H-пиразол, а с метиловым эфиром фторсульфоновой кислоты в дихлорэтане за 48 ч при 20°С - с выходом 90% соль (1-(1-адамантил)-2-метил-1H-пиразолий фторсульфонат). [Р.Cabildo, R.M.Claramunt, J.Elquero. Synthesis and Reactivity of new 1-(1-adamantyl) pyrazoles. // J. Heterocyclic Chem., 1984, 21, 249-251.]
К недостаткам данного способа можно отнести большую продолжительность реакции, многостадийность процесса, связанную с необходимостью получения 1-адамантилгидразина, труднодоступность исходных реагентов (нитрила β-аминокротоновой кислоты и метилового эфира фторсульфоновой кислоты). По данному способу не получают адамант-1-илсодержащих пиразолов заявляемой структуры.
Известен способ получения N-адамантилпиразола при взаимодействии дигидрохлорида 1-адамантилгидразина с 1,3-дикетонами и 4,4-диметоксибутан-2-оном. В исходный дигидрохлорид адамантилгидразина в спирте добавляли раствор эквимолярного количества гидроксида калия в спирте, затем добавляли 2-гидроксиимино-1,3-дикетон в эквимолярном количестве относительно дигидрохлорида 1-адамантилгидразина и реакционную массу выдерживали 12 ч (для соединения (3-(гидроксиимино)пентан-2,4-дион)) или 24 ч (для соединения (2-(гидроксиимино)-1-фенилбутан-1,3-дион)) при 24°С. Отфильтровали белый осадок хлористого калия, фильтрат упарили, охлаждали до 0°С, отфильтровали выпавший осадок. Соответственно были получены: 1-(1-Адамантил)-3,5-диметил-4-нитрозо-1H-пиразол с выходом 40% и 1-(1-Адамантил)-5-метил-4-нитрозо-3-фенил-1H-пиразол с выходом 35%.
Взаимодействием дигидрохлорида 1-адамантилгидразина с 4,4-диметоксибутан-2-оном был получен 1-(1-Адамантил)-3-метил-4-нитрозо-1H-пиразол с выходом 69%. Эквимолярную смесь 4,4-диметоксибутан-2-она с 1 н соляной кислотой перемешивали при 20°С 0,5 ч, охлаждали до 0°С и в течение 0,5 ч добавляли по каплям раствор нитрита натрия (в мольном соотношении 4,4-диметоксибутан-2-он: нитрит натрия 1:1,1) в воде. Затем из реакционной смеси отдували окислы азота в вакууме водоструйного насоса, и добавляли раствор дигидрохлорида адамантилгидразина (в мольном соотношении 4,4-диметоксибутан-2-он: дигидрохлорид адамантилгидразина 1:0,75) в воде. Реакционную смесь перемешивали 10 мин при 20°С. Выпавший осадок отфильтровывали, растворяли в спирте и нагревали на водяной бане 3 ч. Спирт упаривали в вакууме, выпавший 1-(1-Адамантил)-3-метил-4-нитрозо-1H-пиразол отфильтровывали. [Т.А.Фроленко, Е.С.Семиченко, М.Г.Мельникова, Н.А.Гаврилова, Г.А.Субоч. Синтез нитрозо- и амино-М-адамантилпиразолов. // Журнал сибирского федерального университета. Серия «Химия»., 2011, т.4, №3, 301-306.].
К недостаткам данного способа можно отнести большую продолжительность реакции (в случае реакции дигидрохлорида адамантилгидразина с 1,3-дикетонами), многостадийность процесса, связанную с необходимостью получения 1-адамантилгидразина. По данному способу не получают адамант-1-илсодержащих пиразолов заявляемой структуры.
Третьим описываемым в литературе направлением получения N-адамантилпиразолов является непосредственное взаимодействие N-незамещенного пиразолина с галоген - производным адамантана.
Описан синтез N-адамантилпиразолов из пиразолинов с применением 1-хлорадамантана. Вначале исходный пиразолин обрабатывается дисилазаном (Me3SiNHSiMe3, получаемым из 1,1 эквивалента смеси триметилхлорсилана и триэтиламина 1:1) в течение 12 ч при комнатной температуре, затем к реакционной смеси добавляют 1-хлорадамантан и кислоту Льюиса (AlCl3) при 0°С в хлороформе. Таким образом, из 5-метилпиразолина была получена смесь 1-(1-адамантил)-5-метилпиразолина с выходом 18% и продукта его дегидрирования - 1-(1-адамантил)-5-метил-1H-пиразола с выходом 37%. [Sasaki Т., Hakamashi A., Ohno М. Synthesis of Adamantane Derivatives. LVIII. Reaction of 1-Adamantyl Chloride with Some Heterocyclic Unsaturated Silanes. // Chem. Pharm. Bull., 1982, Vol.30, №6, pp.2051-2060.].
К недостаткам данного способа можно отнести большую продолжительность реакции, неуниверсальность способа - в случае 4-метилпиразолина по данному способу был получен исключительно 1-(1-адамантил)-4-метилпиразолин с выходом 60%, образование продукта его дегидрирования (1-адамантил)-4-метил-1H-пиразола отсутствовало. По данному способу невозможно получить адамант-1-илсодержащий пиразол заявляемой структуры.
Наиболее близким к заявляемому способу получения является известный способ синтеза 1-(1-адамантил)-3,4,5-R1,R2,R3-1H-пиразолов, заключающийся в получении 1-(1-адаманил)-3,4,5-триметил-1H-пиразола взаимодействием 1-адамантилгидразина с 3-метил-2,4-пентандионом в этиловом спирте в качестве растворителя. [P. Caildo, R.M. Claramunt, D. Sumz, M.C. Foces-Foces, F. Hernandez Cano, J.P. Fayet, M.C. Vertut, J. Elguero. Adamantylazoles. 5. Molecular Structure of 1-(1-adamantyl)pyrazoles. // J. Heterocyclic. Chem., 1986, 23, 1045-1050.].
Основными недостатками этого способа являются многостадийность процесса, что связано с необходимостью получения 1-адамантилгидразина; ограниченность ряда получаемых структур и многостадийность процесса выделения продукта. По данному способу невозможно получить адамант-1-илсодержащий пиразол заявляемой структуры.
Задачей предлагаемого изобретения является разработка способа получения 1-(1-адамантил)-3,4,5-тринитро-1H-пиразола.
Техническим результатом является технологичный способ получения 1-(1-адамантил)-3,4,5-тринитро-1H-пиразола, с высоким выходом целевого продукта.
Поставленный технический результат достигается в способе получения 1-(1-адамантил)-3,4,5-тринитро-1H-пиразола присоединением к производному адамантана гетероорганического соединения, заключающийся в выдерживании реакционной смеси при температуре кипения раствора геля в течение 3 ч, последующем выделении и перекристаллизации продукта, причем реакционную смесь предварительно выдерживают в течение 1 ч при 0°С, а выделение продукта проводят отгонкой растворителя, при этом в качестве производного адамантана используют 1,3-дегидроадамантан, в качестве гетероорганического соединения 3,4,5-тринитро-1H-пиразол, а в качестве растворителя - диэтиловый эфир при мольном соотношении 1,3-дегидроадамантана и 3,4,5-тринитро-1H-пиразола, равном 1:1.
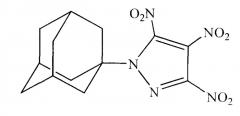
Сущностью метода является реакция присоединения к 1,3-дегидроадамантану 3,4,5-тринитро-1H-пиразола:
Высокая реакционная способность 1,3-дегидроадамантана и высокая кислотность NH-группы позволяют получать продукты реакции с высокими выходами в относительно мягких условиях в одну стадию. Однако высокая NH-кислотность, способствующая высокой реакционной способности 3,4,5-тринитро-1H-пиразола в реакциях с 1,3-дегидроадамантаном, является причиной термической неустойчивости как исходного 3,4,5-тринитро-1H-пиразола, так и продукта реакции.
Реакция 1,3-дегидроадамантана с 3,4,5-тринитро-1H-пиразолом осуществляется взаимодействием растворов реагирующих веществ в диэтиловом эфире при температуре 0°С во избежание резкого вскипания реакционной массы. Кроме этого, повышенные температуры приводят к осмолению продукта реакции. После выдерживания реакционной массы при 0°С в течение 1 ч, ее нагревают до температуры кипения растворителя и кипятят еще 3 ч. Выделение продукта осуществляют отгонкой растворителя. Очищают 1-(1-адамантилил)-3,4,5-тринитро-1H-пиразол перекристаллизацией из этанола.
Преимуществами данного метода является достаточно небольшая продолжительность реакции (4 ч), не высокая температура осуществления реакции (0-34,5°С) и высокий выход продукта (98%), который может являться исходным соединением для синтеза терапевтически активных веществ.
Найдено, что оптимальным условием проведения реакции 3,4,5-тризамещенного 1H-пиразола с 1,3-дегидроадамантаном является ее осуществление при мольном соотношении 1,3-дегидроадамантан: 3,4,5-тризамещенный 1H-пиразол=1:1. Избыток одного из реагентов не влиял на выход целевых продуктов и является нецелесообразным.
Изобретение иллюстрируется следующим примером:
Пример. Синтез 1-(1-адамантил)-3,4,5-тринитро-1H-пиразола.
К 1,5 г (0,00739 моль) 3,4,5-тринитро-1H-пиразола в 20 мл диэтилового эфира при температуре 0°С добавляют по каплям раствор 1 г (0,00739 моль) свежевозогнанного 1,3-дегидроадамантана в 20 мл диэтилового эфира. Смесь выдерживают при перемешивании 1 ч при 0°С, зачем температуру повышают до температуры кипения растворителя и выдерживают еще 3 ч. Растворитель отгоняют. Продукт очищают перекристаллизацией из этанола.
Выход 2,44 г (98%). Тпл=139-140°С.
Масс-спектр, m/z (интенсивность, %): 337 (М+, 2%), 292 ([М-NO2]+, 2%), 247 (2%), 245 ([M-(NO2)2]+, 2%), 199 ([M-3NO2]+, 2%), 177 (36%), 151 (21%), 150 (48%), 135 (Ad+, 96%), 121 (48%), 107 (56%), 95 (71%), 93 (100%), 67 (45%), 55 (75%).
Спектр ЯМР 1Н (300 МГц, DMSO-d6), δ, м.д.: 1.66 с (6Н, CH2, Hδ-Ad), 2.1 с (3Н, СН, Hγ-Ad), 2.18 с (6Н, СН2, Hβ-Ad).
Спектр ЯМР 13 С (75.47 МГц, CDCl3), δ, м.д.: 71.8872 (с, 1C, Cα-Ad), 41.0302 (с, 3С, Cβ-Ad), 35.2616 (с, 3С, Cδ-Ad), 29.9234 (с, 3С, Cγ-Ad).
Таким образом, разработан технологичный одностадийный способ синтеза 1-(1-адамантил)-3,4,5-тринитро-1H-пиразола, характеризующийся высоким выходом целевого продукта.
Способ получения 1-(1-адамантил)-3,4,5-тринитро-1H-пиразола присоединением к производному адамантана гетероорганического соединения, заключающийся в выдерживании реакционной смеси при температуре кипения растворителя в течение 3 ч, последующем выделении и перекристаллизации продукта, отличающийся тем, что реакционную смесь предварительно выдерживают в течение 1 ч при 0°С, а выделение продукта проводят отгонкой растворителя, при этом в качестве производного адамантана используют 1,3-дегидроадамантан, в качестве гетероорганического соединения - 3,4,5-тринитро-1H-пиразол, а в качестве растворителя - диэтиловый эфир при мольном соотношении 1,3-дегидроадамантана и 3,4,5-тринитро-1H-пиразола, равном 1:1.