Способ получения n-замещенных (2-бензолсульфонил-2-диалкоксифосфорил)ацетамидинов
Иллюстрации
Показать всеИзобретение относится к новому способу получения новых n-замещенных (2-бензолсульфонил-2-диалкоксифосфорил)ацетамидинов, которые могут использоваться в получении биологически активных соединений. Предложенный способ состоит в том, что N-замещенные (2-бензолсульфонил-2-диалкоксифосфорил)ацетамидины общей формулы
где R=CH3, C6H5; R1=i-C3H7, C4H9;
R2=N(C2H5)2, N(C3H7)2, N(C4H9)2, ;
получают взаимодействием С-фосфорилированных ацетамидинов формулы
Где R=CH3, C6H5
R1=i-C3H7, C4H9;
R2=N(C2H5)2, N(C3H7)2, N(C4H9)2, ;
с натрием с последующим бензолсульфонилированием полученного натриевого производного бензолсульфонилхлоридом, в среде диоксана при мольном соотношении С-фосфорилированный ацетамидин:натрий:бензолсульфонил-хлорид=1:1:1÷1.02 соответственно и температуре 50÷60°С. Предложен новый способ, позволяющий получить новые N-замещенные (2-бензолсульфонил-2-диалкоксифосфорил)ацетамидины с высоким выходом. 5 пр.
Реферат
Изобретение относится к химии элементоорганических соединений, а именно к новому способу получения N-замещенных (2-бензолсульфонил-2-диалкоксифосфорил)ацетамидинов общей формулы
где R=CH3, C6H5;
R1=i-C3H7, C4H9;
R2=N(C2H5)2, N(C3H7)2, N(C4H9)2, ;
которые являются новыми по структуре элементоорганическими соединениями и могут служить исходными в получении потенциально биологически активных соединений для нужд медицины и сельского хозяйства.
Имеется большое число публикаций, подтверждающих различные виды биологической активности у соединений, содержащих в своей структуре амидиновый фрагмент. Например, в обзоре Patai S. «The chemistry of Amidines and Imidates», изданном в Лондоне в 1975 году, стр.262-269, перечислены различные структуры замещенных и незамещенных амидинов, проявивших высокую антивирусную, антибактериальную, противораковую и другие виды активностей. Заявленные в изобретении N-замещенных (2-бензолсульфонил-2-диалкоксифосфорил)ацетамидины также содержат амидиновый фрагмент, как в вышеприведенной ссылке [Patai S. The chemistry of Amidines and Imidates. - Intrscience: London, 1975. - p.262-269] и можно ожидать, что синтезированные нами соединения обладают этими видами активностей. Кроме того, многие фосфорорганические соединения и соединения, относящиеся к группе алкилсульфонатов, проявили широкий спектр инсектицидной, противоопухолевой активности [Пурдела Д., Вылчану Р. Химия органических соединений фосфора. - М.: Химия, 1972, - с.557-565; Машковский М.Д. Лекарственные средства. - М.: «Издательство Новая Волна», 2000. - Т.2. - С.419].
Известен способ ацилирования эфиров нитрила диалкоксифосфорилуксусной кислоты (RO)2P(O)CH2CN галогенангидридами карбоновых кислот. Ацилированию подвергали их калиевое производные, так как натриевые и этоксимагниевые производные не дали удовлетворительных результатов [Ацилирование диэтилового эфира нитрила фосфонуксусной кислоты. Кирилов Н., Петрова Г. // Докл. Болг. АН., 1965, 18, №4, с.331-334]. Недостатками данного метода являются сравнительно низкий выход (14-36.5%) целевых соединений, то есть ацилированных нитрилов, а использование калия для получения калиевых производных делает процесс взрыво- и пожароопасным, а также усложняет аппаратурное оформление.
Известен способ ацилирования С-фосфорилированных ацетамидинов хлористым и бромистым ацетилом и хлористым бензоилом [Пат. 2374258 РФ, МПК C07F 9/40, 2009], позволяет получать соединения иной структуры, чем в предлагаемом изобретении.
Задачей предлагаемого изобретения является разработка нового технологичного малостадийного метода синтеза N-замещенных (2-бензолсульфонил-2-диалкоксифосфорил)ацетамидинов.
Техническим результатом является расширение арсенала химических соединений, получение новых N-замещенных (2-бензолсульфонил-2-диалкоксифосфорил)ацетамидинов с высоким выходом более 80%.
Поставленный технический результат достигается разработкой нового способа получения N-замещенных (2-бензолсульфонил-2-диалкокси-фосфорил)ацетамидинов формулы
заключающегося во взаимодействии С-фосфорилированных ацетамидинов формулы
Где R=CH3, C6H5
R1=i-C3H7, C4H9;
R2=N(C2H5)2, N(C3H7)2, N(C4H9)2, ;
с натрием с последующим бензолсульфонилированием полученного натриевого производного бензолсульфонилхлоридом, в среде диоксана при мольном соотношении С-фосфорилированный ацетамидин: натрий: бензолсульфонилхлорид=1:1:1÷1.02 соответственно и температуре 50÷60°C.
Химическая схема предложенного способа получения N-замещенных (2- бензолсульфонил-2-диалкоксифосфорил)ацетамидинов:
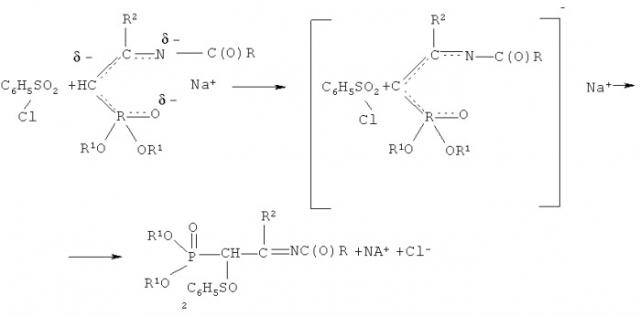
Реакции с бензолсульфохлоридом сводятся к нуклеофильному замещению галогена в молекуле бензолсульфохлорида, причем в качестве нуклеофильного реагента выступает анион СН-кислотного соединения. На основании изучения литературных данных можно предполагать, что эта реакция по механизму SN2. Анион натриевого производного ацетамидина можно рассматривать как амбидентный анион, в котором местом с наибольшей нуклеофильной реакционной способностью является атом углерода метановой группы, а местом наибольшей электронной плотности - атом кислорода фосфорильной группы и атом азота иминогруппы. Механизм взаимодействия бензолсульфохлорида натриевыми производными С-фосфорилированных ацетамидинов можно представить следующим образом:
При выборе растворителя для проведения реакций с бензолсульфохлоридом следует руководствоваться тем, что при использовании неполярных или малополярных растворителей натриевое производное существует в виде ионных пар, причем ион натрия координируется по местам с наибольшей электронной плотностью. В этих условиях ион натрия экранирует атом кислорода фосфорильной группы и атом азота иминогруппы и реакция с бензолсульфохлоридом протекает в основном по атому углерода метиновой группы. Очевидно, натриевому производному С-фосфорилированного ацетамидина соответствует структура, в которой ион натрия координирован одновременно по атому кислорода фосфорильной группы и атому азота иминогруппы - местам с наибольшей электронной плотностью, а не по какому-либо одному из них или по атому углерода:
Если же использовать полярные растворители (ДМФА, ДМСО), то их молекулы будут сольватировать ион натрия, разъединять ионные пары и тем самым благоприятствовать протеканию реакции по местам с наибольшей электронной плотностью - атомам кислорода и азота, что приведет к смеси продуктов.
В этих реакциях наибольший выход N-замещенных (2-бензолсульфонил-2-диалкоксифосфорил)ацетамидинов отмечен при использовании в качестве растворителя диоксана. В начальный момент взаимодействия нет необходимости в дополнительном нагреве, так как реакция начинается самопроизвольно даже при комнатной температуре. Затем для завершения реакции с бензолсульфохлоридом реакционную массу нагревали до 50÷60°C. Для проведения реакции оптимальное соотношение реагентов С-фосфорилированный ацетамидин: натрий: бензолсульфохлорид составляет 1:1:1÷1.02.
Предложенный метод получения N-замещенных (2-бензолсульфонил-2-диалкоксифосфорил)ацетамидинов характеризуется простотой эксперимента, не требует выделения промежуточного натриевого производного, осуществляется в достаточно мягких условиях и обеспечивает высокий (более 80%) выход целевых соединений.
Способ осуществляется следующим образом.
К С-фосфорилированному ацетамидину, растворенному в осушенном диоксане, добавляли эквимольное количество мелкодиспергированного натрия при перемешивании и температуре 20÷30°C. Процесс проводят до полного превращения натрия, что легко контролируется визуально. Затем к полученному натриевому производному С-фосфорилированного ацетамидина при перемешивании и температуре 20÷30°C добавляют по каплям расчетное количество бензолсульфохлорида в диоксане. Использование в данном процессе избытка до 2% бензолсульфохлорида по сравнению со стехиометрическим количеством необходимо для обеспечения полной конверсии натриевого производного. Для завершения реакции с бензолсульфохлоридом рекомендуется постепенное повышение температуры реакционной смеси до 50÷60°C. Для выделения целевого вещества реакционную массу охлаждают до температуры 20÷30°C, хлорид натрия отделяют фильтрацией, растворитель удаляют отгонкой в вакууме (при 15-20 гПа), остаток вакуумируют в течение 1 часа при 50°C и 2÷4 гПа. Выход составил более 80%. Для получения химически чистых соединений осуществляли дополнительную очистку полученных соединений методом колоночной адсорбционной хроматографии на силикагеле марки µLC 5/40. Идентификацию синтезированных соединений проводили по данным элементного анализа, молекулярной рефракции, определения молекулярной массы, ИК- и ЯМР 1Н-спектроскопии. Для лучшего понимания сущности предложенного технического решения приводятся конкретные примеры синтезов.
Пример 1. N1,N1-дипропил-N2-бензоил(2-бензолсульфонил-2-дибутоксифосфорил) ацетамидин
К раствору 1 г (0.0021 моль) N1N1-дипропил-N2-бензоил(цибутоксифосфорил)ацетамидина в 4 мл осушенного диоксана при перемешивании и температуре 20÷30°C прибавляют небольшими порциями 0.046 г (0.0021 моль) натрия. Реакционную массу перемешивают до полного исчезновения натрия. К раствору полученного натриевого производного ацетамидина при перемешивании и температуре 20÷30°C добавляют по каплям 0.36 г (0.0021 моль) бензолсульфохлорида в 2 мл диоксана. Мольное соотношение N1,N1- дипропил-N2-бензоил(дибутоксифосфорил)ацетамидин:натрий:бензолсульфохлорид=1:1:1.01. Температуру реакционной массы повышают до 55-60°C и перемешивают в течение 5 часов. Соль хлорида натрия отделяют фильтрацией, растворитель удаляют отгонкой в вакууме (при 15-20 гПа), остаток вакуумируют в течение 1 часа при 50°C и 2-4 гПа. Очищают вещество методом адсорбционной колоночной хроматографии на силикагеле, элюент хлороформ: диэтиловый эфир: гексан=1:3:1(об.).(Rf 0.64, силуфол. Проявление парами иода). Получают 1.1 г N1,N1-дипропил-N2-бензоил(2-бензолсульфонил-2-дибутоксифосфорил)ацетамидина. Выход 87%. n D 20 1.5216, d 4 20 1.1315. MRD 121.29, выч. 120.41. Mr 561.54, выч. 578. Найдено, %: N 5.15, Р 5.98. C29H43O6N2PS. Вычислено, %: N 4.84, Р 5.36.
Спектр ЯМР 1Н (CCl4), м.д.: 0.94 т (12Н, СН3); 1.38 м (12Н, СН2); 3.01 д (1Н, СНР); 3.28 т (4Н, NCH2); 3.50 м (4Н, CH2OP); 7.35 м (10Н, С6Н5);
ИК-спектр, ν, см-1: 748 (C-S); 982-1070 (РОС); 1140(O=S=O); 1245 (Р=O); 1600(С-Сар); 1664 (C=N); 1735 (С=O).
Пример 2. N1,N1-дибутил-N2-бензоил(2-бензолсульфонил-2-диизопропоксифосфорил)ацетамидин. (II)
Синтезировали аналогично из 2 г (0.0048 моль) N1,N1-дибутил-N2-бензоил-(диизопропоксифосфорил)ацетамидина, 0.11 г (0.0048 моль) натрия и 0.53 г (0.0052 моль) бензолсульфохлорида. Мольное соотношение N1,N1-дипропил-N2-бензоил-(диизопропоксифосфорил)ацетамидин:натрий:бензолсульфохлорид=1:1:1. Выход N1,N1-дибутил-N2-бензоил(2-бензолсульфонил-2-диизопропоксифосфорил)ацетамидина 1.6 г (85%).
n D 20 1.5314, d 4 20 1.1914. MRD 155.90, выч. 155.54. Найдено, %: N 4.93, Р 5.59. C29H43N2O6PS. Вычислено, %: N 4.84, P 5.35.
Спектр ЯМР 1Н (CCl4), м.д.: 0.94 т (12Н, СН3); 1.38 м (12Н, СН2); 3.01 д (1Н, СНР); 3.28 т (4Н, NCH2); 3.50 м (4Н, СН2ОР); 7.35 м (10Н, C6H5);
ИК-спектр, ν, см-1: 748 (C-S); 982-1070 (РОС); 1140(O=S=O); 1245 (Р=O); 1600(С-Сар); 1664 (C=N); 1735 (С=O).
Пример 3. N1,N1-дипропил-N2-ацетил(2-бензолсульфонил-2-дибутоксифосфорил)ацетамидин
Синтезировали аналогично из 1.60 г (0.0039 моль) N1,N1-дипропил-N2-ацетил-(дибутоксифосфорил)ацетамидина, 0.09 г (0.0039 моль) натрия и 0.42 г (0.0039 моль) бензолсульфохлорида. Мольное соотношение N1,N1-дипропил-N2-ацетил-(дибутоксифосфорил)ацетамидин:натрий:бензолсульфо-хлорид=1:1:1. Выход 1.6 г (89%).
n D 20 1.4835, d 4 20 1.1821. MRD 135.92, выч. 135.08. Найдено, %: N 5.67, Р 6.11. C24H41N2O6PS. Вычислено, %: N 5.42, Р 6.21.
Спектр ЯМР 1Н (CCl4), м.д.: 0.91 т (12Н, СН3); 1.35 м (12Н, CH2); 2.96 д (1Н, CHP); 3.62 т (4Н, NCH2); 3.98 м (4Н, CH2OP); 7.41 м (5Н, C6H5);
ИК-спектр, ν, см-1: 746 (C-S); 980-1072 (РОС); 1139 (O=S=O); 1248 (Р=O); 1664 (C=N); 1736 (С=O).
Пример 4. N1-морфолино-N2-бензоил(2-бензолсульфонил-2-диизопропоксифосфорил)ацетамидин.(ГУ)
Синтезировали аналогично из 1.40 г (0.0037 моль) N1-морфолино-N2-бензоил-(диизопропоксифосфорил)ацетамидина, 0.084 г (0.0037 моль) натрия и 0.42 г (0.0038 моль) бензолсульфохлорида. Мольное соотношение N1-морфолино-N2-бензоил-(диизопропоксифосфорил)ацетамидин:натрий:триметилхлорсилан=1:1:1.02. Выход 1.5 г (86%).
n D 20 1.5014, d 4 20 1.1761. MRD 136.19, выч. 136.86. Найдено, %: N 5.34, Р 5.98. C25H33N2O7PS. Вычислено, %: N 5.22, Р 5.77.
Спектр ЯМР 1Н (CCl4), м.д.: 1.23 т (12Н, СН3); 2.95 д (1Н, СНР); 3.42 т (4Н, NCH2); 4.62 м (4Н, CHOP); 7.63 м (10Н, C6H5); 3.64 т (4Н, CH2O).
ИК-спектр, ν, см-1: 754 (C-S); 966-1054 (РОС); 1145 (O=S=O); 1243 (Р=O); 1666 (C=N); 1614(СС); 1735 (С=O).
Пример 5. N1-мopфoлинo-N2-бeнзoил-(2-бензолсульфонил-2-дибутоксифосфорил)ацетамидин
Синтезировали аналогично из 1.70 г (0.0043 моль) N1-морфолино-N2-бензоил-(дибутоксифосфорил)ацетамидина, 0.099 г (0.0043 моль) натрия и 0.48 г (0.0046 моль) бензолсульфохлорида. Мольное соотношение N1-морфолино-N2-бензоил-(дибутоксифосфорил)ацетамидина:натрий бензолсульфохлорида=1:1:1.02. Выход 1.9 г (87%). n D 20 1.5023, d 4 20 1.1632. MRD 145.56, выч. 146.28. Найдено, %: N 5.13, Р 5.26. C27H37N2O7PS. Вычислено, %: N 4.96, Р 5.49.
Спектр ЯМР 1Н (CCl4), м.д.: 1.23 т (12Н, СН3); 2.95 д (1H, СНР); 3.42 т (4Н, NCH2); 4.62 м (4Н, CHOP); 7.63 м (10Н, С6Н5); 3.64 т (4Н, CH2O).
ИК-спектр, ν, см-1: 750 (C-S); 975-1063 (РОС); 1145 (O=S=O); 1233 (P=O); 1675 (C=N); 1613(СС); 1744 (С=O).
Предложенный метод заключается во взаимодействии С-фосфорилированных ацетамидинов с натрием с последующим бензолсульфонилированием с образованием N-замещенных (2-бензолсульфонил-2-диалкоксифосфорил)ацетамидинов, что оказалось возможным вследствие высоких СН-кислотных свойств активированной метиленовой группы исходных ацетамидинов.
Достоинством разработанного метода является простота технологии и универсальность.
Способ получения N-замещенных (2-бензолсульфонил-2-диалкоксифосфорил)ацетамидинов общей формулы где R=CH3, C6H5 R1=i-C3H7, C4H9;R2=N(C2H5)2, N(C3H7)2, N(C4H9)2, ;заключающийся во взаимодействии С-фосфорилированных ацетамидинов формулы с натрием с последующим бензолсульфонилированием полученного натриевого производного бензолсульфонилхлоридом, в среде диоксана при мольном соотношении С-фосфорилированный ацетамидин:натрий:бензолсульфонил-хлорид=1:1:1÷1.02 соответственно и температуре 50÷60°С.