Способ изготовления внутрикостного имплантата с ионно-лучевой модификацией
Иллюстрации
Показать всеИзобретение относится к медицине, конкретно к ортопедической хирургии, и может быть использовано при изготовлении высоконагруженных внутрикостных имплантатов, а также мини-имплантатов. Описан способ, включающий пескоструйную обработку поверхности имплантата частицами оксида алюминия, послойное напыление плазменным методом на основу имплантата системы покрытий из порошка титана и гидроксиапатита кальция и последующее облучение многослойной системы биосовместимых покрытий в вакуумной среде углеводородного газа высокоэнергетическими ионами инертного газа с энергией 40-130 кэВ и дозой облучения 2000-5000 мкКл/см2 . Поверхность металлической основы имплантата перед послойным плазменным напылением модифицируют ионно-лучевым методом путем облучения высокоэнергетическими ионами в вакуумной среде. Внутрикостные имплантаты имеют повышенную прочность металлической основы. 2 з.п. ф-лы, 3 ил., 2 табл.
Реферат
Изобретение относится к области медицинской техники, а именно к ортопедической хирургии, и может быть использовано при изготовлении высоконагруженных внутрикостных имплантатов, а также мини-имплантатов.
Известен способ изготовления внутрикостных стоматологических имплантатов с биоактивным покрытием [патент РФ №2074674, МПК: A61F 2/28], включающий изготовление из металла или сплава универсальным способом (токарная, фрезерная и др. методы обработки или с помощью специальных электрофизических методов) основы имплантата цилиндрической, пластинчатой или трубчатой формы, нанесение на основу имплантата методом плазменного напыления системы покрытий из четырех слоев - двух слоев титана или гидрида титана различной дисперсности и толщины, третьего слоя из механической смеси титана или гидрида титана, или гидроксиапатита с соотношением соответственно 60-80 мас.% и 20-40 мас.% и наружного слоя - гидроксиапатита.
Известен способ изготовления имплантата для замены костной ткани [патент РФ №2025132, МПК: A61F 2/28], согласно которому на имплантат, выполненный из металлического или металл-керамического сплава в виде штифта, наносят трехслойное покрытие, при этом первый слой содержит биостекло на основе фосфата кальция с добавлением оксидов металлов, второй слой - смесь фосфата кальция и гидроксиапатита, а промежуточный слой содержит фосфат кальция.
Однако недостатком данных изобретений является недостаточная прочность металлической основы имплантата, что не позволяет использовать его в качестве высоконагруженных имплантатов и мини-импланатов.
Наиболее близким к предлагаемому изобретению является способ изготовления внутрикостного стоматологического имплантата с ионно-лучевой модификацией плазмонапыленного многослойного биоактивного покрытия [патент РФ №2458707, МПК: A61L 27/02, A61C 8/00, C23C 14/00, C23C 14/58, опубликовано 20.08.2012], включающий пескоструйную обработку поверхности имплантата частицами оксида алюминия, послойное напыление плазменным методом на основу имплантата системы биосовместимых покрытий различной дисперсности и толщины, состоящей из пяти слоев: первых двух из титана или гидрида титана, последующих двух слоев из смеси титана или гидрида титана с гидроксиапатитом кальция, отличающихся содержанием компонентов в слоях, и пятого слоя из гидроксиапатита кальция, после чего многослойную систему биосовместимых покрытий облучают в вакуумной среде углеводородного газа высокоэнергетическими ионами инертного газа с энергией 40-130 кэВ и дозой облучения 2000-5000 мкКл/см2.
Однако недостатком данного изобретения также является низкая механическая прочность металлической основы имплантата, что не позволяет использовать его в качестве высоконагруженных имплантатов и мини-импланатов.
Задача изобретения заключается в расширении области практического применения внутрикостных имплантатов с модифицируемым электроплазменным покрытием путем повышения прочности металлической основы внутрикостного имплантата.
Техническим результатом является образование в поверхностном и приповерхностном слое металлической основы имплантата большого количества упрочняющих фаз и тонкой беспористой наноразмерной алмазоподобной пленки, способствующей увеличению прочности металла и препятствию развития усталостных трещин.
Поставленная задача решается тем, что в способе, включающем пескоструйную обработку поверхности имплантата частицами оксида алюминия, послойное напыление плазменным методом на основу имплантата системы покрытий из порошка титана и гидроксиапатита кальция, при этом первым слоем напыляют титан дисперсностью 50-100 мкм с дистанцией напыления 100 мм, толщиной 15-20 мкм, вторым слоем напыляют гидроксиапатит кальция дисперсностью 40-70 мкм с дистанцией напыления 70 мм и толщиной слоя 20-30 мкм, и последующие облучение многослойной системы биосовместимых покрытий в вакуумной среде углеводородного газа высокоэнергетическими ионами инертного газа с энергией 40-130 кэВ и дозой облучения 2000-5000 мкКл/см2 , согласно предлагаемому решению поверхность металлической основы внутрикостного имплантата перед послойным плазменным напылением модифицируют ионно-лучевым методом путем облучения высокоэнергетическими ионами в вакуумной среде. При этом в качестве высокоэнергетических ионов используют азот, ионно-лучевую модификацию проводят с дозой ионов 1000-10000 мкКл/см2 и энергией ионов 40-120 кэВ, также ионно-лучевую модификацию проводят в вакуумной среде углеводородного CO, CH газа, давление вакуумной среды при ионно-лучевой модификации составляет не более 10-4 мм рт.ст. и не менее 10-6 мм рт.ст.
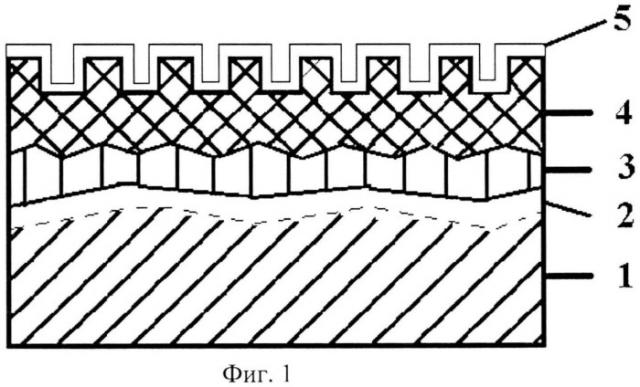
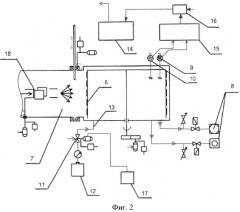
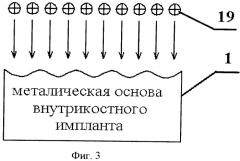
Изобретение поясняется чертежами, на Фиг.1 - схема послойного формирования покрытий, на Фиг.2 - схема установки ионно-лучевого облучения, Фиг.3 - схема ионно-лучевого облучения металлической основы имплантата.
Предлагаемый способ осуществляют следующим образом: перед напылением поверхность основы металлического имплантата 1 (Фиг.3) подвергают пескоструйной обработке частицами оксида алюминия, затем изделие закрепляют на барабане 6 (Фиг.2) в установке ионного легирования, например «Везувий-5» (Мейер Дж. Эриксон Л. Ионное легирование полупроводников. М.: Мир, 1970 г.), в объеме приемной камеры 7 установки откачивают давление до 10-6 мм рт.ст. с помощью высоковакуумных насосов 8, которое фиксируют ионизационным датчиком высокого вакуума 9 и вакуумметром 10, далее по команде оператора в камеру 7 через игольчатый клапан 11 из баллона 12 по герметичному трубопроводу 13 подают реакционный углеводородный газ, например оксид углерода (CO) или углеводорода (CH), при этом давление в камере посредством ЭВМ 14 (автоматически) изменяют в сторону повышения, но не более 10-4 мм рт.ст., потому что в более низком вакууме на поверхности адсорбируется сажевое образование, что является недопустимым. Давление фиксируется ионизационным датчиком высокого вакуума 9 и вакуумметром 10, сигнал с датчика высокого вакуума 9 поступает на электронный блок 15, где происходит сравнение полученных значений вакуума с заданной величиной, далее сигнал через устройство сопряжения с объектом 16 (УСО) передается на ЭВМ 14 и уже затем - на источник питания привода 17 игольчатого клапана 11, данный процесс повторяется постоянно с целью поддержания заданной величины давления в объеме приемной камеры 7 установки.
Давление в приемной камере устанавливают не более 10-4 мм рт.ст., потому что в более низком вакууме на поверхности адсорбируется сажевое образование, что является недопустимым в данном случае; и не менее 10-6 мм рт.ст., потому что при ионно-лучевом облучении уменьшается скорость адсорбции атомов углеродсодержащей среды, что замедляет процесс образования сплошного слоя радикалов, необходимого для образования беспористого алмазоподобного покрытия. Поэтому оптимальным диапазоном давления для получения необходимых свойств материала является 10-4÷10-6 мм рт.ст.
Затем поверхность изделия, находящегося на барабане 6 в приемной камере 7, модифицируют высокоэнергетическими ионами 19 (Фиг.3), например ионами азота (N+), которые образуются в разрядной камере ионного источника 18 (Фиг.2) за счет ионизации паров рабочего вещества в дуговом разряде и вытягиваются из него при помощи электрода. При ионно-лучевой модификации ионами азота в приповерхностном слое изделия происходит образование нитридов, которые являются по своим механическим характеристикам наиболее оптимальным решением для получения прочной структуры поверхности металлической основы имплантата.
При ионно-лучевой модификации в углеродсодержащей среде в поверхностном слое адсорбированных атомов углеродсодержащих фрагментов происходят процессы ионизации и диссоциации молекул, приводящие к возникновению заряженных радикалов, процесс сшивания которых стимулируется энергетическим воздействием внедряемых ионов и контролируется поступлением электронов из нижележащего металла. По мере увеличения толщины заполимеризовавшегося слоя поступление электронов к поверхности реакции затрудняется и при достижении толщины порядка длины туннелирования электронов рост алмазоподобной полимерной пленки прекращается. Наиболее интенсивно процесс роста протекает на участках заполимеризовавшегося слоя с меньшей толщиной и порами, что обеспечивает высокую равномерность и беспористость пленки.
Ионно-лучевая модификация металлической основы внутрикостных имплантатов, например титана марки ВТ1-00, высокоэнергетическими ионами, например азота (N), обеспечивает повышение микротвердости за счет ионного перемешивания фрагментов адсорбированной на поверхности металлической основы полимерной пленкой с приповерхностным слоем металла, при этом энергия и доза ионной имплантации составляют от 40 до 120 кэВ и от 1000 до 10000 мкКл/см2 , соответственно (табл.1, 2).
| Таблица 1 | |||
| Зависимость дозы ионно-лучевой модификации от микротвердости титана марки ВТ 1-00 | |||
| Доза имплантации, мкКл/см2 | Имплантируемый ион | HV, ГПа | Относительное приращение |
| Не облученный | 5 | - | |
| 1000 | 13 | 2,6 | |
| 2000 | Азот (N) | 16 | 3,2 |
| 3000 | 14 | 2,8 | |
| 5000 | 13 | 2,6 | |
| 7000 | 9 | 1,8 | |
| 10000 | 7 | 1,4 |
| Таблица 2 | |||
| Зависимость энергии ионно-лучевой модификации от микротвердости титана марки ВТ1-00 | |||
| Энергия имплантации, кэВ | Имплантируемый ион | HV, ГПа | Относительное приращение |
| Не облученный | 5,4 | - | |
| 40 | 6,4 | 1,18 | |
| 60 | 8,3 | 1,53 | |
| 80 | Азот (N) | 7 | 1,29 |
| 100 | 6,5 | 1,2 | |
| 120 | 6 | 1,1 | |
| 140 | 5,2 | 0,92 |
Из таблицы 1, 2 видно, что наиболее оптимальным диапазоном дозы и энергии ионно-лучевой модификации, при котором микротвердость титана достигает значительного увеличения, являются значения от 1000-10000 мкКл/см2 и от 40 до 120 кэВ, соответственно.
Ионно-лучевая модификация высокоэнергетическими ионами также способствует появлению равномерной алмазоподобной беспористой полимерной пленки, обладающей высокой химической инертностью и механической прочностью, способствующей быстрому росту костной ткани. После модифицирования в структуре образуется большое количество упрочняющих фаз, препятствующих развитию усталостных трещин.
При ионно-лучевой модификации металлической основы имплантата с энергетическим воздействием менее 40 кэВ процесс сшивки полимерной углеродсодержащей пленки происходит менее эффективно, т.к. ионам недостаточно энергетического воздействия, необходимого для разрыва химических связей атомов кристаллической решетки металла, а при облучении с энергетическим воздействием более 130 кэВ внедряемые ионы из-за большой глубины проникновения затрудняют выход электронов на поверхность покрытий к месту синтеза углеродсодержащей полимерной пленки, что приводит к уменьшению механической прочности.
Затем на имплантируемую поверхность металлической основы 2 (Фиг.1) наносят первый слой 3 электроплазменного покрытия путем плазменного напыления диспергированного порошка титана дисперсностью 50-100 мкм с дистанцией напыления 100 мм, толщиной 15-20 мкм, вторым слоем 4 напыляют порошок гидроксиапатита кальция дисперсностью 40-70 мкм с дистанцией напыления 70 мм и толщиной слоя 20-30 мкм, и облучают многослойную систему биосовместимых покрытий в вакуумной среде углеводородного газа высокоэнергетическими ионами инертного газа с энергией 40-130 кэВ и дозой облучения 2000-5000 мкКл/см2, образуя покрытие 5, способствующие более эффективному росту костной ткани.
Таким образом, предлагаемое техническое решение позволяет повысить механическую прочность металлической основы имплантата за счет образования на нем алмазоподобной беспористой наноразмерной химически инертной пленки, активно стимулирующей рост костной ткани и обладающей высокой твердостью.
1. Способ изготовления внутрикостного имплантата с ионно-лучевой модификацией, включающий пескоструйную обработку поверхности имплантата частицами оксида алюминия, послойное напыление плазменным методом на основу имплантата системы покрытий из порошка титана и гидроксиапатита кальция, при этом первым слоем напыляют титан дисперсностью 50-100 мкм с дистанцией напыления 100 мм, толщиной 15-20 мкм, вторым слоем напыляют гидроксиапатит кальция дисперсностью 40-70 мкм с дистанцией напыления 70 мм и толщиной слоя 20-30 мкм, и последующие облучение многослойной системы биосовместимых покрытий в вакуумной среде углеводородного газа высокоэнергетическими ионами инертного газа с энергией 40-130 кэВ и дозой облучения 2000-5000 мкКл/см2 , отличающийся тем, что поверхность металлической основы внутрикостного имплантата перед послойным плазменным напылением модифицируют ионно-лучевым методом путем облучения высокоэнергетическими ионами азота с дозой ионов 1000-10000 мкКл/см2 и энергией ионов 40-120 кэВ в вакуумной среде.
2. Способ изготовления внутрикостного имплантата с ионно-лучевой модификацией по п.1, отличающийся тем, что ионно-лучевую модификацию проводят в вакуумной среде оксида углерода (СО) или углеводородного газа.
3. Способ изготовления внутрикостного имплантата с ионно-лучевой модификацией по п.1, отличающийся тем, что давление вакуумной среды при ионно-лучевой модификации составляет не более 10-4 мм рт.ст. и не менее 10-6 мм рт.ст.