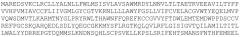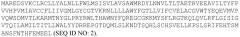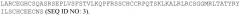Способы ингибирования глазного ангиогенеза
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к офтальмологии, и может быть использована для снижения или ингибирования ангиогенеза у индивидуума, страдающего заболеванием глаз, или состояния, ассоциированного с ангиогенезом. Для этого индивидууму вводят антагонист TSPAN12. Также предложен способ лечения заболевания или состояния глаз, ассоциированного с нежелательным агиогенезом. Группа изобретений обеспечивает снижение ангиогенеза сосудов наружного плексиформного слоя (OPL), связанного со слоем нервных волокон (NFL) зрительного нерва. 2 н. и 28 з.п. ф-лы, 13 ил., 1 табл., 7 пр.
Реферат
РОДСТВЕННЫЕ ЗАЯВКИ
В соответствии с разделом 35, § 119(e) Свода законов США для настоящей заявки испрашивается приоритет предварительной заявки США номер 61/095757, поданной 10 сентября 2008; предварительной заявки США номер 61/103502, поданной 7 октября 2008; и предварительной заявки США номер 61/234519, поданной 17 августа 2009, содержание которых включено в данное описание посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится, главным образом, к композициям и способам, которые можно использовать для лечения состояний и заболеваний, ассоциированных с ангиогенезом. В частности, настоящее изобретение относится к антагонистам тетраспанина 12 (TSPAN12) и норрина.
УРОВЕНЬ ТЕХНИКИ
В настоящее время точно установлено, что ангиогенез представляет собой важный фактор патогенеза большого числа расстройств. К ним относятся солидные опухоли и метастазирование, внутриглазные неоваскулярные заболевания, такие как пролиферативные ретинопатии, например, диабетическая ретинопатия, окклюзия ретинальной вены (RVO), влажная возрастная дегенерация желтого пятна (AMD), неоваскулярная глаукома, иммунное отторжение трансплантированной роговичной ткани и других тканей и ревматоидный артрит. Duda et al. J. Clin. Oncology 25(26): 4033-42 (2007); Kesisis et al. Curr. Pharm. Des. 13: 2795-809 (2007); Zhang & Ma Prog. Ret. & Eye Res. 26: 1-37 (2007).
Сетчатка получает свое кровоснабжение из ретинальных сосудов, которые снабжают внутреннюю часть сетчатки, и хориоидальных сосудов, которые снабжают наружную часть. Повреждение ретинальных сосудов наблюдается при некоторых патологических процессах, включающих диабетическую ретинопатию, ретинопатию недоношенных и окклюзии центральной вены сетчатки и ее ветвей (ишемические ретинопатии). Ишемия сетчатки из-за данного повреждения приводит к нежелательной неоваскуляризации. Хориоидальная неоваскуляризация наблюдается при большом числе других патологических процессов, включая AMD. Напротив, неполная васкуляризация сетчатки характерна для пациентов, страдающих некоторыми генетическими заболеваниями, например, семейной экссудативной витреоретинопатией (FEVR) и болезнью Норри, обусловленной мутацией Wnt-рецептора Frizzled4 (Fzd4), корецептора LRP5 или секретируемого лиганда норрина (Berger et al. Nature Genet. 1:199-203 (1992); Chen et al. Nature Genet. 1:204-208 (1992); Robitaille et al. Nature Genet. 32:326-30 (2002); Toomes et al. Am. J. Hum. Genet. 74:721-30 (2004)). Модели этих генетических заболеваний доступны на мышах с нокаутом соответствующих гомологичных генов.
Несмотря на большое число достижений в области ангиогенеза глаз, сохраняется потребность в идентификации мишеней и разработке средств, которые могут дополнить или усилить эффективность существующих способов лечения.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано, по меньшей мере отчасти, на обнаружении того, что TSPAN12 представляет собой компонент пути сигнальной трансдукции, индуцируемого норрином и опосредуемого Frizzled4 и LRP5, и необходим для развития патологического ангиогенеза. Поэтому норрин и TSPAN12 представляют собой мишени лекарственных средств, ингибирующих аномальный ангиогенез глаз, включающий состояния, при которых не существует генетических мутаций в генах норрина, TSPAN12, Frizzled-4 или LRP5. Соответственно, настоящее изобретение относится к новым способам лечения глазных болезней, ассоциированных с ангиогенезом, используя реагенты, которые блокируют активность норрина или TSPAN12.
В одном из аспектов изобретение относится к способу снижения или ингибирования ангиогенеза у индивидуума, страдающего заболеванием глаз или состоянием, ассоциированным с ангиогенезом, предусматривающему введение индивидууму антагониста TSPAN12. В некоторых вариантах осуществления антагонист TSPAN12 представляет собой антитело против TSPAN12. В некоторых вариантах осуществления антагонист TSPAN12 содержит полипептидный фрагмент TSPAN12, включающий внеклеточный домен, такой как вторая внеклеточная петля. В некоторых вариантах осуществления антагонист дополнительно содержит константный регион иммуноглобулина, например, Fc-регион IgG. В некоторых вариантах осуществления заболевание или состояние глаз выбирают из группы, состоящей из: диабетической ретинопатии, хориоидальной неоваскуляризации (CNV), возрастной дегенерации желтого пятна (AMD), диабетического отека желтого пятна (DME), патологической миопии, болезни Фон Хиппеля-Линдау, гистоплазмоза глаз, окклюзии центральной вены сетчатки (CRVO), окклюзии ветвей центральной вены сетчатки (BRVO), неоваскуляризации роговицы, неоваскуляризации сетчатки, ретинопатии недоношенных (ROP), субконъюнктивального кровоизлияния и гипертензивной ретинопатии.
В некоторых вариантах осуществления способ дополнительно предусматривает введение второго антиангиогенного агента. В некоторых вариантах осуществления второй ангиогенный агент вводят до или после введения антагониста TSPAN12. В других вариантах осуществления, второй антиангиогенный агент вводят одновременно с антагонистом TSPAN12. В некоторых вариантах осуществления второй антиангиогенный агент представляет собой антагонист норрина или фактора роста клеток эндотелия сосудов (VEGF). В некоторых вариантах осуществления антагонист норрина или антагонист VEGF представляет собой антитело против норрина или антитело против VEGF (например, ранибизумаб).
В другом аспекте изобретение относится к способу снижения или ингибирования ангиогенеза у индивидуума, страдающего заболеванием или состоянием глаз, ассоциированным с ангиогенезом, содержащему введение индивидууму антагониста норрина. В некоторых вариантах осуществления антагонист норрина представляет собой антитело против норрина. В некоторых вариантах осуществления заболевание или состояние глаз выбирают из группы, состоящей из: диабетической ретинопатии, CNV, AMD, DME, патологической миопии, болезни фон Хиппеля-Линдау, гистоплазмоза глаз, CRVO, BRVO, неоваскуляризации роговицы, неоваскуляризации сетчатки, ROP, субконъюнктивального кровоизлияния и гипертензивной ретинопатии.
В некоторых вариантах осуществления способ дополнительно предусматривает введение второго антиангиогенного агента. В некоторых вариантах осуществления второй антиангиогенный агент вводят до или после введения антагониста норрина. В других вариантах осуществления второй антиангиогенный агент вводят одновременно с антагонистом норрина. В некоторых вариантах осуществления второй антиангиогенный агент представляет собой антагонист VEGF, например, антитело против VEGF, такое как ранибизумаб.
В другом аспекте изобретение относится к способу лечения заболевания или состояния глаз, ассоциированного с нежелательным ангиогенезом у индивидуума, предусматривающему введение индивидууму антагониста TSPAN12. В некоторых вариантах осуществления антагонист TSPAN12 представляет собой антитело против TSPAN12. В некоторых вариантах осуществления антагонист TSPAN12 содержит полипептидный фрагмент TSPAN12, включающий внеклеточный домен, такой как вторая внеклеточная петля. В некоторых вариантах осуществления антагонист дополнительно содержит константный регион иммуноглобулина, например, Fc-регион IgG. В некоторых вариантах осуществления заболевание или состояние глаз выбирают из группы, состоящей из: пролиферативных ретинопатий, включающих пролиферативную диабетическую ретинопатию, CNV, AMD, диабетической или других ишемических ретинопатий, DME, патологической миопии, болезни фон Хиппеля-Линдау, гистоплазмоза глаз, CRVO, BRVO, неоваскуляризации роговицы, неоваскуляризации сетчатки, ROP, субконъюнктивального кровоизлияния и гипертензивной ретинопатии.
В некоторых вариантах осуществления способ дополнительно предусматривает введение второго антиангиогенного агента. В некоторых вариантах осуществления второй антиангиогенный агент вводят до или после введения антагониста TSPAN12. В других вариантах осуществления второй антиангиогенный агент вводят одновременно с антагонистом TSPAN12. В некоторых вариантах осуществления второй антиангиогенный агент представляет собой антагонист норрина или VEGF. В некоторых вариантах осуществления антагонист норрина или антагонист VEGF представляет собой антитело против норрина или антитело против VEGF (например, ранибизумаб).
В другом аспекте изобретение относится к способу лечения заболевания или состояния глаз, ассоциированного с нежелательным ангиогенезом у индивидуума, содержащему введение индивидууму антагониста норрина. В некоторых вариантах осуществления антагонист норрина представляет собой антитело против норрина. В некоторых вариантах осуществления заболевание или состояние глаз выбирают из группы, состоящей из: пролиферативных ретинопатий, включающих пролиферативную диабетическую ретинопатию, CNV, AMD, диабетической или других ишемических ретинопатий, DME, патологической миопии, болезни Фон Хиппеля-Линдау, гистоплазмоза глаз, CRVO, BRVO, неоваскуляризации роговицы, неоваскуляризации сетчатки, ROP, субконъюнктивального кровоизлияния и гипертензивной ретинопатии.
В некоторых вариантах осуществления способ дополнительно предусматривает введение второго антиангиогенного агента. В некоторых вариантах осуществления второй антиангиогенный агент вводят до или после введения антагониста норрина. В других вариантах осуществления второй антиангиогенный агент вводят одновременно с антагонистом норрина. В некоторых вариантах осуществления второй антиангиогенный агент представляет собой антагонист VEGF, например, антитело против VEGF, такое как ранибизумаб.
В другом аспекте изобретение относится к способу получения антитела, используя пептид, состоящий по существу из аминокислот CRREPGTDQMMSLK (SEQ ID NO: 5). В некоторых вариантах осуществления способ предусматривает иммунизацию животного пептидом. В некоторых вариантах осуществления способ содержит скрининг библиотеки (например, библиотеки Fab) для идентификации антитела или фрагмента антитела, который связывается с пептидом. В некоторых вариантах осуществления изобретение относится к антителам, полученным любым из таких способов. В некоторых вариантах осуществления изобретение относится к способу определения TSPAN12, используя любое из таких антител.
В другом аспекте изобретение относится к in vitro и in vivo способам ингибирования образования мультимера FZD4, предусматривающим введение антагониста TSPAN12. В другом аспекте изобретение относится к in vitro и in vivo способам ингибирования передачи сигнала, опосредованной норрином, предусматривающим введение антагониста TSPAN12. В некоторых вариантах осуществления антагонист TSPAN12 представляет собой антитело против TSPAN12. В некоторых вариантах осуществления антагонист TSPAN12 содержит полипептидный фрагмент TSPAN12, включающий внеклеточный домен, такой как вторая внеклеточная петля. В некоторых вариантах осуществления антагонист дополнительно содержит константный регион иммуноглобулина, например, Fc-регион IgG.
В другом аспекте изобретение относится к способу лечения индивидуума, страдающего врожденным заболеванием глаз, обусловленным генетической мутацией в каком-либо из генов норрина, TSPAN12, FZD4 или LRP5, содержащему введение индивидууму агента, который усиливает образование мультимера FZD4. В некоторых вариантах осуществления заболевание представляет собой FEVR, болезнь Норри или болезнь Коатса. В некоторых вариантах осуществления агент, который повышает образование мультимера FZD4, выбирают из группы, состоящей из: норрина, антитела против FZD4, антитела против LRP5 и биспецифического антитела против FZD4/против LRP5. В некоторых вариантах осуществления генетическая мутация повреждает передачу сигнала, опосредованную FZD4. В некоторых вариантах осуществления генетическая мутация у индивидуума продуцирует аномальный белковый продукт у индивидуума, выбранный из группы, состоящей из: норрин-C95R, FZD4-M105V и FZD4-M157V. В некоторых вариантах осуществления наличие мутации у индивидуума определяют до лечения индивидуума.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На ФИГУРЕ 1 представлены типичные срезы сетчатки при ретинопатии недоношенных (ROP) мышей дикого типа (верх) и с нокаутом (КО) гена TSPAN12 (низ).
На ФИГУРЕ 2 представлены количественные результаты по числу зон неоваскуляризации, обнаруженных в срезах сетчатки при ROP мышей дикого типа (WT; слева) и с КО TSPAN12 (Hom; справа).
На ФИГУРЕ 3 показано, что TSPAN12 усиливает через Fzd4/LRP5 сигнальную трансдукцию, опосредованную норрином.
На ФИГУРЕ 4 показано, что усиление TSPAN12 сигнальной трансдукции, опосредованной норрином, специфично для Fzd4.
На ФИГУРЕ 5 показано, что TSPAN12 не усиливает сигнальную трансдукцию, опосредованную Wnt3a.
На ФИГУРЕ 6 показано, что норрин связывается с Fzd4, но не с LRP5 или TSPAN12.
На ФИГУРЕ 7 показано, что норрин связывается с клетками, экспрессирующими Fzd4, но не с клетками, экспрессирующими Fzd5, LRP5 или TSPAN12, и что норрин не иммунопреципитирует совместно с TSPAN12.
На ФИГУРЕ 8 показано, что TSPAN12 не ассоциирует с LRP5.
На ФИГУРЕ 9 показано, что TSPAN12 не усиливает связывание норрина с Fzd4.
На ФИГУРЕ 10 показано, что коэкспрессия TSPAN12 не изменяет экспрессию Fzd4 на плазматической мембране.
На ФИГУРЕ 11 показаны структуры высокого порядка, образованные норрином дикого типа и мутантным норрином C95R.
На ФИГУРЕ 12 показано, что сверхэкспрессия TSPAN12 может компенсировать дефекты в мономерном норрине C95R.
На ФИГУРЕ 13 показано, что TSPAN12 регулирует кластеризацию FZD4 в процессе передачи сигнала.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Определения
Если иначе не определено, технические и научные термины, использованные в данном документе, имеют то же значение, что и обычно понимаемое специалистами в данной области, к которым настоящее изобретение относится. См., например, руководства Singleton et al., Dictionary of Microbiology and Molecular Biology 2nd ed., J.Wiley & Sons (New York, NY 1994); Sambrook et al., Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Press (Cold Spring Harbor, NY 1989). Для целей настоящего изобретения некоторые термины определяются ниже.
Под используемыми в данном документе терминами «TSPAN12», «полипептид TSPAN12», «норрин» и «полипептид норрина» понимают полипептид, имеющий аминокислотную последовательность природного полипептида TSPAN12 или норрина, независимо от способа его получения или вида. Таким образом, такие полипептиды могут иметь аминокислотную последовательность природного TSPAN12 или норрина человека, мыши или любого другого вида. Полноразмерная аминокислотная последовательность TSPAN12 человека представляет собой:
(SEQ ID NO: 1).
Полноразмерная аминокислотная последовательность TSPAN12 мыши представляет собой:
.
Полноразмерная аминокислотная последовательность норрина человека представляет собой:
Полноразмерная аминокислотная последовательность норрина мыши представляет собой:
Такие полипептиды TSPAN12 или норрина могут быть выделены из природного материала или получены рекомбинантными и/или синтетическими способами.
«Выделенный» в отношении полипептида означает, что он был очищен из природного источника или получен рекомбинантными или синтетическими способами и очищен. «Очищенный» полипептид по существу свободен от других полипептидов или пептидов. «По существу свободен» в данном случае означает меньше чем около 5%, предпочтительно меньше чем около 2%, более предпочтительно меньше чем около 1%, еще более предпочтительно меньше чем около 0,5%, самое предпочтительное, меньше чем около 0,1% контаминации другими белками источника.
Термин «антагонист» используется в широком смысле и включает любую молекулу, которая частично или полностью блокирует, ингибирует или нейтрализует биологическую активность полипептида. Например, антагонист TSPAN12 или норрина частично или полностью блокировал бы, ингибировал или нейтрализовал способность TSPAN12 или норрина трансдуцировать или инициировать индуцированную норрином передачу сигнала или давать возможность патологического образования сосудов в глазе. Подходящие молекулы антагонистов включают, в частности, антагонистические антитела или фрагменты антител, фрагменты или варианты аминокислотной последовательности нативного полипептида TSPAN12 или норрина, пептиды, растворимые фрагменты корецептора(ов) TSPAN12 или норрина, антисмысловые РНК, рибозимы, РНКи, небольшие органические молекулы и т.д. Способы идентификации антагонистов полипептида TSPAN12 или норрина могут предусматривать приведение в контакт полипептида TSPAN12 или норрина с молекулой кандидатного антагониста и измерение детектируемого изменения одной или нескольких биологических активностей, обычно ассоциируемых с полипептидом.
«Активный» или «активность» для целей данного документа относится к форме(ам) TSPAN12 или норрина, которая(ые) сохраняет(ют) биологическую и/или иммунологическую активность, где под «биологической» активностью понимают биологическую функцию, обусловленную TSPAN12 или норрином, отличную от способности индуцировать продукцию антитела, и под «иммунологической» активностью понимают способность индуцировать продукцию антитела против антигенного эпитопа, содержащегося в TSPAN12 или норрине. Основными биологическими активностями TSPAN12 и норрина являются трансдукция или инициация передачи сигнала, индуцированной норрином, и индуцирование патологического образования сосудов в глазу.
Под «корецептором TSPAN12» или «корецептором норрина» понимают молекулы, с которыми TSPAN12 или норрин связывается и которые опосредуют биологическую активность TSPAN12 или норрина.
Термин «антитело» в данном документе используется в широком смысле и включает в частности моноклональные антитела человека, отличные от человеческих (например, мышиные) и гуманизированные (включая полноразмерные моноклональные антитела), поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител при условии, что у них наблюдается желаемая биологическая активность.
«Нативные антитела» обычно представляют собой гетеротетрамерные гликопротеины размером около 150000 дальтон, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (Н) цепей. Каждая легкая цепь соединена с тяжелой цепью одной ковалентной дисульфидной связью, тогда как число дисульфидных связей между тяжелыми цепями различных изотипов иммуноглобулинов варьирует. Каждая тяжелая и легкая цепь также имеет расположенные на равном расстоянии друг от друга внутрицепочечные дисульфидные мостики. Каждая тяжелая цепь имеет на одном конце вариабельный домен (VH) с последующим большим числом константных доменов. Каждая легкая цепь имеет вариабельный домен на одном конце (VL) и константный домен на другом своем конце; константный домен легкой цепи соответствует первому константному домену тяжелой цепи, и вариабельный домен легкой цепи соответствует вариабельному домену тяжелой цепи. Полагают, что определенные аминокислотные остатки образуют поверхность контакта между вариабельными доменами легкой и тяжелой цепей.
Расщепление антител папаином приводит к образованию двух идентичных антигенсвязывающих фрагментов, называемых “Fab”-фрагментами, каждый из которых имеет один антигенсвязывающий сайт, и остаточного “Fc”-фрагмента, название которого отражает его способность легко кристаллизоваться. Обработка пепсином приводит к получению F(ab')2-фрагмента, который имеет два антигенсвязывающих сайта и все еще способен перекрестно связывать антиген.
«Fv» представляет собой минимальный фрагмент антитела, который содержит полный сайт распознавания и связывания антигена. Этот регион состоит из димера вариабельного домена одной тяжелой цепи и одной легкой цепи в плотной нековалентной ассоциации.
Fab-фрагмент также содержит константный домен легкой цепи и первый константный домен (СН1) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов добавлением нескольких остатков на карбоксильном конце домена СН1 тяжелой цепи, включающих один или несколько цистеин(ов) из шарнирного региона антитела. Fab'-SH представляет собой обозначение в данном документе Fab', в котором цистеиновый(е) остаток(ки) константных доменов несет(ут) свободную тиольную группу. F(ab')2-фрагменты антитела исходно получали в виде пар Fab'-фрагментов, которые имеют между собой шарнирные цистеины. Также известны и другие химические сочетания фрагментов антител.
«Легкие цепи» антител (иммуноглобулинов) любого вида позвоночных могут быть отнесены к одному из двух четко различающихся типов, называемых каппа (κ) и лямбда (λ) исходя из аминокислотных последовательностей их константных доменов.
В зависимости от аминокислотной последовательности константного домена их тяжелых цепей иммуноглобулины могут быть отнесены к различным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно разделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелых цепей, которые соответствуют различным классам иммуноглобулинов, называются α, δ, ε, γ и μ соответственно. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны.
«Фрагменты антитела» содержат часть полноразмерного антитела, как правило, его антигенсвязывающий или вариабельный домен. К примерам фрагментов антител относятся Fab, Fab', F(ab')2 и Fv-фрагменты.
Под используемым в данном документе термином «моноклональное антитело» понимают антитело, полученное из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, идентичны за исключением возможных природных мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела высокоспецифичны, они направлены против одного антигенного сайта. Более того, в противоположность препаратам традиционных (поликлональных) антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Определение «моноклональное» указывает на природу антитела, как полученного из по существу гомогенной популяции антител, и не должно быть истолковано, как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела, используемые по настоящему изобретению, могут быть созданы гибридомным способом, впервые описанным в статье Kohler et al., Nature 256:495 (1975), или могут быть созданы способами рекомбинантных ДНК (см., например, патент США 4816567). «Моноклональные антитела» также могут быть выделены из библиотек фаговых антител, используя техники, описанные, например, в статьях Clackson et al., Nature 352:624-628 (1991) и Marks et al., J. Mol. Biol. 222:581-597 (1991).
К моноклональным антителам в данном документе относятся, в частности, «химерные» антитела, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных от конкретного вида или относящихся к определенному классу или подклассу антител, тогда как остальная часть цепи(ей) идентична или гомологична соответствующим последовательностям в антителах, полученных из другого вида или относящихся к другому классу или подклассу антител, а также фрагменты таких антител при условии, что у них наблюдается желаемая биологическая активность (патент США 4816567; и статья Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)).
«Гуманизированные» формы антител, отличных от человеческих (например, мышиных), представляют собой химерные антитела, которые содержат минимальную последовательность, происходящую из иммуноглобулина, отличного от человеческого. Преимущественно, гуманизированные антитела представляют собой иммуноглобулины человека (реципиентное антитело), в которых остатки гипервариабельного региона реципиента замещены остатками гипервариабельного региона вида, отличного от человека (донорное антитело), такого как мышь, крыса, кролик или примат, отличный от человека, обладающие желаемой специфичностью, аффинностью и активностью. В некоторых случаях остатки каркасного региона (FR) иммуноглобулина человека замещены соответствующими остатками, отличными от человеческих. Более того, гуманизированные антитела могут содержать остатки, которых не находят в реципиентном антителе или в донорном антителе. Эти модификации создают для осуществления дополнительного улучшения антитела. В целом гуманизированное антитело должно содержать, по существу, все из по меньшей мере одного и обычно два вариабельных домена, в которых все или по существу все гипервариабельные регионы соответствуют гипервариабельным регионам иммуноглобулина, отличного от человеческого, и все или по существу все регионы FR представляют собой FR последовательности иммуноглобулина человека. Гуманизированное антитело необязательно также будет содержать по меньшей мере часть константного региона иммуноглобулина (Fc), обычно иммуноглобулина человека. Более подробно см. статьи Jones et al. Nature 321:522-525 (1986); Reichmann et al. Nature 332:323-329 (1988); и Presta Curr. Op. Struct. Biol. 2:593-596 (1992).
Под используемым в данном документе термином «лечение» понимают подход для получения благоприятных или желательных клинических результатов. Для целей настоящего изобретения к благоприятным или желательным клиническим результатам относятся, но не ограничиваясь ими, облегчение симптомов, уменьшение степени заболевания, стабилизированное (т.е. не ухудшающееся) состояние заболевания, задержка или замедление прогрессирования заболевания, улучшение состояния или временное облегчение заболевания и ремиссия (либо частичная, либо полная), либо детектируемые, либо недетектируемые. «Лечение» представляет собой вмешательство, осуществляемое с целью предотвращения развития или изменения патологии расстройства. Соответственно, под «лечением» может пониматься терапевтическое лечение или профилактическое или способы упреждения. К нуждающимся в лечении относятся индивидуумы, уже страдающие расстройством, а также индивидуумы, у которых расстройство должно быть предотвращено. Конкретно, лечение может непосредственно предотвращать, замедлять или иным образом уменьшать патологию клеточной дегенерации или повреждения, такую как патология опухолевых клеток при лечении рака, или может делать клетки более чувствительными к лечению другими терапевтическими агентами.
Под «длительным» применением понимают введение агента(ов) продолжительно, в противоположность экстренному введению, чтобы поддерживать начальный терапевтический эффект (активность) в течение длительного периода времени. «Дробное» введение представляет собой лечение, которое осуществляют не последовательно без перерыва, а скорее периодически по характеру.
«Внутриглазное неоваскулярное заболевание» представляет собой заболевание, отличающееся неоваскуляризацией глаза. К примерам внутриглазных неоваскулярных заболеваний относятся, но не ограничиваясь ими, пролиферативные ретинопатии, включающие пролиферативную диабетическую ретинопатию, хориоидальная неоваскуляризация (CNV), возрастная дегенерация желтого пятна (AMD), диабетическая и другие ишемические ретинопатии, диабетический отек желтого пятна (DME), патологическая миопия, болезнь Фон Хиппеля-Линдау, гистоплазмоз глаз, окклюзия центральной вены сетчатки (CRVO), окклюзия ветвей центральной вены сетчатки (BRVO), неоваскуляризация роговицы, неоваскуляризация сетчатки, ретинопатия недоношенных (ROP), субконъюнктивальное кровоизлияние и гипертензивная ретинопатия. Предпочтительно, чтобы внутриглазное неоваскулярное заболевание исключало состояния, которые являются следствием генетических мутаций в каком-либо из генов норрина, TSPAN12, Frizzled-4 или LRP5. Например, внутриглазное неоваскулярное заболевание по изобретению предпочтительно исключает FEVR и болезнь Норри.
К «патологии» заболевания относятся все явления, которые подвергают опасности здоровье пациента.
К введению «в сочетании с» одним или несколькими дополнительными терапевтическими агентами относятся одновременное и последовательное введение в любом порядке.
К «носителям», используемым в данном документе, относятся фармацевтически приемлемые носители, эксципиенты или стабилизаторы, которые нетоксичны для клетки или млекопитающего, подвергаемым их воздействию, в используемых дозах и концентрациях. Часто физиологически приемлемый носитель представляет собой водный рН забуференный раствор. К примерам физиологически приемлемых носителей относятся буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту; низкомолекулярный (меньше чем из около 10 остатков) полипептид; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелирующие агенты, такие как EDTA; сахарные спирты, такие как маннитол или сорбитол; солеобразующие противоионы, такие как натрий; и/или неионные поверхностно-активные вещества, такие как TWEENTM, полиэтиленгликоль (PEG) и PLURONICSTM.
«Малая молекула» определяется в данном документе как имеющая молекулярную массу ниже около 500 дальтон.
Способы осуществления изобретения
Получение и идентификация антагонистов активности TSPAN12 или норрина
Для идентификации соединений, которые связываются или образуют комплекс с полипептидами TSPAN12 или норрина или иным образом влияют на их активность и/или взаимодействие с другими клеточными белками, разрабатывают скрининговые анализы на кандидатные лекарственные средства-антагонисты.
В качестве антагонистов TSPAN12 или норрина могут действовать малые молекулы и, таким образом, быть терапевтически используемыми. К таким малым молекулам могут относиться природные малые молекулы, синтетические органические или неорганические соединения и пептиды. Тем не менее, малые молекулы по настоящему изобретению не ограничиваются этими формами. Обширные библиотеки малых молекул коммерчески доступны, и для скрининга этих молекул в отношении желаемой активности в данном документе представлен или хорошо известен в данной области широкий спектр анализов.
В некоторых вариантах осуществления малые молекулы-антагонисты TSPAN12 или норрина идентифицируют по их способности ингибировать одну или несколько биологических активностей TSPAN12 или норрина. Таким образом, кандидатное соединение приводят в контакт с TSPAN12 или норрином и затем анализируют биологическую активность TSPAN12 или норрина. В одном из вариантов осуществления оценивают способность TSPAN12 или норрина трансдуцировать или инициировать передачу сигнала, опосредованную норрином. При ингибировании биологической активности TSPAN12 или норрина соединение идентифицируют как антагониста.
Соединения, идентифицированные в качестве антагонистов TSPAN12 или норрина, могут быть использованы в способах по настоящему изобретению. Например, антагонисты TSPAN12 или норрина могут быть использованы для лечения внутриглазного неоваскулярного заболевания.
Для дальнейшего понимания значения TSPAN12 или норрина в развитии и патогенезе внутриглазного неоваскулярного заболевания и тестирования эффективности кандидатных терапевтических агентов, включающих антитела и другие антагонисты нативных полипептидов TSPAN12 или норрина, такие как малые молекулы-антагонисты, может быть использовано большое число хорошо известных моделей животных (включая, например, модели ретинопатии недоношенных и индуцированную лазером хориоидальную неоваскуляризацию; Ruiz-Edera & Verkman Invest. Ophthalmol. & Vis. Sci. 48(10): 4802-10 (2007), Yu et al. Invest. Ophthalmol. & Vis. Sci. 49(6): 2599-605 (2007)). In vivo природа таких моделей делает их особенно предсказуемыми в отношении ответов у пациентов-людей.
Исследования связывания антител
Тестируют способность антител связывать и ингибировать влияние TSPAN12 или норрина на репортерные клетки, передающие сигнал Wnt. Типичные способы представлены в примере 2, но специалисту в данной области будут без труда понятны и другие способы. К типичным антителам относятся поликлональные, моноклональные, гуманизированные, биспецифические и гетероконъюгированные антитела, получение которых описано в данном документе.
Исследования связывания антител могут быть осуществлены любым известным способом анализа, таким как анализы конкурентного связывания, прямые и непрямые сэндвич-анализы и анализы иммунопреципитации. Zola, Monoclonal Antibodies: A Manual of Techniques (CRC Press, Inc., 1987), pp.147-158.
Анализы конкурентного связывания основаны на способности меченого стандарта конкурировать с аналитом испытываемого образца за связывание с ограниченным количеством антитела. Количество белка-мишени в испытываемом образце обратно пропорционально количеству стандарта, который становится связанным с антителами. Для содействия определению количества стандарта, становящегося связанным, предпочтительно понижают растворимость антител до или после конкуренции, так что стандарт и аналит, которые связываются с антителами, можно удобно отделить от стандарта и аналита, которые остаются несвязанными.
Сэндвич-анализы включают в себя применение двух антител, каждое из которых способно связываться с отличным иммуногенным участком, или эпитопом, детектируемого белка. В сэндвич-анализе аналит испытываемого образца связывается первичным антителом, которое иммобилизуют на твердой подложке, и после этого вторичное антитело связывается с аналитом, таким образом формируя нерастворимый комплекс, состоящий из трех частей. См., например, патент США 4376110. Вторичное антитело само может являться меченным с помощью детектируемого фрагмента (прямые сэндвич-анализы) или его можно измерить, используя антитело против иммуноглобулина, которое метят с помощью детектируемого фрагмента (непрямой сэндвич-анализ). Например, один из видов сэндвич-анализа представляет собой анализ ELISA, в этом случае детектируемый фрагмент представляет собой фермент.
Для иммуногистохимии образец ткани может быть свежим или замороженным или может быть залит в парафин и фиксирован с помощью консерванта, такого как формалин.
К соединениям, используемым в лечении сердечно-сосудистых, эндотелиальных и ангиогенных расстройств, относятся, без ограничения, антитела, малые органические и неорганические молекулы, пептиды, фосфопептиды, антисмысловая, малая интерферирующая РНК и молекулы рибозимов, трехспиральные молекулы и т.д., которые ингибируют экспрессию и/или активность генного продукта-мишени.
К более конкретным примерам потенциальных антагонистов относятся полипептид, который связывается с TSPAN12 или норрином, и, в частности, антитела, включая, без ограничения, поли- и моноклональные антитела и фрагменты антител, одноцепочечные антитела, антиидиотипические антитела и химерные или гуманизированные варианты таких антител или фрагментов, а также антитела и фрагменты антител человека. В отношении TSPAN12 в качестве антагонистов также может(гут) служить некоторый(е) внеклеточный(е) домен(ы) (см., например, статьи Ho et al. J. Virol. 80(13): 6487-96 (2006); Hemler Nature Rev. Drug Discovery 7: 747-58 (2008)). Альтернативно, потенциальный антагонист может представлять собой близкородственный белок, например, мутированную форму TSPAN12 или норрина, которая взаимодействует с корецептором(ами), но без эффекта, таким образом, конкурентно ингибируя действие TSPAN12 или норрина.
Другой потенциальный антагонист TSPAN12 или норрина представляет собой конструкцию антисмысловой РНК или ДНК, полученную, используя антисенс-технологию, где, например, молекула антисмысловой РНК или ДНК непосредственно блокирует трансляцию мРНК за счет гибридизации с мРНК-мишенью и предотвращения трансляции белка. Антисенс-технология может быть использована для контролирования экспрессии гена через образование