Антитело против nr10 и его применение
Иллюстрации
Показать всеНастоящее изобретение относится к области иммунологии. Предложены варианты антител против NR10 человека или яванского макака, в том числе гуманизированные. Описан способ лечения или профилактики воспалительного заболевания, опосредованного сверхэкспрессией IL-31, и способ получения антитела против NR10 с нейтрализующей активностью - с использованием указанных антител, а также: использование антитела для получения терапевтического средства против воспалительного заболевания, опосредованного сверхэкспрессией IL-31. Использование изобретения обеспечивает антитела с высокой нейтрализующей активностью NR10 как против NR10 человека, так и против NR10 яванского макака, что может найти применение в медицине как для лечения воспалительных заболеваний, связанных с повышенной экспрессией NR10, так и для получения лекарства против таких заболеваний. 8 н.п. ф-лы, 29 ил., 19 табл., 23 пр.
Реферат
Техническая область
Настоящее изобретение относится к антителам против NR10 и к фармацевтическим композициям, содержащим антитело против NR10.
Уровень техники
Многие цитокины известны в качестве гуморальных факторов, вовлеченных в рост и дифференцировку различных типов клеток, или в активацию функций дифференцированных зрелых клеток. Стимулированные цитокинами клетки продуцируют различные типы цитокинов, тем самым образуя в организме сети из множества цитокинов. Биологический гомеостаз поддерживается посредством тонкого равновесия взаимной регуляции цитокинов в этих сетях. Полагают, что многие воспалительные заболевания являются следствием нарушений в таких цитокиновых сетях. Таким образом, значительное внимание привлекает терапия на основе моноклональных антител. Например, было показано, что антитела против TNF и антитела против рецептора для IL-6 являются клинически высоко эффективными. С другой стороны, существует множество примеров неуспеха, когда отсутствуют терапевтические эффекты, если блокируют только один цитокин, такой как IL-4, вследствие активации компенсаторных каскадов при конкретных патологических состояниях.
Авторы настоящего изобретения добились успеха в выделении нового рецептора цитокинов NR10, который является высоко гомологичным gp130, рецептору для передачи сигнала IL-6 (патентный документ 1). NR10 образует гетеродимер с рецептором онкостатина M (OSMR) и функционирует в качестве рецептора IL-31 (непатентный документ 1). В отношении IL-31, было описано, что у трансгенных мышей, сверхэкспрессирующих IL-31, самопроизвольно развивается дерматит с зудом (патентный документ 2).
Антитела, которые связываются с NR10 и ингибируют связывание между NR10 и IL-31, могут быть эффективными в отношении лечения воспалительных заболеваний. Для клинического применения требуется, чтобы антитела против NR10 имели низкую иммуногенность. Более того, для достижения высоких терапевтических эффектов, желательными являются антитела с сильной связывающей или нейтрализующей активностью в отношении NR10.
Документы уровня техники для настоящего изобретения представлены ниже.
Патентный документ 1: WO00/75314.
Патентный документ 2: WO03/060090.
Непатентный документ 1: IL-31 is associated with cutaneous lymphocyte antigen-positive skin homing T cells in patients with atopic dermatitis., J Allergy Clin Immunol. 2006 Feb; 117(2): 418-25.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Проблемы, решаемые изобретением
Ввиду обстоятельств, описанных выше, было выполнено настоящее изобретение. Задачей настоящего изобретения является предоставление антитела против NR10 и фармацевтических композиций, содержащих антитело против NR10.
Средства для решения проблем
Авторы настоящего изобретения провели специализированные исследования для выполнения задачи, описанной выше. Авторы настоящего изобретения добились успеха в получении антител против NR10, имеющих эффективную нейтрализующую активность против NR10. Более того, авторы настоящего изобретения добились успеха в гуманизации антител при сохранении их активности. Также авторы настоящего изобретения успешно продуцировали антитела с улучшенной фармакокинетикой, усиленной антигенсвязывающей активностью, повышенной стабильностью и/или сниженным риском иммуногенности. Эти антитела пригодны в качестве терапевтических средств от воспалительных заболеваний.
Настоящее изобретение относится к антителам против NR10, и фармацевтическим композициям, содержащим антитело против NR10. Более конкретно, настоящее изобретение включает:
[1] антитело, которое распознает домен 1 NR10;
[2] антитело согласно [1], которое обладает нейтрализующей активностью;
[3] антитело согласно [1] или [2], которое представляет собой гуманизированное антитело;
[4] антитело против NR10, которое представляет собой любое из:
(1) антитело, содержащее вариабельную область тяжелой цепи, которая содержит CDR1, содержащую аминокислотную последовательность SEQ ID NO: 1, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 2, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 3;
(2) антитело, содержащее вариабельную область тяжелой цепи SEQ ID NO: 4;
(3) антитело, содержащее вариабельную область легкой цепи, которая содержит CDR1, содержащую аминокислотную последовательность SEQ ID NO: 5, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 6, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 7;
(4) антитело, содержащее вариабельную область легкой цепи SEQ ID NO: 8;
(5) антитело, содержащее вариабельную область тяжелой цепи (1) и вариабельную область легкой цепи (3);
(6) антитело, содержащее вариабельную область тяжелой цепи (2) и вариабельную область легкой цепи (4);
(7) антитело, где одна или более аминокислот заменены, удалены, добавлены и/или вставлены в антитело согласно любому из (1)-(6), которое обладает активностью, эквивалентной активности антитела согласно любому из (1)-(6); и
(8) антитело, которое связывается с тем же эпитопом, с которым связывается антитело согласно любому из (1)-(7);
[5] антитело против NR10, которое представляет собой любое из:
(1) антитело, содержащее вариабельную область тяжелой цепи, которая содержит CDR1, содержащую аминокислотную последовательность SEQ ID NO: 9, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 10, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 11;
(2) антитело, содержащее вариабельную область тяжелой цепи SEQ ID NO: 12;
(3) антитело, содержащее вариабельную область легкой цепи, которая содержит CDR1, содержащую аминокислотную последовательность SEQ ID NO: 13, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 14, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 15;
(4) антитело, содержащее вариабельную область легкой цепи SEQ ID NO: 16;
(5) антитело, содержащее вариабельную область тяжелой цепи (1) и вариабельную область легкой цепи (3);
(6) антитело, содержащее вариабельную область тяжелой цепи (2) и вариабельную область легкой цепи (4);
(7) антитело, где одна или более аминокислот заменены, удалены, добавлены и/или вставлены в антитело согласно любому из (1)-(6), которое обладает активностью, эквивалентной активности антитела согласно любому из (1)-(6); и
(8) антитело, которое связывается с тем же эпитопом, с которым связывается антитело согласно любому из (1)-(7);
[6] антитело против NR10, которое представляет собой любое из:
(1) антитело, содержащее вариабельную область тяжелой цепи, которая содержит CDR1, содержащую аминокислотную последовательность SEQ ID NO: 17, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 18, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 19;
(2) антитело, содержащее вариабельную область тяжелой цепи SEQ ID NO: 20;
(3) антитело, содержащее вариабельную область легкой цепи, которая содержит CDR1, содержащую аминокислотную последовательность SEQ ID NO: 21, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 22, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 23;
(4) антитело, содержащее вариабельную область легкой цепи SEQ ID NO: 24;
(5) антитело, содержащее вариабельную область тяжелой цепи (1) и вариабельную область легкой цепи (3);
(6) антитело, содержащее вариабельную область тяжелой цепи (2) и вариабельную область легкой цепи (4);
(7) антитело, где одна или более аминокислот заменены, удалены, добавлены и/или вставлены в антитело согласно любому из (1)-(6), которое обладает активностью, эквивалентной активности антитела согласно любому из (1)-(6); и
(8) антитело, которое связывается с тем же эпитопом, с которым связывается антитело согласно любому из (1)-(7);
[7] антитело против NR10, которое представляет собой любое из:
(1) антитело, содержащее вариабельную область тяжелой цепи, которая содержит CDR1, содержащую аминокислотную последовательность SEQ ID NO: 25, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 26, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 27;
(2) антитело, содержащее вариабельную область тяжелой цепи SEQ ID NO: 28;
(3) антитело, содержащее вариабельную область легкой цепи, которая содержит CDR1, содержащую аминокислотную последовательность SEQ ID NO: 29, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 30, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 31;
(4) антитело, содержащее вариабельную область легкой цепи SEQ ID NO: 32;
(5) антитело, содержащее вариабельную область тяжелой цепи (1) и вариабельную область легкой цепи (3);
(6) антитело, содержащее вариабельную область тяжелой цепи (2) и вариабельную область легкой цепи (4);
(7) антитело, где одна или более аминокислот заменены, удалены, добавлены и/или вставлены в антитело согласно любому из (1)-(6), которое обладает активностью, эквивалентной активности антитела согласно любому из (1)-(6); и
(8) антитело, которое связывается с тем же эпитопом, с которым связывается антитело согласно любому из (1)-(7);
[8] антитело или вариабельная область антитела, которые представляют собой любое из:
(1) вариабельная область тяжелой цепи, содержащая CDR1 с SEQ ID NO: 196, CDR2 с SEQ ID NO: 197, и CDR3 с SEQ ID NO: 11 (H17);
(2) вариабельная область тяжелой цепи, содержащая CDR1 с SEQ ID NO: 176, CDR2 с SEQ ID NO: 197, и CDR3 с SEQ ID NO: 11 (H19);
(3) вариабельная область тяжелой цепи, содержащая CDR1 с SEQ ID NO: 196, CDR2 с SEQ ID NO: 197, и CDR3 с SEQ ID NO: 184 (H28, H42);
(4) вариабельная область тяжелой цепи, содержащая CDR1 с SEQ ID NO: 9, CDR2 с SEQ ID NO: 197, и CDR3 с SEQ ID NO: 184 (H30, H44);
(5) вариабельная область тяжелой цепи, содержащая CDR1 с SEQ ID NO: 176, CDR2 с SEQ ID NO: 197, CDR3 с SEQ ID NO: 184 (H34, H46);
(6) вариабельная область тяжелой цепи, содержащая CDR1 с SEQ ID NO: 9, CDR2 с SEQ ID NO: 198, и CDR3 с SEQ ID NO: 184 (H57, H78);
(7) вариабельная область тяжелой цепи, содержащая CDR1 с SEQ ID NO: 176, CDR2 с SEQ ID NO: 198, и CDR3 с SEQ ID NO: 184 (H71, H92);
(8) вариабельная область тяжелой цепи, содержащая CDR1 с SEQ ID NO: 9, CDR2 с SEQ ID NO: 199, и CDR3 с SEQ ID NO: 184 (H97, H98);
(9) вариабельная область легкой цепи, содержащая CDR1 с SEQ ID NO: 200, CDR2 с SEQ ID NO: 170, и CDR3 с SEQ ID NO: 193 (L11);
(10) вариабельная область легкой цепи, содержащая CDR1 с SEQ ID NO: 201, CDR2 с SEQ ID NO: 170, и CDR3 с SEQ ID NO: 193 (L12);
(11) вариабельная область легкой цепи, содержащая CDR1 с SEQ ID NO: 202, CDR2 с SEQ ID NO: 170, и CDR3 с SEQ ID NO: 193 (L17);
(12) вариабельная область легкой цепи, содержащая CDR1 с SEQ ID NO: 203, CDR2 с SEQ ID NO: 170, и CDR3 с SEQ ID NO: 193 (L50);
(13) антитело, содержащее вариабельную область тяжелой цепи (3) и вариабельную область легкой цепи (11);
(14) антитело, содержащее вариабельную область тяжелой цепи (4) и вариабельную область легкой цепи (11);
(15) антитело, содержащее вариабельную область тяжелой цепи (5) и вариабельную область легкой цепи (11);
(16) антитело, содержащее вариабельную область тяжелой цепи (6) и вариабельную область легкой цепи (11);
(17) антитело, содержащее вариабельную область тяжелой цепи (7) и вариабельную область легкой цепи (11);
(18) антитело, содержащее вариабельную область тяжелой цепи (8) и вариабельную область легкой цепи (12);
(19) антитело, где одна или более аминокислот заменены, удалены, добавлены и/или вставлены в антитело согласно любому из (13)-(18), которое обладает активностью, эквивалентной активности антитела согласно любому из (13)-(18); и
(20) антитело, которое связывается с тем же эпитопом, с которым связывается антитело согласно любому из (13)-(18);
[9] антитело или вариабельная область антитела, которые представляют собой любое из:
(1) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность SEQ ID NO: 204 (H17);
(2) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность SEQ ID NO: 205 (H19);
(3) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность SEQ ID NO: 206 (H28);
(4) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность SEQ ID NO: 207 (H30);
(5) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность SEQ ID NO: 208 (H34),
(6) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность SEQ ID NO: 209 (H42);
(7) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность SEQ ID NO: 210 (H44);
(8) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность SEQ ID NO: 211 (H46);
(9) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность SEQ ID NO: 212 (H57);
(10) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность SEQ ID NO: 213 (H71);
(11) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность SEQ ID NO: 214 (H78);
(12) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность SEQ ID NO: 215 (H92);
(13) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность SEQ ID NO: 216 (H97);
(14) вариабельная область тяжелой цепи, содержащая аминокислотную последовательность SEQ ID NO: 217 (H98);
(15) вариабельная область легкой цепи, содержащая аминокислотную последовательность SEQ ID NO: 218 (L11);
(16) вариабельная область легкой цепи, содержащая аминокислотную последовательность SEQ ID NO: 219 (L12);
(17) вариабельная область легкой цепи, содержащая аминокислотную последовательность SEQ ID NO: 220 (L17);
(18) вариабельная область легкой цепи, содержащая аминокислотную последовательность SEQ ID NO: 221 (L50);
(19) антитело, содержащее вариабельную область тяжелой цепи (3) и вариабельную область легкой цепи (17) (H28L17);
(20) антитело, содержащее вариабельную область тяжелой цепи (4) и вариабельную область легкой цепи (17) (H30L17);
(21) антитело, содержащее вариабельную область тяжелой цепи (5) и вариабельную область легкой цепи (17) (H34L17);
(22) антитело, содержащее вариабельную область тяжелой цепи (6) и вариабельную область легкой цепи (17) (H42L17);
(23) антитело, содержащее вариабельную область тяжелой цепи (7) и вариабельную область легкой цепи (17) (H44L17);
(24) антитело, содержащее вариабельную область тяжелой цепи (8) и вариабельную область легкой цепи (17) (H46L17);
(25) антитело, содержащее вариабельную область тяжелой цепи (9) и вариабельную область легкой цепи (17) (H57L17);
(26) антитело, содержащее вариабельную область тяжелой цепи (10) и вариабельную область легкой цепи (17) (H71L17);
(27) антитело, содержащее вариабельную область тяжелой цепи (11) и вариабельную область легкой цепи (17) (H78L17);
(28) антитело, содержащее вариабельную область тяжелой цепи (12) и вариабельную область легкой цепи (17) (H92L17);
(29) антитело, содержащее вариабельную область тяжелой цепи (13) и вариабельную область легкой цепи (18) (H97L50);
(30) антитело, содержащее вариабельную область тяжелой цепи (14) и вариабельную область легкой цепи (18) (H98L50),
(31) антитело, где одна или более аминокислот заменены, удалены, добавлены и/или вставлены в антитело согласно любому из (19)-(30), которое обладает активностью, эквивалентной активности антитела согласно любому из (19)-(30); и
(32) антитело, которое связывается с тем же эпитопом, с которым связывается антитело согласно любому из (19)-(30);
[10] антитело против NR10 согласно любому из [4]-[9], которое представляет собой гуманизированное антитело;
[11] антитело, тяжелая цепь антитела, или легкая цепь антитела, которые представляют собой любое из:
(1) тяжелая цепь, содержащая аминокислотную последовательность SEQ ID NO: 222 (H17);
(2) тяжелая цепь, содержащая аминокислотную последовательность SEQ ID NO: 223 (H19);
(3) тяжелая цепь, содержащая аминокислотную последовательность SEQ ID NO: 224 (H28);
(4) тяжелая цепь, содержащая аминокислотную последовательность SEQ ID NO: 225 (H30);
(5) тяжелая цепь, содержащая аминокислотную последовательность SEQ ID NO: 226 (H34);
(6) тяжелая цепь, содержащая аминокислотную последовательность SEQ ID NO: 227 (H42);
(7) тяжелая цепь, содержащая аминокислотную последовательность SEQ ID NO: 228 (H44);
(8) тяжелая цепь, содержащая аминокислотную последовательность SEQ ID NO: 229 (H46);
(9) тяжелая цепь, содержащая аминокислотную последовательность SEQ ID NO: 230 (H57);
(10) тяжелая цепь, содержащая аминокислотную последовательность SEQ ID NO: 231 (H71);
(11) тяжелая цепь, содержащая аминокислотную последовательность SEQ ID NO: 232 (H78);
(12) тяжелая цепь, содержащая аминокислотную последовательность SEQ ID NO: 233 (H92);
(13) тяжелая цепь, содержащая аминокислотную последовательность SEQ ID NO: 234 (H97);
(14) тяжелая цепь, содержащая аминокислотную последовательность SEQ ID NO: 235 (H98);
(15) легкая цепь, содержащая аминокислотную последовательность SEQ ID NO: 236 (L11);
(16) легкая цепь, содержащая аминокислотную последовательность SEQ ID NO: 237 (L12);
(17) легкая цепь, содержащая аминокислотную последовательность SEQ ID NO: 238 (L17);
(18) легкая цепь, содержащая аминокислотную последовательность SEQ ID NO: 239 (L50);
(19) антитело, содержащее тяжелую цепь (3) и легкую цепь (17) (H28L17);
(20) антитело, содержащее тяжелую цепь (4) и легкую цепь (17) (H30L17);
(21) антитело, содержащее тяжелую цепь (5) и легкую цепь (17) (H34L17);
(22) антитело, содержащее тяжелую цепь (6) и легкую цепь (17) (H42L17);
(23) антитело, содержащее тяжелую цепь (7) и легкую цепь (17) (H44L17);
(24) антитело, содержащее тяжелую цепь (8) и легкую цепь (17) (H46L17);
(25) антитело, содержащее тяжелую цепь (9) и легкую цепь (17) (H57L17);
(26) антитело, содержащее тяжелую цепь (10) и легкую цепь (17) (H71L17);
(27) антитело, содержащее тяжелую цепь (11) и легкую цепь (17) (H78L17);
(28) антитело, содержащее тяжелую цепь (12) и легкую цепь (17) (H92L17);
(29) антитело, содержащее тяжелую цепь (13) и легкую цепь (18) (H97L50);
(30) антитело, содержащее тяжелую цепь (14) и легкую цепь (18) (H98L50);
(31) антитело, где одна или более аминокислот заменены, удалены, добавлены и/или вставлены в антитело согласно любому из (19)-(30), которое обладает активностью, эквивалентной активности антитела согласно любому из (19)-(30); и
(32) антитело, которое связывается с тем же эпитопом, с которым связывается антитело согласно любому из (19)-(30);
[12] фармацевтическая композиция, содержащая антитело согласно любому из [1]-[11];
[13] фармацевтический композиция согласно [12], которая представляет собой средство для лечения воспалительного заболевания;
[14] способ лечения или профилактики воспалительного заболевания, который включает стадию введения антитела согласно любому из [1]-[11]; и
[15] применение антитела согласно любому из [1]-[11] для изготовления терапевтического средства против воспалительного заболевания.
Краткое описание фигур
На фиг. 1 представлены аминокислотные последовательности вариабельных областей тяжелых цепей антител мыши NS18, NS22, NS23 и NS33.
На фиг. 2 представлены аминокислотные последовательности вариабельных областей легких цепей антител мыши NS18, NS22, NS23 и NS33.
На фиг. 3 представлен график, на котором показано ингибирование роста клеток hNR10/hOSMR/BaF3 супернатантами клеточных культур.
На фиг. 4 представлен график, на котором показано ингибирование роста клеток cynNR10/cynOSMR/BaF3 супернатантами клеточных культур.
На фиг. 5 представлен график, на котором показана оценка активности химерного NS22 (BaF).
На фиг. 6 представлен график, на котором показана оценка активности химерного NS22 (DU-145).
На фиг. 7 представлен график, на котором показана оценка конкуренции химерного NS22 с IL-31.
На фиг. 8 представлен график, на котором показана конкурентная активность антитела против NR10 в отношении связывания NR10.
На фиг. 9 представлен набор графиков, на которых показана оценка конкуренции гуманизированного NS22 (H0L0) с IL-31.
На фиг. 10 представлен эффект константной области гуманизированного антитела против NR10 H0L0 на гетерогенность, оцененный катионообменной хроматографией.
На фиг. 11 представлен набор графиков, на котором показана оценка конкуренции мутантов гуманизированного антитела против NR10, изоэлектрическая точка вариабельных областей которых снижена без существенного снижения связывания NR10, с IL-31.
На фиг. 12 представлен эффект константной области антитела против рецептора IL-6 на гетерогенность, оцененный катионообменной хроматографией.
На фиг. 13 представлен эффект константной области антитела против рецептора IL-6 на пик денатурации, оцененный посредством DSC.
На фиг. 14 представлен эффект новой константной области M14 на гетерогенность в антителе против рецептора IL-6, оцененный катионообменной хроматографией.
На фиг. 15 представлен эффект новой константной области M58 на гетерогенность в антителе против рецептора IL-6, оцененный катионообменной хроматографией.
На фиг. 16 представлен эффект новой константной области M58 на пик денатурации в антителе против рецептора IL-6, оцененный посредством DSC.
На фиг. 17 представлен результат оценки удержания huPM1-IgG1 и huPM1-M58 в плазме трансгенных мышей с FcRn человека.
На фиг. 18 представлена биологическая активность каждого антитела, оцененная с использованием BaF/NR10.
На фиг. 19 представлен анализ катионообменной хроматографией образцов с термическим ускорением (пунктирная линия) и без ускорения (сплошная линия) для каждого модифицированного антитела для сравнения образования продуктов деградации до и после термического ускорения. Стрелками указано положение пика основного компонента, который был изменен.
На фиг. 20 представлен набор графиков, на которых показана оценка (BaF) активности каждого варианта.
На фиг. 21 представлен график, на котором показана оценка (BaF) активности Ha401La402 и H0L0.
На фиг. 22 представлен график, на котором показана оценка (BaF) активности H17L11 и H0L0.
На фиг. 23 представлен график, на котором показана оценка (BaF) активности H19L12 и H0L0.
На фиг. 24 представлен график, на котором показана биологическая активность H0L12 и H0L17, оцененная с использованием BaF/NR10.
На фиг. 25-1 представлен набор графиков, на которых показана оценка (BaF) активности каждого варианта.
На фиг. 25-2 представлено продолжение фиг. 25-1.
На фиг. 26 представлена схематическая диаграмма для NR10-ECD дикого типа человека/мыши и химерного NR10-ECD.
На фиг. 27 представлен набор фотографий, на которых показана детекция связывающего домена вестерн-блоттингом. A представляет собой фотографию, на которой показан результат детекции с использованием гуманизированного антитела против NR10 человека; B представляет собой фотографию, на которой показан результат детекции с использованием антитела мыши против NR10 человека; и C представляет собой фотографию, на которой показан результат детекции с использованием антитела против Myc. В случае антитела против NR10 человека, связывание антигена было выявлено только у hhh, hhm и hmm, но не у mmm, mmh и mhm.
На фиг. 28-1 представлена аминокислотная последовательность каждого варианта H0 (SEQ ID NO: 50).
На фиг. 28-2 представлено продолжение фиг. 28-1.
На фиг. 28-3 представлено продолжение фиг. 28-2.
На фиг. 29-1 представлена аминокислотная последовательность каждого варианта L0 (SEQ ID NO: 52).
На фиг. 29-2 представлено продолжение фиг. 29-1.
Способ осуществления изобретения
NR10
NR10 представляет собой белок, который образует гетеродимер с рецептором онкостатина M (OSMR) и функционирует в качестве рецептора IL-31. NR10 также известен как glm-r (J Biol Chem 277 16831-6, 2002), GPL (J Biol Chem 278, 49850-9, 2003), IL31RA (Nat Immunol 5, 752-60, 2004), и т.п. Таким образом, NR10 в настоящем изобретении также включает белки, имеющие такие названия.
В настоящем изобретении, NR10 (также называемый IL31RA, GPL или glm-r) конкретно не ограничен с точки зрения его происхождения, и он включает молекулы, происходящие из человека, мышей, обезьян и других млекопитающих. NR10, происходящий из человека, мышей и обезьян, является предпочтительным, и особенно предпочтительным является NR10, происходящий из человека.
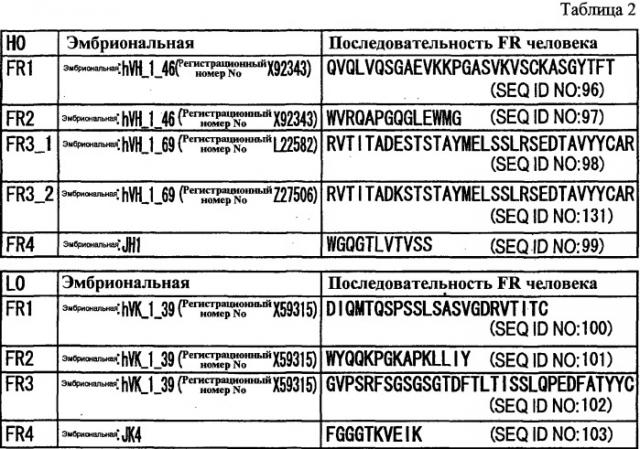
Существует множество известных вариантов по сплайсингу происходящего из человека NR10 (WO 00/075314). Среди указанных выше вариантов по сплайсингу, NR10.1 состоит из 662 аминокислот и содержит трансмембранный домен. NR10.2 представляет собой растворимый подобный рецептору белок, состоящий из 252 аминокислот, без трансмембранного домена. При этом известные варианты по сплайсингу NR10, которые функционируют в качестве трансмембранных рецепторных белков, включают NR10.3 и IL-31RAv3. NR10 человека по настоящему изобретению конкретно не ограничен, при условии, что он образует гетеродимер с рецептором онкостатина M (OSMR) и функционирует в качестве рецептора IL-31. Предпочтительный NR10 включает NR10.3 (также называемый ILRAv4 (Nat Immunol 5, 752-60, 2004)) и IL-31RAv3. NR 10.3 (IL31RAv4) состоит из 662 аминокислот (WO 00/075314; Nat Immunol 5, 752-60, 2004) и IL31RAv3 состоит из 732 аминокислот (регистрационный номер GenBank No: NM_139017). Аминокислотная последовательность IL31RAv4 представлена в SEQ ID NO: 79, и аминокислотная последовательность IL31RAv3 представлена в SEQ ID NO: 80. При этом происходящий из мыши NR10 включает белки, содержащие аминокислотную последовательность SEQ ID NO: 81. Кроме того, происходящий из яванского макака NR10 включает белки, содержащие аминокислотную последовательность SEQ ID NO: 66.
Антитела (последовательности)
Предпочтительные варианты осуществления антитела против NR10 по настоящему изобретению включают антитела против NR10 согласно любому из (1)-(8) в (A)-(D), ниже.
(A) NS18
(1) антитела, имеющие вариабельную область тяжелой цепи, которая содержит CDR1, имеющую аминокислотную последовательность SEQ ID NO: 1 (HCDR1), CDR2, имеющую аминокислотную последовательность SEQ ID NO: 2 (HCDR2), и CDR3, имеющую аминокислотную последовательность SEQ ID NO: 3 (HCDR3);
(2) антитела, имеющие вариабельную область тяжелой цепи SEQ ID NO: 4 (VH);
(3) антитела, имеющие вариабельную область легкой цепи, которая содержит CDR1, имеющую аминокислотную последовательность SEQ ID NO: 5 (LCDR1), CDR2, имеющую аминокислотную последовательность SEQ ID NO: 6 (LCDR2), и CDR3, имеющую аминокислотную последовательность SEQ ID NO: 7 (LCDR3);
(4) антитела, имеющие вариабельную область легкой цепи SEQ ID NO: 8 (VL);
(5) антитела, имеющие вариабельную область тяжелой цепи (1) и вариабельную область легкой цепи (3);
(6) антитела, имеющие вариабельную область тяжелой цепи (2) и вариабельную область легкой цепи (4);
(7) антитела, где одна или более аминокислот заменены, удалены, добавлены и/или вставлены в антитела согласно любому из (1)-(6), которые имеют активность, эквивалентную активности антител согласно любому из (1)-(6); и
(8) антитела, которые связываются с тем же эпитопом, с которым связываются антитела согласно любому из (1)-(7).
(B) NS22
(1) антитела, имеющие вариабельную область тяжелой цепи, которая содержит CDR1, имеющую аминокислотную последовательность SEQ ID NO: 9 (HCDR1), CDR2, имеющую аминокислотную последовательность SEQ ID NO: 10 (HCDR2), и CDR3, имеющую аминокислотную последовательность SEQ ID NO: 11 (HCDR3);
(2) антитела, имеющие вариабельную область тяжелой цепи SEQ ID NO: 12 (VH);
(3) антитела, имеющие вариабельную область легкой цепи, которая содержит CDR1, имеющую аминокислотную последовательность SEQ ID NO: 13 (LCDR1), CDR2, имеющую аминокислотную последовательность SEQ ID NO: 14 (LCDR2), и CDR3, имеющую аминокислотную последовательность SEQ ID NO: 15 (LCDR3);
(4) антитела, имеющие вариабельную область легкой цепи SEQ ID NO: 16 (VL);
(5) антитела, имеющие вариабельную область тяжелой цепи (1) и вариабельную область легкой цепи (3);
(6) антитела, имеющие вариабельную область тяжелой цепи (2) и вариабельную область легкой цепи (4);
(7) антитела, где одна или более аминокислот заменены, удалены, добавлены и/или вставлены в антитела согласно любому из (1)-(6), которые имеют активность, эквивалентную активности антител согласно любому из (1)-(6); и
(8) антитела, которые связываются с тем же эпитопом, с которым связываются антитела согласно любому из (1)-(7).
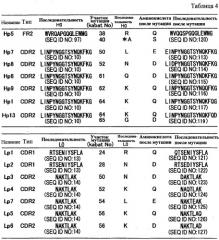
Конкретные примеры описанных выше замены, делеции, добавления и/или вставки одной или более аминокислот, конкретно не ограничены, и включают, например, следующие модификации.
Замена Ile в положении 3 в CDR1 тяжелой цепи с SEQ ID NO: 9 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Val.
Замена Met в положении 4 в CDR1 тяжелой цепи с SEQ ID NO: 9 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Ile.
Замена Met в положении 4 в CDR1 тяжелой цепи с SEQ ID NO: 9 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Leu.
Замена Ile в положении 3 в CDR1 тяжелой цепи с SEQ ID NO: 9 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Ala.
Замена Leu в положении 1 в CDR2 тяжелой цепи с SEQ ID NO: 10 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Glu.
Замена Asn в положении 3 в CDR2 тяжелой цепи с SEQ ID NO: 10 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Asp.
Замена Gln в положении 13 в CDR2 тяжелой цепи с SEQ ID NO: 10 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Asp.
Замена Lys в положении 14 в CDR2 тяжелой цепи с SEQ ID NO: 10 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Gln.
Замена Lys в положении 16 в CDR2 тяжелой цепи с SEQ ID NO: 10 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Gln.
Замена Gly в положении 17 в CDR2 тяжелой цепи с SEQ ID NO: 10 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Asp.
Замена Lys и Gly в положениях 16 и 17, соответственно, в CDR2 тяжелой цепи с SEQ ID NO: 10 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но предпочтительные примеры включают замену Lys в положении 16 на Gln, и Gly в положении 17 на Asp.
Замена Lys, Lys и Gly в положениях 14, 16 и 17, соответственно, в CDR2 тяжелой цепи с SEQ ID NO: 10 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но предпочтительные примеры включают замену Lys в положении 14 на Gln, Lys в положении 16 на Gln, и Gly в положении 17 на Asp.
Замена Gln, Lys, Lys и Gly в положениях 13, 14, 16 и 17, соответственно, в CDR2 тяжелой цепи с SEQ ID NO: 10 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но предпочтительные примеры включают замену Gln в положении 13 на Asp, Lys в положении 14 на Gln, Lys в положении 16 на Gln, и Gly в положении 17 на Asp.
Замена Ser в положении 10 в CDR2 тяжелой цепи с SEQ ID NO: 10 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Asp.
Замена Gln в положении 13 в CDR2 тяжелой цепи с SEQ ID NO: 10 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Pro.
Замена Tyr в положении 3 в CDR3 тяжелой цепи с SEQ ID NO: 11 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Leu.
Замена Met в положении 10 в CDR3 тяжелой цепи с SEQ ID NO: 11 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Leu.
Замена Asp в положении 11 в CDR3 тяжелой цепи с SEQ ID NO: 11 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Glu.
Замена Tyr в положении 12 в CDR3 тяжелой цепи с SEQ ID NO: 11 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Thr и Ser.
Замена Met, Asp, и Tyr в положениях 10, 11, и 12, соответственно, в CDR3 тяжелой цепи с SEQ ID NO: 11 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но предпочтительные примеры включают замену Met в положении 10 на Leu, Asp в положении 11 на Glu, и Tyr в положении 12 на Thr.
Замена Asp и Tyr в положениях 11 и 12, соответственно, в CDR3 тяжелой цепи с SEQ ID NO: 11 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но предпочтительные примеры включают замену Asp в положении 11 на Glu, и Tyr в положении 12 на Thr.
Замена Tyr, Asp, и Tyr в положениях 3, 11, и 12, соответственно, в CDR3 тяжелой цепи с SEQ ID NO: 11 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но предпочтительные примеры включают замену Tyr в положении 3 на Leu, Asp в положении 11 на Glu, и Tyr в положении 12 на Thr или Ser.
Замена Arg в положении 1 в CDR1 легкой цепи с SEQ ID NO: 13 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Gln.
Замена Asn в положении 5 в CDR1 легкой цепи с SEQ ID NO: 13 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Asp.
Замена Arg и Asn в положениях 1 и 5, соответственно, в CDR1 легкой цепи с SEQ ID NO: 13 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но предпочтительные примеры включают замену Arg в положении 1 на Gln, и Asn в положении 5 на Asp.
Замена Ser в положении 8 в CDR1 легкой цепи с SEQ ID NO: 13 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Arg.
Замена Leu в положении 10 в CDR1 легкой цепи с SEQ ID NO: 13 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Val.
Замена Ser и Leu в положениях 8 и 10, соответственно, в CDR1 легкой цепи с SEQ ID NO: 13 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но предпочтительные примеры включают замену Ser в положении 8 на Arg, и Leu в положении 10 на Val.
Замена Thr в положении 2 в CDR1 легкой цепи с SEQ ID NO: 13 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Ala и Ser.
Замена Asn в положении 1 в CDR2 легкой цепи с SEQ ID NO: 14 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Asp.
Замена Lys в положении 3 в CDR2 легкой цепи с SEQ ID NO: 14 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Gln.
Замена Leu в положении 5 в CDR2 легкой цепи с SEQ ID NO: 14 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Glu.
Замена Lys в положении 7 в CDR2 легкой цепи с SEQ ID NO: 14 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Gln и Asp.
Замена Lys, Leu и Lys в положениях 3, 5, и 7 соответственно, CDR2 легкой цепи с SEQ ID NO: 14 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но предпочтительные примеры включают замену Lys в положении 3 на Gln, Leu в положении 5 на Glu, и Lys в положении 7 на Gln.
Замена Glu в положении 5 в CDR3 легкой цепи с SEQ ID NO: 15 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Asp.
Замена Ser в положении 6 в CDR3 легкой цепи с SEQ ID NO: 15 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Asp.
Замена Thr в положении 9 в CDR3 легкой цепи с SEQ ID NO: 15 другой аминокислотой. Аминокислота после замены конкретно не ограничена, но ее предпочтительные замены включают Phe.
Каждую из указанных выше замен можно проводить отдельно, или можно проводить несколько замен в комбинации. Более того, указанные выше замены можно комбинировать с другими заменами. Эти замены могут улучшить фармакокинетику антитела (время удержания в плазме), усилить антигенсвязывающую активность, повысить стабильность и/или снизить риск иммуногенности.
В настоящем изобретении, конкретные примеры вариабельных областей, имеющих комбинацию указанных выше замен, включают, например, вариабельные области тяжелой цепи, имеющие аминокислотную последовательность SEQ ID NO: 167, и вариабельные области легкой цепи, имеющие аминокислотную последовательность SEQ ID NO: 168. Более того, примеры антител, имеющих комбинацию указанных выше замен, включают, например, антитела, которые содержат вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO: 167, и вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO: 168.
Более того, конкретные примеры вариабельных областей тяжелой или легкой цепи, имеющие комбинацию описанных выше замен, включают, например, следующие вариабельные области:
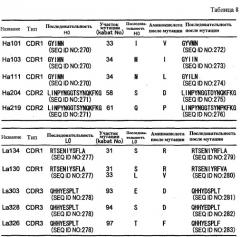
(a) вариабельные области тяжелой цепи, которые содержат CDR1 с SEQ ID NO: 196, CDR2 с SEQ ID NO: 197, и CDR3 с SEQ ID NO: 11 (H17);
(b) вариабельные области тяжелой цепи, которые содержат CDR1 с SEQ ID NO: 176, CDR2 с SEQ ID NO: 197, и CDR3 с SEQ ID NO: 11 (H19);
(c) вариабельные области тяжелой цепи, которые содержат CDR1 с SEQ ID NO: 196, CDR2 с SEQ ID NO: 197, и CDR3 с SEQ ID NO: 184 (H28, H42);
(d) вариабельные области тяжелой цепи, которые содержат CDR1 с SEQ ID NO: 9, CDR2 с SEQ ID NO: 197, и CDR3 с SEQ ID NO: 184 (H30, H44);
(e) вариабельные области тяжелой цепи, которые содержат CDR1 с SEQ ID NO: 176, CDR2 с SEQ ID NO: 197, и CDR3 с SEQ ID NO: 184 (H34, H46);
(f) вариабельные области тяжелой цепи, которые содержат CDR1 с SEQ ID NO: 9, CDR2 с SEQ ID NO: 198, и CDR3 с SEQ ID NO: 184 (H57, H78);
(g) вариабельные области тяжелой цепи, которые содержат CDR1 с SEQ ID NO: 176, CDR2 с SEQ ID NO: 198, и CDR3 с SEQ ID NO: 184 (H71, H92);
(h) вариабельные области тяжелой цепи, которые содержат CDR1 с SEQ ID NO: 9, CDR2 с SEQ ID NO: 199, и CDR3 с SEQ ID NO: 184 (H97,