Антиангиогенная терапия, применяемая для лечения рака молочной железы
Иллюстрации
Показать всеГруппа изобретений относится к способу лечения индивидуума, у которого был диагностирован локально рецидивирующий или метастазирующий рак молочной железы. Для этого индивидууму вводят эффективное количество химиотерапевтического средства и анти-VEGF антитела (бевацизумаб), где химиотерапевтическое средство представляет собой или (а) капецитабин, (b) доцетаксел или Abraxane, (с) или антрациклин, и где анти-VEGF антитело вводится при 15 мг/кг. При этом указанному индивидууму не вводили какое-либо химиотерапевтическое средство для лечения локально рецидивирующего или метастазирующего рака молочной железы, и/или указанный индивидуум не проходил предварительную вспомогательную химиотерапию при рецидиве в течение 12 месяцев или менее после введения последней дозы. Также предложены анти-VEGF антитело, применение анти-VEGF антитела и наборы, содержащие анти-VEGF антитело в комбинации с химиотерапевтическим средством для лечения метастазирующего рака молочной железы. Группа изобретений обеспечивает увеличение продолжительности жизни индивидуума без прогрессирования заболевания. 5 н. и 35 з.п. ф-лы, 6 ил., 5 табл., 1 пр.
Реферат
Родственные заявки
В настоящей заявке испрашивается приоритет и преимущество предварительной заявки на патент США серийный № 61/179307, поданной 18 мая 2009; предварительной заявки на патент США серийный № 61/178009, поданной 13 мая 2009, и предварительной заявки на патент США серийный № 61/117102, поданной 22 ноября 2008, содержание которых вводится в настоящее описание посредством ссылки.
Область, к которой относится изобретение
В общих чертах, настоящее изобретение относится к лечению заболеваний и патологических состояний у человека. Более конкретно, настоящее изобретение относится к антиангиогенной терапии, которая может быть проведена отдельно или в комбинации с другой противораковой терапией, применяемой для лечения рака молочной железы.
Предшествующий уровень техники
Рак является одним из самых опасных заболеваний, угрожающих здоровью человека. Только в США каждый год раком заболевает почти 1,3 миллиона человек, и, по причинам смертности, раковые заболевания занимают второе место после сердечно-сосудистых заболеваний, то есть они являются причиной приблизительно 1 из 4 летальных исходов. Рак молочной железы является второй из наиболее распространенных форм рака и занимает второе место по смертности среди американских женщин. Были также высказаны предположения, что в последующие 5 лет рак может опережать сердечно-сосудистые заболевания по числу летальных исходов. За большинство летальных исходов ответственны солидные опухоли. Хотя в настоящее время наблюдается значительный прогресс в консервативном лечении некоторых видов рака, однако продолжительность жизни для пациентов с любым видом рака обычно составляет 5 лет, а за последние 20 лет, она была увеличена лишь примерно на 10%. Рак или злокачественные опухоли метастазируют и обнаруживают быстрый и неконтролируемый рост, что крайне затрудняет их своевременную диагностику и лечение.
Рак молочной железы является заболеванием, от которого в Соединенных Штатах каждый год умирает много женщин. По оценкам Американского Общества по изучению рака в 2008 году от этого заболевания умерло приблизительно 40000 человек. Ежегодно диагностируется свыше 180000 новых случаев заболевания рака молочной железы, и по оценкам специалистов рак молочной железы развивается у одной из восьми женщин. Полученные результаты показали, что, на сегодняшний день, рак молочной железы является одним из самых опасных заболеваний у женщин.
Обычно метастазирующий рак молочной железы не поддается лечению, и лишь небольшому числу пациентов удается продлить жизнь после проведения стандартной химиотерапии. Greenberg et al., J. Clin. Oncol. 14:2197-2205 (1996).
За последние три десятилетия знания в области фундаментальной биологии рака молочной железы экпоненциально возрастают, и некоторые из них могут найти свое применение в терапии. В многонациональных испытаниях фазы II с открытой меткой, проводимые с участием 222 женщин с HER2-сверхэкспрессирующим метастазирующим раком молочной железы, был получен показатель отклика 15%, причем в шести случаях, где было использовано рекомбинантное гуманизованное моноклональное антитело (трастузумаб, также известный как Herceptin®, Genentech, South San Francisco), направленное против HER2 (Cobleigh et al., Proc. Am. Soc. Clin. Oncol. 17:97 (1998)), был подтвержден полный ответ. Рандомизированное испытание фазы III указывало на безопасность и эффективность добавления герцептина (Herceptin) в химиотерапию первого ряда, проводимую с использованием либо паклитаксела, либо комбинации доксорубицина и циклофосфамида. Общий показатель отклика и время до прогрессирования заболевания значительно увеличивались при проведении химиотерапии с добавлением герцептина по сравнению с указанными параметрами, полученными при проведении только одной химиотерапии (Slamon et al., Proc. Am. Soc. Clin. Oncol. 17:98 (1998)). Еще более важно отметить, что добавление герцептина приводит к увеличению общей продолжительности жизни (Norton et al., Proc. Am. Soc. Clin. Oncol. 18: 127a (1999)).
Хотя трастузумаб представляет собой первое новое биологическое терапевтическое средство, разрешенное для лечения подгруппы пациентов с раком молочной железы, имеющих HER2-сверхэкспрессирующие раковые опухоли, однако были продемонстрированы и другие перспективные подходы, и такие подходы были применены в клинической практике. По оценкам специалистов, 75 процентов женщин, у которых был впервые диагностирован рак молочной железы, являются HER2-негативными. Соединения, ингибирующие ангиогенез, представляют особый интерес с точки зрения их применения для лечения других групп пациентов с раком молочной железы, и такие соединения были и являются объектом клинических испытаний в США и в других странах.
Ангиогенез представляет собой важное событие, при котором происходит пролиферация, аномальное сокращение и реорганизация васкулярных эндотелиальных клеток с образованием новых сосудов из уже существующей сосудистой сети. Существуют неопровержимые данные, указывающие на то, что развитие сосудистой сети является главным событием в нормальных и патологических пролиферативных процессах (Folkman and Klagsbrun Science 235:442-447(1987)). Доставка кислорода и питательных веществ, а также удаление продуктов катаболизма, представляет собой скорость-ограничивающие стадии в большинстве процессов роста опухоли, наблюдающихся у многоклеточных организмов.
Хотя считается, что индуцирование образования новых кровеносных сосудов является доминирующим механизмом опухолевого ангиогенеза, однако последние данные показали, что некоторые опухоли могут расти благодаря кооптации уже существующих кровеносных сосудов хозяина. Затем такая кооптированная сосудистая сеть разрушается, что приводит к регрессии опухоли, которая, в конечном счете, возвращается к своему прежнему состоянию благодаря индуцированному гипоксией ангиогенезу в пограничном участке опухоли. Holash et al. Science 284:1994-1998 (1999).
Одним из ключевых позитивных регуляторов нормального и аномального ангиогенеза является васкулярный эндотелиальный фактор роста (VEGF)-A. VEGF-A является членом семейства генов, включающего VEGF-B, VEGF-C, VEGF-D, VEGF-E, VEGF-F и PlGF. VEGF-A связывается, главным образом, с двумя высокоаффинными тирозинкиназными рецепторами, VEGFR-1 (Flt-1) и VEGFR-2 (Flk-1/KDR), причем последний рецептор является основным передатчиком митотических сигналов VEGF-A в васкулярные эндотелиальные клетки. Кроме того, нейропилин-1 был идентифицирован как рецептор для связывающихся с гепарином изоформ VEGF-A и может играть определенную роль в развитии сосудов.
VEGF, помимо того, что он является ангиогенным фактором, участвующим в ангиогенезе и образовании новых сосудов, также представляет собой плейотропный фактор роста, обладающий множеством биологических свойств в других физиологических процессах, таких как выживание эндотелиальных клеток, сосудистая проницаемость и вазодилатация, хемотаксис моноцитов и приток кальция. Ferrara and Davis-Smyth (1997), см. выше. Кроме того, проводимые исследования выявили митогенное действие VEGF на некоторые неэндотелиальные клетки, такие как пигментные эпителиальные клетки сетчатки, клетки протоков поджелудочной железы и шванновские клетки. Guerrin et al. J. Cell Physiol. 164:385-394 (1995); Oberg-Welsh et al. Mol. Cell. Endocrinol. 126:125-132 (1997); Sondell et al. J. Neurosci. 19:5731-5740 (1999).
Идентификация VEGF как первичного регулятора ангиогенеза при патологических состояниях послужила стимулом для множества попыток блокировать активность VEGF при состояниях, в которых участвует патологический ангиогенез. Экспрессия VEGF активируется при многих злокачественных заболеваниях, а сверхэкспрессия VEGF коррелирует с более запущенной стадией заболевания или с более плохим прогнозом многих солидных опухолей. Поэтому молекулы, ингибирующие пути передачи сигнала VEGF, были использованы для лечения относительно запущенных солидных опухолей, при которых наблюдается патологический ангиогенез.
Поскольку рак является одним из самых опасных смертельных заболеваний, необходимо разработать дополнительные способы лечения рака у пациентов. В частности, лечение пациентов с раком молочной железы (РМЖ) необходимо для повышения контроля над заболеванием в целях предупреждения симптомов данного заболевания при минимальной токсичности. Настоящее изобретение направлено на решение указанных и других проблем, которые будут очевидны из нижеследующего описания.
Описание сущности изобретения
Настоящее изобретение относится к применению анти-VEGF антитела для эффективного лечения пациентов с раком молочной железы, которые ранее не подвергались лечению метастазирующего рака молочной железы. В частности, настоящее изобретение относится к рандомизированному клиническому испытанию фазы III, проводимому с использованием бевацизумаба (AVASTIN®) в комбинации со схемой химиотерапии с участием индивидуумов с метастазирующим раком молочной железы, а именно людей, у которых это заболевание ранее не подвергалось лечению. Такими схемами химиотерапии являются терапия таксаном (например, частицами, связанными с белком доцетакселом или паклитакселом (например, Abraxane®)), терапия антрациклином (например, доксорубицином, эпирубиксином или их комбинациями) или терапия капецитабином. В некоторых вариантах изобретения такое лечение применяется в качестве терапии первого ряда для лечения локально рецидивирующего рака молочной железы или метастазирующего рака молочной железы, ранее не подвергаемого лечению. Успешно проведенное испытание показало, что добавление анти-VEGF антитела к стандартной химиотерапии дает статистически значимые и клинически значимые эффекты в лечении пациентов с раком молочной железы. Кроме того, результаты предварительных испытаний, проводимых с использованием бевацизумаба, показали, что такое лечение является безопасным.
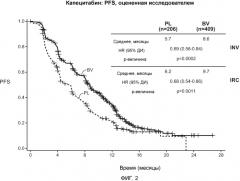
Результаты клинических исследований, проводимых с использованием бевацизумаба у человека, имеющего метастазирующую раковую опухоль молочной железы, показали, что эффективность, оцениваемая по выживаемости без прогрессирования заболевания (PFS), была, в основном, позитивной по сравнению с PFS-данными, полученными с использованием только химиотерапевтических средств. У индивидуумов, участвующих в клинических испытаниях, которые проводили с использованием бевацизумаба в комбинации с терапией таксаном (например, частицами, связанными с белком доцетакселом или паклитакселом (например, Abraxane®))/терапией антрациклином (например, доксорубицином, эпирубицином или их комбинациями), наблюдалось увеличение продолжительности жизни без прогрессирования заболевания по сравнению с индивидуумами, проходящими только терапию таксаном (например, частицами, связанными с белком доцетакселом или паклитакселом (например, Abraxane®))/терапию антрациклином (например, доксорубицином, эпирубицином или их комбинациями). У индивидуумов, участвующих в клинических испытаниях, проводимых с использованием бевацизумаба в комбинации с терапией капецитабином, описанной ниже, наблюдалось увеличение продолжительности жизни без прогрессирования заболевания по сравнению с индивидуумами, прошедшими только терапию капецитабином. Такое различие было статистически значимым.
В соответствии с этим, настоящее изобретение относится к способам лечения индивидуума, у которого был диагностирован ранее не подвергаемый лечению метастазирующий рак молочной железы, где указанные способы включают проведение у данного индивидуума схемы лечения, включающей введение эффективного количества по меньшей мере одного химиотерапевтического средства и анти-VEGF антитела, где указанному индивидууму не вводили какое-либо химиотерапевтическое средство для лечения локально рецидивирующего рака молочной железы или метастазирующего рака молочной железы. Такой индивидуум является, но необязательно, HER2-негативным. В некоторых вариантах изобретения, такой индивидуум является HER2-позитивным. Указанный индивидуум не подвергался, но необязательно, предварительной вспомогательной химиотерапии при рецидиве в течение 12 месяцев или менее после введения последней дозы. Комбинированная схема лечения, включающая химиотерапию и введение анти-VEGF антитела, увеличивала продолжительность жизни индивидуума без прогрессирования заболевания (PFS). В некоторых вариантах изобретения, комбинированная схема лечения, включающая химиотерапию и введение анти-VEGF антитела, имела профиль безопасности, соответствующий профилю безопасности, наблюдаемому при проведении предварительных испытаний с использованием бевацизумаба.
Настоящее изобретение также относится к применению анти-VEGF антитела вместе по меньшей мере с одним химиотерапевтическим средством в целях приготовления лекарственного средства для лечения пациента с метастазирующим раком молочной железы, который ранее не подвергался какому-либо лечению, где указанному индивидууму не вводили какое-либо химиотерапевтическое средство для лечения локально рецидивирующего рака молочной железы или метастазирующего рака молочной железы. Такой индивидуум является, но необязательно, HER2-негативным. В некоторых вариантах изобретения, такой индивидуум является HER2-позитивным. Указанный индивидуум не подвергался, но необязательно, предварительной вспомогательной химиотерапии при рецидиве в течение 12 месяцев или менее после введения последней дозы. Применение анти-VEGF антитела и химиотерапевтического средства приводило к увеличению продолжительности жизни индивидуума без прогрессирования заболевания (PFS). В некоторых вариантах изобретения, применение химиотерапевтического средства и анти-VEGF антитела давало профиль безопасности, соответствующий профилю безопасности, наблюдаемому при проведении предварительных испытаний с использованием бевацизумаба.
Настоящее изобретение также относится к анти-VEGF антителам, применяемым в способе лечения локально рецидивирующего рака молочной железы или метастазирующего рака молочной железы у индивидуума, где указанный способ включает проведение данному индивидууму схемы лечения, включающей введение эффективного количества химиотерапевтического средства и анти-VEGF антитела, где указанному индивидууму не вводили какого-либо химиотерапевтического средства для лечения локально рецидивирующего рака молочной железы или метастазирующего рака молочной железы. Указанный индивидуум является, но необязательно, HER2-негативным. В некоторых вариантах изобретения, такой индивидуум является HER2-позитивным. Указанный индивидуум не подвергался, но необязательно, предварительной вспомогательной химиотерапии по поводу рецидива в течение 12 месяцев или менее после введения последней дозы. Комбинированная схема лечения, включающая химиотерапию и введение анти-VEGF антитела, увеличивала продолжительность жизни индивидуума без прогрессирования заболевания (PFS). В некоторых вариантах изобретения комбинированная схема лечения, включающая химиотерапию и введение анти-VEGF антитела, имела профиль безопасности, соответствующий профилю безопасности, наблюдаемому при проведении предварительных испытаний с использованием бевацизумаба.
В некоторых вариантах любых описанных здесь способов, применений и композиций, PFS увеличивается примерно на 1 месяц, 1,2 месяца, 2 месяца, 2,4 месяца, 2,9 месяца, 3 месяца, 3,5 месяца, 4 месяца, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 1 год, примерно 2 года, примерно 3 года и т.п. В одном из вариантов изобретения, PFS увеличивается примерно на 2,9 месяца - 3,5 месяца (например, при использовании капецитабина). В одном из вариантов изобретения, PFS увеличивается примерно на 1,2 месяца - 2,4 месяца (например, при использовании таксана/антрациклина).
В любых описанных здесь способах, применениях и композициях может быть использовано любое химиотерапевтическое средство, обладающее противораковой активностью. В некоторых вариантах изобретения, химиотерапевтическое средство выбрано из группы, состоящей из алкилирующих агентов, антиметаболитов, аналогов фолиевой кислоты, аналогов пиримидина, аналогов пурина и родственных ингибиторов, винкаалкалоидов, эпиподофиллотоксинов, антибиотиков, L-аспарагиназы, ингибитора топоизомеразы, интерферонов, координационных комплексов платины, мочевины, замещенной антрацендионом, производных метилгидразина, адренокортикальных суппрессоров, адренокортикостероидов, прогестинов, эстрогенов, антиэстрогена, андрогенов, антиандрогена и аналога гонадотропин-высвобождающего гормона. В некоторых вариантах изобретения химиотерапевтическими средствами являются, например, капецитабин, таксан, антрациклин, паклитаксел, доцетаксел, частицы, связанные с белком паклитакселом (например, Abraxane®), доксорубицин, эпирубицин, 5-фторурацил, циклофосфамид или их комбинации. Могут быть использованы два или более химиотерапевтических средств (например, в виде коктейля), вводимых в комбинации с анти-VEGF антителом.
Клинические эффекты, достигаемые путем применения любых описанных здесь способов и композиций согласно изобретению, могут быть определены, например, по продолжительности жизни без прогрессирования заболевания (PFS), времени, прошедшего до тех пор, пока лечение не будет признано безуспешным, по объективному показателю отклика и по продолжительности ответа.
В соответствии с этим, настоящее изобретение относится к способу информирования пациента, страдающего, например, раком молочной железы, путем его инструктирования относительно проведения лечения с использованием анти-VEGF антитела в целях увеличения продолжительности жизни индивидуума без прогрессирования заболевания, для снижения риска рецидива рака у данного индивидуума или для увеличения вероятности выздоровления данного индивидуума. В некоторых вариантах изобретения указанный способ также включает инструктирование пациента относительно приема по меньшей мере одного химиотерапевтического средства. Лечение анти-VEGF антителом может быть проведено одновременно с лечением химиотерапевтическим средством, либо оно может быть проведено после такого лечения. В некоторых вариантах изобретения данный индивидуум проходит лечение в соответствии с инструкциями, полученными указанным способом.
Настоящее изобретение также относится к способу стимулирования, включающему содействие или помощь по введению анти-VEGF антитела для лечения, например, рака молочной железы у человека. В некоторых вариантах изобретения указанный способ также включает содействие или помощь по введению по меньшей мере одного химиотерапевтического средства. Введение анти-VEGF антитела может быть осуществлено одновременно с введением химиотерапевтического средства или после введения указанного средства. Такая помощь может быть осуществлена любыми доступными способами. В некоторых вариантах изобретения такая помощь осуществляется путем включения вкладыша в промышленную упаковку, содержащую анти-VEGF антитело. Такая помощь может быть также осуществлена путем включения вкладыша в промышленную упаковку, содержащую химиотерапевтическое средство. Такая помощь может быть осуществлена путем письменного или устного общения с врачом или со специалистом, оказывающим медицинские услуги. В некоторых вариантах изобретения, такая помощь может быть осуществлена путем включения вкладыша в упаковку, где в указанном вкладыше имеются инструкции по лечению анти-VEGF антителом. В некоторых вариантах изобретения, после такой информационной поддержки осуществляют лечение индивидуума анти-VEGF антителом в присутствии или в отсутствие химиотерапевтического средства.
Настоящее изобретение относится к способу проведения коммерческих операций, включающему реализацию анти-VEGF антитела для лечения, например, рака молочной железы у индивидуума в целях увеличения продолжительности жизни индивидуума без прогрессирования заболевания, снижения вероятности рецидива рака у данного индивидуума или увеличения вероятности выздоровления данного индивидуума. В некоторых вариантах изобретения указанный способ также включает реализацию химиотерапевтического средства, применяемого в комбинации с анти-VEGF антителом. В некоторых вариантах изобретения после такой реализации осуществляют лечение индивидуума анти-VEGF антителом в присутствии или в отсутствие химиотерапевтического средства.
Настоящее изобретение также относится к способу проведения коммерческих операций, включающему реализацию химиотерапевтического средства, используемого в комбинации с анти-VEGF антителом для лечения, например, рака молочной железы у индивидуума в целях увеличения его продолжительности жизни без прогрессирования заболевания, снижения вероятности рецидива рака у данного индивидуума или увеличения вероятности выздоровления данного индивидуума. В некоторых вариантах изобретения после такой реализации осуществляют лечение индивидуума комбинацией химиотерапевтического средства с анти-VEGF антителом.
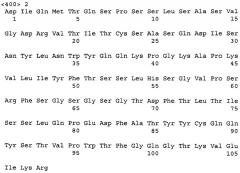
В любых из описанных здесь способов, применений и композиций, анти-VEGF антитело может быть заменено VEGF-специфическим антагонистом, например молекулой рецептора VEGF или молекулой химерного рецептора VEGF, описанными в настоящей заявке. В некоторых вариантах описанных здесь способов, применений и композиций, анти-VEGF антителом является бевацизумаб. Анти-VEGF антителом или его антигенсвязывающим фрагментом может быть моноклональное антитело, химерное антитело, полностью человеческое антитело или гуманизованное антитело. Примерами антител, используемых в способах согласно изобретению, являются бевацизумаб (AVASTIN®), антитело G6, антитело B20 и их фрагменты. В некоторых вариантах изобретения анти-VEGF антитело имеет вариабельную область тяжелой цепи, содержащую нижеследующую аминокислотную последовательность:
EVQLVESGGG LVQPGGSLRL SCAASGYTFT NYGMNWVRQA PGKGLEWVGW
INTYTGEPTY AADFKRRFTF SLDTSKSTAY LQMNSLRAED TAVYYCAKYP
HYYGSSHWYF DVWGQGTLVT VSS (SEQ ID NO: 1)
и вариабельную область легкой цепи, содержащую нижеследующую аминокислотную последовательность:
DIQMTQSPSS LSASVGDRVT ITCSASQDIS NYLNWYQQKP GKAPKVLIYF
TSSLHSGVPS RFSGSGSGTD FTLTISSLQP EDFATYYCQQ YSTVPWTFGQ
GTKVEIKR (SEQ ID NO: 2).
Антителом или его антигенсвязывающим фрагментом может быть также антитело, не содержащее Fc-части, F(ab')2-, Fab- или Fv-структуры.
В одном из вариантов описанных здесь способов, применений и композиций, указанное лечение осуществляют с использованием комбинации VEGF-специфического антагониста, например анти-VEGF антитела, и по меньшей мере одного химиотерапевтического средства. В других вариантах описанных здесь способов, применений и композиций, указанным VEGF-специфическим антагонистом является средство для монотерапии.
Все описанные здесь способы, применения и композиции могут относиться к лечению рака, включая, но не ограничиваясь ими, карциному, лимфому, бластому, саркому и лейкоз. Более конкретными примерами таких раковых заболеваний являются рак молочной железы, плоскоклеточный рак легких, мелкоклеточный рак легких, немелкоклеточный рак легких, аденокарцинома легких, плоскоклеточная карцинома легких, рак брюшины, гепатоцеллюлярный рак, рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластома, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатома, рак толстой кишки, рак прямой и ободочной кишки, карцинома эндометрия или матки, карцинома слюнных желез, рак почек, рак печени, рак предстательной железы, рак почек, рак вульвы, рак щитовидной железы, карцинома печени, рак желудка, меланома и рак головы и шеи различных типов. В некоторых вариантах способов согласно изобретению, указанный индивидуум страдает метастазирующим раком молочной железы. В некоторых вариантах описанных здесь способов, применений и композиций, указанный индивидуум страдает метастазирующим раком молочной железы, ранее не подвергавшимся лечению. В некоторых вариантах изобретения указанный индивидуум страдает HER2-негативным метастазирующим раком молочной железы.
Каждый из вышеуказанных аспектов может дополнительно включать обследование индивидуума на рецидив рака. Обследование может быть осуществлено, например, путем оценки продолжительности жизни без прогрессирования заболевания (PFS) или общей продолжительности жизни (OS) или объективного показателя отклика (ORR). В одном из вариантов изобретения, PFS, или OS, или ORR оценивают после начала проведения лечения.
В зависимости от типа и тяжести заболевания, предпочтительные дозы анти-VEGF антитела, например бевацизумаба, описаны в настоящей заявке и могут составлять примерно от l мкг/кг до 50 мг/кг, а наиболее предпочтительно примерно от 5 мг/кг до 15 мг/кг, включая, но не ограничиваясь ими, дозы 5 мг/кг, 7,5 мг/кг, 10 мг/кг или 15 мг/кг. Частота введения варьируется в зависимости от типа и тяжести указанного заболевания. В случае повторного введения в течение нескольких дней или более, в зависимости от состояния, лечение продолжают до полного исчезновения раковой опухоли или до достижения желаемого терапевтического эффекта, как было определено методами, описанными в настоящей заявке или известными специалистам. В одном из примеров, анти-VEGF антитело вводят один раз в неделю, раз в две недели или раз в три недели в дозе, составляющей примерно от 5 мг/кг до 15 мг/кг, включая, но не ограничиваясь ими, 5 мг/кг, 7,5 мг/кг, 10 мг/кг или 15 мг/кг. Однако могут быть применены и другие схемы введения доз. Мониторинг успеха лечения в соответствии с настоящим изобретением может быть легко проведен с применением стандартных методов и анализов.
В дополнительных вариантах каждого из вышеуказанных аспектов, VEGF-специфический антагонист, например анти-VEGF антитело, вводят местно или системно (например, перорально или внутривенно). В других вариантах изобретения в одном из аспектов лечения, VEGF-специфический антагонист используется в монотерапии или в монотерапии в течение длительного периода лечения VEGF-специфическим антагонистом, например, в более продолжительной фазе лечения или при поддерживающей терапии, в соответствии с оценкой врача-клинициста или описанным здесь методом.
В других вариантах описанных здесь способов, применений и композиций, такое лечение VEGF-специфическим антагонистом, его применение или композиции, содержащие такой антагонист, представляют собой комбинацию с дополнительной противораковой терапией, включая, но не ограничиваясь ею, хирургическую операцию, лучевую терапию, химиотерапию, дифференцирующую терапию, биотерапию, иммунотерапию, терапию ингибитором ангиогенеза, цитотоксическим средством и/или антипролиферативным соединением. Лечение VEGF-специфическим антагонистом, его применение и композиция, содержащая такой антагонист, могут также включать любую комбинацию схем лечения вышеуказанных типов. В некоторых вариантах изобретения химиотерапевтическое средство и VEGF-специфический антагонист вводят одновременно.
В некоторых вариантах описанных здесь способов, применений и композиций, которые включают дополнительную противораковую терапию, указанный индивидуум может быть также подвергнут лечению путем проведения дополнительной противораковой терапии до, во время (например, одновременно с введением VEGF-специфического антагониста) или после введения VEGF-специфического антагониста. В одном из вариантов изобретения VEGF-специфический антагонист, вводимый отдельно или в комбинации с противораковой терапией, может быть использован в качестве средства для поддерживающей терапии.
Другие отличительные признаки и преимущества настоящего изобретения будут очевидны из нижеследующего подробного описания изобретения, из описания графического материала и из формулы изобретения.
Краткое описание графического материала
На фигуре 1 представлен протокол исследований, в которых проводили испытания по лечению метастазирующего рака молочной железы с использованием бевацизумаба (BV) или плацебо (PL) в комбинации с различными химиотерапевтическими средствами.
На фигуре 2 представлены кривые продолжительности жизни без прогрессирования заболевания (PFS), построенные по данным, полученным в ветви испытания с использованием капецитабина. Аббревиатура INV (исследователь) означает исследование по продолжительности жизни без прогрессирования заболевания (PFS), проводимое исследователем, а аббревиатура IRC означает PFS, оцениваемую независимой экспертной комиссией (IRC), где плацебо обозначено PL, а бевацизумаб обозначен BV.
На фигуре 3 представлены кривые PFS, построенные по данным, полученным в ветви испытания с использованием таксана/антрациклина. Аббревиатура INV означает исследование PFS, проводимое исследователем, а аббревиатура IRC означает PFS, оцениваемую независимой экспертной комиссией (IRC), где плацебо обозначено PL, а бевацизумаб обозначен BV.
На фигуре 4 проиллюстрированы анализы PFS у подгрупп индивидуумов, участвующих в испытаниях в группах, которым вводили капецитабин и таксан/антрациклин.
На фигуре 5 проиллюстрированы объективные показатели отклика для групп, которым вводили капецитабин (Cape) и таксан/антрациклин (T/Antra).
На фигуре 6 проиллюстрированы анализы PFS у подгрупп индивидуумов в группах, которым вводили таксан/антрациклин (T/Anthra).
Подробное описание изобретения
1. Определения
Используемые здесь термины «VEGF» или «VEGF-A» означают человеческий фактор роста васкулярных эндотелиальных клеток, состоящий из 165 аминокислот, и родственные человеческие факторы роста васкулярных эндотелиальных клеток, состоящие из 121, 145, 189 и 206 аминокислот, как описано в публикациях Leung et al. Science, 246:1306 (1989), и Houck et al. Mol. Endocrin., 5:1806 (1991), а также их природные аллельные и процессированные формы. VEGF-A представляет собой член генного семейства, включающего VEGF-B, VEGF-C, VEGF-D, VEGF-E, VEGF-F и PlGF. VEGF-A, главным образом, связывается с двумя высокоаффинными тирозинкиназными рецепторами, VEGFR-1 (Flt-1) и VEGFR-2 (Flk-1/KDR), где последний рецептор представляет собой главный медиатор передачи митогенных VEGF-A-сигналов в васкулярных эндотелиальных клетках. Кроме того, нейропилин-1 был идентифицирован как рецептор для изоформ связывающегося с гепарином VEGF-A, и было обнаружено, что он может играть определенную роль в развитии сосудов. Термины «VEGF» или «VEGF-A» также означают VEGF, происходящие от животных, не являющихся человеком, таких как мыши, крысы или приматы. Иногда VEGF, происходящий от животных конкретных видов, обозначают hVEGF, для человеческого VEGF, или mVEGF, для мышиного VEGF. Обычно VEGF означает человеческий VEGF. Используемый здесь термин «VEGF» также означает усеченные формы или фрагменты полипептида, содержащего аминокислоты 8-109 или 1-109 человеческого фактора роста васкулярных эндотелиальных клеток, состоящего из 165 аминокислот. В настоящей заявке ссылка на любую из таких форм VEGF может означать, например, «VEGF (8-109)», «VEGF (1-109)» или «VEGF165». Положения аминокислот для «усеченного» нативного VEGF пронумерованы, как указывается в нативной последовательности VEGF. Так, например, положение аминокислоты 17 (метионина) в усеченном нативном VEGF также соответствует положению 17 (метионина) в нативном VEGF. Усеченный нативный VEGF обладает аффинностью связывания с рецепторами KDR и Flt-1, сравнимой с аффинностью связывания нативного VEGF.
«Анти-VEGF антитело» представляет собой антитело, которое связывается с VEGF с достаточной аффинностью и специфичностью. Выбранное антитело обычно обладает достаточно высокой аффинностью связывания с VEGF, например, антитело может связываться с hVEGF с величиной Kd, составляющей 100 нМ - 1 пМ. Аффинности антител могут быть определены, например, с помощью анализа методом поверхностного плазмонного резонанса (такого как анализ BIAcore, описанный в публикации заявки PCT № WO 2005/012359); твердофазного иммуноферментного анализа (ELISA); и анализов на конкурентное связывание (например, РИА). В некоторых вариантах изобретения анти-VEGF антитело согласно изобретению может быть использовано в качестве терапевтического средства для нацеливания на пораженный участок и подавления симптомов заболеваний или состояний, ассоциированных с активностью VEGF. Кроме того, указанное антитело может быть проанализировано с помощью других анализов на биологическую активность, например, для оценки его эффективности в качестве терапевтического средства. Такие анализы известны специалистам, и их выбор зависит от антигена-мишени и цели применения данного антитела. Примерами таких анализов являются анализ на ингибирование HUVEC; анализы на ингибирование роста опухолевых клеток (описанные, например, в WO 89/06692); анализы на антитело-зависимую клеточную цитотоксичность (ADCC) и комплемент-опосредуемую цитотоксичность (CDC) (патент США 5500362); и анализы на агонистическую активность или на гемопоэз (см. WO 95/27062). Анти-VEGF антитело обычно не связывается с другими гомологами VEGF, такими как VEGF-B или VEGF-C, а также с другими факторами роста, такими как PlGF, PDGF или bFGF.
Термин «антагонист VEGF» означает молекулу, обладающую способностью нейтрализовать, блокировать, ингибировать, элиминировать, снижать или подавлять активность VEGF, включая его связывание с одним или несколькими рецепторами VEGF. Антагонистами VEGF являются анти-VEGF антитела и их антигенсвязывающие фрагменты, молекулы рецепторов и производные, которые специфически связываются с VEGF, с последующей секвестрацией их связывания с одним или несколькими рецепторами; антитела против рецепторов VEGF и антагонисты рецепторов VEGF, такие как небольшие молекулы-ингибиторы тирозинкиназных VEGFR.
Полипептид с «нативной последовательностью» включает полипептид, имеющий такую же аминокислотную последовательность, как и последовательность природного полипептида. Таким образом, полипептид с нативной последовательностью может иметь аминокислотную последовательность природного полипептида, происходящую от любого млекопитающего. Такой полипептид с нативной последовательностью может быть выделен из природного источника, либо он может быть продуцирован рекомбинантными методами или методами синтеза. Термин полипептид с «нативной последовательностью», в частности, включает природные усеченные или секретированные формы полипептида (например, последовательность внеклеточного домена), природные модифицированные формы (например, альтернативно сплайсированные формы) и природные аллельные варианты полипептида.
Термин «вариант» полипептида означает биологически активный полипептид, аминокислотная последовательность которого по меньшей мере примерно на 80% идентична аминокислотой последовательности полипептида с нативной последовательностью. Такими вариантами являются, например, полипептиды, в которых у их N- или C-конца добавлены или делетированы один или несколько аминокислотных остатков. Обычно вариант может иметь аминокислотную последовательность, которая по меньшей мере примерно на 80%, более предпочтительно по меньшей мере примерно на 90%, а еще более предпочтительно по меньшей мере примерно на 95% идентична аминокислотой последовательности полипептида с нативной последовательностью.
Используемый здесь термин «антитело» применяется в самом широком смысле, а в частности охватывает моноклональные антитела (включая полноразмерные или интактные моноклональные антитела), поликлональные антитела, поливалентные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител (см. ниже), при условии, что они обладают нужной биологической активностью.
Во всем описании настоящего изобретения и в формуле изобретения, нумерация остатков в тяжелой цепи иммуноглобулина соответствует Европейской системе нумерации, описанной Кэбатом в публикации Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991), точное описание которой вводится в настоящую заявку посредством ссылки. Термин “EU-нумерация по Кэбату” означает Европейскую систему нумерации остатков человеческого антитела IgG1.
В одном из вариантов изобретения, «Kd» или «величину Kd» согласно изобретению определяют с помощью анализа на связывание с радиоактивно меченным VEGF (РИА), осуществляемого с использованием Fab-варианта антитела и молекулы VEGF, описанных в нижеследующем анализе, где указанный анализ позволяет измерять аффинность связывания Fab с VEGF в растворе путем уравновешивания Fab с минимальной концентрацией 125I-меченного VEGF(109) в присутствии титрационного набора немеченного VEGF, с последующей иммобилизацией связанного VEGF на планшете, сенсибилизированном