Способ получения производных пирипиропена
Иллюстрации
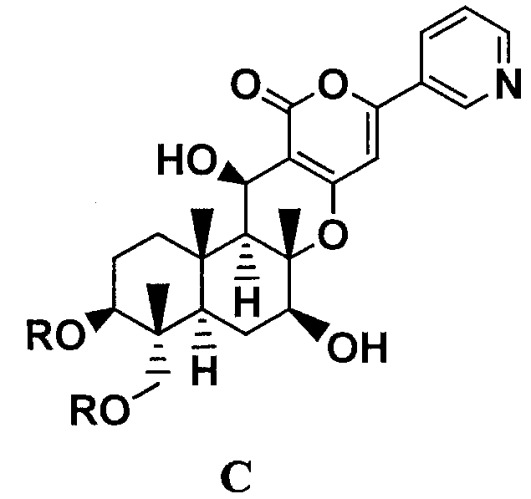
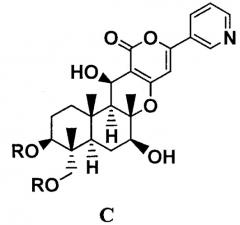
Показать всеДанное изобретение относится к способу получения производных пирипиропена, а именно соединению формулы C:
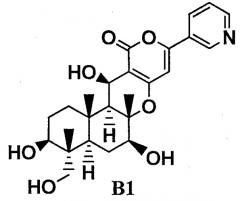
где R представляет прямую цепь, разветвленную цепь или циклический C2-6алкилкарбонил, при условии, что, когда алкильный фрагмент в алкилкарбонильной группе представляет собой разветвленную цепь или циклическую группу, R представляет C3-6алкилкарбонил, включающий: селективное ацилирование гидроксильных групп в 1-положении и 11-положении соединения B1, представленного формулой B1:
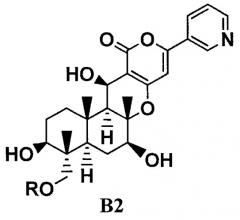
ацилирующим агентом через одну-три стадии в присутствии или отсутствии основания, причем (i) соединение C получают посредством ацилирования гидроксильных групп в 1-положении и 11-положении соединения В1 через одну стадию; (ii) способ, включающий получение соединения C посредством ацилирования через две стадии, состоящие из стадий: ацилирования гидроксильной группы в 11-положении соединения B1 ацилирующим агентом с получением соединения B2, представленного формулой B2:
где R определен в формуле C; и дополнительного ацилирования гидроксильной группы в 1-положении соединения B2; или (iii) способ, включающий в себя получение соединения C посредством ацилирования через три стадии, состоящие из стадий: ацилирования гидроксильной группы в 11-положении соединения B1 с получением соединения B2, представленного формулой B2:
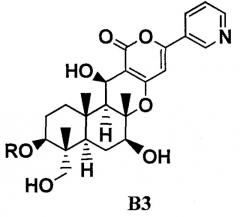
где R определен в формуле C; переноса ацила в 11-положении соединения B2 к гидроксилу в 1-положении с получением соединения B3, представленного формулой B3:
где R такой, как определено в формуле C; и ацилирования гидроксильной группы в 11-положении соединения В3.
3 н. и 13 з.п. ф-лы, 1 ил., 3 табл., 22 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Данная заявка на патент является заявкой, по которой запрашивается приоритет по предшествующим патентным заявкам Японии, заявке на патент Японии № 116305/2009 (дата подачи: 13 мая 2009 г.) и заявке на патент Японии № 44416/2010 (дата подачи: 1 марта 2010 г.). Полные раскрытия предшествующих заявок включены в данный документ посредством ссылки.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу получения производных пирипиропена, применимых в качестве средств борьбы с сельскохозяйственными вредителями, и, более конкретно, к получению производных пирипиропена, которые имеют ацилокси в его 1-положении и 11-положении и гидроксил в 7-положении.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Производные пирипиропена, имеющие ацилокси в его 1-положении и 11-положении и гидроксил в 7-положении, представляют собой соединения, которые эффективны в борьбе против сельскохозяйственных вредителей, как описано в WO 2006/129714.
WO 2006/129714 и выложенная заявка на патент Японии № 259569/1996 раскрывают способ получения производных пирипиропена, имеющих ацилокси в его 1-положении и 11-положении и гидроксил в 7-положении. В соответствии со способом получения, производные пирипиропена очищают или выделяют из множества продуктов, полученных посредством неселективного гидролиза ацилокси с использованием 1,7,11-триацилоксисоединения в качестве исходного соединения.
Дополнительно, выложенная заявка на патент Японии № 259569/1996 описывает применение комбинации защитных групп для синтеза производных пирипиропена. Journal of Antibiotics Vol. 49, No. 11, p. 1149 (1996), Bioorganic Medicinal Chemistry Letter Vol. 5, No. 22, p. 2683 (1995), и выложенная заявка на патент Японии № 269065/1996 раскрывают пример синтеза, в котором вводят ацил в 7-положение посредством использования защитной группы.
WO 2009/022702 раскрывает способ получения 1,11-диацил-7-деацетилпирипиропена из 1,7,11-тридеацетилпирипиропена с использованием защитной группы.
Производные пирипиропена, имеющие ацилокси в 1-положении и 11-положении и гидроксил в 7-положении до этого времени получали через множество стадий с использованием неселективного гидролиза 1,7,11-триацилоксисоединения и с использованием защитной группы. Соответственно, при получении производных пирипиропена в промышленном масштабе, желательными являются дополнительное улучшение эффективности при получении, например, через снижение производственных затрат, улучшение, выхода, упрощение очистки и выделения или снижение числа стадий.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения добились успеха при получении рассматриваемого применимого 1,11-диацилоксисоединения через ускоренный способ посредством селективного ацилирования, либо непосредственного или постадийного, гидроксила в 1-положении и 11-положении тридеацилсоединения (выложенная заявка на патент Японии № 259569/1996 и Journal of Technical Disclosure No. 500997/2008), легко получаемого из пирипиропена (природного вещества) и его аналога (Pure Appl. Chem., vol. 71, No. 6, pp.1059-1064, 1999; WO 94/09147; выложенная заявка на патент Японии № 239385/1996, выложенная заявка на патент Японии № 259569/1996, Bioorganic Medicinal Chemistry Letter Vol. 5, No. 22, p. 2683 (1995); и WO 2004/060065), что привело к завершению настоящего изобретения.
1. В соответствии с настоящим изобретением, предоставлен способ получения соединения C, представленного формулой C:
Химическая формула 1
где R представляет прямую цепь, разветвленную цепь или циклический C2-6алкилкарбонил, при условии, что, когда алкильный фрагмент в алкилкарбонильной группе представляет собой разветвленную цепь или циклическую группу, R представляет С3-6алкилкарбонил, включающий:
селективное ацилирование, через одну-три стадии, гидроксильных групп в 1-положении и 11-положении соединения B1, представленного формулой B1:
Химическая формула 2
ацилирующим агентом в присутствии или отсутствии основания.
2. В соответствии с настоящим изобретением, предоставлен способ, в соответствии с указанным выше параграфом 1., отличающийся тем, что соединение C ацилируют из соединения B1 через единственную стадию. То есть в соответствии с этим вариантом осуществления, в способе, в соответствии с указанным выше параграфом 1., соединение C получают посредством ацилирования гидроксильных групп в 1-положении и 11-положении соединения B1 через единственную стадию.
3. В соответствии с настоящим изобретением, предоставлен способ в соответствии с указанным выше параграфом 1., отличающийся тем, что ацилирование осуществляют двум стадиями, состоящие из стадий:
ацилирования гидроксильной группы в 11-положении соединения B1 ацилирующим агентом с получением соединения B2, представленного формулой B2:
Химическая формула 3
где R такой, как определено в формуле C в указанном выше параграфе 1.;
и
дополнительного ацилирования гидроксильной группы в 1-положении соединения B2. То есть, в соответствии с этим вариантом осуществления, в способе в соответствии с указанным выше параграфом 1., соединение C получают посредством ацилирования через две стадии, состоящие из стадий: ацилирования гидроксильной группы в 11-положении соединения B1 ацилирующим агентом с получением соединения B2; и дополнительного ацилирования гидроксильной группы в 1-положении соединения B2.
4. В соответствии с еще одним аспектом настоящего изобретения, предоставлен способ в соответствии с указанным выше параграфом 1., отличающийся тем, что ацилирование осуществляют в три стадии, состоящие из стадий: ацилирования гидроксильной группы в 11-положении соединения B1 с получением соединения B2; переноса ацила в 11-положении соединения B2 к гидроксилу в 1-положении с получением соединения B3, представленного формулой B3:
Химическая формула 4
где R такой, как определено в формуле C, в указанном выше параграфе 1.; и
ацилирования гидроксильной группы в 11-положении соединения B3. То есть, в соответствии с этим вариантом осуществления, в способе в соответствии с указанным выше параграфом 1., соединение C получают через три стадии, состоящий из стадий:
ацилирования гидроксильной группы в 11-положении соединения B1 с получением соединения B2; переноса ацила в 11-положении соединения B2 к гидроксилу в 1-положении с получением соединения B3; и ацилирования гидроксильной группы в 11-положении соединения B3.
5. Дополнительно, в соответствии с настоящим изобретением, предоставлен способ в соответствии с любым из указанных выше параграфов от 1. до 4., включающий в себя, в качестве стадии получения соединения B1, гидролиз ацильных групп в 1-положении, 7-положении и 11-положении соединения A1, представленного формулой Al в присутствии основания:
Химическая формула 5
где A1, A7 и A11, которые могут быть одинаковыми или различными, представляют ацетил или пропионил. То есть, в соответствии с этим вариантом осуществления, способ в соответствии с указанными выше параграфами от 1. до 4., дополнительно включает в себя, в качестве стадии получения соединения B1, гидролиз ацильных групп в 1-положении, 7-положении и 11-положении соединения A1 в присутствии основания.
6. В соответствии с еще одним другим аспектом настоящего изобретения, предоставлен способ получения соединения C, который включает в себя стадии: ацилирования гидроксильных групп в 1-положении, 11-положении, и 7-положении соединения B1 с получением соединения B4, представленного формулой B4:
Химическая формула 6
где R такой, как определено выше; и затем селективного деацилирования гидроксильной группы в 7-положении.
В соответствии с дополнительным аспектом настоящего изобретения, предоставлен способ выделения и очистки кристаллов сольвата соединения C, полученных посредством способа В, в соответствии с любым из указанных выше параграфов от 1. до 5., включающий в себя: добавление подходящего растворителя к неочищенному продукту соединения C, полученному посредством концентрирования реакционного раствора, содержащего соединение C, полученного посредством любого из указанных выше параграфов от 1. до 5., при пониженном давлении; концентрирование этилацетатного экстракта реакционного раствора, содержащего соединение C, полученное посредством способа в соответствии с любым из указанных выше параграфов от 1. до 5.; или дополнительное добавление выбранного растворителя к концентрату для осаждения кристаллов сольвата соединения C.
В соответствии с еще одним аспектом настоящего изобретения, предоставлен способ выделения и очистки кристаллов сольвата соединения C, включающий в себя стадии: (a) экстракции реакционного раствора, содержащего соединение C, органическим растворителем, выбранным из группы, состоящей из метилацетата, этилацетата, бутилацетата, толуола, хлорбензола, хлороформа, дихлорметана, диэтилового эфира, диизопропилового эфира, тетрагидрофурана и диоксана, и концентрирования экстракта после или без сушки; (b) упаривания реакционного раствора, содержащего соединение C, досуха с получением неочищенного продукта и затем растворения неочищенного продукта в органическом растворителе, выбранном из группы, состоящей из метилацетата, этилацетата, бутилацетата, толуола, хлорбензола, хлороформа, дихлорметана, диэтилового эфира, диизопропилового эфира, тетрагидрофурана, диоксана, метанола и этанола при комнатной температуре или при нагреве; или (c) упаривания реакционного раствора, содержащего соединение C, досуха с получением неочищенного продукта, растворения неочищенного продукта в органическом растворителе, выбранном из группы, состоящей из метилацетата, этилацетата, бутилацетата, толуола, хлорбензола, хлороформа, дихлорметана, диэтилового эфира, диизопропилового эфира, тетрагидрофурана, диоксана, метанола и этанола при комнатной температуре или при нагреве, и добавления слабого растворителя, выбранного из группы, состоящей из гептана, гексана и циклогексана, к раствору. В предпочтительном варианте осуществления настоящего изобретения, указанная стадия (a) должна быть стадией (a') экстракции реакционного раствора, содержащего соединение C, этилацетатом, и концентрирования экстракта после или без осушки. В еще одном предпочтительном варианте осуществления настоящего изобретения, указанная стадия (b) должна быть стадией (b') упаривания реакционного раствора, содержащего соединение C, досуха с получением неочищенного продукта и затем растворения неочищенного продукта в этилацетате при комнатной температуре или при нагреве. В еще одном предпочтительном варианте осуществления настоящего изобретения, указанная стадия (c) должна быть стадией (c') упаривания реакционного раствора, содержащего соединение C, досуха с получением неочищенного продукта, растворения неочищенного продукта в этилацетате при комнатной температуре или при нагреве, и добавления гексана к раствору.
В соответствии с еще одним другим аспектом настоящего изобретения, предоставлен способ получения соединения C из соединения B1 в соответствии с любым из указанных выше параграфов от 1. до 5., который включает в себя стадию выделения и очистки соединения C посредством кристаллизации из реакционного раствора, содержащего соединение C. То есть, в соответствии с этим вариантом осуществления, способ в соответствии с любым из указанных выше параграфов от 1. до 5. дополнительно включает в себя стадию выделения и очистки соединения C посредством кристаллизации из реакционного раствора, содержащего соединение C. В соответствии с настоящим изобретением, производные пирипиропена, которые имеют ацилокси в 1-положении и 11-положении и гидроксил в 7-положении, и являются применимыми в качестве средств уничтожения сельскохозяйственных насекомых-вредителей, могут быть эффективно получены через короткий способ.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 представляет собой порошковую рентнгенограмму, измеренную для кристаллов этилацетатного сольвата 1,11-ди-O-циклопропанкарбонил-1,7,11-тридеацетилпирипиропена A.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Способ получения
Термин "алкил", как используется в настоящем документе, в качестве заместителя или части заместителя означает алкил, то есть с прямой цепью, разветвленной цепью или циклической группой или типа их комбинации, если не указано иначе.
Символ "Ca-b", присоединенный к заместителю, как используется в настоящем документе, означает, что число атомов углерода, содержащихся в заместителе, как используется в настоящем документе, равно от a до b. Дополнительно, "Ca-b" в "Ca-bалкилкарбонил" означает, что число атомов углерода в алкильном фрагменте, исключая атом углерода в карбонильном фрагменте равно от a до b.
Конкретными примерами прямоцепного, с разветвленной цепью или циклического C2-6алкилкарбонила, представленного R, при условии, что, когда алкильный фрагмент в алкилкарбонильной группе представляет собой разветвленную цепь или циклическую группу, R представляет C3-6алкилкарбонил, включают циклопропанкарбонил и пропионил.
В соответствии с еще одним предпочтительным вариантом осуществления настоящего изобретения, в способе в соответствии с любым из указанных выше параграфов от 1. до 5., ацилирование осуществляют в отсутствии основания.
В соответствии с предпочтительным вариантом осуществления настоящего изобретения, в способе в соответствии с любым из указанных выше параграфов от 1. до 5., основание, используемое при ацилировании гидроксила в 1-положении и 11-положении соединения B1, представляет собой 2,4,6-коллидин или 2,6-лутидин.
В соответствии с еще одним предпочтительным вариантом осуществления настоящего изобретения, в способе в соответствии с указанным выше параграфом 2., ацилирующий агент используют в количестве от 2,0 до 5,0 эквивалентов в расчете от соединения B1.
В соответствии с дополнительным предпочтительным вариантом осуществления настоящего изобретения, способ в соответствии с указанным выше параграфом 3., отличается тем, что растворитель, применяемый на стадии получения соединения B2, отличается от растворителя, применяемого на стадии дополнительного ацилирования гидроксила в 1-положении соединения B2.
В соответствии с еще одним предпочтительным вариантом осуществления настоящего изобретения, способ, в соответствии с указанным выше параграфом 4., отличается тем, что стадию получения соединения B3 из соединения B2 осуществляют в присутствии основания.
В соответствии с еще одним предпочтительным вариантом осуществления настоящего изобретения, способ в соответствии с указанным выше параграфом 4., отличается тем, что стадию получения соединения B3 из соединения B2 осуществляют в присутствии 1,8-диазабицикло[5.4.0]ундека-7-ена (DBU) в качестве основания.
В соответствии с дополнительным предпочтительным вариантом осуществления настоящего изобретения, C2-6алкилкарбонил, представленный R, является циклическим C3-6алкилкарбонилом, более предпочтительно, циклопропанкарбонилом.
В соответствии с предпочтительным вариантом осуществления настоящего изобретения, в способе в соответствии с указанным выше параграфом 3., основание применяют на стадии получения соединения B2 и на стадии дополнительного ацилирования гидроксила в 1-положении соединения B2, количество основания применяемого на стадии получения соединения B2, составляет от 1,0 до 3,0 эквивалентов, в расчете от соединения B1, общее количество основания, применяемого на стадии получения соединения B2 и основания, применяемого на стадии дополнительного ацилирования гидроксила в 1-положении соединения B2, составляет от 2,0 до 4,5 эквивалентов, более предпочтительно от 2,0 до 3,0 эквивалентов.
В соответствии с предпочтительным вариантом осуществления настоящего изобретения, в способе, в соответствии с любым из указанных выше параграфов от 1. до 4., ацилирующий агент используют в количестве от 2,0 до 5,0 эквивалентов в расчете от соединения B1.
В соответствии с предпочтительным вариантом осуществления настоящего изобретения, в способе, в соответствии с указанным выше параграфом 3., ацилирующий агент используют на стадии получения соединения B2 и на стадии дополнительного ацилирования гидроксила в 1-положении соединения B2, количество ацилирующего агента, используемое на стадии получения соединения B2, составляет от 1,0 до 3,5 эквивалентов в расчете от соединения B1, общее количество ацилирующего агента, применяемого на стадии получения соединения B2 и ацилирующего агента, применяемого на стадии дополнительного ацилирования гидроксила в 1-положении соединения B2, составляет от 2,0 до 4,5 эквивалентов.
В соответствии с еще одним предпочтительным вариантом осуществления настоящего изобретения, предоставлено применение соединения B2 в качестве промежуточного соединения при получении соединения C из соединения B1. То есть в варианте осуществления предоставлено применение соединения B2 при получении соединения C.
В соответствии с еще одним предпочтительным вариантом осуществления настоящего изобретения, предоставлено применение соединения B2 и соединения B3 в качестве промежуточного соединения при получении соединения C из соединения B1. То есть в этом варианте осуществления предоставлено применение соединения B3 при получении соединения C.
Настоящее изобретение будет описано более подробно в соответствии со следующей схемой.
Химическая формула 7
где А1, A7, A11 и R являются такими, как определено выше.
Продукт, получаемый на каждой стадии схемы, может также применяться без последующей обработки или выделения на следующей стадии.
1-1: Получение соединения B1 из соединения A1
Соединение A1 может быть получено посредством способа, описанного, например, в Pure Appl. Chem., vol. 71, No. 6, pp. 1059-1064, 1999.; выложенной заявке на патент Японии № 239385/1996, выложенной заявке на патент Японии № 184158/1994, WO 2004/060065, Выложенной заявке на патент Японии № 259569/1996 или Bioorganic Medicinal Chemistry Letter vol. 5, No. 22, p. 2683.
Когда соединение A1 в качестве исходного соединения представляет пирипиропен A, пирипиропен А может быть один получен посредством способа, описанного в Journal Synthetic Organic Chemistry (1998), Vol. 56, No. 6, p. 478-488 или WO 94/09147.
Соединение B1 может также являться производным, полученным посредством способа, описанного, например, в выложенной заявке на патент Японии № 259569/1996 или Journal of Technical Disclosure No. 50997/2008.
Способ, описанный в WO 2009/022702, может быть упомянут как способ получения соединения B1 из соединения A1, и соединение B1 может быть получено посредством гидролиза ацила в 1-положении, 7-положении, и 11-положении соединения A1 в присутствии основания.
Более конкретно, растворители, применимые в данном изобретении, включают спиртовые растворители, имеющие от 1 до 4 атомов углерода, такие как метанол; растворители из простых эфиров, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан; апротонные полярные органические растворители, такие как N,N-диметилформамид, диметилсульфоксид, N,N-диметилацетамид, и ацетонитрил; галогенированные растворители, такие как дихлорметан и хлороформ; или вода; и смешанные растворители, составленные из двух или более из этих растворителей.
Основания, применимые в данном изобретении, включают неорганические основания, такие как карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия, гидроксид натрия, гидроксид калия, гидрид натрия, гидрид калия, цианид натрия, цианид калия, гидроксид магния, гидроксид кальция, гидроксид лития и гидроксид бария; алкоксиды щелочных металлов, такие как метоксид натрия, этоксид натрия и трет-бутоксид калия; алкоксиды щелочноземельных металлов; и органические основания, такие как 1,8-диазабицикло[5.4.0]ундека-7-ен, 1,5-диазабицикло[4.3.0]нона-5-ен, триэтиламин, диизопропилэтиламин, пиридин, гидразин и гуанидин. Предпочтительными являются 1,8-диазабицикло[5.4.0]ундека-7-ен, 1,5-диазабицикло[4.3.0]нона-5-ен, карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия, гидроксид натрия и гидроксид калия.
Количество применяемого основания составляет предпочтительно от 0,01 до 4,5 эквивалентов в расчете от количества соединения A1. Температура реакции составляет предпочтительно от -20°C до 50°C. Время реакции составляет предпочтительно от 0,5 час до 72 час.
2-1: Получение соединения C из соединения B1
(1) Стадия получения соединения C непосредственно из соединения B1
Растворители, применимые в способе получения соединения C из соединения B1 в указанном выше параграфе 2., включают растворители из простых эфиров, такие как диэтиловый эфир диизопропиловый эфир, тетрагидрофуран и диоксан; апротонные полярные органические растворители, такие как N,N-диметилформамид, диметилсульфоксид, N,N-диметилацетамид, ацетонитрил, N-метил-2-пирролидинон, N-метил-2-пиперазинон и N,N-диметил-2-имидазолидинон; галогенированные растворители, такие как дихлорметан и хлороформ; или ароматические углеводородные растворители, такие как толуол; и смешанные растворители, составленные из двух или более из этих растворителей. Предпочтительными являются апротонные полярные органические растворители. Более предпочтительными являются N-метил-2-пирролидинон и N,N-диметил-2-имидазолидинон. Особенно предпочтительным является N-метил-2 пирролидинон.
Способ в соответствии с указанным выше параграфом 2., предпочтительно осуществляют в отсутствии основания. Однако, когда способ осуществляют в присутствии основания, примеры применимых оснований включают неорганические основания, такие как карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия, гидроксид натрия, гидроксид калия, гидрид натрия, гидрид калия, цианид натрия, цианид калия, гидроксид магния, гидроксид кальция, гидроксид лития, и гидроксид бария; и органические основания, такие как 1,8-диазабицикло[5.4.0]ундека-7-ен, 1,5-диазабицикло[4.3.0]нона-5-ен, триэтиламин, диизопропилэтиламин, пиридин, гуанидин, лутидин, коллидин, 2,2'-бипиридил, трифениламин, хинолин, N,N-диметиланилин, и N,N-диэтиланилин. Предпочтительными являются пиридин, 2,6-лутидин, 2,4,6-коллидин, 2,2'-бипиридил, трифениламин, N,N-диметиланилин, N,N-диэтиланилин и т.п. Более предпочтительными являются 2,6-лутидин, 2,4,6-коллидин, трифениламин, N,N-диметиланилин, и N,N-диэтиланилин. Особенно предпочтительными являются 2,6-лутидин и 2,4,6-коллидин.
Когда применяют основание, количество основания составляет предпочтительно от 2,0 до 4,5 эквивалентов, более предпочтительно от 2,0 до 3,0 эквивалентов, в расчете от количества соединения B1.
Группа R может быть введена в 1-положение и 11-положение с использованием ROH, RCl, (R)2O или смешанного кислотного ангидрида, предпочтительно RCl или (R)2О, в качестве ацилирующего агента, соответствующего рассматриваемому R. Реакция может осуществляться в присутствии или отсутствии основания или с использованием конденсирующего агента, такого как дициклогексилкарбодиимид, гидрохлорид l-этил-3-(3-диметиламинопропил)карбодиимида, карбонилдиимидазол, дипиридилдисульфид, диимидазолилдисульфид, 1,3,5-трихлорбензоилхлорид, 1,3,5-трихлорбензоил ангидрид, PyBop или PyBrop. Предпочтительно, реакцию осуществляют с использованием RCl или (R)2О в присутствии или отсутствии основания.
Более предпочтительные ацилирующие агенты включают циклопропанкарбонилхлорид, бутирилхлорид, и ангидрид циклопропанкарбоновой кислоты.
Количество применяемого ацилирующего агента составляет предпочтительно от 2,0 до 5,0 эквивалентов, более предпочтительно от 2,2 до 4,5 эквивалентов, в расчете от количества соединения B1. Это количество применяют сразу или двумя-пятью разделенными частями.
Температура реакции составляет предпочтительно от -20°C до 50°C, более предпочтительно от -10°C до 50°C, еще более предпочтительно от -10°C до комнатной температуры. Время реакции составляет предпочтительно от 0,1 час до 7 дней, более предпочтительно от 3 час до 4 дней.
В соответствии с этим способом, соединение C может быть получено из соединения B1 через единственную стадию при выходе не меньше, чем 40%.
(2) Стадия получения соединения B2 из соединения B1
Растворители, применимые в способе получения соединения B2 из соединения B1 в указанном выше параграфе 3., или 4., включают растворители из простых эфиров, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, и диоксан; апротонные полярные органические растворители, такие как N,N-диметилформамид, диметилсульфоксид, N,N-диметилацетамид, ацетонитрил, N-метил-2-пирролидинон, N-метил-2-пиперазинон и N,N-диметил-2-имидазолидинон; галогенированные растворители, такие как дихлорметан и хлороформ; или ароматические углеводородные растворители, такие как толуол; и смешанные растворители, составленные из двух или более из этих растворителей. Предпочтительными являются апротонные полярные органические растворители. Особенно предпочтительным является N-метил-2-пирролидинон.
Реакция может осуществляться без применения основания. Однако когда применяют основание, примеры применимых оснований включают неорганические основания, такие как карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия, гидроксид натрия, гидроксид калия, гидрид натрия, гидрид калия, цианид натрия, цианид калия, гидроксид магния, гидроксид кальция, гидроксид лития и гидроксид бария; и органические основания, такие как 1,8-диазабицикло[5.4.0]ундека-7-ен, 1,5-диазабицикло[4.3.0]нона-5-ен, триэтиламин, диизопропилэтиламин, пиридин, гуанидин, лутидин, коллидин, 2,2'-бипиридил, трифениламин, хинолин, N,N-диметиланилин и N,N-диэтиланилин. Предпочтительными являются пиридин, 2,6-лутидин, 2,4,6-коллидин, 2,2'-бипиридил, трифениламин, N,N-диметиланилин, N,N-диэтиланилин и т.п. Более предпочтительными являются триэтиламин, 2,6-лутидин, 2,4,6-коллидин, трифениламин, N,N-диметиланилин и N,N-диэтиланилин. Особенно предпочтительными являются триэтиламин и 2,6-лутидин.
ROH, RCl, (R)2О или смешанный кислотный ангидрид, предпочтительно RCl или (R)2O, применяют в качестве ацилирующего агента для введения в качестве группы R. Реакция может осуществляться в присутствии или отсутствии основания или с использованием конденсирующего агента, такого как дициклогексилкарбодиимид, гидрохлорид l-этил-3-(3-диметиламинопропил)карбодиимида, карбонилдиимидазол, дипиридилдисульфид, диимидазолилдисульфид, 1,3,5-трихлорбензоилхлорид, 1,3,5-трихлорбензоилангидрид, PyBop или PyBrop. Предпочтительно, реакцию осуществляют с использованием RCl или (R)2O в присутствии или отсутствии основания.
Более предпочтительные ацилирующие агенты включают циклопропанкарбонилхлорид и ангидрид циклопропанкарбоновой кислоты.
Количество применяемого ацилирующего агента составляет предпочтительно от 1,0 до 3,5 эквивалентов, более предпочтительно от 1,1 до 3,0 эквивалентов, в расчете от количества соединения B1.
Когда применяют основание, количество основания составляет предпочтительно от 1,0 до 3,0 эквивалентов, более предпочтительно от 1,1 до 2,5 эквивалентов, в расчете от количества соединения B1.
Температура реакции составляет предпочтительно от -20°C до 50°C, более предпочтительно от -10°C до 50°C. Время реакции составляет предпочтительно от 0,1 час до 7 дней, более предпочтительно от 45 мин до 48 час.
(3) Стадия получения соединения C из соединения B2
Растворители, применимые в способе получения соединения C из соединения B2 в указанном выше параграфе 3., включают растворители из простых эфиров, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан; апротонные полярные органические растворители, такие как N,N-диметилформамид, диметилсульфоксид, N,N-диметилацетамид, ацетонитрил, N-метил-2-пирролидинон, N-метил-2-пиперазинон и N,N-диметил-2-имидазолидинон; галогенированные растворители, такие как дихлорметан и хлороформ; или ароматические углеводородные растворители, такие как толуол; и смешанные растворители, составленные из двух или более из этих растворителей. Предпочтительными являются апротонные полярные органические растворители. Особенно предпочтительным является N-метил-2-пирролидинон.
Реакция может осуществляться без применения основания. Однако когда применяют основание, примеры применимых оснований включают неорганические основания, такие как карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия, гидроксид натрия, гидроксид калия, гидрид натрия, гидрид калия, цианид натрия, цианид калия, гидроксид магния, гидроксид кальция, гидроксид лития, и гидроксид бария; и органические основания, такие как 1,8-диазабицикло[5.4.0]ундека-7-ен, 1,5-диазабицикло[4.3.0]нона-5-ен, триэтиламин, диизопропилэтиламин, пиридин, гуанидин, лутидин, коллидин, 2,2'-бипиридил, трифениламин, хинолин, N,N-диметиланилин, и N,N-диэтиланилин. Предпочтительными являются пиридин, 2,6-лутидин, 2,4,6-коллидин, 2,2'-бипиридил, трифениламин, N,N-диметиланилин, N,N-диэтиланилин и т.п. Более предпочтительными являются триэтиламин, 2,6-лутидин, 2,4,6-коллидин, трифениламин, N,N-диметиланилин и N,N-диэтиланилин. Особенно предпочтительными являются триэтиламин и 2,6-лутидин.
ROH, RCl, (R)2O или смешанный кислотный ангидрид, предпочтительно RCl или (R)2O, применяют в качестве ацилирующего агента для введения в качестве группы R. Реакция может осуществляться в присутствии или отсутствии основания или с использованием конденсирующего агента, такого как дициклогексилкарбодиимид, гидрохлорид l-этил-3-(3-диметиламинопропил)карбодиимида, карбонилдиимидазол, дипиридилдисульфид, диимидазолилдисульфид, 1,3,5-трихлорбензоилхлорид, 1,3,5-трихлорбензоил ангидрид, PyBop или PyBrop. Предпочтительно, реакцию осуществляют с использованием RCl или (R)2O в присутствии или отсутствии основания.
Более предпочтительные ацилирующие агенты включают циклопропанкарбонилхлорид и ангидрид циклопропанкарбоновой кислоты.
Когда применяют основание, количество основания составляет предпочтительно от 0,1 до 5,0 эквивалентов, более предпочтительно от 0,1 до 3,0 эквивалентов в расчете от количества соединения B2. В более предпочтительном варианте осуществления, общее количество снования, используемого на этой стадии и на стадии, описанной в указанном выше параграфе (2) составляет от 2,0 до 4,5 эквивалентов, более предпочтительно от 2,0 до 3,0 эквивалентов.
Количество используемого ацилирующего агента составляет предпочтительно от 1,0 до 3,0 эквивалентов в расчете от количества соединения B1, более предпочтительно от 2,0 до 4,5 эквивалентов с учетом общего количества ацилирующего агента, используемого на этой стадии и на стадии, описанной в указанном выше параграфе (2).
Температура реакции составляет предпочтительно от -20°C до 60°C. Время реакции составляет предпочтительно от 0,1 час до 7 дней.
Эта стадия может также осуществляться непрерывно без отбора продукта, полученного на стадии, описанной в указанном выше параграфе (2).
(4) Стадия получения соединения B3 из соединения B2
Растворители, применимые в способе получения соединения B3 из соединения B2 в указанном выше параграфе 4., включают растворители из простых эфиров, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан; апротонные полярные органические растворители, такие как N,N-диметилформамид, диметилсульфоксид, N,N-диметилацетамид, ацетонитрил, N-метил-2-пирролидинон, N-метил-2-пиперазинон и N,N-диметил-2-имидазолидинон; галогенированные растворители, такие, как дихлорметан и хлороформ; или ароматические углеводородные растворители, такие как толуол, хлорбензол и дихлорбензол; и смешанные растворители, составленные из двух или более из этих растворителей. Предпочтительными являются апротонные полярные органические растворители.
Основания, применимые в данном изобретении, включают неорганические основания, такие как карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия, карбонат цезия, гидроксид натрия, гидроксид калия, гидрид натрия, гидрид калия, цианид натрия, цианид калия, гидроксид магния, гидроксид кальция, гидроксид лития, гидроксид бария, и трет-бутоксид калия; и органические основания, такие как 1,8-диазабицикло[5.4.0]ундека-7-ен, 1,5-диазабицикло[4.3.0]нона-5-ен, триэтиламин, диизопропилэтиламин, пиридин, гуанидин, лутидин, коллидин, хинолин, N,N-диметиланилин, N,N-диэтиланилин, фосфазен. Предпочтительными являются карбонат калия, карбонат цезия, трет-бутоксид калия, 1,8-диазабицикло[5.4.0]ундека-7-ен и 1,5-диазабицикло[4.3.0]нона-5-ен и т.п. Более предпочтительным являются 1,8-диазабицикло[5.4.0]ундека-7-ен и 1,5-диазабицикло[4.3.0]нона-5-ен.
Количество применяемого основания составляет предпочтительно от 0,1 до 3,0 эквивалентов, более предпочтительно от 0,1 до 2,0 эквивалентов, в расчете от количества соединения B2.
Температура реакции составляет предпочтительно от 0°C до 150°C. Время реакции составляет предпочтительно от 0,1 час до 7 дней.
(5) Стадия получения соединения C из соединения B3
Растворители, применимые в способе получения соединения C из соединения B3 в указанном выше параграфе 4., включают растворители из простых эфиров, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан; апротонные полярные органические растворители, такие как N,N-диметилформамид, диметилсульфоксид, N,N-диметилацетамид, ацетонитрил, N-метил-2-пирролидинон, N-метил-2-пиперазинон и N,N-диметил-2-имидазолидинон; галогенированные растворители, такие как дихлорметан и хлороформ; или ароматические углеводородные растворители, такие как толуол; и смешанные растворители, составленные из двух или более из этих растворителей. Предпочтительными являются апротонные полярные органические растворители. Особенно предпочтительным является N-метил-2-пирролидинон.
Реакция может осуществляться без применения основания. Однако, когда применяют основание, примеры применимых оснований включают неорганические основания, такие как карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия, гидроксид натрия, гидроксид калия, гидрид натрия, гидрид калия, цианид натрия, цианид калия, гидроксид магния, гидроксид кальция, гидроксид лития, и гидроксид бария; и органические основания, такие как 1,8-диазабицикло[5.4.0]ундека-7-ен, 1,5-диазабицикло[4.3.0]нона-5-ен, триэтиламин, диизопропилэтиламин, пиридин, гуанидин, лутидин, коллидин, 2,2'-бипиридил, трифениламин, хинолин, N,N-диметиланилин и N,N-диэтиланилин. Предпочтительными являются пиридин, 2,6-лутидин, 2,4,6-коллидин, 2,2'-бипиридил, трифениламин, N,N-диметиланилин, N,N-диэтиланилин и т.п. Более предпочтительными являются 2,6-лутидин, 2,4,6-коллидин, трифениламин, N,N-диметиланилин, и N,N-диэтиланилин.
ROH, RCl, (R)2O или смешанный кислотный ангидрид, предпочтительно RCl или (R)2O, применяют в качестве ацилирующего агента для введения R в качестве группы. Реакция может осуществляться в присутствии или отсутствии основания или с использованием конденсирующего агента, такого как дициклогексилкарбодиимид, гидрохлорид l-этил-3-(3-диметиламинопропил)карбодиимида, карбонилдиимидазол, дипиридилдисульфид, диимидазолилдисульфид, 1,3,5-трихлорбензоилхлорид, 1,3,5-трихлорбензоилангидрид, PyBop или PyBrop. Предпочтительно, реакцию осуществляют с использованием RCl или (R)2O в присутствии или отсутствии основания.
Более предпочтительные ацилирующие агенты включают циклопропанкарбонилхлорид и ангидрид циклопропанкарбоновой кислоты.
Когда применяют основание, количество основания составляет предпочтительно от 1,0 до 3,0 эквивалентов в расчете от количества соединения B2.
Количество применяемого ацилирующего агента составляет предпочтительно от 1,0 до 2,5 эквивалентов в расчете от количества соединения B1.
Температура реакции составляет предпочтительно от -20°C до 60°C.
Время реакции составляет предпочтительно от 0,1 час до 7 дней.
(6) Способ очистки и выделения соединения C из неочищенного продукта
Способ получения соединения C посредством кристаллизации предпочтительно упомянут как способ очистки и выделения соединения C из реакционного раствора или неочищенного продукта соединения C, полученного в способе, описанном в указанном выше параграфе (1), (3) или (5). Кристаллы могут быть получены в виде кристаллов сольвата, содержащих растворитель, включенный в кристаллическую решетку. Альтер