Абсорберы видимого света для материалов офтальмологических линз
Иллюстрации
Показать всеИзобретение относится к абсорберам видимого света, в частности к новым мономерам азосоединений, в особенности применимым для использования в материалах для имплантируемых офтальмологических линз. Материал для офтальмологического устройства включает азосоединение, образующий устройство акриловый мономер и сшивающий агент. Офтальмологическое устройство получают из материала для офтальмологического устройства и оно представляет собой внутриглазные линзы, контактные линзы, кератопротезы и корнеальный имплантат или кольцо. Азосоединения подходят для применения в качестве мономеров, которые абсорбируют часть спектра видимого света (приблизительно 380-495 нм). 6 н. и 11 з.п. ф-лы, 6 ил., 3 табл.
Реферат
Область техники, к которой относится изобретение
Данное изобретение относится к абсорберам видимого света. В частности, данное изобретение относится к новым мономерам азосоединений, в особенности применимым для использования в материалах для имплантируемых офтальмологических линз.
Предпосылки создания изобретения
В качестве ингредиентов для полимерных материалов, используемых для изготовления офтальмологических линз, известны абсорберы как УФ, так и видимого света, и подобные абсорберы могут быть использованы в комбинации друг с другом. Предпочтительно, подобные абсорберы не просто включены в данный материал, а ковалентно связаны с полимерной структурой материала линз для того, чтобы предотвратить их миграцию, разделение фаз или вытекание из материала линз. Подобная стабильность особенно важна в случае имплантируемых офтальмологических линз, в которых вытекание абсорбера может представлять собой как токсикологические проблемы, так и приводить к потере активности блокирования УФ/видимого света в имплантате.
Многие абсорберы содержат обычные олефиновые полимеризуемые группы, такие как метакрилатные, акрилатные, метакриламидные, акриламидные или стирольные группы. В результате сополимеризации с другими ингредиентами в материалах для линз, обычно в присутствии радикального инициатора, происходит внедрение абсорберов в образующуюся полимерную цепь. Включение дополнительных функциональных групп в абсорбер может оказать влияние на одно или более свойств светопоглощения, растворимости или реакционноспособности абсорбера. Если абсорбер не обладает достаточной растворимостью в остатке ингредиентов материала для офтальмологических линз или в полимерном материале для линз, абсорбер может коалесцировать в домены, которые могли бы взаимодействовать со светом и приводить к пониженной оптической прозрачности линз.
Примеры абсорберов видимого света, подходящих для использования во внутриглазных линзах, можно найти в патенте США № 5470932. Есть необходимость в дополнительных соединениях, абсорбирующих видимый свет, сополимеризуемых с другими ингредиентами в материалах имплантируемых линз, сравнительно недорогих в получении, и которые эффективны в абсорбции света с длиной волны в интервале 380-495 нм.
Краткое описание изобретения
Настоящее изобретение представляет новые азосоединения, удовлетворяющие упомянутым выше задачам. Данные азосоединения особенно подходят для применения в качестве мономеров, которые абсорбируют часть спектра видимого света (приблизительно 380-495 нм). Данные абсорберы подходят для применения в офтальмологических линзах, включая контактные линзы. Они особенно применимы в имплантируемых линзах, таких как внутриглазные линзы (IOL).
Азосоединения настоящего изобретения содержат реакционноспособные группы, которые позволяют абсорберам ковалентно связываться с материалами глазных линз. Кроме того, абсорберы настоящего изобретения можно синтезировать приблизительно за 3-4 стадии из легкодоступных, недорогих исходных веществ, исключая необходимость использования колоночной хроматографии.
Настоящее изобретение также относится к материалам для офтальмологических устройств, содержащим подобные азосоединения.
Краткое описание чертежей
На фигурах 1-4 представлены кривые коэффициента прозрачности для соединений А-С при различных концентрациях.
На фигуре 5 представлена кривая коэффициента прозрачности для комбинации соединения А и абсорбера УФ («УФ-1»).
На фигуре 6 представлены результаты фотостабильности для препарата примера 11D после оптического экспонирования, эквивалентного 20 годам.
Подробное описание изобретения
Если не указано иначе, все количества ингредиентов, выраженные в процентных долях, представлены в виде % масс./масс.
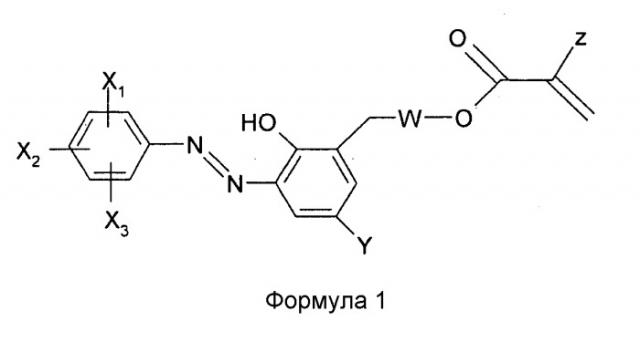
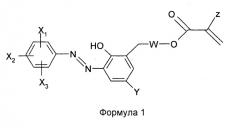
Азосоединения настоящего изобретения имеют структуру
,
в которой
Х1, Х2 и Х3 независимо означают Н, С1-С6 алкил, С1-С6 алкокси, фенокси или бензилокси;
Y означает Н, F, Cl, Br, I или С1-С6 алкил;
W отсутствует или означает -O-C(=O)NH-СН2СН2-; и
Z означает H, CH3, С2Н5 или СН2ОН.
Предпочтительными соединениями формулы I являются соединения, в которых
Х1, Х2 и Х3 независимо означают Н, С1-С4 алкил или С1-С4 алкокси,
Y означает Н, Cl или С1-С4 алкил;
W отсутствует, а
Z означает H или CH3.
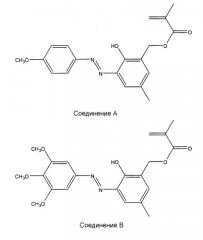
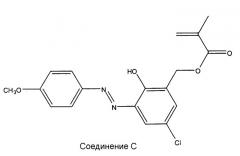
Более предпочтительными соединениями формулы I являются следующие три соединения: 2-гидрокси-3-((4-метоксифенил)диазенил)-5-метилбензилметакрилат («соединение А»); 2-гидрокси-5-метил-3-((3,4,5-триметоксифенил)диазенил)бензилметакрилат («соединение В»); и 5-хлор-2-гидрокси-3-((4-метоксифенил)диазенил)бензилметакрилат («соединение С»).
Более предпочтительными соединениями формулы I являются соединения А и В.
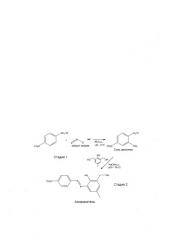
Репрезентативный синтез азосоединений формулы I является следующим.
1. На стадиях 1-2 получают соль диазония производного 2-нитроанилина, а затем вводят ее во взаимодействие с требуемым соединением фенола, получая азокраситель.
2. На стадии 3 свободную гидроксильную группу азокрасителя этерифицируют, получая полимеризуемый азокраситель, содержащий (мет)акрилатную группу. Затем данная (мет)акрилатная группа образует ковалентные связи при взаимодействии с виниловыми мономерами, сомономерами, макромерами, сшивающими агентами и другими компонентами, которые обычно используют при получении сополимерных веществ для глазных приспособлений, в частности, акриловых IOL.
Азосоединения настоящего изобретения подходят для применения в материалах для офтальмологических устройств, в частности IOL. Как правило, материалы для IOL будут содержать от 0,005 до 0,2% (масс./масс.) соединения формулы I. Предпочтительно, материалы для IOL будут содержать от 0,01 до 0,08% (масс./масс.) соединения настоящего изобретения. Наиболее предпочтительно, материалы для IOL будут содержать от 0,01 до 0,05% (масс./масс.) соединения настоящего изобретения. Материалы для подобных устройств получают сополимеризацией соединений формулы I с другими ингредиентами, такими как вещества, образующие устройства, сшивающими агентами. Материалы для IOL или других офтальмологических устройств, содержащие соединения формулы I, необязательно содержат абсорберы УФ и другие абсорберы видимого света.
В данной области известно много веществ, образующих устройства, и они включают, помимо прочего, как акриловые, так и кремнийсодержащие мономеры. См., например, патенты США № 7101949, 7067602, 7037954, 6872793, 6852793, 6846897, 6806337, 6528602 и 5693095. В случае IOL для применения в композициях настоящего изобретения подходит любой известный материал для IOL. Предпочтительно, материалы для офтальмологических устройств содержат акриловый или метакриловый мономер, образующий устройство. Более предпочтительно, образующие устройства мономеры содержат мономер формулы II:
,
где в формуле II:
А представляет собой Н, СН3, СН2СН3 или СН2ОН;
В представляет собой (СН2)m или [O(СН2)2]z;
C представляет собой (СН2)w,
m равно 2-6;
z равно 1-10;
Y отсутствует или представляет собой O, S или NR', при условии, что если Y является O, S или NR', то В представляет собой (СН2)m;
R' представляет собой Н, СН3, Cn'H2n'+1 (n'=1-10), изо-ОС3Н7, С6Н5 или СН2С6Н5;
w равно 0-6, при условии, что m+w≤8; и
D представляет собой Н, С1-С4 алкил, С1-С4 алкокси, С6Н5, СН2С6Н5 или галоген.
Предпочтительными мономерами формулы II являются мономеры, в которых А представляет собой Н или СН3, В представляет собой (СН2)m, m равно 2-5, Y отсутствует или представляет собой O, w равно 0-1, а D представляет собой Н. Наиболее предпочтительными являются 2-фенилэтилметакрилат, 4-фенилбутилметакрилат, 5-фенилпентилметакрилат, 2-бензилоксиэтилметакрилат и 3-бензилоксипропилметакрилат и их соответствующие акрилаты.
Мономеры формулы II известны и могут быть получены известными способами. Например, сопряженный спирт требуемого мономера можно соединить в реакционном сосуде с метилметакрилатом, тетрабутилтитанатом (катализатор) и ингибитором полимеризации, таким, как 4-бензилоксифенол. Затем данный сосуд можно нагреть для содействия реакции и отогнать побочные продукты реакции, чтобы довести реакцию до завершения. Альтернативные схемы синтеза включают прибавление метакриловой кислоты к сопряженному спирту и катализ карбодиимидом или смешивание сопряженного спирта с метакрилоилхлоридом и основанием, таким как пиридин или триэтиламин.
Материалы для устройств обычно содержат в целом по меньшей мере около 75%, предпочтительно по меньшей мере около 80%, мономеров, образующих устройство.
Помимо абсорбера настоящего изобретения и образующего устройство мономера, материалы для устройств настоящего изобретения обычно включают сшивающий агент. Сшивающий агент, используемый в материалах для устройств настоящего изобретения, может представлять собой любое терминально ненасыщенное по этиленовому типу соединение, содержащее более одной ненасыщенной группы. Подходящие сшивающие агенты включают, например, этиленгликольдиметакрилат, диэтиленгликольдиметакрилат, аллилметакрилат, 1,3-пропандиолдиметакрилат, 2,3-пропандиолдиметакрилат, 1,6-гександиолдиметакрилат, 1,4-бутандиолдиметакрилат, СН2=С(СН3)С(=О)О-(СН2СН2О)p-C(=O)C(CH3)=CH2, где р=1-50 и СН2=С(СН3)С(=О)О(СН2)tO-C(=O)C(CH3)=CH2, где t=3-20 и их соответствующие акрилаты. Предпочтительным сшивающим мономером является СН2=С(СН3)С(=О)О-(СН2СН2О)p-C(=O)C(CH3)=CH2, где р такой, что среднечисленная молекулярная масса составляет около 400, около 600 или около 1000.
В целом, общее количество сшивающего компонента составляет по меньшей мере 0,1% масс., и, в зависимости от идентичности и концентрации остальных компонентов и требуемых физических свойств, может изменяться до примерно 20% масс. Предпочтительный интервал концентрации сшивающего компонента составляет 1-5% для малых гидрофобных соединений с молекулярными массами, составляющими обычно менее 500 дальтон, и 5-17% (масс./масс.) для больших гидрофильных соединений с молекулярными массами обычно в интервале 500-5000 дальтон.
Подходящие инициаторы полимеризации для материалов устройств, содержащих абсорбер УФ/вид. настоящего изобретения, включают термические инициаторы и фотоинициаторы. Предпочтительные термические инициаторы включают пероксидные свободнорадикальные инициаторы, такие как трет-бутил(перокси-2-этил)гексаноат и ди(трет-бутилциклогексил)пероксидикарбонат (коммерчески доступный в виде Perkadox® 16 от Akzo Chemicals Inc. Chicago, Illinois). Обычно инициаторы присутствуют в количестве от около 5% (масс./масс), или менее. Поскольку свободнорадикальные инициаторы химически не становятся частью образующегося полимера, общее количество инициатора обычно не включают в определение количества прочих ингредиентов.
Материалы для устройств, содержащие азосоединение настоящего изобретения, также необязательно включают абсорбер УФ и/или другой абсорбер видимого света. Известно много реакционноспособных (сополимеризуемых) абсорберов УФ, которые подходят для использования в имплантируемых офтальмологических линзах и устройствах. Предпочтительные абсорберы УФ включают абсорберы, описанные в одной из двух совместно переданных, предварительных патентных заявок США с серийным номером 61/111204, одновременно находящихся на рассмотрении патентного ведомства, поданных 4 ноября 2008 года. Абсорберы УФ обычно присутствуют в материалах для внутриглазных линз.
Помимо азосоединения формулы I, образующего устройство мономера, сшивающего агента, и, необязательно, абсорбера УФ и/или другого абсорбера видимого света, материалы настоящего изобретения могут также включать другие ингредиенты для снижения клейкости и отблесков. Примерами агентов для уменьшения клейкости являются агенты, описанные в публикации США № 2009/0132039 А1 и 2009/0137745 А1. Примерами агентов для уменьшения отблесков являются агенты, описанные в публикации США № 2009/0093604 А1 и 2009/0088544 А1.
IOL, созданные из материалов настоящего изобретения, могут иметь любую конструкцию, которую можно свернуть или сложить до небольшого поперечного сечения, которое пройдет в сравнительно меньший разрез. Например, IOL могут представлять собой то, что известно как моноблочный или полиблочный дизайн, и включать оптические и тактильные компоненты. Оптика представляет собой ту часть, которая служит в качестве линзы. Тактильные компоненты связаны с оптикой и удерживают оптику в глазу на надлежащем месте. Оптический и тактильный(е) компоненты могут быть из одного и того же или из разного материала. Полиблочные линзы называются так потому, что оптический и тактильный(е) компоненты изготовлены отдельно, а затем тактильные компоненты связаны с оптическими. В моноблочных линзах оптический и тактильный компоненты получены из одной части материала. В зависимости от материала, тактильные компоненты затем отсекают, или стачивают с материала, получая IOL.
Помимо IOL, материалы настоящего изобретения также подходят для использования в других офтальмологических устройствах, таких как контактные линзы, кератопротезы и корнеальные имплантаты или кольца.
Далее изобретение будет иллюстрировано следующими примерами, которые предназначены для иллюстрации, но не ограничения.
Пример 1
Синтез 2-(гидроксиметил)-4-метил-6-((3,4,5-триметоксифенил)диазенил)фенола. В круглодонную колбу на 250 мл, снабженную магнитной мешалкой, помещали 9,06 г (49,4 ммоль) 3,4,5-триметоксианилина (Aldrich, Milwaukee, WI), 21 мл концентрированной HCl (водн.) (J.T. Baker), 100 мл абсолютного этанола и 100 мл деионизированной воды. В течение 30 минут прибавляли по каплям нитрит натрия (3,63 г, 52,6 ммоль, Sigma-Aldrich) в 30 мл воды, поддерживая температуру реакционной смеси при -10°С. Реакционную смесь перемешивали еще в течение 1 часа. Прибавляли сульфаминовую кислоту (300 мг, Aldrich) и перемешивали смесь еще в течение 20 минут. Твердое вещество отфильтровывали, а холодный фильтрат оставляли. (2-Гидрокси-5-метил-1,3-фенилен)диметанол растворяли в 100 мл деионизированной воды. К раствору (2-гидрокси-5-метил-1,3-фенилен)диметанола прибавляли приблизительно одну четвертую объема раствора, содержащего 10,0 г (250 ммоль) NaOH в воде, и охлаждали смесь до 0°С. В течение 30-60 минут к смеси (2-гидрокси-5-метил-1,3-фенилен)диметанола одновременно прибавляли смесь диазония и оставшийся раствор NaOH, а затем перемешивали в течение 1 часа при 0°С и в течение 4 часов при температуре окружающей среды. Смесь выливали в 3 л деионизированной воды и подкисляли до рН 4 1N HCl. Твердое вещество отфильтровывали и промывали несколькими литрами воды и сушили в вакууме при 50°С, получая твердый продукт темного цвета.
lH ЯМР (CDCl3) дельта: 13,21 (с, 1H, Ar-OH), 7,71 (с, 1H, Ar-H), 7,21 (с, 1H, Ar-H), 7,15 (с, 2H, Ar-OH), 4,78 (с, 2H, Ar-CH2), 3,96 (с, 6H, Ar-OCH3), 3,94 (с, 3H, Ar-OCH3), 2,39 (с, 3H, Ar-CH3).
Данное соединение (и другие соединения, приведенные ниже) можно функционализировать боковыми (мет)акрилатными группами (согласно формуле I) при помощи различных способов этерификации. Например, данное соединение растворяют в безводном тетрагидрофуране, или хлористом метилене, содержащем MEHQ в качестве ингибитора и пиридин в качестве акцептора HCl. Прибавляли по каплям приблизительно 1-1,5 молярных эквивалента метакрилоилхлорида при -20-0°С. В процессе прибавления метакрилоилхлорида охлаждающую баню убирают и оставляют реакционную смесь перемешиваться при температуре окружающей среды в течение 20 часов. Соли HCl выделяют фильтрованием, а органический слой промывают 0,5-1N HCl, сушат над MgSO4 или Na2SO4, а затем концентрируют при пониженном давлении, получая сырой продукт, который перекристаллизовывают из метанола или этанола, получая требуемый продукт. Прочие стандартные способы этерификации, которые известны специалистам в данной области, включают способы с использованием метакрилового ангидрида и метилметакрилата.
Пример 2
Синтез 2-(гидроксиметил)-6-((4-метоксифенил)диазенил)-4-метилфенола. В круглодонную колбу на 250 мл, снабженную магнитной мешалкой, помещали 8,91 г (72,4 ммоль) п-анизидина (Aldrich), 30 мл концентрированной HCl (водн.) (J.T. Baker), 150 мл абсолютного этанола и 150 мл деионизированной воды. В течение 30 минут прибавляли по каплям нитрит натрия (5,36 г, 77,6 ммоль), в 30 мл воды, поддерживая температуру реакционной смеси при -10°С. Реакционную смесь перемешивали еще в течение 1 часа. Прибавляли 300 мг сульфаминовой кислоты, а затем перемешивали еще в течение 20 минут. Твердое вещество отфильтровывали, а холодный раствор диазония оставляли. (2-Гидрокси-5-метил-1,3-фенилен)диметанол растворяли в 100 мл деионизированной воды. К раствору (2-гидрокси-5-метил-1,3-фенилен)диметанола прибавляли приблизительно одну четвертую объема раствора, содержащего 14,7 г (367 ммоль) NaOH в воде, и охлаждали смесь до 0°С. В течение 30-60 минут к смеси (2-гидрокси-5-метил-1,3-фенилен)диметанола одновременно прибавляли смесь диазония и оставшийся раствор NaOH, а затем перемешивали еще в течение 1 часа при 0°С и в течение 4 часов при температуре окружающей среды. Смесь выливали в 3 л деионизированной воды и подкисляли до рН 4 1N HCl. Твердое вещество отфильтровывали и промывали несколькими литрами воды и сушили в вакууме при 50°С, получая 15,9 г (81%) твердого вещества оранжевого цвета.
1H ЯМР (CDCl3) дельта: 13,22 (с, 1H, Ar-OH), 7,85 (м, 2H, Ar-H), 7,66 (с, 1H, Ar-H), 7,17 (с, 1H, Ar-H), 7,03 (м, 2H, Ar-H), 4,77 (с, 2H, Ar-CH2), 3,89 (с, 3H, CH3O-Ar), 2,37 (с, 3H, Ar-СН3).
Пример 3
Синтез 2-метокси-3-((4-метоксифенил)диазенил)-5-метилбензилметакрилата («Соединение А»). В круглодонной колбе на 500 мл, снабженной магнитной мешалкой и вводом азота, растворяли 8,75 г (32,1 ммоль) 2-(гидроксиметил)-6-((4-метоксифенил)диазенил)-4-метилфенола в 300 мл безводного ТГФ. Прибавляли ~50 мг 4-метоксифенола (MEHQ), затем 16,5 г (209 ммоль) безводного пиридина. Реакционную смесь охлаждали до -20°С и прибавляли по каплям 4,91 г (47,0 ммоль) метакрилоилхлорида. Реакционную смесь перемешивали в течение 1 часа при -20°С, а затем в течение 20 часов при температуре окружающей среды. Осадок отфильтровывали и прибавляли к фильтрату диэтиловый эфир (200 мл) и этилацетат (200 мл). Органический слой промывали 0,5 N HCl, а затем сушили над сульфатом магния. Растворитель удаляли при пониженном давлении, а сырой продукт перекристаллизовывали из метанола, получая твердое вещество оранжевого цвета, которое промывали холодным этанолом, а затем сушили в течение 20 часов в вакууме (0,1 мм рт. ст.) при комнатной температуре, получая 7,0 г (64%).
1H ЯМР (CDCl3) дельта: 13,12 (с, 1H, Ar-OH), 7,84 (м, 2H, Ar-H), 7,68 (с, 1H, Ar-H), 7,23 (с, 1H, Ar-H), 7,02 (м, 2H, Ar-H), 6,16 (с, 1H, винильный-H), 5,58 (с, 1H, винильный-H), 5,31 (с, 2H, Ar-CH2), 3,89 (с, 3H, CH3O-Ar), 2,38 (с, 3H, Ar-CH3), 1,98 (с, 3H, C=C-CH3).
Пример 4
Синтез (5-хлор-2-гидрокси-1,3-фенилен)диметанола. В 1-литровой градуированной колбе, снабженной магнитной мешалкой, суспендировали 100,4 г (781 ммоль) 4-хлорфенола (99+%, Aldrich) в 500 мл воды. К реакционной смеси прибавляли по каплям раствор, содержащий 38,9 г (973 ммоль) NaOH в 100 мл, что приводило к тому, что суспензия становилась прозрачной. Прибавляли 168 г (2,07 моль) раствора формальдегида (37% в воде, Aldrich) и накрывали реакционную смесь алюминиевой фольгой и оставляли перемешиваться в течение 10 дней при температуре окружающей среды и еще на 3 дня без перемешивания. Смесь охлаждали до 0°С и фильтровали. Осадок суспендировали в ~800 мл воды и подкисляли 70 мл ледяной уксусной кислоты. Смесь охлаждали до 0°С, фильтровали и суспендировали осадок в 500 мл воды, охлаждали до 0°С и фильтровали. Твердое вещество почти белого цвета сушили в вакууме, получая 43,8 г (30%).
1Н ЯМР (DMF-d7) дельта: 7,35 (с, 2Н, Ar-Н), 4,86 (с, 4Н, Ar-CH2).
Пример 5
Синтез 4-хлор-2-(гидроксиметил)-6-((4-метоксифенил)диазенил)фенола. В круглодонную колбу на 250 мл, снабженную магнитной мешалкой, помещали 7,60 г (61,7 ммоль) п-анизидина, 26 мл концентрированной HCl (водн.), 150 мл абсолютного этанола и 150 мл деионизированной воды. В течение 30 минут прибавляли по каплям нитрит натрия (4,58 г, 66,3 ммоль) в 30 мл воды, поддерживая температуру реакционной смеси при -10°С. Реакционную смесь перемешивали еще в течение 1 часа. Прибавляли 300 мг сульфаминовой кислоты, а затем перемешивали еще в течение 20 минут. Твердое вещество отфильтровывали, а холодный раствор диазония оставляли. (5-Хлор-2-гидрокси-1,3-фенилен)диметанол из примера 3 растворяли в 100 мл деионизированной воды. К раствору (5-хлор-2-гидрокси-1,3-фенилен)диметанола прибавляли приблизительно одну четвертую объема раствора, содержащего 12,7 г (318 ммоль) NaOH в воде, и охлаждали реакционную смесь до 0°С. В течение 30-60 минут к смеси (5-хлор-2-гидрокси-1,3-фенилен)диметанола одновременно прибавляли смесь диазония и оставшийся раствор NaOH. Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Смесь выливали в 3 л деионизированной воды и подкисляли до рН 4 1N HCl. Твердое вещество отфильтровывали и промывали несколькими литрами воды и сушили в вакууме при 50°С, получая твердое вещество темного цвета.
Данное соединение можно этерифицировать в соответствии с известными способами (см. приведенный выше пример 1).
Пример 6
Синтез (5-бром-2-гидрокси-1,3-фенилен)диметанола. В 2-литровой градуированной колбе, снабженной магнитной мешалкой, суспендировали 101 г (585 ммоль) 4-бромфенола в 500 мл воды. К реакционной смеси прибавляли за один раз раствор, содержащий 28,9 г (723 ммоль) NaOH в 100 мл. Затем прибавляли 128 г (1,58 моль) раствора формальдегида (Aldrich, 37% в воде) и накрывали реакционную смесь алюминиевой фольгой и оставляли стоять в течение 45 дней при температуре окружающей среды. Для высаживания осадки прибавляли ледяную уксусную кислоту (60 мл, 1,0 моль). Данный осадок промывали ампульными количествами воды, а затем сушили в высоком вакууме (0,1 мм рт.ст.) в течение 20 часов при 50°С, получая 101,2 г (74%) твердого вещества светло-оранжевого цвета.
1H ЯМР (DMF-d7) дельта: 8,21 (с, 1H, фенольный-OH), 7,56 (с, 2H, Ar-H), 5,70 (с, 2H, OH), 4,90 (с, 4H, CH2).
Пример 7
Синтез 4-бром-2-(гидроксиметил)-6-(п-толилдиазенил)фенола. В круглодонную колбу на 500 мл, снабженную магнитной мешалкой, помещали 10,6 г (98,9 ммоль) п-толуидина (Aldrich), 42 мл концентрированной HCl (водн.) (J.T. Baker), деионизированную воду (100 мл) и этанол (100 мл) и охлаждали реакционную смесь до 0°С. В течение 30 минут прибавляли по каплям нитрит натрия (7,21 г, 104 ммоль) в 50 мл воды, поддерживая температуру реакционной смеси при 0°С. Реакционную смесь перемешивали еще в течение 1 часа. Прибавляли 300 мг сульфаминовой кислоты для разложения избытка нитрита и перемешивали смесь еще в течение 20 минут. (5-Бром-2-гидрокси-1,3-фенилен)диметанол из примера 6 растворяли в 400 мл смеси 50/50 этанол/деионизированная вода. К раствору (5-бром-2-гидрокси-1,3-фенилен)диметанола прибавляли при 0°С приблизительно одну четвертую объема раствора, содержащего 21,3 г (533 ммоль) NaOH в 100 мл воды. В течение 60 минут к смеси (5-бром-2-гидрокси-1,3-фенилен)диметанола одновременно прибавляли смесь диазония и оставшийся раствор NaOH. Реакционную смесь перемешивали в течение 20 часов при температуре окружающей среды, а затем выливали в 3,5 л деионизированной воды и подкисляли до рН 4-5 1N HCl. Твердое вещество отфильтровывали, промывали ампульными количествами воды и сушили в вакууме (0,1 мм рт.ст.), получая 16,64 г (52%) твердого продукта темного цвета.
Как в случае примера 6, данное соединение можно этерифицировать в соответствии с известными способами (см. приведенный выше пример 1).
Пример 8
Синтез 2-(гидроксиметил)-4-метил-6-(п-толилдиазенил)фенола. В круглодонную колбу на 500 мл, снабженную магнитной мешалкой, помещали 10,6 г (98,9 ммоль) п-толуидина (99%, Aldrich), 42 мл (500 ммоль) концентрированной HCl (водн.) (J.T. Baker), деионизированную воду (100 мл) и этанол (100 мл) и охлаждали реакционную смесь до 0°С. В течение 20 минут прибавляли при 0°С по каплям нитрит натрия (7,21 г, 105 ммоль) (Sigma-Aldrich) в 50 мл воды. Реакционную смесь перемешивали еще в течение 1 часа. Прибавляли 300 мг сульфаминовой кислоты (Aldrich) для разложения избытка нитрита и перемешивали смесь еще в течение 20 минут. (2-Гидрокси-5-метил-1,3-фенилен)диметанол (95%, Aldrich) растворяли в 400 мл смеси 50/50 этанол/деионизированная вода. К раствору (2-гидрокси-5-метил-1,3-фенилен)диметанола прибавляли приблизительно одну четвертую объема водного раствора гидроксида натрия (>97%, Aldrich) (21,34 г/100 мл) и охлаждали до 0°С. В течение 60 минут к смеси (2-гидрокси-5-метил-1,3-фенилен)диметанола одновременно прибавляли смесь диазония и оставшийся раствор NaOH. Реакционную смесь перемешивали в течение 20 часов при комнатной температуре, а затем выливали в 3,5 л деионизированной воды и подкисляли до рН 4-5 1N HCl. Твердое вещество отфильтровывали и сушили в высоком вакууме до постоянного веса, получая 17,8 г (70%) твердого вещества оранжевого цвета.
1H ЯМР (CDCl3) дельта: 13,28 (с, 1H, Ar-OH), 7,76 (д, 2H, Ar-H), 7,68 (с, 1H, Ar-H), 7,31 (д, 2H, Ar-H), 7,19 (с, 1H, Ar-H), 4,77 (с, 2H, CH2), 2,44 (с, 3H, Ar-CH3), 2,38 (с, 3H, Ar-CH3).
Как в случае примера 6, данное соединение можно этерифицировать в соответствии с известными способами (см. приведенный выше пример 1).
Пример 9
Синтез 2-((2-гидрокси-3-((4-метоксифенил)диазенил)-5-метилбензилокси)карбониламино)этилметакрилата. В 3-горлой круглодонной колбе на 500 мл, снабженной магнитной мешалкой и вводом азота, растворяли 5,01 г (18,4 ммоль) 2-(гидроксиметил)-6-((4-метоксифенил)диазенил)-4-метилфенола из примера 2 в 300 мл безводного ТГФ. Прибавляли октоат олова (50 мг, Pfaltz & Bauer), затем 2-изоцианатоэтилметакрилат (3,14 г, 20,2 ммоль). Прибавляли MEHQ (100 мг). Реакционную смесь перемешивали в течение 20 ч при 60°С, а затем выливали в 200 мл диэтилового эфира и промывали 0,5 N HCl и водой. Органический слой сушили над сульфатом магния, фильтровали и упаривали на роторном испарителе, получая требуемый продукт, который перекристаллизовывали из этанола, получая 6,0 г (76%) твердого вещества оранжевого цвета.
1H ЯМР (CDCl3) дельта: 13,22 (c, 1H, Ar-OH), 7,85 (м, 2H, Ar-H), 7,69 (с, 1H, Ar-H), 7,23 (с, 1H, Ar-HI), 7,03 (м, 2H, Ar-H), 6,09 (с, 1H, винильный-H), 5,57 (с, 1H, винильный-H), 5,24 (с, 2H, Ar-CH2), 5,02 (с, 1H, CONH), 4,24 (м, 2H, CH2OCO), 3,90 (с, 3H, Ar-OCH3), 3,53 (м, 2H, OCNHCH2), 2,38 (с, 3H, Ar-CH3), 1,92 (с, 3H, CH3-C=C).
Пример 10
Кривые прозрачности для соединений А-С получали при помощи УФ/вид. спектроскопии. Каждое соединение растворяли в хлороформе в указанной концентрации и проводили его оценку при помощи спектрометра PerkinElmer Lambda 35 UV/Vis. Результаты приведены на фигурах 1-4. Кроме того, кривую прозрачности для сочетания соединения А и абсорбера УФ 2-гидрокси-5-метокси-3-(5-(трифторметил)-2Н-бензо[d][1,2,3]триазол-2-ил)бензилметакрилата («УФ-1», приведен ниже) получали по аналогичной методике. Результаты для данного сочетания приведены на фигуре 5.
Пример 11
Препараты акриловых IOL
Из соединений формулы I можно получить состав для материала для IOL, как показано в приведенных ниже таблицах 1-3. Все компоненты перемешивали при вращении в стеклянном сосуде на 30 мл, дегазировали азотом, а затем фильтровали при помощи шприца с использованием 0,2-микронного тефлонового фильтра в полипропиленовые матрицы. Образцы подвергали термической обработке при 70°С в течение 1 часа и при 110°С в течение 2 часов, а затем экстрагировали ацетоном при 50°С в течение 6 часов при замене растворителя на свежий каждые 90 минут.
| Таблица 1 | ||||
| Пример | ||||
| % (масс./масс.) | ||||
| Компонент | 11А | 11В | 11С | 11D |
| Соединение АУФ-1 | 0,02081,48 | 0,02001,49 | 0,02001,50 | 0,0241,52 |
| РЕА | 73,1 | 73,9 | 0 | 73,6 |
| РЕМА | 20,9 | 20,0 | 0 | 19,3 |
| BzA | 0 | 0 | 94,0 | 0 |
| Этилат вторичного спирта, эфир метакриловой кислоты | 3,00 | 3,03 | 3,00 | 3,00 |
| BDDA | 1,53 | 1,49 | 1,50 | 1,53 |
| PSMA | 0 | 0 | 0 | 1,00 |
| Perkadox 16S | 0 | 0,99 | 1,0 | 1,01 |
| AIBN | 0,50 | 0 | 0 | 0 |
| РЕА = 2-фенилэтилакрилатРЕМА = 2-фенилэтилметакрилатBzA = бензилакрилатBDDA = 1,4-бутандиолдиакрилатЭтилат вторичного спирта, эфир метакриловой кислоты = эфир метакриловой кислоты и поверхностно-активного вещества Tergitol™ NP-70 (Dow/Union Carbide)AIBN = 2,2'-азобис(2-метилпропионитрил)Perkadox 16S = ди(4-трет-бутилциклогексил)пероксидикарбонат (AlzoNobel)PSMA = раствор полистирола, терминированного метакрилатом (Aldrich, Mn~12000) (33% масс. в циклогексане), отфильтрованный и осажденный. |
| Таблица 2 | |||
| Пример | |||
| (% масс./масс.) | |||
| Компонент | 11D | 11E | 11F |
| Соединение АУФ-1 | 0,03001,51 | 0,02021,46 | 0,0251,50 |
| РЕА | 73,1 | 0 | 73,6 |
| РЕМА | 20,9 | 0 | 19,3 |
| BzA | 0 | 94,1 | 0 |
| polyPEGMA | 3,00 | 3,00 | 3,01 |
| BDDA | 1,53 | 1,45 | 1,53 |
| PSMA | 0 | 0 | 1,00 |
| Perkadox 16S | 0 | 1,04 | 0,99 |
| AIBN | 0,50 | 0 | 0 |
| PolyPEGMA = макромономер метакрилата монометилового эфира поли(этиленгликоля) (М=550), Mn (SEC): 4100 Дальтон, Mn (ЯМР): 3200 Дальтон, PDI=1,50. |
| Таблица 3 | ||||
| Пример | ||||
| % (масс./масс.) | ||||
| Компонент | 11G | 11H | 11I | 11J |
| Соединение АУФ-1 | 0,021,12 | 0,021,12 | 0,021,12 | 0,021,12 |
| РЕА | 0 | 74,1 | 73,3 | 74,3 |
| РЕМА | 0 | 19,9 | 20,0 | 20,0 |
| BzA | 94,3 | 0 | 0 | 0 |
| polyPEGMA | 0 | 0 | 0 | 3,00 |
| polyPEGMA-2 | 3,02 | 3,25 | 3,06 | 0 |
| BDDA | 1,53 | 1,54 | 1,50 | 1,52 |
| PSMAPerkadox 16S | 00 | 00 | 1,001,25 | 00 |
| AIBN | 0,50 | 0,50 | 0 | 0,50 |
| PolyPEGMA-2 = макромономер метакрилата монометилового эфира поли(этиленгликоля) (М=475), Mn (SEC): 11000 Дальтон, PDI=1,2. |
Пример 12
Фотостабильность
Образцы препарата 11D подвергали УФ облучению с длиной волны от 300 до 800 нм при помощи камеры для проведения испытаний Atlas Suntest CPS+ (Atlas Electric Devices Company, Chicago, Illinois) с использованием ксеноновой дуговой лампы с интенсивностью света приблизительно 8-10 мВ/см2 на верху тестируемого образца. Температура среды PBS составляла 35°С. Спектры УФ/вид. срезов образца толщиной 0,9 мм получали при помощи спектрометра PerkinElmer Lambda 35 UV/Vis. Результаты оптического экспонирования, эквивалентные 20 годам (пример 11D, N=3), приведены на фигуре 6.
Данное изобретение было описано со ссылкой на некоторые предпочтительные варианты осуществления, однако следует понимать, что оно может быть воплощено в других конкретных формах или их модификациях, не выходя за рамки его конкретных, или существенных характеристик. Поэтому описанные выше варианты осуществления во всех отношениях считаются иллюстративными и не ограничивающими, при этом рамки данного изобретения указаны приведенной формулой изобретения, а не предшествующим описанием.
1. Азосоединение формулы где X1, X2 и X3 независимо представляют собой H, C1-C6 алкил, C1-C6 алкокси, фенокси или бензилокси;Y представляет собой H, F, Cl, Br, I или C1-C6 алкил;W отсутствует или представляет собой -O-С(=O)NH-CH2CH2-; иZ представляет собой Н, СН3, C2H5 или CH2OH.
2. Азосоединение по п.1, гдеX1, X2 и X3 независимо представляют собой Н, C1-C4 алкил или C1-C4 алкокси,Y представляет собой Н, Cl или C1-C4 алкил;W отсутствует, аZ представляет собой Н или CH3.
3. Азосоединение по п.2, где соединение выбирают из группы, состоящей из 2-гидрокси-3-((4-метоксифенил)диазенил)-5-метилбензилметакрилата, 2-гидрокси-5-метил-3-((3,4,5-триметоксифенил)диазенил)бензилметакрилата и 5-хлор-2-гидрокси-3-((4-метоксифенил)диазенил)бензилметакрилата.
4. Азосоединение по п.3, где соединение представляет собой 2-гидрокси-3-((4-метоксифенил)диазенил)-5-метилбензилметакрилат.
5. Материал для офтальмологического устройства, включающий азосоединение по п.1, образующий устройство акриловый мономер и сшивающий агент.
6. Материал для офтальмологического устройства по п.5, содержащий от 0,005 до 0,2% (масс./масс.) азосоединения по п.1.
7. Материал для офтальмологического устройства по п.6, содержащий от 0,01 до 0,08% (масс./масс.) азосоединения по п.1.
8. Материал для офтальмологического устройства по п.7, содержащий от 0,01 до 0,05% (масс./масс.) азосоединения по п.1.
9. Материал для офтальмологического устройства по п.5, содержащий образующий устройство мономер формулы [II]: где в формуле [II]:А представляет собой Н, СН3, СН2СН3 или СН2ОН;В представляет собой (СН2)m или [O(СН2)2]z;С представляет собой (CH2)w,m равно 2-6;z равно 1-10;Y отсутствует или представляет собой О, S или NR′, при условии, что если Y является О, S или NR′, то В представляет собой (СН2)m;R′ представляет собой Н, СН3, Cn′H2n′+1 (n′=1-10), изо-ОС3Н7, C6H5 или СН2С6Н5;w равно 0-6, при условии, что m+w≤8; иD представляет собой Н, C1-C4 алкил, C1-C4 алкокси, C6H5, CH2C6H5 или галоген.
10. Материал для офтальмологического устройства по п.9, где в формуле [II]:А представляет собой Н или СН3;В представляет собой (СН2)m;m равно 2-5;Y отсутствует или представляет собой О;w равно 0-1; иD представляет собой Н.
11. Материал для офтальмологического устройства по п.10, содержащий мономер, выбранный из группы, состоящей из 2-фенилэтилметакрилата, 4-фенилбутилметакрилата, 5-фенилпентилметакрилата, 2-бензилоксиэтилметакрилата и 3-бензилоксипропилметакрилата и их соответствующих акрилатов.
12. Материал для офтальмологического устройства по п.6, содержащий реакционноспособное соединение, поглощающее УФ-лучи.
13. Внутриглазные линзы, полученные из материала для офтальмологического устройства по любому из пп.5-12, содержащего азосоединение по п.1.
14. Внутриглазные линзы, полученные из материала для офтальмологического устройства по любому из пп.5-12, содержащего азосоединение по п.2.
15. Внутриглазные линзы, полученные из материала для офтальмологического устройства по любому из пп.5-12, содержащего азосоединение по п.3.
16. Офтальмологическое устройство, полученное из материала для офтальмологического устройства по п.5.
17. Офтальмологическое устройство по п.16, выбранное из группы, включающей внутриглазные линзы, контактные линзы, кератопротезы и корнеальный имплантат или кольцо.