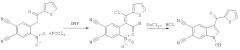
Способ получения 1-гидрокси-3-r-индол-5,6-дикарбонитрилов
Иллюстрации
Показать всеИзобретение относится к способу получения 1-гидрокси-3-R-индол-5,6-дикарбонитрилов структурной формулы:
, где R=С6Н5 или 4-СН3С6Н4, или 4-ОСН3С6Н4, или 2-тиенил, который включает две стадии, при этом на первой стадии замещенные 4-нитро-5-(2-оксоэтил)фталонитрилы реагируют с хлорокисью фосфора POCl3, взаимодействие указанных реагентов протекает при температуре 90…110°C и мольном соотношении 1:2-3, соответственно, в течение 2.5-5 часов в растворе ДМФА, затем реакционную массу охлаждают, выливают в холодный 5…40-ный % раствор гидрокарбоната натрия, далее выпавший кристаллический осадок отфильтровывают и перекристаллизовывают из спирта, сушат на воздухе, а на второй стадии к раствору двухлористого олова в концентрированной соляной кислоте при температуре 30…50°C при интенсивном перемешивании прибавляют раствор полученного 4-замещенного 5-нитрофталонитрила в этиловом спирте при мольном соотношение 2.8-4.5:1, соответственно, и времени реакции 1-2 часа, полученную реакционную массу охлаждают, образовавшийся осадок 1-гидрокси-3-R-индол-5,6-дикарбонитрилов отфильтровывают и перекристаллизовывают из спирта, сушат на воздухе. Технический результат: разработан способ получения индол-дикарбонитрилов, которые могут быть использованы в качестве прекурсоров для синтеза биологически активных веществ, для синтеза фталоцианинов, гексазоцикланов. 1 табл. 4 пр.
Реферат
Изобретение относится к способу получения новых азотсодержащих гетероциклических соединений, а именно 1-гидрокси-3-R-индол-5,6-дикарбонитрилов, которые могут быть использованы в качестве прекурсоров для синтеза биологически активных веществ, для синтеза фталоцианинов, гексазоцикланов.
Данные соединения являются новыми, и из уровня техники нам не известны способы получения таких соединений.
Задачей изобретения является разработка способа получения 1-гидрокси-3-R-индол-5,6-дикарбонитрилов структурной формулы:
где R=С6Н5 или 4-СН3С6Н4, или 4-ОСН3С6Н4, или 2-тиенил.
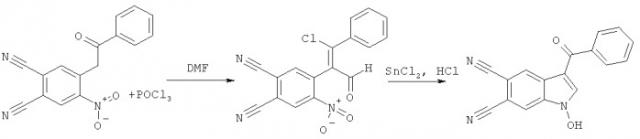
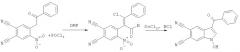
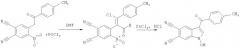
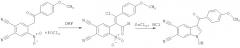
Поставленная задача достигается тем, что способ синтеза 1-гидрокси-3-R-индол-5,6-дикарбонитрилов включает две стадии. На первой стадии при взаимодействии замещенных 4-нитро-5-(2-оксоэтил)фталонитрилов, полученных по патенту RU 2443681 С2, опуб. 27.02.2012, и хлорокиси фосфора POCl3 происходит образование соответствующих 4-замещенных 5-нитрофталонитрилов. На второй стадии 4-замещенные 5-нитрофтало-нитрилы восстанавливают двухлористым оловом с получением 1-гидрокси-3-R-индол-5,6-дикарбонитрилов.
Вышеуказанные соединения получают следующей реакцией:
,
,
,
при условиях, описанных ниже.
На первой стадии взаимодействие реагентов протекает при температуре 90…110°C и мольном соотношении 1:2-3, соответственно, в течение 2.5-5 часов в растворе ДМФА. Полученную реакционную массу охлаждают, выливают в холодный 5…20-ый % раствор гидрокарбоната натрия. Выпавший кристаллический осадок 4-замещенного 5-нитрофталонитрила отфильтровывают и перекристаллизовывают из спирта. Сушат на воздухе. На второй стадии к раствору двухлористого олова в концентрированной соляной кислоте при температуре 30…50°C при интенсивном перемешивании прибавляют раствор полученного 4-замещенного 5-нитрофталонитрила в этиловом спирте при мольном соотношении 2.8-4.5:1, соответственно, и времени реакции 1-2 часа. Выпавший осадок 1-гидрокси-3-R-индол-5,6-дикарбонитрилов отфильтровывают и перекристаллизовывают из спирта. Сушат на воздухе.
Все приведенные отличительные признаки являются существенными, и только заявляемая совокупность признаков позволяет достичь технического результата.
Строение всех синтезированных соединений определено на основании совокупности данных ИК-, ЯМР-спектроскопий и масс-спектрометрии.
Изобретение иллюстрируется следующими примерами.
Пример 1. 3-бензоил-1-гидрокси-1H-индол-5,6-дикарбонитрил:
К раствору 0.018 моль POCl3 в 3 мл ДМФА прибавляют 0.006 моль 4-нитро-5-(2-оксо-2-фенилэтил)фталонитрила, перемешивают при температуре 100°C в течение 4 часов, затем реакционную массу охлаждают, выливают в холодный 10%-ый раствор гидрокарбоната натрия. Выпавший кристаллический осадок отфильтровывают, тщательно промывают водой и перекристаллизовывают из спирта. Сушат на воздухе. Далее к раствору 0.01 моль двухлористого олова в 2 мл концентрированной соляной кислоты прибавляют раствор 0.003 моль 4-[(E)-2-хлор-1-формил-2-фенилвинил]-5-нитрофталонитрила в 2 мл спирта и перемешивают при температуре 40°C в течение полутора часов. Полученную реакционную массу охлаждают, а образовавшийся осадок 1-гидрокси-3R-индол-5,6-дикарбонитрила отфильтровывают и перекристаллизовывают из спирта. Получают 0.46 г (53% от теории) 3-бензоил-1-гидрокси-1H-индол-5,6-дикарбонитрила - аморфный осадок бледно-желтого цвета, Тпл.=205-206°C.
Пример 2. 1-гидрокси-3-(4-метилбензоил)-1H-индол-5,6-дикарбо-нитрил:
К раствору 0.018 моль POCl3 в 3 мл ДМФА прибавляют 0.006 моль 4-[2-(4-метилфенил)-2-оксоэтил]-5-нитрофталонитрила, перемешивают при температуре 105°C в течение 3.5 часов, затем реакционную массу охлаждают, выливают в холодный 15%-ый раствор гидрокарбоната натрия. Выпавший кристаллический осадок отфильтровывают, тщательно промывают водой и перекристаллизовывают из спирта. Сушат на воздухе. Далее к раствору 0.01 моль двухлористого олова в 2 мл концентрированной соляной кислоты прибавляют раствор 0.003 моль 4-[(E)-2-хлор-1-формил-2-(4-метилфенил)винил]-5-нитрофталонитрила в 2 мл спирта и перемешивают при температуре 45°C в течение 2 часов. Полученную реакционную массу охлаждают, а образовавшийся осадок 1-гидрокси-3-R-индол-5,6-дикарбонитрила отфильтровывают и перекристаллизовывают из спирта. Получают 0.72 г (80% от теории) 1-гидрокси-3-(4-метилбензоил)-1H-индол-5,6-дикарбонитрила - аморфный осадок бледно-желтого цвета, Тпл.=272-273°C.
Пример 3. 1-гидрокси-3-(4-метоксибензоил)-1H-индол-5,6-дикарбо-нитрил:
К раствору 0.018 моль POCl3 в 3 мл ДМФА прибавляют 0.006 моль 4-[2-(4-метоксифенил)-2-оксоэтил]-5-нитрофталонитрила, перемешивают при температуре 110°C в течение 5 часов, затем реакционную массу охлаждают, выливают в холодный 20%-ый раствор гидрокарбоната натрия. Выпавший кристаллический осадок отфильтровывают, тщательно промывают водой и перекристаллизовывают из спирта. Сушат на воздухе. Далее к раствору 0.01 моль двухлористого олова в 2 мл концентрированной соляной кислоты прибавляют раствор 0.003 моль 4-[(E)-2-хлор-1-формил-2-(4-метоксифенил)винил]-5-нитрофталонитрила в 2 мл спирта и перемешивают при температуре 50°C в течение 2 часов. Полученную реакционную массу охлаждают, а образовавшийся осадок 1-гидрокси-3-R-индол-5,6-дикарбонитрила отфильтровывают и перекристаллизовывают из спирта. Получают 0.68 г (71% от теории) 1-гидрокси-3-(4-метоксибензоил)-1H-индол-5,6-дикарбонитрила - аморфный осадок бледно-желтого цвета, Тпл.=291-293°C.
Пример 4. 1-гидрокси-3-(3-тиенилкарбонил)-1H-индол-5,6-дикарбо-нитрил:
К раствору 0.018 моль POCl3 в 3 мл ДМФА прибавляют 0.006 моль 4-нитро-5-[2-оксо-2-(3-тиенил)этенил]фталонитрила, перемешивают при температуре 90°C в течение 2.5 часов, затем реакционную массу охлаждают, выливают в холодный 5%-ый раствор гидрокарбоната натрия. Выпавший кристаллический осадок отфильтровывают, тщательно промывают водой и перекристаллизовывают из спирта. Сушат на воздухе. Далее к раствору 0.01 моль двухлористого олова в 2 мл концентрированной соляной кислоты прибавляют раствор 0.003 моль 4-[(E)-2-хлор-1-формил-2-тиофен-2-илэтенил]-5-нитро-фталонитрила в 2 мл спирта и перемешивают при температуре 30°C в течение 1 часа. Полученную реакционную массу охлаждают, а образовавшийся осадок 1-гидрокси-3-R-индол-5,6-дикарбонитрила отфильтровывают и перекристаллизовывают из спирта. Получают 0.42 г (48% от теории) 1-гидрокси-3-(4-метоксибензоил)-1H-индол-5,6-дикарбонитрила - аморфный осадок бледно-желтого цвета, Тпл.=234-235°C.
Физико-химические характеристики 1-гидрокси-3-R-индол-5,6-дикарбонитрилов приведены в Таблице 1.
Техническим результатом изобретения является получение новых химических соединений достаточной степени чистоты, которые могут быть использованы в качестве прекурсоров для синтеза биологически активных веществ, для синтеза фталоцианинов, гексазоцикланов.
| Таблица 1 | |||||||
| Пример | R | Тпл., °C | Выход, % | ИК-спектр (ν, см-1) | Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)) | Спектр ЯМР 1H (ДМСО-d6 δ, м.д., J/Гц) | Элементный анализ |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 1 | С6Н5 | 205-206 | 53 | 2742 (-ОН), 22290 (ON), 1659 (С=O), 1613 (ОС), | 7.58 (t, 2H, Н-3', Н-5', J=7.6), 7.68 (t, 1H, H-4', J=7.8), 7.85 (d, 2H, Н-2', H-6', J=7.8), 8.46 (s, 1H, H-4), 8.61 (s, 1H, H-2), 8.81 (s, 1H, H-7), 12.89 (s, 1H, NOH) | ||
| 2 | 4-СН3ОС6Н4 | 291-293 | 71 | 2723 (-ОН), 2240 (ON), 1665 (С=O), 1614 (С=С), 1582 (Ar). | Спектр ЯМР 13С (ДМСО-d6, δ, м.д.): 187.20, 162.59. 137.22, 133.64, 131.09, 129.07, 128.59, 124.80, 117.16, 116.86, 116.58, 114.01, 110.80, 107.34, 106.63, 55.56. | 3,87 (s, 3H, OMe), 7.10 (d, 2H, H-3', H-5', J=8.7), 7.87 (d, 2H, H-2', H-6', J=8.7), 8.44 (s, 1H, H-4), 8.62 (s, 1H, H-2), 8.77 (s, 1H, H-7), 12,86 (s, 1H, OH). | Найдено (%): C, 67.92; H, 3.32; N, 13.14. Cl8H14N3O3. Вычислено (%): С, 68.14; H, 3.49; N, 13.24. |
| 3 | 4-СН3С6Н4 | 272-273 | 80 | 2718 (-ОН), 2229 (ON), 1731 (С=O), 1607, 1585 (Ar). | 285 [M+-OH] (46), 270 (29), 194 (100), 155 (42), 155 (46). Спектр ЯМР 13С (ДМСО-d6 δ, м.д.): 188.26, 142.46, 137.61, 136.05, 133.73, 129.26, 128.92, 128.52, 124.72, 117.11, 116.91, 116.82, 110.70, 107.46, 106.81, 21.16. | 2.42 (s, 3H, Me), 7.38 (d, 2H, H-3', H-5', J=8.0), 7.77 (d, 2H, H-2', H-6', J=8.0), 8.44 (s, 1H, H-4), 8.61 (s, 1H, H-2), 8.80 (s, 1H, H-7), 12.87 (s, 1H, OH). | Найдено (%): С, 71.53; N, 3.52; N, 13.88. Cl8H11N3O2. Вычислено (%): С, 71.75%; H, 3.68; N, 13.95. |
| 4 | 2-тиенил | 234-235 | 48 | 2703 (-ОН), 2238 (ON), 1664 (C=O), 1614 (С=С), 1586 (Ar). | 293 [М+] (31), 276 [М+-ОН] (27), 111 (100). | 7.31 (d.d, 1H, H-4', J=3.9, J=4.9), 8.06 (d.d, 1H, H-3', J=4.9, 4J=0.8), 8.07 (d.d, 1H, H-5', J=3.9, 4J=0.8), 8.45 (s, 1H, H-4), 8.79 (s, 1H, H-2), 8.99 (s, 1H, H-7), 12.93 (s, 1H, OH). | Найдено (%): С, 61.32; H, 2.28; N, 17.24. C15H7N3O2S. Вычислено (%): С, 61.43; H, 2.41; N, 14.33. |
Способ получения 1-гидрокси-3-R-индол-5,6-дикарбонитрилов общей формулы: где R=C6H5 или 4-CH3C6H4, или 4-OCH3C6H4, или 2-тиенил,заключающийся в том, что метод синтеза включает две стадии, при этом на первой стадии замещенные 4-нитро-5-(2-оксоэтил)фталонитрилы реагируют с хлорокисью фосфора POCl3, взаимодействие указанных реагентов протекает при температуре 90…110°C и мольном соотношении 1:2-3, соответственно, в течение 2.5-5 часов в растворе ДМФА, затем реакционную массу охлаждают, выливают в холодный 5…40-ный % раствор гидрокарбоната натрия, далее выпавший кристаллический осадок отфильтровывают и перекристаллизовывают из спирта, сушат на воздухе, а на второй стадии к раствору двухлористого олова в концентрированной соляной кислоте при температуре 30…50°C при интенсивном перемешивании прибавляют раствор полученного 4-замещенного 5-нитрофталонитрила в этиловом спирте при мольном соотношении 2.8-4.5:1, соответственно, и времени реакции 1-2 часа, полученную реакционную массу охлаждают, образовавшийся осадок 1-гидрокси-3-R-индол-5,6-дикарбонитрилов отфильтровывают и перекристаллизовывают из спирта, сушат на воздухе.