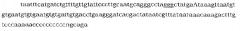Продуцирование высокоманнозных белков в растительных культурах
Иллюстрации
Показать всеИзобретение относится к биохимии и представляет собой фармацевтическую композицию для лечения болезни Гоше, содержащую в качестве активного ингредиента лиофилизированные растительные клетки, экспрессирующие рекомбинантную человеческую глюкоцереброзидазу, и фармацевтически приемлемый носитель, где указанная фармацевтическая композиция составлена для перорального введения и где указанная человеческая глюкоцереброзидаза имеет высокоманнозное гликозилирование. Изобретение позволяет получить эффективную фармацевтическую композицию для лечения болезни Гоше с высокой биоактивностью фермента вследствие его высокоманнозного гликозилирования. 2 н. и 14 з.п. ф-лы, 21 ил., 3 табл., 6 пр.
Реферат
Область изобретения
Настоящее изобретение относится к трансформированным клеткам-хозяевам для продуцирования белков с высоким содержанием маннозы и способу и системе продуцирования таких белков, в частности, в растительной культуре.
Предпосылки создания изобретения
Болезнь Гоше представляет собой наиболее распространенную лизосомальную болезнь накопления. Она вызвана рецессивным генетическим нарушением (хромосома 1 q21-q31), приводящим к дефициту глюкоцереброзидазы, также известной как глюкозилкерамидаза, которая представляет собой мембранно-связанный лизосомальный фермент, который катализирует гидролиз глюкозфинголипидного глюкоцереброзида (глюкозилкерамид, GlcCer) до глюкозы и керамида. Болезнь Гоше вызывается точечными мутациями в гене (GBA) hGCD (глюкоцереброзидазы человека), что приводит к накоплению GlcCer в лизосомах макрофагов. Характерные клетки накопления, называемые клетками Гоше, находятся в печени, селезенке и костном мозге. Связанные с этим клинические симптомы включают серьезную гепатоспленомегалию, анемию, тромбоцитопению и повреждение скелета.
Ген, кодирующий GCD человека, был впервые секвенирован в 1985 г. (6). Белок, состоящий из 497 аминокислот, получен из 536-mer пробелка. Зрелый GCD содержит пять N-гликозилированных согласованных последовательностей аминокислот (Asn-X-Ser/Thr). Четыре из этих сайтов гликозилированы обычным образом. Гликозилирование пятого сайта является необходимым для продуцирования активного белка. Были идентифицированы как высокоманнозные, так и комплексные олигосахаридные цепи (7). HGCD плаценты содержит 7% углевода, 20% которого относится к высокоманнозному типу (8). Биохимические исследования и исследования сайт-направленного мутагенеза обеспечили первоначальную карту областей и остатков, важных для складчатости, активаторного взаимодействия и расположения активного сайта.
Обработка плацентарной hGCD нейраминидазой (приводящая к азиало-ферменту) приводит к повышенным скоростям выведения и поглощения в клетках печени крысы с сопутствующим увеличением гепатической ферментативной активности (Furbish et al., 1981, Biochim.Biophys. Acta 673:425-434). Такая гликан-модифицированная плацентарная hGC обычно используется в качестве терапевтического агента при лечении болезни Гоше. Биохимические исследования и исследования сайт-направленного мутагенеза обеспечили первоначальную карту областей и остатков, важных для складчатости, активаторного взаимодействия и расположения активного сайта [Grace et al., J.Biol.Chem., 269:228302291 (1994)].
Существует три различных типа болезни Гоше, каждый из которых определяется уровнем активности hGC. Основными клетками, поражаемыми заболеванием, являются макрофаги, которые являются сильно увеличенными благодаря накоплению GlcCer, и, соответственно, упоминаются как «клетки Гоше».
Идентификация дефекта в GCD в качестве первичной причины болезни Гоше привела к развитию ферментативной заместительной терапии в качестве терапевтической стратегии для данного заболевания.
De Duve первым предположит, что замещение недостающего лизосомального фермента экзогенным биологически активным ферментом могло бы оказаться подходом, приносящим хорошие результаты при лечении лизосомальных болезней накопления. [Fed Proc. 23:1045 (1964)].
С этого времени в различных исследованиях предполагалось, что ферментативная заместительная терапия может оказаться выигрышной для лечения различных лизосомальных болезней накопления. Максимальный успех был достигнут в случае индивидуумов, имеющих болезнь Гоше типа I, которых лечили экзогенным ферментом (β-глюкоцереболзидазой), полученным из плаценты (Цередаза (CeredaseTM)), или, позднее, полученным рекомбинантным образом (Церезим (CerezymeTM)).
Немодифицированная глюкоцереброзидаза, полученная из природных источников, представляет собой гликопротеин с четырьмя углеводными цепями. Данный белок не направлен на фагоцитные клетки тела и, следовательно, имеет ограниченное терапевтическое значение. При развитии современной терапии болезни Гоше концевые сахара на углеводных цепях глюкоцереброзидазы последовательно удаляли с помощью обработки тремя различными гликозидазами. Такая обработка гликозидазами приводит к гликопротеину, концевые сахара которого состоят из остатков маннозы. Поскольку фагоциты имеют рецепторы маннозы, которые распознают гликопротеины и гликопептиды с олигосахаридными цепями, на конце которых расположены остатки маннозы, углеводное модифицирование глюкоцереброзидазы улучшило нацеливание фермента на данные клетки [Furbish et al., Biochim.Biophys. Acta 673: 425, (1981)].
Как указано в данном описании, гликозилирование играет решающую роль в активности hGCD, следовательно, дегликозилирование hGCD, экспрессируемой клеточными линиями, с использованием либо туникамицина (клетки Sf9), либо точечных мутаций, разрушающее все сайты гликозилирования (как клетки Sf9, так и COS-1), приводит к полной потере ферментативной активности. Кроме того, было установлено, что hGCD, экспрессируемый в E.coli, не является активным. Дополнительное исследование указало на значимость различных сайтов гликозилирования в активности белка. В дополнение к роли гликозилирования в фактической активности белка коммерчески получаемый фермент содержит модификации последовательности гликана, которые облегчают специфическую доставку лекарственного средства. Гликозилированные белки модифицируют после экстракции так, чтобы они включали только содержащие маннозу последовательности гликана.
Фермент GCD человека содержит 4 сайта гликозилирования и 22 лизина. Получаемый рекомбинантным образом фермент (ЦерезимТМ) отличается от плацентарного фермента (Цередаза ТМ) в положении 495, где аргинин был замещен на гистидин. Кроме того, олигосахаридный состав различается между рекомбинантной и плацентарной GCD, поскольку первый содержит больше фукозных и N-ацетилглюкозаминных остатков, тогда как последний сохраняет только одну цепь с высоким содержанием маннозы. Как отмечено выше, оба типа GCD обрабатывают тремя различными гликозидазами (нейраминидазой, галактозидазой и P-N ацетилглюкозаминидазой), чтобы оставить незащищенными концевые маннозы, которые дают возможность целеуказания в отношении фагоцитных клеток. Фармацевтический препарат, содержащий полученный рекомбинантным образом фермент, описан в патенте США 5549892. Следует отметить, что все отмеченные в данном описании публикации включены посредством ссылки во всей своей полноте.
Один из недостатков, связанных с существующей в настоящее время лизосомальной заместительной терапией, заключается в том, что биоактивность фермента in vivo является нежелательно низкой, например, вследствие низкого поглощения, пониженного целеуказания на лизосомы специфических клеток, где аккумулируется субстрат, и короткого функционального времени полураспада в лизосомах in vivo.
Другим основным недостатком существующих рекомбинантных ферментов GCD является их стоимость, которая может лечь тяжелым экономическим бременем на системы здравоохранения. Высокая стоимость данных рекомбинантных ферментов связана со сложным протоколом их очистки и относительно большими количествами лекарственных средств, требуемых для существующего в настоящее время лечения. Следовательно, существует неотложная необходимость в снижении стоимости GCD так, чтобы данное сохраняющее жизнь людей лечение могло быть более доступно по средствам для всех, кто в нем нуждается.
Белки для фармацевтического применения традиционно продуцируются в системах экспрессии млекопитающих и бактерий. В последнее десятилетие была разработана новая система экспрессии в растениях. В данной методологии используется Agrobacterium, бактерия, способная встраивать молекулы отдельных цепей ДНК (Т-ДНК) в растительный геном. Вследствие относительной простоты введения генов для массового продуцирования белков и пептидов данная методология становится все более популярной в качестве альтернативной системы экспрессии белка (1).
Хотя посттрансляционные модификации не существуют в бактериальных системах экспрессии, системы экспрессии, полученные из растений, действительно облегчают данные модификации, известные как решающие для экспрессии и активности белка. Одним из основных различий между системой экспрессии млекопитающих и растений является изменение боковых цепей сахаров белка, вызванное разницей в биосинтетических путях. Показано, что гликозилирование оказывает чрезвычайное влияние на активность, складчатость, стабильность, растворимость, восприимчивость к протеазам, скорость выведения из крови и антигенный потенциал белков. Следовательно, при любом продуцировании белка в растениях следует принимать во внимание потенциальные разветвления растительного гликозилирования.
Гликозилирование белка подразделяют на две категории: N-связанные и О-связанные модификации (2). Эти два типа отличаются аминокислотой, к которой присоединен гликановый фрагмент: N-связанный присоединен к остаткам Asn, тогда как О-связанный присоединен к остаткам Ser или Thr. Кроме того, последовательность гликанов каждого типа содержит уникальные отличительные особенности. Среди этих двух типов N-связанное гликозилирование является более частым, и его влияние на функцию белка интенсивно исследовалось. О-связанные гликаны, с другой стороны, являются относительно редкими, и относительно их влияния на белки доступно меньшее количество информации.
Краткое изложение сущности изобретения
В предшествующем уровне развития данной области не указаны или не предложены устройство, система или способ селективного продуцирования гликозилированных белков в растительной культуре. Также в предшествующем уровне данной области не указываются или не предлагаются такие устройство, система или способ продуцирования высокоманнозных белков в растительной культуре. Кроме того, в предшествующем уровне данной области не указывается или не предлагается устройство, система или способ продуцирования белков в растительной культуре посредством эндоплазматической сети (ER). Также в предшествующем уровне данной области не указывается или не предлагается устройство, система или способ продуцирования белков в растительной культуре посредством эндоплазматической сети (ER), при этом в обход аппарата Гольджи. Также в предшествующем уровне данной области не указывается или не предлагается устройство, система или способ продуцирования белков в растительной культуре с использованием ER-сигнала для обхода аппарата Гольджи.
В настоящем изобретении преодолены данные недостатки предшествующего уровня техники посредством разработки устройства, системы или способа продуцирования гликозилированных белков в растительной культуре, в частности белков, имеющих высокоманнозное гликозилирование, в то время как необязательно и предпочтительно для таких белков проводят целеуказание (и/или в других обстоятельствах манипулируют их переработкой) с помощью ER-сигнала. Не желая ограничиваться какой-либо одной гипотезой, авторы настоящего изобретения полагают, что такое целеуказание вызывает обход белками аппарата Гольджи и, следовательно, сохраняет желаемое гликозилирование, в частности высокоманнозное гликозилирование. Следует отметить, что термин «растительная культура», как он использован в данном описании, включает любой тип трансгенных и/или иначе генетически сконструированных клеток растений, которые выращивают в культуре. Генная инженерия может быть постоянной или временной. Предпочтительно отличительной особенностью культуры является то, что клетки не группируются, образуя полное растение, так что, по крайней мере, не присутствует одна биологическая структура растения. Необязательно и предпочтительно культура может отличаться множеством различных типов растительных клеток, но предпочтительно в культуре используют конкретный тип растительной клетки. Следует отметить, что необязательно растительные культуры, отличительной особенностью которых является определенный тип растительной клетки, могут первоначально происходить из множества различных типов таких растительных клеток.
Растительные клетки можно выращивать в соответствии с любым типом подходящего способа культивирования, включая, но не ограничиваясь указанным, культивирование на твердой поверхности (такой, как пластиковые сосуды для культивирования или, например, чашки Петри) или в суспензии.
Кроме того, отличительной особенностью изобретения являются векторы и способы экспрессии и продуцирования ферментативно активных высокоманнозных лизосомальных ферментов с использованием корней трансгенных растений, в частности клеток моркови. Более конкретно, отличительной особенностью изобретения являются клетки-хозяева, в частности трансгенные суспендированные клетки-моркови, векторы и способы экспрессии и продуцирования с высоким выходом биологически активной высокоманнозной глюкоцереброзидазы (GCD). Кроме того, изобретение относится к композициям и способам лечения лизосомальных болезней накопления.
Настоящее изобретение также относится к устройству, системе и способу обеспечения дефицитных клеток достаточными количествами биологически активных лизосомальных ферментов и, в частности, GCD человека. Настоящее изобретение также относится к клеткам-хозяевам, включающим композиции новых векторов, которые дают возможность эффективного продуцирования генов, кодирующих лизосомальные ферменты, такие как GCD.
Таким образом, настоящее изобретение решает продолжительную необходимость в экономически жизнеспособной технологии получения белков, соответствующих определенным требованиям в отношении гликозилирования, таким как высокоманнозное гликозилирование лизосомальных ферментов, таких, например, как GCD. Настоящее изобретение способно решить эту продолжительную необходимость посредством использования культуры клеток растений.
Для дальнейшего объяснения настоящего изобретения будет приведено краткое объяснение биосинтетического пути для белков с высоким содержание маннозы. Основной путь биосинтеза высокоманнозных и комплексных N-связанных гликанов является высококонсервативным для всех эукариотов. Биосинтез начинается в эндоплазматической сети (ER) с переносом предшественника гликана от длинного липидного носителя к специфическому остатку Asn на белке с помощью олигосахарилтрансферазы. Предшественник впоследствии модифицируется в ER гликозидазами I и II и предположительной маннозидазой, давая высокоманнозные структуры, аналогично процессу, происходящему у млекопитающих.
Последующие модификации последовательности гликана в комплексные и гибридные структуры происходят в аппарате Гольджи. Такие модификации включают удаление одного из четырех маннозных остатков с помощью α-маннозидазы I, присоединение остатка N-ацетилглюкозамина, удаление двух дополнительных остатков маннозы с помощью α-маннозидазы II, присоединение N-ацетилглюкозамина, и, необязательно, на данной стадии могут присоединяться остатки ксилозы и фукозы, давая растительно-специфические N-связанные гликаны. После переноса ксилозы и фукозы в ядро N-гликаны комплексного типа могут в дальнейшем перерабатываться путем присоединения концевой фукозы и галактозы. Последующие модификации также могут происходить во время транспорта гликопротеина.
В данной области в настоящее время используется несколько подходов для контроля и приспособления для определенных целей гликозилирования белков в растениях, все из которых имеют заметные недостатки, в частности в сравнении с настоящим изобретением. Модификации Гросса, такие как полное ингибирование гликозилирования или удаление сайтов гликозилирования из пептидной цепи, представляют собой одну из стратегий. Однако данный подход может привести к структурным дефектам. Дополнительный подход включает сильный удар и введение специфических ферментов переработки углеводов. Опять же данный подход труден и также может оказать вредное влияние на сами клетки растений.
Настоящее изобретение преодолевает такие недостатки этих подходов предшествующего уровня техники посредством использования ER-сигнала и/или путем блокирования секреции из эндоплазматической сети в аппарат Гольджи. Не желая ограничиваться одной гипотезой, поскольку предпочтительной является высокоманнозная структура лизосомальных ферментов, если секреция может быть блокирована и белок может сохраняться в эндоплазматической сети, природные высокоманнозные структуры получают без необходимости в последующей трансформации.
Как указано выше, белки, транспортируемые через эндомембранную систему, сначала проходят в эндоплазматическую сеть. Необходимый транспортный сигнал для данной стадии представлен сигнальной последовательность на N-конце молекулы так называемым сигнальным пептидом. Как только данный сигнальный пептид выполнил свою функцию, которая заключается во введении присоединенного к нему белка-предшественника в эндоплазматическую сеть, он протеолитически отщепляется от белка-предшественника. На основании его специфической функции последовательность данного типа сигнального пептида оставалась в высокой степени консервативной во время эволюции во всех живых клетках вне зависимости от того, являются ли они бактериями, дрожжами, грибами, животными или растениями.
Многие растительные белки, которые вводятся в эндоплазматическую сеть с помощью сигнального пептида, не находятся в ER, а транспортируются из эндоплазматической сети в аппарат Гольджи и продолжают движение из аппарата Гольджи в вакуоли. Одним из классов таких сортирующих сигналов для данного перемещения являются сигналы, которые находятся на С-концевой части белка-предшественника [Neuhas and Rogers, (1998) Plant Mol. Biol. 38: 127-144]. Предполагается, что белки, содержащие как N-концевой сигнальный пептид для введения в эндоплазматическую сеть, так и С-вакуолярный нацеливающий сигнал, содержат комплексные гликаны, которые присоединяются к ним в аппарате Гольджи [Lerouge et al., (1998) Plant Mol.Biol., 38:31-48]. Природа таких С-концевых сортирующих сигналов может варьироваться очень широко. В патенте США 6054637 описаны пептидные фрагменты, полученные из области основной хитиназы табака, которая представляет собой вакуолярный белок, которые действуют как вакуолярные нацеливающие пептиды. Примером вакуолярного белка, содержащего С-концевой нацеливающий сигнал и комплексные гликаны, является фазеолинхранящий белок семян бобов [Frigerio et al., (1998) Plant Cell, 10:1031-1042; Frigerio et al., (2001) Plant Cell 13:1109-1126].
Принципиально то, что во всех эукариотических клетках вакуолярные белки проходят через ER и аппарат Гольджи перед изолированием в вакуоле в качестве их конечного места назначения. Неожиданно трансформированные клетки корней растений по настоящему изобретению продуцировали GCD с необычно высоким содержанием маннозы. Было установлено, что преимущественно такой высокоманнозный продукт является биологически активным и, следовательно, нет необходимости в дополнительных стадиях для его активации. Не желая ограничиваться единственной гипотезой, будет очевидно, что применение ER-сигнала вместе с рекомбинантным белком, продуцируемым в культуре растительных клеток, способно преодолеть транспортирование через аппарат Гольджи и, следовательно, сохранять желаемое высокоманнозное гликозилирование. Необязательно любой тип механизма, который способен продуцировать высокоманнозное гликозилирование, включая любой тип механизма обхода аппарата Гольджи, можно использовать в соответствии с настоящим изобретением.
В первом аспекте настоящее изобретение относится к клетке-хозяину, продуцирующей высокоманнозный рекомбинантный белок, представляющий интерес. Данная клетка может быть трансформирована или трансфицирована молекулой рекомбинантной нуклеиновой кислоты, кодирующей представляющий интерес белок, или вектором экспрессии, включающим молекулу нуклеиновой кислоты. Такая молекула нуклеиновой кислоты включает первую последовательность нуклеиновой кислоты, кодирующую целевой белок, функционально связанную со второй последовательность нуклеиновой кислоты, кодирующей вакуолярный нацеливающий сигнальный пептид. Первая последовательность нуклеиновой кислоты может быть необязательно дополнительно функционально связана с третьей последовательностью нуклеиновой кислоты, кодирующей ER(эндоплазматическая цепь)-нацеливающий сигнальный пептид. Клетка-хозяин по изобретению отличается тем, что представляющий интерес белок продуцируется клеткой в высокоманнозилированной форме.
Клетка-хозяин по изобретению может представлять собой эукариотическую или прокариотическую клетку.
В одном варианте осуществления клетка-хозяин по изобретению представляет собой прокариотическую клетку, предпочтительно бактериальную клетку, наиболее предпочтительно клетку Agrobacterium tumefaciens. Данные клетки используются для инфицирования предпочтительных растительных клеток-хозяев, описанных далее.
В другом предпочтительном варианте осуществления клетка-хозяин по изобретению может представлять собой эукариотическую клетку, предпочтительно растительную клетку и наиболее предпочтительно клетку корня растений, выбранную из группы, включающей трансформированную Agrobacterium rihzogenes клетку корня, клетку сельдерея, клетку имбиря, клетку хрена и клетку моркови.
В предпочтительном варианте осуществления клетка корня растения представляет собой клетку моркови. Следует отметить, что трансформированные клетки моркови по изобретению выращивают в суспензии. Как отмечено выше и описано в примерах, данные клетки были трансформированы с использованием клеток Agrobacterium tumefaciens.
В другом варианте осуществления молекула рекомбинантной нуклеиновой кислоты, включенная в клетку-хозяина по изобретению, включает первую последовательность нуклеиновой кислоты, кодирующую лизосомальный фермент, которая функционально связана со второй последовательностью нуклеиновой кислоты, кодирующей вакуолярный нацеливающий сигнальный пептид, полученный из основного гена хитиназы А табака. Данный вакуолярный сигнальный пептид имеет последовательность аминокислот, представленную в SEQ ID NO:2. Первая последовательность нуклеиновой кислоты необязательно может быть дополнительно связана с третьей последовательностью нуклеиновой кислоты, кодирующей нацеливающий сигнальный пептид ER (эндоплазматической сети), обозначенный как SEQ ID NO:1. В одном варианте осуществления рекомбинантная молекула нуклеиновой кислоты, включенная в клетку-хозяина по изобретению, дополнительно включает промотор, который является функциональным в клетках растений. Данный промотор должен быть функционально связанным с рекомбинантной молекулой по изобретению.
В другом варианте осуществления данная рекомбинантная молекула нуклеиновой кислоты необязательно дополнительно может включать функционально связанный терминатор, который предпочтительно является функциональным в клетках растений. Рекомбинантная молекула нуклеиновой кислоты по изобретению необязательно может дополнительно включать дополнительные контрольные, промотирующие и регулирующие элементы и/или селектируемые маркеры. Следует отметить, что данные регуляторные элементы являются функционально связанными с рекомбинантной молекулой.
В предпочтительном варианте осуществления представляющий интерес высокоманнозный белок, продуцируемый клеткой-хозяином по изобретению, может представлять собой высокоманнозный гликопротеин, имеющий незащищенные концевые остатки маннозы.
Такой высокоманнозный белок может в соответствии с другим предпочтительным вариантом осуществления представлять собой лизосомальный фермент, выбранный из группы, состоящей из глюкоцереброзидазы (GCD), кислотной сфингомиелиназы, гексозаминидазы, α-N-ацетилгалактозаминидизы, кислотной липазы, α-галактозидазы, глюкоцереброзидазы, α-L-идуронидазы, идуронатсульфатазы, α-маннозидазы или зиалидазы. В предпочтительном варианте осуществления лизосомальный фермент может представлять собой глюкоцереброзидазу человека (GCD). Далее рекомбинантный GCD, rGCD, rhGCD все упоминаются как различные формы рекомбинантной GCD человека, если не указано другое.
Как описано ранее, болезнь Гоше, наиболее распространенная лизосомальная болезнь накопления, вызвана точечными мутациями гена (GBA) hGCD (глюкоцереброзидаза человека, что приводит к накоплению GlcCer в лизосомах макрофагов. Идентификация дефицита GCD в качестве первичной причины болезни Гоше привела к развитию ферментозаместительной терапии как терапевтической стратегии для данного заболевания. Однако гликозилирование играет решающую роль в активности hGCD и поглощении целевыми клетками.
Следовательно, в соответствии с другими предпочтительными вариантами настоящего изобретения предпочтительно разработан подходящим образом гликозилированный hGCD посредством контролирования экспрессии hGCD в клетках растительной культуры и более предпочтительно путем обеспечения сигнала ER и/или в других обстоятельствах посредством, необязательно и более предпочтительно, блокирования транспортировки в аппарат Гольджи.
Необязательно и предпочтительно hGCD имеет по крайней мере одну олигосахаридную цепь, включающую незащищенный остаток маннозы для лечения или профилактики болезни Гоше.
В дальнейшем в конкретном варианте осуществления данную предпочтительную клетку-хозяина трансформируют или трансфектируют молекулой рекомбинантной нуклеиновой кислоты, которая дополнительно включает 35S промотор вируса мозаики цветной капусты, терминатор октопинсинтазы Agrobacterium tumefaciens и омега-трансляционный элемент-энхансер регуляторный элемент представляет собой TMV (вируса мозаики табака). В соответствии с предпочтительным вариантом осуществления данная рекомбинантная молекула нуклеиновой кислоты включает последовательность нуклеиновой кислоты по существу такую, как представлено в SEQ ID NO:13, и кодирует высокоманнозную GCD, имеющую последовательность аминокислот по существу такую, как представлено в SEQ ID NO: 14.
Следует понимать, что настоящее изобретение дополнительно обеспечивает вектор экспрессии, включающий молекулу нуклеиновой кислоты, кодирующую биологически активный лизосомальный фермент.
В одном предпочтительном варианте осуществления вектор экспрессии по изобретению включает молекулу нуклеиновой кислоты, кодирующую биологически активную высокоманнозную глюкоцереброзидазу человека (GCD). Предпочтительно предпочтительный вектор экспрессии включает нуклеиновую рекомбинантную молекулу нуклеиновой кислоты, которая имеет последовательность нуклеиновой кислоты по существу такую, как представлено в SEQ ID NO:13.
Во втором аспекте настоящее изобретение относится к рекомбинантному высокоманнозному белку, продуцируемому клеткой-хозяином по изобретению.
В предпочтительном варианте осуществления данный высокоманнозный белок может представлять собой биологически активный высокоманнозный лизосомальный фермент, выбранный из группы, состоящей из глюкоцереброзидазы (GCD), кислотной сфингомиелиназы, гексозаминидазы, α-N-ацетилгалактозаминидизы, кислотной липазы, α-галактозидазы, глюкоцереброзидазы, α-L-идуронидазы, идуронатсульфатазы, α-маннозидазы или зиалидазы. Наиболее предпочтительно данный лизосомальный фермент может представлять собой глюкоцереброзидазу человека (GCD).
В дальнейшем изобретение относится к рекомбинантному биологически активному высокоманнозному лизосомальному ферменту, имеющему по крайней мере одну олигосахаридную цепь, включающую незащищенный остаток маннозы.
В соответствии с предпочтительным вариантом осуществления рекомбинантный лизосомальный фермент по изобретению может связываться с рецептором маннозы на клетке-мишени в сайте-мишени. Предпочтительно данный сайт может находиться в организме пациента, страдающего от лизосомальной болезни накопления.
Следует отметить, что рекомбинантный лизосомальный фермент обладает повышенной аффинностью по отношению к клетке-мишени по сравнению с соответствующей аффинностью природного лизосомального фермента по отношению к клетке-мишени. В конкретном варианте осуществления клетка-мишень с сайтом-мишенью может представлять собой клетку Купфера печени пациента.
В предпочтительном варианте осуществления рекомбинантный лизосомальный фермент может быть выбран из группы, состоящей из глюкоцереброзидазы (GCD), кислотной сфингомиелиназы, гексозаминидазы, α-N-ацетилгалактозаминидизы, кислотной липазы, α-галактозидазы, глюкоцереброзидазы, α-L-идуронидазы, идуронатсульфатазы, α-маннозидазы или зиалидазы.
Наиболее предпочтительно рекомбинантный лизосомальный фермент представляет собой глюкоцереброзидазу (GCD).
В третьем аспекте изобретение относится к способу продуцирования высокоманнозного белка. Соответственно, способ изобретения включает стадии: (а) получение культуры рекомбинантных клеток-хозяев, трансформированных или трансфицированных рекомбинатными молекулами нуклеиновых кислот, кодирующими целевой рекомбинантный белок, или вектором экспрессии, включающим рекомбинантные молекулы нуклеиновых кислот; (b) культивирование данных культур клеток-хозяев, полученных на стадии (а) в условиях, допускающих экспрессию белка, где клетки-хозяева продуцируют данный белок в высокоманнозилированной форме; (с) выделение белка из клеток и сбор клеток из культуры, обеспеченных на стадии (а); и (d) очистку белка со стадии (с) с помощью подходящего способа очистки белков.
В соответствии с предпочтительным вариантом осуществления клетка-хозяин, используемая в данном способе, представляет собой клетку-хозяина по изобретению.
В другом предпочтительном варианте осуществления высокоманнозный белок, продуцируемый способом по изобретению, может представлять собой биологически активный высокоманнозный лизосомальный фермент, имеющий по крайней мере одну олигосахаридную цепь, включающую незащищенный остаток маннозы.
Данный рекомбинантный фермент может связываться с рецептором маннозы на клетке-мишени в сайте-мишени. Более конкретно, рекомбинантный фермент, продуцируемый способом по изобретению, обладает повышенной аффинностью по отношению к клетке-мишени по сравнению с соответствующей аффинностью природного лизосомального фермента по отношению к клетке-мишени. Соответственно клетка-мишень в сайте-мишени может представлять собой клетку Купфера печени пациента.
В конкретном варианте осуществления лизосомальный фермент может быть выбран из группы, состоящей из глюкоцереброзидазы (GCD), кислотной сфингомиелиназы, гексозаминидазы, α-N-ацетилгалактозаминидизы, кислотной липазы, α-галактозидазы, глюкоцереброзидазы, α-L-идуронидазы, идуронатсульфатазы, α-маннозидазы или зиалидазы. Наиболее предпочтительно данный лизосомальный фермент может представлять собой глюкоцереброзидазу (GCD).
В другом предпочтительном варианте осуществления клетка-хозяин, используемая в способе по изобретению, может представлять собой клетку корней растений, выбранную из трансформированной Agrobacterium rihzogenes клетки корня, клетки сельдерея, клетки имбиря, клетки хрена и клетки моркови. Наиболее предпочтительно клетка корня растений представляет собой клетку моркови. Следует особо отметить, что в способе по изобретению трансформированные клетки-хозяева моркови выращивают в суспензии.
В следующем аспекте настоящее изобретение относится к способу лечения пациента, имеющего лизособную болезнь накопления с использованием экзогенного рекомбинантного лизосомального фермента, включающему: (а) получение биологически активной формы рекомбинантного лизосомального фермента, полученного очисткой из трансформированных клеток корней растений и способного эффективно направляться к клеткам с аномальным дефицитом лизосомального фермента. Данный рекомбинантный лизосомальный фермент имеет незащищенные концевые остатки маннозы на присоединенных олигосахаридах; и (b) введение пациенту терапевтически эффективного количества рекомбинантного биологически активного лизосомального фермента. В предпочтительном варианте осуществления рекомбинантный высокоманнозный фермент, используемый в способе по изобретению, может продуцироваться клетками-хозяевами по изобретению. Предпочтительно данная клетка-хозяин представляет собой клетку моркови.
В другом предпочтительном варианте осуществления лизосомальный фермент, используемый в способе по изобретению, может представлять собой высокоманнозный фермент, включающий по крайней мере одну олигосахаридную цепь, имеющую незащищенный остаток маннозы. Данный рекомбинантный фермент может связываться с рецептором маннозы на клетке-мишени в сайте-мишени в организме пациента. Более предпочтительно данный рекомбинантный лизосомальный фермент обладает повышенной аффинностью к данным клеткам-мишеням по сравнению с соответствующей аффинностью по отношению к клетке-мишени природного лизосомального фермента.
Более конкретно, лизосомальный фермент, используемый в способе по изобретению, может быть выбран из группы, состоящей из глюкоцереброзидазы (GCD), кислотной сфингомиелиназы, гексозаминидазы, α-N-ацетилгалактозаминидизы, кислотной липазы, α-галактозидазы, глюкоцереброзидазы, α-L-идуронидазы, идуронатсульфатазы, α-маннозидазы или зиалидазы. Предпочтительно данный лизосомальный фермент представляет собой глюкоцереброзидазу (GCD).
В соответствии с предпочтительным вариантом осуществления способ по изобретению, следовательно, предназначен для лечения лизосомальной болезни накопления, в частности болезни Гоше.
В таком случае клетка-мишень у сайта-мишени может представлять собой клетку Купфера печени пациента.
Изобретение, кроме того, относится к фармацевтической композиции для лечения лизосомальной болезни накопления, включающей в качестве активного ингредиента рекомбинантный биологически активный высокоманнозный лизосомальный фермент, как определено в данном изобретении. Композиция по изобретения необязательно может включать фармацевтически приемлемый разбавитель, носитель или эксципиент.
В конкретном варианте осуществления композиция по изобретению предназначена для лечения болезни Гоше. Такая композиция предпочтительно может включать в качестве эффективного ингредиента биологически активную высокоманнозую глюкоцереброзидазу человека (GCD), как определено в изобретении.
Изобретение дополнительно относится к применению рекомбинантного биологически активного высокоманнозного лизосомального фермента по изобретению для получения лекарственного средства для лечения или профилактики лизосомальной болезни накопления. Более конкретно, данное заболевание может представлять собой болезнь Гоше.
Соответственно данный биологически активный лизосомальный фермент представляет собой биологически активную высокоманнозую глюкоцереброзидазу человека (GCD), как определено в изобретении.
Согласно настоящему изобретению разработана клетка-хозяин, продуцирующая высокоманнозный рекомбинантный белок, включающая полинуклеотид, кодирующий рекомбинантный белок и сигнал, вызывающий продуцирование рекомбинантного белка в виде высокоманнозного белка. Предпочтительно полинуклеотид включает первую последовательность нуклеиновой кислоты, кодирующую целевой белок, функционально связанную со второй последовательностью нуклеиновой кислоты, кодирующей сигнальный пептид. Необязательно сигнальный пептид включает нацеливающий сигнальный пептид ER (эндоплазматической сети). Предпочтительно полинуклеотид дополнительно включает третью последовательность нуклеиновой кислоты для кодирования вакуолярного нацеливающего сигнального пептида.
Предпочтительно сигнал вызывает нацеливание рекомбинантного белка в ER. Более предпочтительно сигнал включает сигнальный пептид, вызывающий нацеливание рекомбинантного белка в ER. Наиболее предпочтительно полинуклеотид включает сегмент нуклеиновой кислоты для кодирования сигнального пептида.
Необязательно и предпочтительно сигнал вызыва