Способ получения 3-арил-1,5,3-дитиазепанов
Иллюстрации
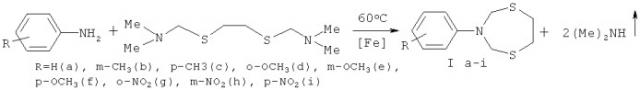
Показать всеИзобретение относится к области органической химии, в частности к способу получения 3-арил-1,5,3-дитиазепанов общей формулы (Ia-i), где R = H (a), m-CH3 (b), p-CH3 (c), o-OCH3 (d), m-OCH3 (e), p-OCH3 (f), o-NO2 (g), m-NO2 (h), p-NO2 (i), отличающийся тем, что N1,N1,N6,N6-тетраметил-2,5-дитиагексан-1,6-диамина подвергают взаимодействию с ариламином (арил = фенил, m- и p-метилфенил, o-, m- и р-метоксифенил, о-, m- и р-нитрофенил) в присутствии катализатора FeCl3·6H2O в мольном соотношении N1,N1,N6,N6-тетраметил-2,5-дитиагексан-1,6-диамин: ариламин: FeCl3 ·6H2O=10:10:(0.3-0.7) при температуре ~60°С и атмосферном давлении в хлороформе в качестве растворителя в течение 50-80 минут. Технический результат: разработан способ получения производных 3-арил-1,5,3-дитиазепанов, которые могут найти применение в качестве антибактериальных, антигрибковых и антивирусных агентов, в качестве биологически активных комплексообразователей, селективных сорбентов и экстрагентов драгоценных металлов, специальных реагентов для подавления жизнедеятельности бактерий в различных технических средах.
Реферат
Предлагаемое изобретение относится к области органической химии, в частности к способу получения 3-арил-1,5,3-дитиазепанов общей формулы (I)
Азот и серусодержащие гетероциклы известны как антибактериальные, антигрибковые и антивирусные агенты (Stillings M.R., Welbourn A.P., Walter D.J. Substituted 1,3,4-thiadiazoles with anticonvulsant activity// Med. Chem. 1986. 29. P. 2280-2284. Kidwai M., Negi N., Chaudhary S.R. Cyclothiomethylation of arge hydrazines with formaldehyde// Acta Pharma. 1995. 45. P. 511. Тюкавкина H.A., Зурабян С.Э., Белобородов В.Л. и др. Органическая химия. М.: Дрофа, 2008. с.66-67). Они перспективны в качестве катализаторов, биологически активных комплексообразователей, селективных сорбентов и экстрагентов драгоценных металлов [Deutsche Gold- und Silber-Scheideanstalt vormals Roessler. F.P. 1,341,792/1963 (Chem. Abs., 1964, 60, 5528d)], специальных реагентов для подавления жизнедеятельности бактерий в различных технических средах (от легкой промышленности до нефти) (Джемилев У.М., Алеев Р.С/, Дальнова Ю.С, Кулакова Р.В., Хафизова С.Р., Ковтуненко С.В., Калимуллин А.А., Андрианов В.М., Исмагилов Ф.Р., Гафиатуллин P.P. Средство для подавления роста сульфатвосстанавливающих бактерий. Пат. РФ №2160233, 2000; Джемилев У.М., Алеев Р.С, Дальнова Ю.С, Кулакова Р.В., Хафизова С.Р. Средство для подавления роста сульфатвосстанавливающих бактерий. Пат. РФ №2206726, 2003).
Известен способ (В.Р.Ахметова, Г.Р.Надыргулова, С.Р.Хафизова, Т.В. Тюмкина, А.А.Яковенко, М.Ю.Антипин, Л.М.Халилов, Р.В.Кулакова, У.М. Джемилев. Взаимодействие аминофенолов с формальдегидом и сероводородом. Изв. АН. Сер. хим., 2006, №3, с.305) получения шестичленных N,S-содержащих гетероциклов, а именно N-арил-1,3,5-дитиазинанов (2) взаимодействием соответственно о-, n-аминофенолов, водного формальдегида (37%) и сероводорода при температуре 40°С по схеме:
Известный способ не технологичен, так как предполагает применение газообразного и чрезвычайно токсичного сероводорода, который при высокой концентрации не имеет запаха, но даже однократное его вдыхание может вызвать мгновенную смерть. Кроме того, известным способом не могут быть получены 3-арил-1,5,3-дитиазепаны общей формулы (Ia-i).
Известен способ (U.Wellmar. Urea as Leaving Group in the Synthesis of 3-(tert-Butyl)perhydro-l,5,3-dithiazepine. J.Heterocyclic Chem., 1998, 35, p.1531) получения соединений 1,5,3-дитиазепанового ряда, а именно, 3-{трет-бутил)пергидро-1,5,3-дитиазепина (3) с выходом 45% взаимодействием 5-(трет-бутил)-2-оксогексагидро-1,3,5-триазина с 1,2-этандитиолом в присутствии BF3·2HOAc при комнатной температуре за 2 ч по схеме:
Известным способом не могут быть получены 3-арил-1,5,3-дитиазепинаны общей формулы (Ia-i).
Таким образом, в литературе отсутствуют сведения по получению 3-арил-1,5,3-дитиазепанов общей формулы (Ia-i).
Предлагается новый способ получения 3-арил-1,5,3-дитиазепанов общей формулы (Ia-i).
Сущность способа заключается во взаимодействии N1,N1,N6,N6-тетраметил-2,5-дитиагексан-1,6-диамина с ариламином (арил=фенил, m- и р-метилфенил, о-, m- и p-метоксифенил, о-, m- и p-нитрофенил) в присутствии катализатора FeCl3·6H2O, взятыми в мольном соотношении N1,N1,N1,N6-тетраметил-2,5-дитиагексан-1,6-диамин: ариламин: FеСl3·6Н2O=10:10:(0.3-0.7), предпочтительно 10:10:0.5, при температуре ~60°С и атмосферном давлении в хлороформе в качестве растворителя в течение 50-80 минут, предпочтительно 65 минут. Выход соответствующих 3-арил-1,5,3-дитиазепанов общей формулы (Ia-i) составляет 68-93%. Реакция протекает по схеме:
3-Арил-1,5,3-дитиазепаны общей формулы (Ia-i) образуются только лишь с участием N1,N1,N6,N6-тетраметил-2,5-дитиагексан-1,6-диамина и ариламина, взятых в стехиометрических количествах. При другом соотношении исходных реагентов снижается селективность реакции. В присутствии других серусодержащих соединений (например, алкил-, арилтиолы) или других первичных аминов (например, алкиламины) целевые продукты (Ia-i) не образуются. Без катализатора реакция идет с выходом, не превышающим 10%.
Проведение указанной реакции в присутствии катализатора FeCl3·6H2O больше 7 мол. % не приводит к существенному увеличению выхода целевого продукта (Ia-i). Использование катализатора FeСl3·6Н2O менее 3 мол.% снижает выход (Ia-i), что связано, возможно, со снижением каталитически активных центров в реакционной массе. Реакции проводили при температуре 60°С. При меньшей температуре (например, 10°С) снижается скорость реакции. Опыты проводили в хлороформе, т.к. в нем хорошо растворяются исходные реагенты и целевые продукты.
Существенные отличия предлагаемого способа
В известном способе реакция идет с участием в качестве исходного реагента 5-(трет-бутил)-2-оксогексагидро-1,3,5-триазина в присутствии BF3·2HOAc с образованием 3-(трет-бутил)пергидро-1,5,3-дитиазепина (2). Известный способ не позволяет получать индивидуальные 3-арил-1,5,3-дитиазоканы общей формулы (Ia-i).
В предлагаемом способе в качестве исходных реагентов применяются ариламины и N1,N1,N6,N6-тетраметил-2,5-дитиагексан-1,6-диамин, реакция идет под действием катализатора FeСl3·6Н2O. В отличие от известных предлагаемый способ позволяет получать индивидуальные 3-арил-1,5,3-дитиазепаны общей формулы (Ia-i).
Способ поясняется следующими примерами.
ПРИМЕР 1.
В сосуд Шленка, установленный на магнитной мешалке, в атмосфере аргона помещают 2.08 г (10 ммоль) N1,N1,N6,N6-тетраметил-2,5-дитиагексан-1,6-диамина и 0.93 г (10 ммоль) анилина, 5 мл хлороформа, 0.14 г (0.5 ммоль) катализатора FeСl3·6Н2O, перемешивают при температуре ~60°С 65 мин, выделяют 3-фенил-1,5,3-дитиазепан (Iа) с выходом 78%. Другие примеры, подтверждающие способ, приведены в табл.1.
| Таблица 1 | ||||
| №№ п/п | Исходный нитроанилин | Соотношение ариламин: N1,N1,N6,N6-тетраметил-2,5-дитиагексан-1,6-диамин: FeО3·6H2О, ммоль | Время реакции, мин | Выход (I), % |
| 1 | анилин | 10:10:0.5 | 65 | 78 |
| 2 | -«- | 10:10:0.3 | 65 | 68 |
| 3 | -«- | 10:10:0.7 | 65 | 86 |
| 4 | -«- | 10:10:0.5 | 50 | 70 |
| 5 | -«- | 10:10:0.5 | 80 | 81 |
| 6 | м-метиланилин | 10:10:0.5 | 65 | 76 |
| 7 | р-метиланилин | 10:10:0.5 | 65 | 87 |
| 8 | о-метиланилин | 10:10:0.5 | 65 | 93 |
| 9 | м-метиланилин | 10:10:0.5 | 65 | 79 |
| 10 | р-метиланилин | 10:10:0.5 | 65 | 88 |
| 11 | о-метиланилин | 10:10:0.5 | 65 | 85 |
| 12 | м-метиланилин | 10:10:0.5 | 65 | 80 |
| 13 | р-метиланилин | 10:10:0.5 | 65 | 89 |
Все опыты проводили в хлороформе при температуре ~60°С.
3-Фенил-1,5,3-дитиазепан.
Спектр ЯМР 1H, δ, м.д.: 3.08 (с, 4Н, СН2); 4.80 (с, 4Н, СН2); 6.91-7.35 (м, 4H, СН). Спектр ЯМР 13С, δ, м.д.: 35.78(С6,7); 54.92(С2,4); 115.93(С9,13); 119.95(С11); 129.30(С10,12); 145.83(С8). Масс-спектр, m/z (Iотн, %): 211 [М]+ (12), 78 [C6H5]+(10), 91 [C6H5N]+ (15), 137 [C7H7NS]+ (100); 165 [C9H12NS]+ (95).
3-(м-Метилфенил)-1,5,3-дитиазепан (Ib).
Спектр ЯМР 1H, δ, м.д.: 2.38 (с, 3H, СН3); 3.10 (с, 4H, СН2); 4.81 (с, 4H, СН2); 6.79-7.23 (м, 4Н, СН). Спектр ЯМР 13С, δ, м.д.: 21.83(С14); 35.91(С6,7) 55.06(С2,4); 112.29(С13); 116.69(С9); 120.93(С11); 129.08(С10); 138.90(С12); 145.95(С8). Масс-спектр, m/z (Iотн, %): 225 [М]+ (12), 91 [С7Н8]+ (70), 106 [C7H8N]+ (100), 119 [C8H9N]+ (100); 165 [C11H14NS]+ (40). М 225.
3-(р-Метилфенил)-1,5,3-дитиазепан (Ic).
Спектр ЯМР 1Н, δ, м.д.: 2.33 (с, 3Н, СН3); 3.91 (с, 4H, СН2); 4.89 (с, 4Н, СН2); 6.53-6.67 (м, 4H, СН). Спектр ЯМР 13С, δ, м.д.: 21.77(С14); 35.83(С6,7) 54.95(С2,4); 114.76(С9,13); 119.43(С10,12); 139.04(С11); 148.74(С8).
3-(о-Метоксифенил)-1,5,3-дитиазепан (Id).
Спектр ЯМР 1Н, δ, м.д.: 2.71-2.95 (м, 4Н, СН2); 3.35 (с, 3Н, СН3); 4.53 (с, 4Н, CH2): 6.67-7.87 (м, 4Н, СН). Спектр ЯМР 13С, δ, м.д.: 33.48(С6,7); 53.66(С15) 58.93(С2,4); 111.35(С11); 115.76(С13); 123.05(С10); 128.96(С12); 144.78(С9); 147.20(С8).
3-(м-Метоксифенил)-1,5,3-дитиазепан (Iе).
Спектр ЯМР 1Н, δ, м.д.: 2.61-2.73(м, 4Н, СН2); 3.42 (с, 3Н, CH3); 4.47 (с, 4Н, СН2); 6.71-7.53 (м, 4Н, СН). Спектр ЯМР 13С. δ, м.д.: 33.95(С6,7); 52.00(С15); 60.97(С2,4); 109.89(С11); 112.43(С12); 119.97(С13); 124.77(С9); 144.55(С10); 147.32(С8). Масс-спектр, m/z (Iотн, %): 241 [М]+ (20), 77 [С6Н5]+ (70), 106 [С7Н6O]+ (40), 120 [C7H6ON]+ (100); 135 [C8H9NO]+ (60); 180 [C9H11NOS]+ (10); 208 [C11H15NOS]+ (80). М241.
3-(п-Метоксифенил)-1,5,3-дитиазепан (If).
Спектр ЯМР 1Н, δ, м.д.: 2.64-2.81 (м, 4Н, СН2); 3.51 (с, 3Н, СН3); 4.39 (с, 4Н, СН2); 6.59-7.12 (м, 4Н, СН). Спектр ЯМР 13С, δ, м.д.: 34.28(С6,7); 51.93(С15); 59.99(С2,4); 113.33(С9,13); 125.07(С10,12); 143.98(С11); 148.01(С8).
3-(о-Нитрофенил)-1,5,3-дитиазепан (Ig).
Спектр ЯМР 1H, δ, м.д.: 2.66-2.99 (м, 4Н, СН2); 4.46 (с, 4Н, СH2); 6.67-7.87 (м. 4Н, СН). Спектр ЯМР 13С, δ, м.д.: 34.51 (С6,7); 59.65(С2,4); 110.55(С11); 114.71(С13); 122.45(С10); 129.01(С12); 145.92(С9); 147.20(С8). Масс-спектр, m/z (Iотн, %): 256 [M]+ (20), 122 [C6H4NO2]+ (70), 136 [C6H4N2O2]+ (40), 181 [C7H8N2O2S]+(100); 210 [C9H10N2O2S]+ (100). M 256.
3-(м-Нитрофенил)-1,5,3-дитиазепан (Ih).
Спектр ЯМР 1H, δ, м.д.: 2.74-2.79 (м, 4Н, СН2); 4.14 (с, 4Н, СН2); 7.12-7.74 (м, 4H, СН). Спектр ЯМР 13С, δ, м.д.: 35.45(С6,7); 61.59(С2,4); 109.43(С11); 113.55(С13); 121.13(С9); 128.73(С12); 143.67(С10); 147.01(С8).
3-(р-Нитрофенил)-1,5,3-дитиазепан (Ii).
Спектр ЯМР 1Н, δ, м.д.: 2.79-2.90 (м, 4Н, СН2); 4.30 (с, 4Н, СН2); 6.91-7.85 (м, 4Н, СН). Спектр ЯМР 13С, δ, м.д.: 36.41(С6,7); 59.75(С2,4); 111.92(C9,13); 124.25(С10,12); 138.90(С11); 149.52(С8).
Способ получения 3-арил-1,5,3-дитиазепанов общей формулы (Ia-i): отличающийся тем, что N1,N1,N6,N6-тетраметил-2,5-дитиагексан-1,6-диамина подвергают взаимодействию с ариламином (арил = фенил, m- и p-метилфенил, o-, m- и р-метоксифенил, о-, m- и р-нитрофенил) в присутствии катализатора FeCl3·6H2O в мольном соотношении N1,N1,N6,N6-тетраметил-2,5-дитиагексан-1,6-диамин : ариламин : FeCl3·6H2O=10:10:(0.3-0.7) при температуре ~60°С и атмосферном давлении в хлороформе в качестве растворителя в течение 50-80 минут.