Фармацевтические композиции и пероральные дозированные формы пролекарства леводопы и способы применения
Иллюстрации
Показать всеИзобретение относится к медицине и представляет собой фармацевтические композиции и пероральные дозированные формы, включающие гранулы, полученные влажной грануляцией с большим усилием сдвига и содержащие безводный кристаллический (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата и С6-18 алкилсульфат. Изобретение заключается также в способах лечения болезни Паркинсона, шизофрении, когнитивного нарушения, синдрома усталых ног, нарушения периодических движений конечностей, поздней дискинезии, болезни Хантингтона, гипертензии и чрезмерной дневной сонливости с помощью введения пациенту терапевтически эффективного количества фармацевтической композиции или дозированной формы. Технический результат заключается в контроле образования гидрата кристаллического (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата. 6 н. и 12 з.п. ф-лы, 11 пр., 11 табл., 9 ил.
Реферат
По настоящей заявке испрашивается приоритет по предварительной патентной заявке США номер 61/259567, поданной 9 ноября 2009, которая включена в данное описание путем ссылки.
Настоящая заявка относится к фармацевтическим композициям и пероральным дозированным формам пролекарства леводопы и способам лечения заболевания, включающим пероральное введение таких фармацевтических композиций и дозированных форм.
Болезнь Паркинсона представляет собой лишающее трудоспособности, прогрессирующее заболевание, которое поражает одного человека на 1000 и обычно встречается у людей в возрасте после 50 лет. У пациентов с болезнью Паркинсона наблюдается дефицит нейромедиатора допамина в мозге в результате нарушения нигростриатального пути, вызванного дегенерацией черной субстанции (substantia nigra). Леводопа (L-допа или L-3,4-дигидроксифенилаланин), непосредственный предшественник допамина, является стандартным лекарственным средством, назначаемым для лечения этого заболевания.
После перорального введения леводопа быстро адсорбируется с помощью аминокислотного транспортера, присутствующего в верхнем тонком кишечнике. Поскольку распределение этой транспортерной системы ограничено, то окно, доступное для абсорбции леводопы, и степень абсорбции может зависеть от скорости, с которой лекарственное средство проходит через верхний желудочно-кишечный тракт.
Метаболизм леводопы в кишечнике является основным источником первой потери на пути лекарственного средства. Приблизительно 35% введенной дозы леводопы попадает в большой круг кровообращения в виде интактной леводопы после перорального введения больным (Sasahara, J. Pharm. Sci 1990, 69, 261). После адсорбции леводопа быстро метаболизируется в допамин ферментами декарбоксилазой L-ароматических аминокислот (AADC) в периферических тканях (например, кишечном тракте и печени). Поэтому вместе с леводопой обычно применяют ингибитор декарбоксилазного фермента, такой как карбидопа или бенсеразид. При введении вместе с карбидопой, концентрация в плазме интактной леводопы увеличивается и, таким образом, большее количество леводопы становится доступным для переноса в центральную нервную систему, где она превращается в допамин. Карбидопа и бенсеразид практически не проходят через гематоэнцефалический барьер и поэтому не ингибируют желаемое превращение леводопы в допамин в мозге.
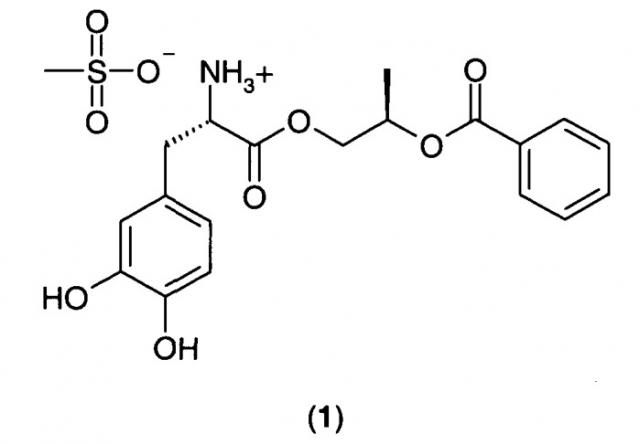
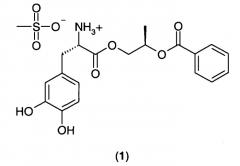
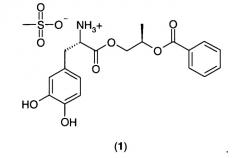
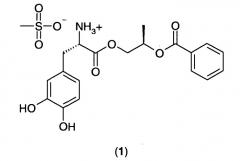
Пролекарства леводопы, предназначенные для адсорбции как в тонком, так и в толстом кишечнике, описаны в патенте США номер 7323585, патенте США номер 7342131, публикации патентной заявки США номер 2008/0103200 (выданной как патент США номер 7671089), патенте США номер 7534813, публикации патентной заявки США номер 2008/0171789 (выданной как патент США номер 7709527), публикации патентной заявки США номер 2008/0214663 и публикации патентной заявки США номер 2009/0137834. С такими пролекарствами леводопы пероральная биодоступность леводопы может достигать значений, по меньшей мере в два раза больших, чем пероральная биодоступность леводопы при пероральном введении эквивалентных молярных количеств. Более конкретно, патент США номер 7342131 и патент США номер 7534813 раскрывают соединение (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат гидрохлорид в аморфной или кристаллической форме. Кристаллический (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат 1:
описан в патенте США номер 7563821. Такие пролекарства леводопы могут быть включены в препараты с замедленным высвобождением, для создания длительного системного воздействия леводопы при пероральном введении пациенту.
Патентная заявка США 12/581810, поданная 19 октября 2009 (номер публикации американской заявки 2010/0099761), раскрывает кристаллогидраты (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата и, в частности, (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат сесквигидрат. Было установлено, что гидраты (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата образуются при определенных условиях влагосодержания в окружающей среде. Различные кристаллические формы и гидраты соединения могут проявлять различные физические свойства твердого тела, которые могут сильно влиять, например, на возможность технологической обработки, скорости растворения соединения из дозированной формы и стабильности соединения. Поэтому существует необходимость в контроле образования гидрата.
Таким образом, раскрываются фармацевтические композиции и пероральные дозированные формы, в которых образование гидрата кристаллического (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата контролируется.
В первом аспекте предложены фармацевтические композиции, содержащие кристаллический (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат и C6-18алкилсульфат или его фармацевтически приемлемую соль.
Во втором аспекте предложены пероральные дозированные таблетированные формы, содержащие кристаллический (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат и C6-18алкилсульфат или его фармацевтически приемлемую соль.
В третьем аспекте предложены способы лечения заболевания пациента, такого как болезнь Паркинсона, шизофрения, когнитивные нарушения, синдром усталых ног, периодические нарушения движения конечностей, поздняя дискинезия, заболевание Хантингтона, гипертензия и избыточная дневная сонливость, включающие введение пациенту, нуждающемуся в таком лечении, фармацевтической композиции, содержащей терапевтически эффективное количество кристаллического (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата и C6-18алкилсульфата или его фармацевтически приемлемой соли.
В четвертом аспекте предложены способы лечения заболевание пациента, такого как болезнь Паркинсона, шизофрения, когнитивные нарушения, синдром усталых ног, периодические нарушения движения конечностей, поздняя дискинезия, заболевание Хантингтона, гипертензия и избыточная дневная сонливость, включающие введение пациенту, нуждающемуся в таком лечении, пероральной дозированной формы, содержащей кристаллический (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат и C6-18алкилсульфат или его фармацевтически приемлемую соль.
Специалисту в данной области должно быть понятно, что описанные здесь фигуры служат только для иллюстративных целей. Фигуры не предназначены для ограничения объема настоящего раскрытия.
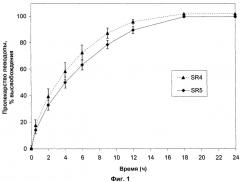
На фигуре 1 показан профиль растворения для таблеток SR4 и SR5, полученных по примеру 5.
На фигуре 2 показаны картины PXRD для измельченных таблеток SR5, полученных в примере 5, после воздействия условий 40°C/75% относительной влажности (RH) в течение 4 недель.
На фигуре 3 показаны картины PXRD для (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата и для гранул, содержащих (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат, полученных с различным количеством воды, для влажной грануляции с большим усилием сдвига.
На фигуре 4 показан фармакокинетический профиль леводопы после перорального введения натощак таблеток SR4 или SR5 субъектам исследования.
На фигуре 5 показан фармакокинетический профиль леводопы после перорального введения после еды таблеток SR4 или SR5 субъектам исследования.
На фигуре 6 показаны профили растворения пролекарства леводопы для двухслойных таблеток, полученных по примеру 9 и имеющих состав, приведенный в таблице 5.
На фигуре 7 показаны профили растворения пролекарства леводопы для двухслойных таблеток, полученных по примеру 9 и имеющих составы препаратов e, f, g и h, приведенные в таблице 7.
На фигуре 8 показаны профили растворения пролекарства леводопы для трехслойных таблеток, полученных по примеру 9 и имеющих состав, приведенный в таблицах 8-11.
На фигуре 9 показаны профили растворения карбидопы для двухслойных таблеток, полученных по примеру 9 и имеющих состав, приведенный в таблицах 8-11.
"Пациент" или "субъект" включают млекопитающих, таких как, например, человек.
"Фармацевтически приемлемый носитель" относится к фармацевтически приемлемому разбавителю, фармацевтически приемлемому адъюванту, фармацевтически приемлемому эксципиенту, фармацевтически приемлемому носителю или комбинации любых перечисленных, с которыми пролекарство леводопы может быть введено пациенту, которое не снижает его фармакологическую активность, и который нетоксичен при введении в дозах, достаточных для обеспечения терапевтически эффективного количества леводопы.
"(2R)-2-Фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат (1)" имеет следующую структурную формулу:
"Пролекарство" относится к производному активного соединения (лекарственного средства), которое подвергается превращению в условиях применения, таких как внутри тела, высвобождая активное лекарственное средство. Пролекарства часто, но не обязательно, фармакологически неактивны до превращения в активное лекарственное средство. Пролекарства могут быть получены присоединением прогруппы (определенной здесь), как правило, посредством функциональной группы, к лекарственному средству. Например, (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат метаболизируется внутри тела пациента, образуя исходное лекарственное средство, леводопу.
"Прогруппа" относится к группе, присоединенной к лекарственному средству, как правило, к функциональной группе лекарственного средства, посредством связи(ей), которые легко расщепляются при определенных условиях применения. Связь(и) между лекарственным средством и прогруппой может быть расщеплена ферментативными или неферментативными агентами. В условиях применения, например, после введения пациенту, связь(и) между лекарственным средством и прогруппой может расщепляться, высвобождая исходное лекарственное средство. Отщепление прогруппы может произойти самопроизвольно, посредством реакции гидролиза или под воздействием катализатора или другого агента, такого как фермент, свет, кислота или при изменении или воздействии физического или экологического параметра, такого как изменение температуры, pH и т.д. Агент может быть эндогенным по отношению к условиям применения, таким как фермент, находящийся в большом круге кровообращения пациента, которому вводится пролекарство, или кислотные условия желудка, или агент может быть экзогенным. Например, для (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата, лекарственным средством является леводопа, а прогруппа имеет структуру:
"Терапевтически эффективное количество" относится к такому количеству соединения, которое при введении субъекту с целью лечения заболевания или нарушения, или по меньшей мере одного клинического симптома заболевания или нарушения, достаточно для осуществления такого лечения заболевания, нарушения или симптома. Терапевтически эффективное количество может изменяться в зависимости, например, от соединения, заболевания, нарушения и/или симптомов заболевания, тяжести заболевания или нарушения, и/или симптомов заболевания, возраста, массы и/или состояния пациента, которому требуется лечение, и мнения врача, назначающего лечение. Необходимое количество может быть установлено специалистом в данной области или может быть определено рутинным экспериментом.
"Лечить" или "лечение" заболевания относятся к прекращению или улучшению заболевания, нарушения или по меньшей мере одного из клинических симптомов заболевания или нарушения. В некоторых вариантах осуществления "лечить" или "лечение" относится к прекращению или улучшению по меньшей мере одного физического параметра заболевания или нарушения, которое может быть не отмечено или отмечено пациентом. В некоторых вариантах осуществления, "лечить" или "лечение" относится к подавлению или контролю заболевания или нарушения, либо физически (например, стабилизация замеченного симптома), либо физиологически (например, стабилизация физического параметра), или/и того и другого. В некоторых вариантах осуществления, "лечить" или "лечение" относятся к задержке, в некоторых случаях неопределенной, начала заболевания или нарушения.
Далее будут раскрываться конкретные варианты осуществления фармацевтических композиций, дозированных форм и способов. Раскрытые варианты осуществления не служат для ограничения формулы изобретения. Наоборот, формула изобретения охватывает все варианты, модификации и эквиваленты.
Фармацевтические композиции, представленные в настоящем описании, содержат кристаллический (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил) пропаноат мезилат и C6-18алкилсульфат или их фармацевтически приемлемую соль.
Пролекарства леводопы раскрыты в патенте США номер 7323585, патенте США номер 7342131, опубликованной патентной заявке США номер 2008/0171789, и опубликованной патентной заявке США 2008/0214663 (по которой выдан патент США номер 7709527). Пролекарство леводопы, (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат 1:
и его кристаллическая форма и способы синтеза раскрыты в патенте США номер 7563821. Способы синтеза также раскрыты в заявке США номер 12/581808, поданной 19 октября 2009 (публикация заявки США номер 2010/0099907). Гидраты кристаллического (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноата, мезилата раскрыты в заявке США номер 12/581810, поданной 19 октября 2009 (публикация заявки США номер 2010/0099761).
Специалисту в данной области должно быть понятно, что хотя кристаллический (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат раскрыт, образец кристаллического (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноата может иметь отличающуюся композиционную и диастереоизомерную чистоту. В некоторых вариантах осуществления, кристаллический (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата может иметь композиционную чистоту по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98%, по меньшей мере приблизительно 99%, и в некоторых вариантах осуществления по меньшей мере более чем, приблизительно 99%. В некоторых вариантах осуществления кристаллический (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат может иметь диастереомерную чистоту по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98%, по меньшей мере приблизительно 99%, и в некоторых вариантах осуществления по меньшей мере более чем приблизительно 99%.
Кристаллический (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат может существовать в нескольких таутомерных формах. Соответственно, все возможные таутомерные формы кристаллического(R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата входят в объем притязаний, если не определено иначе. Все меченные изотопами формы кристаллического (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата также входят в объем притязаний, если иначе не определено. Примеры изотопов, которые могут быть включены в кристаллический (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат, без ограничения включают 2H, 3H, 11C, 13C, 14C, 15N, 18О и 17О.
В некоторых вариантах осуществления порошковая рентгеновская дифрактограмма (PXRD) безводного кристаллического (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата показывает характерные дифракционные пики (°2Θ) при 4,7°±0,2°, 5,0°±0,2°, 8,5°±0,2°, 9,6°±0,2°, 13,6°±0,2°, 15,0°±0,2°, 17,0°±0,2°, 17,4°±0,2°, 17,7°±0,2°, 19,1°±0,2°, 19,5°±0,2°, 20,0°±0,2°, 20,4°±0,2°, 21,1°±0,2°, 22,3°±0,2°, 22,9°±0,2°, 23,1°±0,2°, 23,3°±0,2°, 24,3°±0,2°, 25,0°±0,2°, 25,3°±0,2°, 25,7°±0,2°, 25,8°±0,2°, 26,9°±0,2°, 27,3°±0,2°, 28,2°±0,2°, 30,1°±0,2°, 30,5°±0,2, 32,0°±0,2°, 33,8°±0,2°, 34,3°±0,2°, 37,6°±0,2° и 38,4°±0,2°. PXRD картины безводного кристаллического (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата показаны на фигуре 2 (картины A-C) и фигуре 3 (картина A).
Специалисту в данной области должно быть понятно, что могут быть незначительные отклонения наблюдаемых °2Θ дифракционных углов, которые могут быть обусловлены, например, конкретным используемым дифрактометром, специалистом, выполняющим анализ, и методикой пробоподготовки. Большее отклонение может ожидаться в относительной интенсивности пика. Сравнение дифракционных картин может быть выполнено в первую очередь по наблюдаемым °2Θ дифракционным углам с меньшим вниманием к относительным интенсивностям пиков. Для порошковых рентгеновских дифрактограмм безводного кристаллического (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата, основные пики, которые показывают наибольшую интенсивность, расположены в °2Θ дифракционных углах при 5,0°±0,2°, 8,5°±0,2°, 13,6°±0,2°, 15,0°±0,2°, 17,0°±0,2°, 17,7°±0,2°, 20,4°±0,2°, 21,1°±0,2°, 25,0°±0,2°, 25,8°±0,2°, 28,2°±0,2, 30,1°±0,2° и 37,6°±0,2°. Порошковая рентгеновская дифрактограмма с характерными дифракционными пиками (°2Θ) при 5,0°±0,2°, 8,5°±0,2°, 13,6°±0,2°, 15,0°±0,2°, 17,0°±0,2°, 17,7°±0,2°, 20,4°±0,2°, 21,1°±0,2°, 25,0°±0,2°, 25,8°±0,2°, 28,2°±0,2°, 30,1°±0,2° и 37,6°±0,2°, будет по существу такой же, как и порошковая рентгеновская дифрактограмма безводного кристаллического (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата.
В некоторых вариантах осуществления точка плавления безводного кристаллического (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата находится от приблизительно 157°C до приблизительно 162°C.
В некоторых вариантах осуществления безводный кристаллический (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат характеризуется термограммой дифференциальной сканирующей калориметрии (DSC) с эндотермическим пиком при приблизительно 164,5°C, и в некоторых вариантах осуществления при приблизительно 164,5±2,5°C.
В некоторых вариантах осуществления безводный кристаллический (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат стабилен, т.е. не абсорбирует влагу и/или не принимает другую изоморфную форму при обычных фармацевтической обработке или и/или условиях хранения.
Физические свойства и характеристики кристаллического (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата, полученного способами, раскрытыми в патенте США номер 7563821, соответствуют таковым для единственного изоморфа. Стабильность при внешних воздействиях единственной изоморфной формы кристаллического (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата позволяет использовать ее в фармацевтических композициях.
В некоторых условиях водной активности, как раскрыто в американской заявке номер 12/581810, поданной 19 октября 2009 (номер публикации американской заявки 2010/0099761), безводный кристаллический (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат превращается в кристаллогидрат.
В некоторых вариантах осуществления кристаллический (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилатгидрат характеризуется порошковой рентгеновской дифрактограммой с характерными углами рассеяния, измеренными при Cu-Kα излучении (°2Θ), по меньшей мере при 6,0°±0,2°, 9,1±0,2°, 9,6°±0,2°, 12,0°±0,2°, 13,8°±0,2°, 14,6°±0,2°, 15,1°±0,2°, 15,6°±0,2°, 16,1±0,20, 16,6°±0,2°, 17,6°±0,2°, 18,5°±0,2° и 19,2°±0,2°. В некоторых вариантах осуществления, кристаллический (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат гидрат характеризуется порошковой рентгеновской дифрактограммой с характерными углами рассеяния, измеренными при Cu-Kα излучении (°2Θ), по меньшей мере при 6,0°±0,2°, 9,1±0,2°, 9,6°±0,2°, 12,0°±0,2°, 13,8°±0,2°, 14,6°±0,2°, 15,1°±0,2°, 15,6°±0,2°, 16,1°±0,2°, 16,6°±0,2°, 17,6°±0,2°, 18,5°±0,2°, 19,2°±0,2°, 20,8°±0,2°, 21,9°±0,2°, 22,8°±0,2°, 23,4°±0,2°, 23,7°±0,2°, 23,9°±0,2° и 26,5°±0,2°. В некоторых вариантах осуществления, кристаллический (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат гидрат характеризуется порошковой рентгеновской дифрактограммой с характерными углами рассеяния, измеренными при Cu-Kα излучении (°2Θ), по меньшей мере при 6,0°±0,2°, 9,1°±0,2°, 9,6°±0,2°, 11,2°±0,2°, 12,0°±0,2°, 12,8°±0,2°, 13,8°±0,2°, 14,3°±0,2°, 14,6°±0,2°, 15,1°±0,2°, 15,6°±0,2°, 16,1±0,2°, 16,6°±0,2°, 17,6°±0,2°, 18,5°±0,2°, 18,7°±0,2°, 19,2°±0,2°, 20,5°±0,2°, 20,8°±0,2°, 21,1°±0,2°, 21,9°±0,2°, 22,8°±0,2°, 23,4°±0,2°, 23,7°±0,2°, 23,9°±0,2°, 24,7°±0,2°, 26,5°±0,2°, 28,2°±0,2°, 28,3°±0,2° и 29,5°±0,2°. Картина PXRD гидрата кристаллического (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата показана на фигуре 3 (картина C). Кристаллогидрат может образовываться при технологических операциях, таких как влажная грануляция с большим усилием сдвига или при воздействии определенных температурных и влажностных режимов.
Было установлено, что добавление малого количества алкилсульфата или его фармацевтически приемлемой соли в фармацевтическую композицию может позволить контролировать или предотвратить превращение безводного кристаллического (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата в гидратированную форму. Соответственно, фармацевтические композиции и пероральные дозированные формы, раскрытые в настоящем описании, содержат, помимо кристаллического (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата, C6-18алкилсульфат или его фармацевтически приемлемую соль. В некоторых вариантах осуществления, C6-18алкилсульфат или его фармацевтически приемлемая соль представляет собой C6-18алкилсульфат или его фармацевтически приемлемую соль, а в некоторых вариантах осуществления C10-14алкилсульфат или его фармацевтически приемлемую соль. В некоторых вариантах осуществления C6-18алкилсульфат или его фармацевтически приемлемая соль представляют собой лаурилсульфатную соль (C12алкилсульфат), а в некоторых вариантах осуществления лаурилсульфат натрия. В некоторых вариантах осуществления количество C6-18алкилсульфата или его фармацевтически приемлемой соли в фармацевтической композиции составляет более чем приблизительно 0,5 масс.%, где масс.% рассчитывается по общей массе сухого вещества композиции. В некоторых вариантах осуществления количество C6-18алкилсульфата или его фармацевтически приемлемой соли в фармацевтической композиции или пероральной дозированной форме может составлять от приблизительно 0,5 масс.% до приблизительно 2,0 масс.%, от приблизительно 0,5 масс.% до приблизительно, 1,5 масс.%, и в некоторых вариантах осуществления составляет от приблизительно 0,6 масс.% до приблизительно 0,9 масс.%. Количество C6-18алкилсульфата или его фармацевтически приемлемой соли должно быть достаточно для контроля или предотвращения превращения безводного кристаллического (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата в гидратированную форму.
В некоторых вариантах осуществления фармацевтические композиции и пероральные дозированные формы, раскрытые в настоящем описании, могут дополнительно содержать один или более фармацевтически приемлемых эксципиентов.
В некоторых вариантах осуществления фармацевтическая композиция содержит от приблизительно 50 масс.% до приблизительно 90 масс.% кристаллического (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата; от приблизительно 0,5 масс.% до приблизительно 2,0 масс.% C6-18алкилсульфата или его фармацевтически приемлемой соли; от приблизительно 6 масс.% до приблизительно 20 масс.% гидроксипропилметилцеллюлозы; и от приблизительно 0,5 масс.% до приблизительно 2,0 масс.% стеарата магния; где масс.% рассчитывает по общей массе сухого вещества композиции. В некоторых вариантах осуществления фармацевтическая композиция содержит от приблизительно 80 масс.% до приблизительно 90 масс.%, кристаллического (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата; от приблизительно 0,5 масс.% до приблизительно 1,0 масс.% C6-18алкилсульфата или его фармацевтически приемлемой соли; от приблизительно 6 масс.% до приблизительно 10 масс.%: гидроксипропилметилцеллюлозы; и от приблизительно 0,5 масс.% до приблизительно 2,0 масс.% стеарата магния; где масс.% рассчитывается по общей массе сухого вещества композиции.
Как раскрывается в американской заявке номер 12/581810, поданной 19 октября 2009 (номер публикации американской заявки 2010/0099761) и в примере 3 данного описания, процесс грануляции с большим усилием сдвига безводного кристаллического (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата приводит к превращению (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата в кристаллический гидрат. Как показано в примере 6, добавление малого количества лаурилсульфата натрия в состав для влажной грануляции с большим усилием сдвига позволяет контролировать или препятствовать превращению кристаллического безводного (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата в гидратированную форму. Применение анионных поверхностно-активных веществ для контроля твердофазных превращений вообще (Davey et al., J Am Chem Soc 1997, 119, 1767-1772; and Ataab et al., Adv Mater 1990, 2(1), 40-43) и при влажной грануляции с большим усилием сдвига (Airaksinen et al., AAPS PharmSciTech 2005, 6(2), E31 1-E322; and Wikstrom et al., Pharmaceutical Research 2008, 25(4), 923-935) известны в данной области.
Пероральные дозированные формы, раскрытые в настоящем описании, содержат кристаллический (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат и C6-18алкилсульфат или его фармацевтически приемлемой соли. В некоторых вариантах осуществления дозированные формы могут представлять собой капсулы или таблетки. В некоторых вариантах осуществления пероральная дозированная форма содержит гранулы, где гранулы содержат кристаллический (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат и C6-18алкилсульфат или его фармацевтически приемлемую соль. В некоторых вариантах осуществления пероральных дозированных форм и гранул, C6-18алкилсульфат или его фармацевтически приемлемая соль представляет собой C6-18алкилсульфат или его фармацевтически приемлемую соль, и в некоторых вариантах осуществления C10-14алкилсульфат или его фармацевтически приемлемую соль. В некоторых вариантах осуществления, C6-18алкилсульфат или его фармацевтически приемлемая соль представляют собой лаурилсульфатную соль (C12алкилсульфат), и в некоторых вариантах осуществления, лаурилсульфат натрия. В некоторых вариантах осуществления гранулы содержат от приблизительно 90 масс.% до приблизительно 99 масс.% кристаллического (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата и от приблизительно 0,5 масс.% до приблизительно 2 масс.% C6-18алкилсульфат или его фармацевтически приемлемой соли; где масс.% рассчитывается по общей массе сухого вещества гранул. В некоторых вариантах осуществления гранулы содержат от приблизительно 90 масс.% до приблизительно 99 масс.% кристаллического (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата и от приблизительно 0,5 масс.% до приблизительно 1 масс.% лаурилсульфата натрия; где масс.% рассчитывается по общей массе сухого вещества гранул.
Гранулы, содержащие кристаллический (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат и C6-18алкилсульфат или его фармацевтически приемлемую соль, могут быть получены влажной грануляцией с большим усилием сдвига. Для получения гранул кристаллический (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат и C6-18алкилсульфат или его фармацевтически приемлемую соль смешивают с водой. В некоторых вариантах осуществления количество воды, добавляемой при влажной грануляции с большим усилием сдвига, составляет от приблизительно 6 масс.% до приблизительно 10 масс.%, в некоторых вариантах осуществления от приблизительно 7 масс.% до приблизительно 10 масс.%, и в некоторых вариантах осуществления, от приблизительно 7 масс.% до приблизительно 9 масс.%, где масс.% рассчитывается по общей массе воды и сухого вещества, добавляемых при влажной грануляции с большим усилием сдвига.
Дозированные формы, содержащие гранулы, могут включать суспензию, в которой гранулы, содержащие кристаллический (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат, диспергированы в фармацевтически приемлемом растворяющем составе. Растворяющие составы могут включать воду, этанол, ароматизаторы, окрашивающие или комбинации любых перечисленных. Жидкие пероральные дозированные формы могут включать водные и неводные растворы, эмульсии, суспензии и растворы и/или суспензии, восстановленные из нешипучих гранул, содержащие соответствующие растворители, эмульгаторы, суспендирующие средства, разбавители, подсластители, окрашивающие средства и вкусовые добавки, консерванты и комбинации любых перечисленных. Растворитель водного перорально приемлемого фармацевтического носителя представляет собой полностью или в основном воду и может включать суспендирующее средство. Примеры носителей включают водные растворы, сиропы, эликсиры, дисперсию, суспензии, эмульсии, такие как эмульсии типа «масло-в-воде» и микроэмульсии. Примеры суспендирующих средств включают микрокристаллическую целлюлозу/натрий карбоксиметилцеллюлозу, гуаровую камедь и т.п. Вспомогательные растворители, используемые для солюбилизации и включения водонерастворимых ингредиентов в суспензию, включают пропиленгликоль, глицерин, раствор сорбита и т.п. Кроме того, жидкий состав может включать носители, такие как увлажняющие компоненты, эмульгирующие и суспендирующие средства, подслащивающие, ароматизирующие, красящие, парфюмерные и консервирующие средства. Примеры используемых в суспензии средств включают этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и сорбитановые сложные эфиры, микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит, агар-агар, трагант и комбинации любых перечисленных.
В некоторых вариантах осуществления пероральная дозированная форма включает от приблизительно 50 масс.% до приблизительно 90 масс.% кристаллический (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата, от приблизительно 0,5 масс.% до приблизительно 2,0 масс.% C6-18алкилсульфат или его фармацевтически приемлемой соли, от приблизительно 6 масс.% до приблизительно 20 масс.% гидроксипропилметилцеллюлозы и от приблизительно 0,5 масс.% до приблизительно 2,0 масс.% стеарата магния; где масс.% рассчитывается по общей массе сухого вещества дозированной формы. В некоторых вариантах осуществления пероральная дозированная форма содержит от приблизительно 80 масс.% до приблизительно 90 масс.% кристаллического (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата, от приблизительно 0,5 масс.% до приблизительно 1,0 масс.% C6-18алкилсульфата или его фармацевтически приемлемой соли, от приблизительно 6 масс.% до приблизительно 10 масс.% гидроксипропилметилцеллюлозы и от приблизительно 0,5 масс.% до приблизительно 2,0 масс.% стеарата магния, где масс.% рассчитывается по общей массе сухого вещества дозированной формы.
В некоторых вариантах осуществления пероральная дозированная форма представляет собой многослойную таблетку, такую как двухслойная таблетка, где слой, содержащий кристаллический (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат, содержит от приблизительно 50 масс.% до приблизительно 90 масс.% кристаллического (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилата, от приблизительно 0,5 масс.% до приблизительно 2,0 масс.% C6-18алкилсульфата или его фармацевтически приемлемой соли; от приблизительно 6 масс.% до приблизительно 20 масс.% гидроксипропилметилцеллюлозы и приблизительно 0,5 масс.% до приблизительно 2,0 масс.% стеарата магния, где масс.% рассчитывается по общей массе сухого вещества композиции слоя. В некоторых вариантах осуществления пероральная дозированная форма представляет собой многослойную таблетку, такую как двухслойная таблетка, где слой, содержащий кристаллический (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат, содержит от приблизительно 80 масс.% до приблизительно 90 масс.% кристаллического (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат, от приблизительно 0,5 масс.% до приблизительно 1,0 масс.% C6-18алкилсульфата или его фармацевтически приемлемой соли, от приблизительно 6 масс.% до приблизительно 0 масс.% гидроксипропилметилцеллюлозы и от приблизительно 0,5 масс.% до приблизительно 2,0 масс.% стеарата магния, где масс.% рассчитывается по общей массе сухого вещества композиции слоя.
В некоторых вариантах осуществления дозированные формы могут быть представлены в форме таблеток. В некоторых вариантах осуществления гранулы и дополнительные носители могут быть спрессованы в таблетки на обычном оборудовании для таблетирования и по стандартным методикам. Методики и составы для получения таблеток (прессование и формование), капсул (твердых и мягких желатиновых) и пеллет известны в данной области. При включении гранул в таблетки, прессование гранул выполняют без разрушения. Дезинтегранты могут быть включены в таблетки, включающие частицы с контролируемым высвобождением, для улучшения высвобождения и/или растворения гранул из таблетки после проглатывания. Дозированные таблетированные формы могут иметь любую форму, подходящую для перорального введения лекарственного средства, такую как сфероидальную, кубообразный овал или эллипсоидальную форму. В некоторых вариантах осуществления дозированные таблетированные формы, раскрытые в настоящем описании, представляют собой матричные системы, в которых кристаллический (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат и C6-18алкилсульфат или его фармацевтически приемлемая соль распределены в матрице, включающей по меньшей мере одно соединение, изменяющее скорость высвобождения. Матричные системы известны в данной области. Дозированные таблетированные формы могут также представлять собой двухслойные таблетки, в которых первый слой включает кристаллический (2R)-2-фенилкарбонилоксипропил(2S)-2-амино-3-(3,4-дигидроксифенил)пропаноат мезилат и C6-18алкилсульфат или его фармацевтически приемлемую соль, такую как лаурилсульфат натрия, а второй слой включают другое фармацевтически применимое соединение, такое как ингибитор декарбоксилазы L-ароматических аминокислот, такой как карбидопа, ингибитор катехол-О-метилтрансферазы или комбинацию ингибитора декарбоксилазы L-ароматических аминокислот и ингибитора катехол-О-метилтрансферазы.
Соединение, изменяющее скорость высвобождения, может задерживать высвобождение фармацевтической композиции из дозированной формы. Примеры соединения, изменяющего скорость высвобождения,