Растворимые дозированные формы, содержащие производные цефема, приемлемые для парентерального введения
Иллюстрации
Показать всеИзобретение относится к медицине, конкретно к новым дозированным формам соединений цефема, полезным для лечения бактериальных инфекций. Дозированные формы являются стабильными, демонстрируют улучшенную растворимость и являются особенно приемлемыми для парентерального введения. 8 з.п. ф-лы, 29 табл., 8 пр.
Реферат
Эта заявка заявляет приоритет временной заявки США №60/974,194, поданной 21 сентября 2007, полное содержание которой введено в данную заявку в качестве ссылки.
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новым дозированным формам соединений цефема, полезным для лечения бактериальных инфекций. Дозированные формы стабильны, демонстрируют улучшенную растворимость и являются особенно приемлемыми, например, для парентерального введения.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
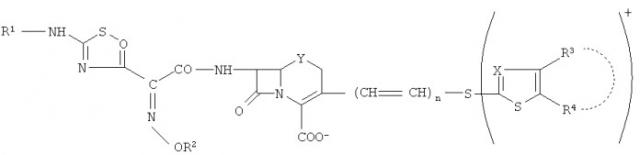
Патент США №6,417,175 раскрывает производные фосфоноцефема, обладающие отличной антибактериальной активностью в отношении широкого спектра грамположительных и грамотрицательных бактерий. Эти соединения имеют общую формулу:
где R1-R4, Q, X, Y и n являются такими, как определено в данном патенте. Одно из таких соединений представляет собой 7β-[2(Z)-этоксиимино-2-(5-фосфоноамино-1,2,4-тиадиазол-3-ил)ацетамидо]-3-[4-(1-метил-4-пиридинио)-2-тиазолитио]-3-цефем-4-карбоксилат. Патент США №6,417,175 раскрывает способы получения этого соединения (смотри, например, Примеры 1, 2, 5 и 6), и в общем раскрывает композиции соединений, описанных в данном патенте.
Патент США №6,906,055 раскрывает соединения формулы:
в которой X представляет собой CH3COOH, CH3CH2COOH или CH3CN, и n равно 0-5. Одно из таких соединений (в котором X представляет собой CH3COOH, а n равно 1) представляет собой (6R,7R)-7-[[2(Z)-этоксиимино-[5-(фосфоноамино)-1,2,4-тиадиазол-3-ил] ацетил]амино]-3-[[4-(1-метилпиридиний-4-ил)тиазол-2-ил]сульфанил]-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоксилат моноацетат моногидрат, который также является известным как пиридиний, 4-[2-[[(6R,7R)-2-карбокси-7-[[2(Z)-этоксиимино-[5-(фосфоноамино)-1,2,4-тиадиазол-3-ил]ацетил]амино]-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]тио-4-тиазолил]-1-метил-, внутренняя соль, моноацетат, моногидрат (молекулярная формула C22H21N8O8PS4. C2H4O2. H2O, молекулярный вес 762,75). Наименование препарата по Справочнику национальных непатентованных названий США для этого соединения представляет собой цефтаролин фозамил.
Предложенное международное непатентованное название (WHO Drug Information, том 21, №2, 2007) цефтаролин фозамил относится к следующему соединению: 4-[2-[[(6R,7R)-2-карбокси-7-[[2(Z)-этоксиимино-[5-(фосфоноамино)-1,2,4-тиадиазол-3-ил]ацетил]амино]-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]тио-4-тиазолил]-1-метил-, внутрення соль. INN название цефтаролина фозамила относится к цефтаролину фозамилу, скорректированному на безводную, свободную от ацетата основу (молекулярная формула C22H21N8O8PS4, молекулярный вес 684,68)
При парентеральном введении (таком, как внутривенное, внутримышечное или подкожное введение), пролекарственные средства, такие, как 7β-[2(г)-этоксиимино-2-(5-фосфоноамино-1,2,4-тиадиазол-3 -ил)ацетамидо]-3-[4-(1-метил-4-пиридинио)-2-тиазолитио]-3-цефем-4-карбоксилат и цефтаролин фозамил (USAN и INN), превращаются с помощью жидкостей организма в активный антибактериальный остаток цефтаролина (молекулярная формула C22H22N8O5S4, молекулярный вес 604,71)
Антибактериальные соединения могут вводиться несколькими путями, включая парентеральный, например, с помощью внутривенных (ВВ) болюсов, ВВ инфузии и путем внутримышечной (ВМ) инъекции. Адсорбция лекарственного средства зависит от его биодоступности. Лекарственные средства, которые вводятся внутривенно, непосредственно поступают в системную циркуляцию и типично предполагаются как такие, которые являются на 100% биодоступными. Однако лекарственные средства, которые вводятся внутримышечно, могут проходить через одну или более биологических мембран для того, чтобы достичь системной циркуляции. Является желательным, чтобы все парентеральные дозированные формы обладали одинаковой биодоступностью (то есть, такой же площадью под кривой (AUC)) для всех парентеральных дозированных форм. Однако фармакокинетические профили для ВВ и ВМ композиций могут отличаться, и получение желаемых значений биодоступности (то есть, AUC) после внутримышечного введения является сложным. Например, перфузия (поток крови на 1 грамм ткани) в значительной мере влияет на капиллярную адсорбцию малых молекул при внутримышечном введении. Таким образом, сайт адсорбции может влиять на скорость адсорбции. Кроме того, адсорбция лекарственного средства после ВМ введения может быть отсроченной или неправильной для солей слаборастворимых оснований и кислот. В дополнение к этому, ВМ композиции или дозированная форма должны обладать достаточной растворимостью для того, чтобы обладать способностью к доставке требуемой дозы в малом инъекционном объеме с минимальным местным раздражением. Эти ограничения должны успешно преодолеваться при разработке композиции для ВМ введения. ВМ введение является необходимым в ряде случаев, например, на пунктах первой медицинской помощи и в интернатах для престарелых, где инфузия не является целесообразной.
Кроме того, для лекарственных средств с коротким периодом полураспада введение ВВ болюсов типично приводит к быстрому выведению лекарственного средства из системы пациента. Быстрая ВВ инфузия дозированной формы может быть желательной в некоторых случаях. Однако дозированная форма должна быть стабильной и совместимой с ВВ жидкостью (например, представлять собой 0,9% раствор хлорида натрия или 5% раствор сахара) для осуществления курса лечения. Таким образом, существует также потребность в разработке дозированных форм, обладающих улучшенной растворимостью, для применения при ВВ введении, когда введение больших объемов инфузионного раствора не является желательным, например, при ВВ введении младенцам, детям и пожилым людям.
В соответствии с этим все еще остается потребность в получении новых дозированных форм, содержащих соединения цефема, которые являются стабильными, биодоступными и демонстрируют приемлемые фармакокинетические параметры при введении, например, парентерально.
Заявителями были разработаны дозированные формы, содержащие соединения цефема, такого, как цефтаролин фозамил, обладающие повышенной растворимостью, которая является приемлемой для парентерального, например, ВВ и ВМ введений. Дозированные формы являются стабильными и демонстрируют отличные фармакокинетические параметры при введении, например, внутримышечно или внутривенно.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым дозированным формам соединений цефема, в которых активный агент обладает повышенной растворимостью. Дозированные формы являются особенно приемлемыми для парентерального (например, внутривенного и внутримышечного) введения.
В одном воплощении описываются дозированные формы, содержащие цефтаролин или его фармацевтически приемлемую соль и/или сольват, и/или пролекарственную форму и солюбилизирующий агент, где молярность солюбилизирующего агента в водном растворе дозированной формы является большей чем приблизительно 0,1 М.
В дополнительных воплощениях описываются дозированные формы, содержащие цефтаролин или его фармацевтически приемлемую соль и/или сольват, и/или пролекарственную форму, в которой активный агент обладает растворимостью, большей чем приблизительно 40 мг/мл.
В некоторых воплощениях дозированная форма включает пролекарственную форму цефтаролина, например, цефтаролин фозамил.
В дополнительных воплощениях описываются дозированные формы, содержащие от приблизительно 223 до приблизительно 2005 мг цефтаролина фозамила, где единичная доза парентерального введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 10650 нг час/мл.
В дополнительных воплощениях описываются дозированные формы, содержащие от приблизительно 223 до приблизительно 2005 мг цефтаролина фозамила, где единичная доза ВВ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 10650 нг час/мл, и средним значением Cmax менее чем приблизительно 39500 нг/мл.
В дополнительных воплощениях описываются дозированные формы, содержащие от приблизительно 223 до приблизительно 2005 мг цефтаролина фозамила, где единичная доза ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 10650 нг час/мл, средним значением Cmax менее чем приблизительно 39500 нг/мл, и средним значением Tmax приблизительно 1 или более часов.
Описываются способы лечения при использовании растворимых дозированных форм.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым дозированным формам соединений цефема, которые стабильны, демонстрируют улучшенную растворимость, и являются особенно приемлемыми для, например, парентерального (например, ВВ, ВМ) введения.
Цефтаролин представляет собой активное антибактериальное соединение, полезное для лечения широкого спектра грамположительных и грамотрицательных бактерий. Однако растворимость в воде цефтаролина ограничена (~2-3 мг/мл) и является, таким образом, слишком низкой для того, чтобы позволить непосредственное применение цефтаролина в композициях для парентерального введения. Например, максимальная дозировка цефтаролина, которая может быть введена из объема 100 мл пакета для ВВ инфузии, составляет только приблизительно 200-300 мг.
Цефтаролин фозамил, пролекарственная форма цефтаролина обладает более высокой растворимостью в воде (приблизительно 36 мг/мл). Несмотря на то, что растворимость пролекарственной формы является большей чем для активного остатка цефтаролина, растворимость в воде цефтаролина фозамила все же является недостаточной для того, чтобы позволить цефтаролину фозамилу использоваться непосредственно для ВМ введения, где вводимые объемы типично составляют 5 мл или менее на сайт введения. Например, максимальная дозировка цефтаролина фозамила, которая может вводиться внутримышечно при использовании 5 мл раствора, составляет только приблизительно 180 мг на сайт введения.
Заявители обнаружили, что могут быть получены высокорастворимые дозированные формы, содержащие соединения цефема, такого, как цефтаролин фозамил. Растворимые дозированные формы являются, таким образом, полезными для парентерального (как ВВ, так и ВМ) введения и позволяют вводить более высокие дозы активного ингредиента при использовании меньших объемов раствора. Дозированные формы включают соединение цефема, например, цефтаролин или его фармацевтически приемлемую соль и/или сольват, и/или пролекарственную форму в качестве активного агента и солюбилизирующий агент, где солюбилизирующий агент присутствует при молярности такой, что растворимость активного агента повышается. Например, растворимость активного агента повышается по сравнению с соответствующей дозированной формой, которая не содержит солюбилизирующего агента.
В одном аспекте настоящее изобретение относится к дозированным формам, содержащим цефтаролин или его фармацевтически приемлемую соль, и/или сольват, и/или пролекарственную форму (например, цефтаролин фозамил) и солюбилизирующий агент, где солюбилизирующий агент является присутствующим при молярности, большей чем приблизительно 0,1 М.
В дополнительных воплощениях солюбилизирующий агент является присутствующим при молярности, большей чем приблизительно 0,2 М, большей чем приблизительно 0,3 М, большей чем приблизительно 0,4 М, большей чем приблизительно 0,5 М, большей чем приблизительно 0,6 М, большей чем приблизительно 0,7 М, большей чем приблизительно 0,8 М, большей чем приблизительно 0,9 М, большей чем приблизительно 1,0 М, большей чем приблизительно 1,1 М, большей чем приблизительно 1,2 М, большей чем приблизительно 1,3 М, большей чем приблизительно 1,4 М, большей чем приблизительно 1,5 М, большей чем приблизительно 1,75 М, большей чем приблизительно 2,0 М, большей чем приблизительно 2,3 М или большей чем приблизительно 2,5 М.
В дополнительных воплощениях солюбилизирующий агент является присутсвующим при молярности приблизительно 0,5 М, приблизительно 0,6 М, приблизительно 0,7 М, приблизительно 0,8 М, приблизительно 0,9 М, приблизительно 1,0 М, приблизительно 1,1 М, приблизительно 1,2 М, приблизительно 1,3 М, приблизительно 1,4 М, приблизительно 1,5 М, приблизительно 1,6 М, приблизительно 1,7 М, приблизительно 1,8 М, приблизительно 1,9 М, приблизительно 2,0 М, приблизительно 2,3 М или приблизительно 2,5 М. Например, солюбилизирующий агент является присутствующим при молярности приблизительно 0,5 М, приблизительно 1,0 М, приблизительно 1,5 М, приблизительно 2,0 М или приблизительно 2,3 М.
Приемлемые солюбилизирующие агенты включают, но не ограничены, кислоты, такие, как карбоновые кислоты, аминокислоты. Например, солюбилизирующий агент может быть выбран из насыщенных карбоновых кислот, ненасыщенных карбоновых кислот, жирных кислот, кетокислот, ароматических карбоновых кислот, дикарбоновых кислот, трикарбоновых кислот, α-гидроксикислот, аминокислот и их комбинаций.
Специфические солюбилизирующие агенты, которые могут использоваться, включают, но не ограничены, муравьиную кислоту, уксусную кислоту, пропионовую кислоту, масляную кислоту, валериановую кислоту, капроновую кислоту, энантовую кислоту, каприловую кислоту, пеларгоновую кислоту, каприновую кислоту, лауриновую кислоту, стеариновую кислоту, акриловую кислоту, докозагексаеновую кислоту, эйкозапентаеновую кислоту, пировиноградную кислоту, бензойную кислоту, салициловую кислоту, альдаровую кислоту, щавелевую кислоту, малоновую кислоту, яблочную кислоту, янтарную кислоту, глутаровую кислоту, адипиновую кислоту, лимонную кислоту, молочную кислоту, аланин, аргинин, аспарагин, аспарагиновую кислоту, цистеин, глутамин, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пралин, серин, треонин, триптофан, тирозин, валин и их комбинации (включая их соли и/или индивидуальные стереоизомеры, и/или смеси их стереоизомеров).
В некоторых воплощениях солюбилизирующий агент является выбранным из уксусной кислоты, ее солей и их комбинаций, (например, уксусная кислота/ацетат натрия), лимонной кислоты, ее солей и их комбинаций (например, лимонная кислота/цитрат натрия), DL аргинина, L-аргинина и гистидина. В одном воплощении солюбилизирующий агент представляет собой DL-аргинин. В одном воплощении солюбилизирующий агент представляет собой L-аргинин. В одном воплощении солюбилизирующий агент представляет собой уксусную кислоту/ацетат натрия. В одном воплощении солюбилизирующий агент представляет собой лимонную кислоту/цитрат натрия.
В дополнительных воплощениях растворимость активного агента в дозированной форме является большей чем приблизительно 40 мг/мл, такой, как большей чем приблизительно 50 мг/мл, большей чем приблизительно 75 мг/мл, большей чем приблизительно 100 мг/мл, большей чем приблизительно 125 мг/мл, большей чем приблизительно 150 мг/мл, большей чем приблизительно 175 мг/мл, большей чем приблизительно 200 мг/мл или большей чем приблизительно 250 мг/мл, при измерении, например, в воде при 25°С.
В дополнительных воплощениях растворимость активного агента в дозированной форме составляет от приблизительно 100 до приблизительно 250 мг/мл, от приблизительно 150 до приблизительно 250 мг/мл, от приблизительно 180 до приблизительно 200 мг/мл или от приблизительно 200 до приблизительно 250 мг/мл, при измерении, например, в воде при 25°С.
В некоторых воплощениях дозированная форма включает пролекарственную форму цефтаролина, например цефтаролин фозамил. Примеры приемлемых дозированных форм представлены в Таблицах 1-4.
| Таблица 1: | |||||
| Дозированные формы, содержащие L-аргинин | |||||
| Ингредиент | Интервал (мг) | Предпочтительный интервал (мг) | Пример 1* (мг) | Пример 2** (мг) | Пример 3*** (мг) |
| Цефтаролин фозамилa | 100-2200 | 200-1400 | 668 | 668 | 668 |
| L-аргинин | 26-1350 | 50-800 | 400 | 348 | 174 |
| * 2,3 М L-аргинина; ** 2,0 М L-аргинина; *** 1,0 М L-аргинина а Доза приблизительно 668 мг цефтаролина фозамила (USAN) является эквивалентной дозе приблизительно 530 мг цефтаролина |
| Таблица 2: | |||||
| Дозированные формы, содержащие DL-аргинин | |||||
| Ингредиент | Интервал(мг) | Предпочтительный интервал (мг) | Пример 1* (мг) | Пример 2** (мг) | Пример 3*** (мг) |
| Цефтаролин фозамилa | 100-2200 | 200-1400 | 668 | 668 | 668 |
| DL-аргинин | 26-1350 | 50-800 | 400 | 348 | 174 |
| * 2,3 М DL-аргинина; ** 2,0 М DL-аргинина; *** 1,0 М DL-аргинина а Доза приблизительно 668 мг цефтаролина фозамила (USAN) является эквивалентной дозе приблизительно 530 мг цефтаролина |
| Таблица 3: | ||||
| Дозированные формы, содержащие уксусную кислоту/ацетат натрия | ||||
| Ингредиент | Интервал (мг) | Предпочтительный интервал (мг) | Пример 1* (мг) | Пример 2** (мг) |
| Цефтаролин фозамилa | 100-2200 | 200-1400 | 668 | 668 |
| Уксусная кислота/ацетат натрия | 10-550 | 24-300 | 164 | 82 |
| * 2,0 М уксусная кислота/ацетат; ** 1,0 М уксусная кислота/ацетат а Доза приблизительно 668 мг цефтаролина фозамила (USAN) является эквивалентной дозе приблизительно 530 мг цефтаролина |
| Таблица 4: | ||||
| Дозированные формы, содержащие лимонную кислоту/цитрат натрия | ||||
| Ингредиент | Интервал (мг) | Предпочтительный интервал (мг) | Пример 1* (мг) | Пример 2** (мг) |
| Цефтаролин фозамилa | 100-2200 | 200-1400 | 668 | 668 |
| Лимонная кислота/цитрат натрия | 40-550 | 80-1200 | 588 | 294 |
| * 2,0 М лимонная кислота/цитрат; ** 1,0 М лимонная кислота/цитрат а Доза приблизительно 668 мг цефтаролина фозамила (USAN) является эквивалентной дозе приблизительно 530 мг цефтаролина |
Дозированные формы могут быть получены, например, путем смешивания пролекарственной формы активного агента (например, цефтаролина фозамила) и солюбилизирующего агента (например, DL аргинина, L-аргинина, лимонной кислоты/цитрата натрия, уксусной кислоты/ацетата натрия) в устройстве для смешивания в условиях стерильности до получения однородной смеси. Предварительно простерилизованные флаконы могут потом заполняться приемлемым количеством стерильной смеси. Предварительно определенное количество стерильной смеси может потом смешиваться с растворителем, например, водой, физиологическим раствором, сахарным раствором в концентрации приблизительно 5-10% (например, раствором глюкозы, декстрозы) и их комбинацией перед введением. В дополнение к этому, раствор может замораживаться и оттаиваться перед дополнительной обработкой.
Солюбилизирующий агент может использоваться в твердой форме или в форме раствора. Если используется твердая форма, то солюбилизирующий агент и пролекарственная форма активного ингредиента (например, цефтаролин фозамил) могут смешиваться вместе так, как описано выше, после чего растворитель прибавляется перед парентеральным введением. Если используется форма раствора, то пролекарственная форма активного ингредиента (например, цефтаролин фозамил) может смешиваться с раствором солюбилизирующего агента перед осуществлением парентерального введения.
В дополнительных воплощениях дозированная форма включает от приблизительно 177 до приблизительно 2005 мг цефтаролина или его фармацевтически приемлемой соли, и/или сольвата, и/или пролекарственной формы, например, от приблизительно 177 мг до приблизительно 1337 мг цефтаролина или его фармацевтически приемлемой соли, и/или сольвата, и/или пролекарственной формы, например, от приблизительно 353 до приблизительно 891 мг цефтаролина или его фармацевтически приемлемой соли, и/или сольвата, и/или пролекарственной формы, для дополнительного примера, от приблизительно 353 мг до приблизительно 668 мг цефтаролина или его фармацевтически приемлемой соли, и/или сольвата, и/или пролекарственной формы.
В дополнительных воплощениях дозированная форма включает от приблизительно 223 до приблизительно 2005 мг цефтаролина фозамила, например, от приблизительно 223 мг до приблизительно 1337 мг цефтаролина фозамила, например, от приблизительно 446 до приблизительно 891 мг цефтаролина фозамила, для дополнительного примера, от приблизительно 446 мг до приблизительно 668 мг цефтаролина фозамила. Например, цефтаролина фозамила (USAN) (молекулярная формула С22H21N8O8PaS4. C2H4O2. H2O, молекулярный вес 762,75).
В одном воплощении дозированная форма содержит приблизительно 223 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 446 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 557 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 668 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 891 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 1114 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 1337 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 2005 мг цефтаролина фозамила. Например, цефтаролина фозамила (USAN) (молекулярная формула C22H21N8O8PS4. C2H4O2. H2O, молекулярный вес 762,75).
В одном воплощении дозированная форма содержит приблизительно 200 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 400 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 500 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 600 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 800 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 1000 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 1200 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 1800 мг цефтаролина фозамила. Например, цефтаролина фозамила (INN) (в пересчете на безводную, свободную от ацетата основу, молекулярная формула C22H21N8O8PS4, молекулярный вес 684,68).
В дополнительных воплощениях дозированная форма включает от приблизительно 177 до приблизительно 1589 мг цефтаролина, например, от приблизительно 177 мг до приблизительно 1060 мг цефтаролина, например, от приблизительно 353 до приблизительно 706 мг цефтаролина, для дополнительного примера, от приблизительно 353 мг до приблизительно 618 мг цефтаролина, для дополнительного примера, от приблизительно 353 мг до приблизительно 530 мг цефтаролина. В дополнительных воплощениях дозированная форма содержит приблизительно 177 мг цефтаролина, приблизительно 353 мг цефтаролина, приблизительно 442 мг цефтаролина, приблизительно 530 мг цефтаролина, приблизительно 618 мг цефтаролина, приблизительно 706 мг цефтаролина, приблизительно 883 мг цефтаролина, приблизительно 1060 мг цефтаролина или приблизительно 1589 мг цефтаролина. Например, цефтаролина, молекулярная формула C22H22N8O5S4, молекулярный вес 604,71.
В одном воплощении дозированная форма содержит приблизительно 668 мг цефтаролина фозамила (USAN). В одном воплощении дозированная форма содержит приблизительно 600 мг цефтаролина фозамила (INN).
В одном воплощении дозированная форма содержит приблизительно 446 мг цефтаролина фозамила (USAN). В одном воплощении дозированная форма содержит приблизительно 400 мг цефтаролина фозамила (INN).
В одном воплощении дозированная форма содержит приблизительно 530 мг цефтаролина.
В дополнительных воплощениях дозированная форма содержит приблизительно 353 мг цефтаролина.
В клиническом исследовании противоинфекционных лекарственных средств выбор дозы, режим дозирования, длительность терапии будут принимать во внимание биофармацевтические, фармакокинетические и фармакодинамические свойства противоинфекционного лекарственного средства/лекарственного продукта. Смотри, например, "Developing Antimicrobial Drugs - General Considerations for Clinical Trials," U.S. Department of Health и Human Services, Food и Drug Administration, Draft Guidance for Industry, July 1998.
Фармакодинамика может устанавливать связь между дозой противоинфекционного лекарственного средства и его противомикробной активностью. Сочетанная фармакокинетическая/фармакодинамическая (PK/PD) оценка включает соотнесение концентраций лекарственного средства в плазме крови с in-vitro чувствительностью микроорганизмов-мишеней и/или клиническими исходами. Обычно концентрации лекарственного средства в плазме крови являются связанными с минимальной ингибиторной концентрацией (MIC). Кроме того, профиль концентрация лекарственного средства-время может быть преобразован для получения единого измерения воздействия (например, площадь под кривой (AUC) или время выше минимальной ингибиторной концентрации (T>MIC)) и связываться с микробиологическим и/или клиническим выходом для определения оптимального режима дозирования. Выбор фармакодинамической переменной (например, AUC/MIC, пик концентрации в плазме крови (Cmax)/MIC, T>MIC) зависит от механизмов антимикробного эффекта.
AUC представляет собой меру общего воздействия антибиотического лекарственного средства на систему циркуляции в течение периода времени. Концентрация антибиотического средства в сыворотке и период времени, в течение которого концентрация антибиотического средства является выше MIC, считаются фармакокинетическими свойствами противомикробного средства. Продукт этих двух факторов представляется площадью под кривой концентрация в сыворотке крови-время (AUC). Таким образом, уничтожение бактерий представляет собой функцию AUC.
Для разработки антимикробного лекарственного средства дозированные формы, приемлемые для парентерального (например, ВМ) введения, должны иметь значения AUC, наблюдаемые после ВМ введения дозированной формы, подобные значениям AUC, которые наблюдаются для лекарственного средства, когда дозированная форма вводится внутривенно. Кроме того, должен быть соблюден приемлемый MIC критерий, для того, чтобы ВМ введение лекарственного средства было эффективным.
При парентеральном введении дозированные формы, описанные в данной заявке, обеспечивают следующие фармакокинетические параметры.
При внутримышечном введении наблюдается время максимальной концентрации в плазме крови (Tmax) для цефтаролина (активный остаток) у пациентов, представляющих собой людей, приблизительно 1 или более часов (например, приблизительно 1,5 или более часов). В дополнительных воплощениях наблюдают значение Tmax цефтаролина (активный остаток) у пациентов, представляющих собой людей, которое колеблется от приблизительно 1 до приблизительно 4 часов, например, от приблизительно 1 до приблизительно 3 часов, например, от приблизительно 1,5 до приблизительно 2 часов. В других воплощениях наблюдается значение Tmax для цефтаролина фозамила (пролекарственное средство) у пациентов, представляющих собой людей, приблизительно 0,05 или более часов. Время максимальной концентрации в плазме крови измеряется после окончания инфузии.
(a) В одном аспекте настоящее изобретение относится к дозированной форме, содержащей от приблизительно 223 мг до приблизительно 2005 мг цефтаролина фозамила (USAN), где единичная доза для парентерального введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 10650 нг час/мл.
(b) В одном воплощении дозированная форма включает от приблизительно 223 мг до приблизительно 2005 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением Cmax менее чем приблизительно 39500 нг/мл.
(c) В другом воплощении дозированная форма включает от приблизительно 223 мг до приблизительно 2005 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 10650 нг час/мл, и средним значением Cmax менее чем приблизительно 39500 нг/мл.
(d) В дополнительном воплощении дозированная форма включает от приблизительно 223 мг до приблизительно 2005 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 10650 нг час/мл, средним значением Cmax менее чем приблизительно 39500 нг/мл, и средним значением Tmax приблизительно 1 или более часов.
(e) В другом аспекте настоящее изобретение относится к дозированной форме, содержащей приблизительно 223 мг цефтаролина фозамила (USAN), где единичная доза для парентерального введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 10650 нг час/мл.
(f) В одном воплощении дозированная форма включает приблизительно 223 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением Cmax менее чем приблизительно 4900 нг/мл.
(g) В другом воплощении дозированная форма включает приблизительно 223 мг цефтаролина фозамила (USAN), где единичная доза длят ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 10650 нг час/мл, и средним значением Cmax менее чем приблизительно 4900 нг/мл.
(h) В дополнительном воплощении дозированная форма включает приблизительно 223 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 10650 нг час/мл, средним значением Cmax менее чем приблизительно 4900 нг/мл, и средним значением Тmax приблизительно 1 или более часов.
(i) В другом аспекте настоящее изобретение относится к дозированной форме, содержащей приблизительно 446 мг цефтаролина фозамила (USAN), где единичная доза для парентерального введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 21350 нг час/мл.
(j) В одном воплощении дозированная форма включает приблизительно 446 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением Cmax менее чем приблизительно 9800 нг/мл.
(k) В другом воплощении дозированная форма включает приблизительно 446 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 21350 нг час/мл, средним значением Cmax менее чем приблизительно 9800 нг/мл.
(l) В дополнительном воплощении дозированная форма включает приблизительно 446 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 21350 нг час/мл, средним значением Cmax менее чем приблизительно 9800 нг/мл, и средним значением Tmax приблизительно 1 или более часов.
(m) В другом аспекте настоящее изобретение относится к дозированной форме, содержащей приблизительно 557 мг цефтаролина фозамила (USAN), где единичная доза для парентерального введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 25800 нг час/мл.
(n) В одном воплощении дозированная форма включает приблизительно 557 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением Cmax менее чем приблизительно 11100 нг/мл.
(o) В другом воплощении дозированная форма включает приблизительно 557 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 25800 нг час/мл, и средним значением Cmax менее чем приблизительно 11100 нг/мл.
(p) В дополнительном воплощении дозированная форма включает приблизительно 557 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 25800 нг час/мл, средним значением Cmax менее чем приблизительно 11100 нг/мл, и средним значением Tmax приблизительно 1 или более часов.
(q) В другом аспекте настоящее изобретение относится к дозированной форме, содержащей приблизительно 668 мг цефтаролина фозамила (USAN), где единичная доза для парентерального введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 28800 нг час/мл.
(r) В одном воплощении дозированная форма включает приблизительно 668 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением Cmax менее чем приблизительно 12000 нг/мл.
(s) В другом воплощении дозированная форма включает приблизительно 668 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 28800 нг час/мл, и средним значением Cmax менее чем приблизительно 12000 нг/мл.
(t) В дополнительном воплощении дозированная форма включает приблизительно 668 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 28800 нг час/мл, средним значением Cmax менее чем приблизительно 12000 нг/мл, и средним значением Tmax приблизительно 1 или более часов.
(u) В другом аспекте настоящее изобретение относится к дозированной форме, содержащей приблизительно 891 мг цефтаролина фозамила (USAN), где единичная доза для парентерального введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 49000 нг час/мл.
(v) В одном воплощении дозированная форма включает приблизительно 891 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением Cmax менее чем приблизительно 17750 нг/мл.
(w) В другом воплощении дозированная форма включает приблизительно 891 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AU