Терапия опухолей с использованием антитела к сосудистому эндотелиальному фактору роста и антитела к рецептуру типа 2 человеческого эпителиального фактора роста
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается применения антитела к HER2 и/или антитела к VEGF для приготовления лекарственного средства, предназначенного для снижения метастазов при лечении рака молочной железы, характеризующегося сверхэкспрессией протеина рецептора HER2, у пациента, невосприимчивого к предшествующей терапии с использованием антитела к VEGF, при котором лечение включает введение пациенту терапевтически эффективного количества антитела к HER2 и антитела к VEGF, причем антитело к VEGF представляет собой бевацизумаб, а антитело к HER2 представляет собой трастузумаб. Также группа изобретений касается применения антитела к HER2 для снижения метастазов в способе лечения рака молочной железы и применения антитела к VEGF для снижения метастазов в способе лечения рака молочной железы. Комбинирование бевацизумаба и трастузумаба позволяет достичь предупреждения образования метастазов. 3 н. и 9 з.п. ф-лы, 1 пр., 2 ил., 4 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к совместной терапии с использованием антител к HER2 и к VEGF. В частности, изобретение относится к применению указанных антител для лечения рака молочной железы у пациента, невосприимчивого к предшествующей терапии с использованием антитела к VEGF.
Предпосылки создания изобретения
Ангиогенез принимает участие в патогенезе различных нарушений, включая плотные опухоли, синдромы внутриглазной неоваскуляризации, такие как пролиферативные ретинопатии или связанная с возрастом дегенерация желтого пятна (AMD), ревматоидный артрит и псориаз (Folkman J. и др., J.Biol.Chem. 267, 1992, cc.10931-10934; Klagsbrun M. и др., Annu. Rev.Physiol. 53, 1991, cc.217-239; и Garner A., Vascular diseases, в: Pathobiology of ocular disease, A dynamic approach, под ред. Garner А. и Klintworth G.К., 2-ое изд., изд-во Marcel Dekker, New York, 1994, cc. 1625-1710). В случае плотных опухолей неоваскуляризация приводит к тому, что опухолевые клетки приобретают преимущество с позиций роста и автономии пролиферации по сравнению со здоровыми клетками. Так, обнаружена корреляция между плотностью микрососудов в срезах опухоли и выживанием пациента, страдающего раком молочной железы, а также в случае некоторых других опухолей (Weidner N. и др., N.Engl. J.Med. 324, 1991, cc.1-6; Horak E.R. и др., Lancet 340, 1992, cc.1120-1124 и Macchiarini Р. и др.. Lancet 340, 1992. cc.145-146).
Сосудистый эндотелиальный фактор роста (VEGF) участвует в регуляции нормального и аномального ангиогенеза и неоваскуляризации, ассоциированной с опухолями и внутриглазными нарушениями (Ferrara N. и др., Endocr. Rev. 18, 1997, cc.4-25; Berkman R.A. и др., J.Clin. Invest. 91, 1993, cc.153-159; Brown L.F. и др., Human Pathol. 26, 1995, cc.86-91; Brown L.F. и др., Cancer Res. 53, 1993, cc.4727-4735; Mattern J. и др., Brit. J. Cancer 73, 1996, cc.931-934; и Dvorak H.F. и др., Am.J.Pathol. 146, 1995; cc.1029-1039). Нейтрализующие антитела к VEGF подавляют рост различных человеческих линий опухолевых клеток в мышах (Kim К.J. и др., Nature 362, 1993, cc.841-844; Warren R.S. и др., J.Clin. Invest. 95, 1995, cc.1789-1797; Borgstrom P. и др., Cancer Res. 56, 1996, cc.4032-4039; и Melnyk О. и др., Cancer Res. 56, 1996. cc.921-924). В WO 94/10202, WO 98/45332, WO 2005/00900 и WO 00/35956 описаны антитела к VEGF. Гуманизированное моноклональное антитело бевацизумаб (поступает в продажу под товарным знаком Avastin®) представляет собой антитело к VEGF, которое применяют для терапии опухолей и которое является единственным антиангиогенным лекарственным средством, разрешенным для лечения рака (WO 98/45331).
HER2 является представителем семейства рецепторов человеческого эпидермального фактора роста и обладает тирозинкиназной активностью в цитоплазматическом домене. В опухолевых клетках происходит сверхэкспрессия HER2 и это коррелирует с неблагоприятным прогнозом и малым временем выживания. Таким образом, HER2 представляет собой важную мишень при лечении рака молочной железы. Антитела к HER2 описаны у Takai N. и др., Cancer 104, 2005, cc.2701-2708; Yeon С.Н. и др., Invest. New Drugs 23, 2005, cc.391-409; Wong W.М. и др., Cancer Pract. 7, 1999, cc.48-50; Albanell J. и др., Drugs Today (Barc). 35, 1999, cc.931-46.
Трастузумаб (поступает в продажу под товарным знаком Herceptin®) представляет собой рекомбинантное гуманизированное моноклональное антитело к HER2, которое применяют для лечения метастатического рака молочной железы, характеризующего сверхэкспрессий НЕК2/амплификацией гена HER2. Доклинические исследования продемонстрировали, что антитело обладает противоопухолевой активностью in vivo и in vitro. Кроме того, на мышиных моделях обнаружена аддитивная или повышенная в результате синергизма противоопухолевая активность трастузумаба при его применении в сочетании с различными противоопухолевыми агентами. В клинических исследованиях у пациентов, страдающих раком молочной железы, который характеризуется сверхэкспрессией HER2, выявлено более продолжительное выживание.
Согласно WO 98/45331 эффективность антитела к VEGF в отношении предупреждения или лечения заболевания можно повышать путем введения антитела периодически или в сочетании с другим агентом, который обладает эффективностью в отношении таких состояний, например, с антителом, которое обладает способностью связываться с рецептором HER2. В WO 2005/012531 описаны антитела, которые можно объединять с антителом к VEGF (например, Avastin®) и/или антителами к ErbB (например, Herceptin®), для лечения колоректального рака, метастатического рака молочной железы и рака почки. Согласно WO 2005/063816 антитела к VEGF можно объединять с антителами к ErbB для лечения метастатического рака молочной железы. В WO 2005/00090 и WO 2003/077841 описана также комбинация антител к VEGF и антител к ErbB2 для лечения опухолей.
Практикующие онкологи сходятся во мнении, что отсутствие успеха в лечении рака не обязательно связано с ростом первичной опухоли, с которой, как правило, можно бороться с помощью хирургического вмешательства, а скорее с метастатическим распространением в другие органы. Регресс первичных опухолей, достигаемый с помощью различных цитотоксических лекарственных средств, не всегда является показателем антиметастатической активности per se. Наоборот, обнаружен повышенный уровень метастазирования в ответ на применение некоторых противораковых лекарственных средств (GeldofA. А. и др., Anticancer Res. 8, 1988, cc. 1335-1339; Murphy S. В., J.Clin. Oncol. 11, 1993, cc.199-201; и De Larco J.E. и др., Cancer Res. 61, 2001, cc.2857-2861). Очевидно, что существует потребность в разработке лекарственных терапий, мишенью которых является не только первичная опухоль, но которые обладают также способностью подавлять метастазы.
Краткое изложение сущности изобретения
Настоящее изобретение относится к применению антитела к HER2 и антитела к VEGF для приготовления лекарственного средства, предназначенного для лечения рака молочной железы у пациента, невосприимчивого к предшествующей терапии с использованием антитела к VEGF, которое предусматривает введение пациенту в терапевтически эффективном количестве антитела к HER2 и антитела к VEGF.
Предпочтительным вариантом осуществления изобретения является применение трастузумаба и бевацизумаба для приготовления лекарственного средства, предназначенного для лечения рака молочной железы, который характеризуется сверхэкспрессией белка рецептора HER2 у пациента, невосприимчивого к предшествующей терапии с использованием антитела к VEGF, такого как бевацизумаб, которое предусматривает введение пациенту в терапевтически эффективном количестве трастузумаба и бевацизумаба.
Изобретение относится также к способу лечения рака молочной железы у пациента, невосприимчивого к предшествующей терапии с использованием антитела к VEGF, заключающемуся в том, что пациенту вводят в терапевтически эффективном количестве антитело к HER2, продолжая при этом лечение с использованием антитела к VEGF.
Изобретение относится также к способу лечения рака молочной железы, который характеризуется сверхэкспрессией белка рецептора HER2, у пациента, невосприимчивого к предшествующей терапии с использованием антитела к VEGF, заключающемуся в том, что пациенту вводят в терапевтически эффективном количестве трастузумаб, продолжая при этом лечение с использованием бевацизумаба.
Изобретение относится также к способу удлинения продолжительности жизни страдающего раком молочной железы пациента, невосприимчивого к предшествующей терапии с использованием антитела к VEGF, который заключается в том, что пациенту вводят в эффективных количествах антитело к VEGF и антитело к HER2, при этом совместное введение антитела к VEGF и антитела к HER2 эффективно повышает продолжительность жизни.
Изобретение относится также к способу удлинения продолжительности жизни до прогрессирования заболевания у страдающего раком молочной железы пациента, невосприимчивого к предшествующей терапии с использованием антитела к VEGF, который заключается в том, что пациенту вводят в эффективных количествах антитело к VEGF и антитело к HER2, при этом совместное введение антитела к VEGF и антитела к HER2 эффективно повышает продолжительность жизни до прогрессирования заболевания.
Изобретение относится также к способу лечения группы пациентов, страдающих раком молочной железы и невосприимчивых к предшествующей терапии с использованием антитела к VEGF, который заключается в том, что пациентам вводят в эффективных количествах антитело к VEGF и антитело к HER2, при этом совместное введение антитела к VEGF и антитела к HER2 эффективно повышает уровень ответа (уровень чувствительности) группы пациентов.
Изобретение относится также к способу повышения продолжительности ответа у страдающего раком молочной железы пациента, невосприимчивого к предшествующей терапии с использованием антитела к VEGF, который заключается в том, что пациенту вводят в эффективных количествах антитело к VEGF и антитело к HER2, при этом совместное введение антитела к VEGF и антитела к HER2 эффективно повышает продолжительность ответа.
Изобретение относится также к способу лечения страдающего раком молочной железы пациента, невосприимчивого к предшествующей терапии с использованием антитела к VEGF, который заключается в том, что пациенту вводят в эффективных количествах антитело к VEGF и антитело к HER2, при этом совместное введение антитела к VEGF и антитела к HER2 приводит к статистически достоверному и клинически значимому улучшению состояния подвергнутого лечению пациента с позиций продолжительности жизни, продолжительности жизни до прогрессирования заболевания, уровня ответа или продолжительности ответа.
Настоящее изобретение относится также к способу уменьшения метастазов у страдающего раком молочной железы пациента, невосприимчивого к предшествующей терапии с использованием антитела к VEGF, который заключается в том, что пациенту вводят в эффективных количествах антитело к VEGF и антитело к HER2, при этом совместное введение антитела к VEGF и антитела к HER2 эффективно уменьшает метастазы.
Изобретение относится также к способу лечения группы пациентов, страдающих раком молочной железы и невосприимчивых к предшествующей терапии с использованием антитела к VEGF, который заключается в том, что пациентам вводят в эффективных количествах антитело к VEGF и антитело к HER2, при этом совместное введение антитела к VEGF и антитела к HER2 эффективно уменьшает метастазы у группы пациентов.
Изобретение относится к изделию, представляющему собой контейнер, в который входит композиция, содержащая антитело к VEGF, и листовка-вкладыш в упаковке с инструкцией по применению композиции для введения страдающему раком молочной железы пациенту, невосприимчивому к предшествующей терапии с использованием антитела к VEGF, антитела к VEGF и антитела к HER2.
Изобретение относится к изделию, представляющему собой контейнер, в который входит композиция, содержащая антитело к HER2, и листовка-вкладыш в упаковке с инструкцией по применению композиции для введения страдающему раком молочной железы пациенту, невосприимчивому к предшествующей терапии с использованием антитела к VEGF, антитела к HER2 и антитела к VEGF.
Изобретение относится также к композиции, содержащей антитело к HER2 и антитело к VEGF, которую можно применять для лечения рака молочной железы у пациента, невосприимчивого к предшествующей терапии с использованием антитела к VEGF. Предпочтительно антитело к HER2 представляет собой трастузумаб. Предпочтительно также антитело к VEGF представляет собой бевацизумаб.
Краткое описание чертежей
На чертежах показано:
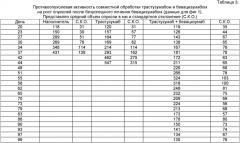
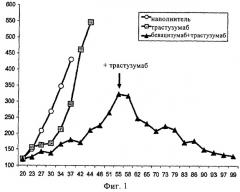
на фиг.1 - противоопухолевая активность совместной обработки трастузумабом и бевацизумабом в отношении роста опухоли после того как лечение бевацизумабом не дало результата. На оси у представлены средние значения объема опухолей (мм3); на оси х представлено количество дней после инъекции опухолевых клеток. Представлены данные, полученные при обработке наполнителем (окружности), трастузумабом в ударной дозе 30 мг/кг и поддерживающей дозе 15 мг/кг (квадраты), бевацизумабом в дозе 5 мг/кг до 55-го дня, когда в схему лечения был включен также трастузумаб в дозе 15 мг/кг (треугольники);
на фиг.2 - эффективность совместной обработки трастузумабом и бевацизумабом в отношении метастазов легкого. Средние значения уровня человеческой последовательности ДНК Alu (нг/мл) количественно оценены в ткани легкого с помощью ПЦР в реальном времени и представлены на оси у.
Подробное описание изобретения
Понятие «VEGF» в контексте изобретения относится к фактору роста сосудистых эндотелиальных клеток (Swiss-Prot №Р 15692), полученным в результате альтернативного сплайсинга формам (см., например, Leung D. W. и др., Science, 246, 1989, cc. 1306-1309; и Houck К. А. и др., Mol. Endocrin. 5, 1991, cc. 1806-1814) и активным фрагментам, предпочтительно N-концевым фрагментам.
Понятие «антитело к VEGF» в контексте настоящего изобретения относится к антителу, которое специфически связывается с VEGF. Связывание предпочтительного гуманизированного антитела к VEGF или варианта антитела к VEGF, предлагаемого в изобретении, с человеческим VEGF характеризуется значением Kd, составляющим не более чем примерно 1×10-8M и предпочтительно не более чем примерно 5×10-9 М. Предпочтительно антитело к VEGF представляет собой моноклональное антитело, которое связывается с тем же эпитопом, что и рекомбинантное гуманизированное моноклональное антитело к VEGF, созданное согласно методу, описанному у Presta L.G. и др., Cancer Res. 57, 1997, cc.4593-4599. Предпочтительным антителом является бевацизумаб. Антитела к VEGF и методы их получения описаны, например, в US 6054297, US 2003/0190317, US 6632926, US 6884879 и US 2005/0112126.
Бевацизумаб содержит мутантные каркасные участки человеческого IgG1 и антигенсвязывающие гипервариабельные участки мышиного моноклонального антитела к hVEGF, которое блокирует связывание челрвеческого VEGF с его рецепторами. Примерно 93% аминокислотной последовательности бевацизумаба, включающей большую часть каркасных участков, выведено из человеческого IgG1, а примерно 7% последовательности выведено из мышиного антитела А4.6.1. Бевацизумаб имеет молекулярную массу примерно 149000 Да и является гликозилированным. Бевацизумаб и метод его получения описаны в ЕР 1325932.
HER2 представляет собой имеющий молекулярную массу 185 кДа рецептор фактора роста, который обозначают так же как neu и c-erbB-2 (Slamon D.J. и др., Science 235, 1987, cc.177-182; Swiss-Prot P04626), функция которого связана с неопластической трансформацией клеток рака молочной железы человека. Сверхэкспрессия этого белка обнаружена у 20-30% пациентов, страдающих раком молочной железы, что коррелирует с региональным прогрессированием заболевания, повышенной вероятностью рецидива опухоли и уменьшенной продолжительностью жизни пациентов. У 30-40% пациентов, страдающих раком желудка, эндометрия, слюнных желез, немелкоклеточным раком легкого, раком поджелудочной железы, яичника, перитонеальным раком, раком предстательной железы или колоректальным раком, также может иметь место сверхэкспрессия этого белка. Антитела к HER2 и методы их получения описаны, например, в US 6054297, WO 89/06692, US 6953842, US 6949245, US 6399063, US 6165464, US 6054297, US 5772997, WO 2003/087131, WO 01/00245, WO 01/00238, WO 00/69460, WO 00/52054, WO 99/31140 и WO 98/17797. В предпочтительном варианте осуществления изобретения антитело к HER2 представляет собой трастузумаб. Трастузумаб и методы его получения описаны в ЕР 0590058.
Подразумевается, что понятие «сверхэкспрессия» белка рецептора HER2 относится к аномальному уровню экспрессии белка рецептора HER2 в клетке, полученной из опухоли конкретной ткани или органа пациента, относительно уровня экспрессии в здоровой клетке из этой ткани или органа. Пациентов, которые страдают раком, характеризующимся сверхэкспрессией рецептора HER2, можно выявлять с помощью стандартных анализов, известных в данной области. Предпочтительно сверхэкспрессию оценивают в фиксированных клетках замороженных или погруженных в парафин срезах ткани с помощью иммуногистохимического (ИГХ) обнаружения. С помощью гистологического окрашивания можно выявлять локализацию целевого белка и можно оценивать уровень его экспрессии в опухоли как качественно, так и полуколичественно. Такие ИГХ-анализы известны в данной области и включают анализ в клиническом исследовании (Clinical Trial Assay (СТА)), поступающий в продажу тест фирмы LabCorp 4D5 и поступающий в продажу тест фирмы DAKO HercepTest® (DAKO, Карпинтерия, шт. Калифорния). Последний анализ основан на оценке степени специфического окрашивания клеток, характеризующегося баллами от 0 до 3+ (0 означает нормальный уровень экспрессии, 3+ обозначает наиболее высокую положительную экспрессию), для идентификации рака, характеризующегося сверхэкспрессией белка HER2 (см. полную предоставленную информацию о Herceptin® (трастузумаб), сентябрь 1998 г., фирма Genentech Inc., Сан-Франциско, шт. Калифорния). Так, для пациентов, рак которых характеризуется сверхэкспрессией белка HER2 на уровне 1+, 2+ или 3+, предпочтительно 2+ или 3+, более предпочтительно 3+, должно оказывать благоприятное воздействие применение способов лечения, предлагаемых в настоящем изобретении.
Понятие «болезнь, представляющая собой рак молочной железы» («рак молочной железы»), относится к неконтролируемому росту аномальных клеток молочной железы. Оно включает относящуюся к протоку карциному in situ, инвазивную относящуюся к протоку карциному in situ, карциному долек in situ, инвазивную карциному долек, медуллярную карциному, болезнь Педжета (рак соска) и метастатический рак молочной железы.
Понятие «невосприимчивость к предшествующей терапии с использованием антитела к VEGF» или «невосприимчивость к лечению» в контексте настоящего описания относится к страдающим раком пациентам, у которых отсутствует реакция на предшествующую терапию с использованием антитела к VEGF («нереспонденты») или которые первоначально реагируют на предшествующую терапию, но у которых терапевтический ответ не сохраняется (обозначены как «пациенты на стадии рецидива»). Предпочтительно понятие «невосприимчивость к предшествующей терапии с использованием антитела к VEGF» относится к пациентам на стадии рецидива. Отсутствие успеха лечения (соответственно ответ (RE) и отсутствие ответа (NR)) оценивают на основе медицинского заключения лечащего врача по результатам клинических и лабораторных исследований, которые, как правило, применяют в данной области для оценки воздействия лечения на пациента. Такие данные можно получать, например, на основе клинического обследования, цитологических и гистологических методов, эндоскопии и лапароскопии, ультразвукового обследования, КТ (компьютерная томография), ПЭТ (позитронная эмиссионная томография) и ЯМР-томографии, рентгеноскопии грудной клетки и маммографии, и на основе оценки концентрации опухолевых маркеров, таких как КЭА (карциноэмбриональный антиген), Cyfra, CA15-3, интерлейкин 8 и растворимый HER2. В этом контексте понятие «невосприимчивость к лечению» относится к отсутствию клинического улучшения. Альтернативно этому можно использовать критерии RECIST (критерии оценки ответа плотных опухолей) для определения ответа опухоли (Therasse P. и др., J. Nat. Cancer Institute 92, 2000, cc.205-216). В этом контексте понятие «невосприимчивость к лечению» относится либо к «неполному ответу/стабильному заболеванию» или к «прогрессирующему заболеванию».
Согласно этим RECIST-критериям ответ плотных опухолей (Therasse P. и др., J.Nat. Cancer Institute 92, 2000, cc.205-216) классифицируют в зависимости от увеличения объема или регресса опухолей (например, по данным КТ) по 4 уровням: полный ответ (CR) или частичный ответ (PR), стабильное состояние болезни (SD) и прогрессирующее состояние болезни (PD) (см. таблицу 1). Кроме того, Европейской организацией по исследованию и лечению рака (European Organization for Research and Treatment of Cancer (EORTC)) предложена классификация по 4 приведенным ниже уровням в зависимости от метаболизма опухолей, что оценивают с помощью позитронной эмиссионной томографии с использованием 2-[l8F]-фтор-2-дезоксиглюкозы (ФДГ-ПЭТ) (Young Н. и др., Eur. J.Cancer 35, 1999, cc.1773-1782 и KellofG. J. и др., Clin. Cancer Res. 11, 2005, cc.2785- 2808): полный метаболический ответ (CMR) или частичный метаболический ответ (PMR), стабильное метаболическое состояние болезни (SMD) и прогрессирующее метаболическое состояние болезни (PMD) (см. таблицу 2).
| Таблица 1:КТ-критерии (по RECIST) | Таблица 2:Предложенные ФДГ-ПЭТ-критерии (по EORTC, см. Young H. и др., Eur J Canc 35, 1999, cc.1773-1782) | |||
| КТ-оценка: Изменение в сумме наиболее длинных диаметров | RECIST | ПЭТ-оценка | Предложенные ФДГ-ПЭТ-критерии | |
| Исчезновение; подтверждено на 4 неделе (после начала лечения) | CR | Полное отсутствие поглощения опухолью 2-[18F]-фтор-2-дезоксиглюкозы (ФДГ) | CMR | |
| Снижение на 30%; подтверждено на 4 неделе | PR | Снижение минимум на 15-25% стандартизованного объема поглощения (SUV) после одного цикла лечения и >25% после более одного цикла лечения | PMR | |
| Не выполняются ни PR-, ни PD-критерии | SD | Повышение стандартизованного объема поглощения (SUV) <25% или снижение SUV<15%. Отсутствие заметного повышения уровня поглощения ФДГ опухолью | SMD | |
| Повышение на 20%, не зафиксированы ни CR, PR, SD перед усилением болезни | PD | Повышение SUV>25% Заметное повышение поглощения опухолью ФДГ (>20% наиболее длинного размера). Появление новых областей поглощения ФДГ в метастатических повреждениях | PMD |
Таким образом, предпочтительно «Ответ (RE)» и «Отсутствие ответа (NR)» согласно настоящему изобретению определяют на основе данных, полученных путем комбинации компьютерной томографии (КТ) и позитронной эмиссионной томографии с использованием 2-[18F]-фтор-2-дезоксиглюкозы (ФДГ-ПЭТ) (KellofG. J. и др., Clin, Cancer Res. 11, 2005, cc.2785-2808 и Young H. и др., Eur. J.Canc. 35, 1999, cc.1773-1782), с использованием описанных выше и RECIST-, и ФДГ-ПЭТ-критериев. Таким образом, наличие Ответа (RE) и Отсутствие ответа (NR) согласно настоящему изобретению определяют предпочтительно следующим образом:
Ответ (RE): CR или PR определяют с помощью KT-RECIST-критерия (таблица 1) и одновременно определяют CMR или PMR посредством ФДГ-ПЭТ (таблица 2). Таким образом. Ответ (RE) означает соответствие одному из четырех вариантов объединенной КТ- или ПЭТ-оценки: CR и CMR, PR и PMR, CR и PMR, и PR и CMR.
Отсутствие ответа (NR): SD или PD определяют на основе KT-RECIST-критерия (таблица 1) и одновременно определяют SMD или PMD с помощью ФДГ-ПЭТ (таблица 2). Таким образом. Отсутствие ответа (NR) означает соответствие одному из четырех вариантов объединенной КТ- или ПЭТ- оценки: SD и SMD, SD и PMD, PD и SMD, и PD и PMD.
Как правило, ответ определяют примерно через 3-8 недель, предпочтительно примерно через 6 недель после начала лечения. Этот Ответ определяют, «как правило» повторно, с интервалами 4-8 недель, предпочтительно 6-8 недель. Когда при первом определении идентифицирован выраженный ответ (RE), то рецидив (что означает Отсутствие ответа (RE) после первого определения) может быть обнаружен не ранее чем при определении второго ответа.
В этом контексте понятие «пациент, невосприимчивый к предшествующей терапии с использованием антитела к VEGF», относится к пациенту, у которого либо первый ответ классифицирован как отсутствие ответа (NR), что позволяет отнести его к «нереспондентам», либо первый ответ классифицирован как «Ответ» (RE), а второй или последующие ответы классифицированы как «Отсутствие ответа» (NR), что позволяет отнести его к «Пациенту на стадии рецидива».
Понятие «метастаз» согласно настоящему изобретению относится к трансмиссии раковых клеток от первичной опухоли еще в одну или несколько областей в организме пациента, что приводит к образованию вторичных опухолей. Опухоль, образовавшаяся из распространившихся клеток, обозначают как «метастатическая опухоль» или «метастаз». Метастатическая опухоль содержит клетки, подобные клеткам исходной (первичной) опухоли. Методы определения, является ли опухоль метастазирующей, известны в данной области и включают тесты с использованием маркеров опухолей, сканирование костной ткани, рентгеноскопию грудной клетки, компьютерную томографию (КТ), компьютерную трансаксиальную томографию (CAT), ЯМР-томографию, позитронную эмиссионную томографию (ПЭТ), однофотонную эмиссионную компьютерную томографию (SPECT), флуоресцентную визуализацию (FI) и биолюминисцентную визуализацию (BLI) и оценку маркеров опухолей (см., например, Helms M.W. и др., Contributions to microbiology 13, 2006, cc.209-231 и Pantel К. и др., J.Nat.Cancer Inst. 91, 1999, cc.1113-1124).
В контексте настоящего описания понятие «пациент» предпочтительно относится к человеку, нуждающемуся в лечении рака или предракового состояния или повреждения. Однако понятие «пациент» относится также, среди прочего, к животным, кроме человека, предпочтительно млекопитающим, таким как собаки, кошки, лошади, коровы, свиньи, овцы и приматы, кроме человека, которые нуждаются в лечении.
Понятие «группа» относится к группе пациентов, а также к подгруппе пациентов.
Понятие « листовка-вкладыш в упаковке» относится к инструкциям, которые обычно входят в поступающие в продажу упаковки терапевтических продуктов, они могут включать информацию о показаниях, применении, дозе, пути введения, противопоказаниях и/или мерах предосторожности, касающихся применения таких терапевтических продуктов.
Рак может представлять собой, например, рак легкого, немелкоклеточный рак легкого (NSCL), альвеолярно-клеточный рак легкого, рак костной ткани, рак поджелудочной железы, рак кожи, рак головы и шеи, кожную или внутриглазную меланому, рак матки, рак яичника, ректальный рак, рак анальной области, рак желудка, гастральный рак, рак ободочной кишки, рак молочной железы, карциному маточных труб, карциному эндометрия, карциному шейки матки, карциному влагалища, карциному вульвы, болезнь Ходжкина, рак пищевода, рак тонкого кишечника, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, рак надпочечников, саркому мягких тканей, рак мочеиспускательного канала, рак пениса, рак предстательной железы, рак мочевого пузыря, рак почки или мочеиспускательного канала, печеночно-клеточную карциному, карциному почечной лоханки, мезотелиому, печеночно-клеточный рак, рак желчного пузыря, хронический или острый лейкоз, лимфоцитарную лимфому, неоплазмы центральной нервной системы (ЦНС), опухоли спинномозговых позвонков, глиому ствола головного мозга, мультиформную глиому, астроцитомы, невриномы, эпендимомы, медуллобластомы, менингиомы, плоскоклеточные карциномы, аденомы гипофиза, включая устойчивые варианты любого из перечисленных выше видов рака или комбинацию одного или нескольких вышеперечисленных видов рака. Предраковое состояние или повреждение включает, например, группу таких состояний или повреждений, как оральная лейкоплакия, старческий кератоз (солнечный кератоз), предраковые полипы ободочной или прямой кишки, гастральную эпителиальную дисплазию, аденоматозную дисплазию, наследственный неполипозный раковый синдром ободочной кишки (HNPCC), язва пищевода Баррета, дисплазия мочевого пузыря и предраковые состояния шейки матки. В предпочтительном варианте осуществления изобретения подлежащий лечению рак представляет собой рак молочной железы. Кроме того, в предпочтительном варианте осуществления изобретения рак характеризуется сверхэкспрессией белка рецептора HER2.
Изобретение относится также к способу лечения рака молочной железы у пациента, невосприимчивого к предшествующей терапии с использованием антитела к VEGF, заключающемуся в том, что пациенту вводят в терапевтически эффективном количестве антитело к HER2, сохраняя при этом терапию с использованием антитела к VEGF.
Понятие «лечение» в контексте настоящего описания, если не указано иное, означает реверсию, ослабление, ингибирование развития или предупреждение, либо частичное, либо полное, роста опухолей, метастазов опухолей или других вызывающих рак или неопластических клеток у пациента. Понятие «лечение» в контексте настоящего описания, если не указано иное, относится к акту лечения.
Понятие «способ лечения» или его эквиваленты, применительно, например, к раку, относится к процедуре или последовательности действий, направленных на снижение или элиминацию количества раковых клеток в организме пациента или облегчение симптомов рака. «Способ лечения» рака или другого пролиферативного нарушения не обязательно означает, что раковые клетки или другое нарушение должны быть фактически элиминированы, что количество клеток или степень другого нарушения должны быть фактически снижены, или что симптомы рака или другого нарушения должны быть фактически ослаблены. Часто способ лечения рака можно осуществлять даже при небольшой вероятности успеха, но если при этом с учетом истории болезни или ожидаемой продолжительности жизни пациента, тем не менее, можно ожидать благоприятного воздействия лечения.
Понятие «терапевтически эффективное количество» или «эффективное количество» означает количество предлагаемого в изобретении соединения или комбинации, которое должно вызывать биологический или медицинский ответ ткани, системы, животного или человека, которое выбирается исследователем, ветеринаром, доктором медицины или другим клиницистом.
Изобретение относится также к применению антитела к HER2 и антитела к VEGF для приготовления лекарственного средства, предназначенного для лечения рака молочной железы у пациента, невосприимчивого к предшествующей терапии с использованием антитела к VEGF, предусматривающему введение пациенту в терапевтически эффективном количестве антитела к HER2, сохраняя при этом терапию с использованием антитела к VEGF. Антитела можно вводить по отдельности или одновременно.
Понятие «способ приготовления лекарственного средства» относится к приготовлению лекарственного средства, предназначенного для применения при показаниях, указанных в настоящем описании, и, в частности, предназначенного для лечения опухолей, метастазов опухолей или рака в целом. Понятие относится к формату формулы изобретения так называемого швейцарского типа касательно указанных показаний.
В контексте настоящего изобретения в сочетании с антителом к VEGF плюс антителом к HER2 можно применять также другие цитотоксические, химиотерапевтические или противораковые агенты или соединения, которые усиливают эффективность указанных агентов. Такие агенты представляют собой, например, алкилирующие агенты или агенты с алкилирующим действием, такие как: циклофосфамид (СТХ; например Cytoxan®), хлорамбуцил (CHL; например, Leukeran®), цисплатин (CisP; например, Platinol®), бусульфан (например, Myleran®), мелфалан, кармустин (BCNU), стрептозотоцин, триэтиленмеламин (ТЕМ), митомицин С и т.п.; антиметаболиты, такие как: метотрексат (МТХ), этопозид (VP16; например, Vepesid®), 6-меркаптопурин (6МР), 6-тиогуанин (6TG), цитабин (Ara-С), 5-фторурацил (5-FU), капецитабин (например, Xeloda®), декарбазин (DTIC) и т.п.; антибиотики, такие как: актиномцин D, доксорубицин (DXR; например, Adriamycin®), даунорубицин (дауномицин), блеомицин, митрамицин и т.п.; алкалоиды, такие как алкалоиды барвинка, такие как винкристин (VCR), винбластин и т.п.; и другие противоопухолевые агенты, такие как: паклитаксел (например, Taxol®) и производные паклитаксела, цитостатические агенты, глюкокортикоиды, такие как: дексаметазон (DEX; например, Decadron®), кортикостероиды, такие как: преднизон, ингибиторы нуклеозидных ферментов, такие как: гидроксимочевина, расщепляющие (истощающие) аминокислоты ферменты, такие как: аспарагиназа, лейковорин и другие производные фолиевой кислоты и аналогичные разнообразные противоопухолевые агенты. В качестве дополнительных агентов можно использовать также: арнифостин (например, Ethyol®), дактиномицин, мехлорэтамин (горчичный газ), стрептозоцин, циклофосфамид, ломустин (CCNU), доксорубицин липо (например, Doxil®), гемцитабин (например, Gemzar®), даунорубицин липо (например, Daunoxome®), прокарбазин, митомицин, доцетаксел (например, Taxotere®), альдслеукин, карбоплатин, оксалиплатин, кладрибин, камптотецин, СРТ 11 (иринотекан), 10-гидрокси-7-этилкампотецин (SN38), флоксуридин, флударабин, ифосфамид, идарубицин, месна, интерферон-бета, интерферон-альфа, митоксантрон, топотекан, леупролид, мегестрол, мелфалан, меркаптопурин, пликамицин, митотан, пегаспаргаз, пентостатин, пипоброман, пликамицин, томоксифен, тенипозид, тестолактон, тиогуанин, тиотепу, урацил мустард, винорелбин, хлорамбуцил.
В контексте настоящего описания в сочетании с антителом к VEGF плюс антителом к HER2 можно применять антигормональный агент. В контексте настоящего описания понятие «антигормональный агент» включает встречающиеся в естественных условиях или синтетические органические или пептидные соединения, которые обладают способностью регулировать или ингибировать гормональное действие на опухоли. К антигормональным агентам относятся, например: антагонисты стероидного рецептора, антиэстрогены, такие как тамоксифен, ралоксифен, ингибрующие ароматазу 4(5)-имидазолы, другие ингибиторы ароматазы, 42-гидрокситамоксифен, триоксифен, кеоксифен, LY 117018, онапристон и торемифен (например, Fareston®); антиандрогены, такие как: флутамид, нилутамид, бикалутамид, леупролид и госерелин; и фармацевтически приемлемые соли, кислоты или производные любого из вышеперечисленных агентов; агонисты и/или антагонисты гликопротеиновых гормонов, таких как: фолликулостимулирующий гормон (ФСК), тиреотропный гормон (ТГ) и лютеинизирующий гормон (ЛГ) и ЛГРФ (рилизинг-фактор лютеинизирующего гормона); и агонист ЛГРФ госерелина ацетат, поступающий в продажу как Zoladex® (фирма AstraZeneca); и антагонист ЛГРФ D-аланинамид N-ацетил-3-(2-нафталенил)-D-аланил-4-хлор-D-фенилаланил-3-(3-пиридинил)-D-аланил-L-серил-N6-(3-пиридинилкарбонил)-L-лизил-N6-(3-пиридинилкарбонил)-D-лизил-L-лейцил-N6-(1-метилэтил)-L-лизил-L-пролина (например, Antide®, фирма Ares-Serono); антагонист ЛГРФ ганиреликса ацетат; стероидные антиадрогены ципротерона ацетат (СРА) и мегестрола ацетат, поступающий в продажу как Megace® (фирма Bristol-Myers Oncology); нестероидный антиандроген флутамид (2-метил-N-[4,20-нитро-3-(трифторметил)фенилпропанамид), поступающий в продажу как Eulexin® (фирма Sohering Corp.); нестероидный антиандроген нилутамид, (5,5-диметил-3-[4-нитро-3-(трифторметил-4'-нитрофенил)-4,4-диметилимидазолидиндион); и антагонисты других необязательных рецепторов, например антагонисты RAR (рецептор ретиноевой кислоты), RXR (ретиоидный Х-рецептор), TR (тиреоидный рецептор), VDR (рецептор витамина-D) и т.п.
Применение цитотоксических и других противораковых агентов, описанных выше, в химиотерапевтических режимах, как правило, хорошо известно в области терапии рака и их применение предусматривает использование таких же условий мониторинга толерантности и эффективности и контроля путей введения и доз с определенным регулированием. Например, фактические дозы цитотоксических агентов могут варьироваться в зависимости от реакции клеток пациента в культуре, которую определяют в культуре с помощью гистологических методов. Как правило, дозу можно снижать по сравнению с количеством, применяемым в отсутствии дополнительных других агентов.
Типичные дозы эффективного цитотоксического агента могут находиться в диапазонах, рекомендованных производителем, и, если это установлено по ответам in vitro или по ответам созданных на животных моделей, могут содержать сниженные примерно на порядок концентрацию или количество. Так, фактическая доза должна зависеть от рекомендаций лечащего врача, состояния пациента и эффективности терапевтического метода, оцененной in vitro на основе восприимчивости первичных злокачественных клеток в культуре или образце ткани, который культивируют для гистологических методов, или по ответам, полученным на соответствующих созданных на животных моделях.
В контексте настоящего изобретения дополнительные антипролиферативные агенты можно применять в сочетании с антителом к VEGF плюс антителом к HER2, такие, например, как: ингибиторы фермента фарнезилпротеинтрансферазы и ингибиторы рецепторной тирозинкиназы PDGFR, включая соединения, описанные и заявленные в US 6080769; 6194438; 6258824; 6586447; 6071935; 6495564; 6150377; 6596735 и 6479513 и в опубликованной международной заявке на патент WO 01/40217.
В контексте настоящего изобретения можно использовать ионизирующее излучение в эффективной дозе и/или применять радиофармацевтическое лечение в сочетании с применением антитела к VEGF плюс антитела к HER2. Источник излучения может быть либо внешним либо внутренним по отношению к подлежащему лечению пациенту. Когда источник является внешним по отношению к пациенту, такую терапию относят к внешней дистанционной лучевой терапии (EBRT). Когда источник излучения является внутренним по отношению к пациенту, такое лечение относят к близкофокусной лучевой терапии (брахитерапия, ВТ). Радиоактивные атомы, которые можно применять в контексте настоящего изобретения, выбирают из группы, которая включает (но не ограничена только ими), радий, цезий-137, ириди