Способы лечения, диагностики и мониторинга ревматоидного артрита
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описан способ предсказания ответа субъекта на терапевтическое средство для лечения ревматоидного артрита (RA). Также представлен способ предсказания, будет ли субъект с RA отвечать на лечение антагонистом В-клеток. Кроме того, представлен способ предсказания того, будет ли субъект с ревматоидным артритом эффективно отвечать на лечение антагонистом В-клеток, и способ выбора терапии пациента или субпопуляции пациентов с ревматоидным артритом. Все способы включают измерение в биологическом образце, полученном от субъекта, экспрессии одного гена или их комбинации или экспрессии одного белка или их комбинации, кодируемой одним геном или их комбинацией, где один ген или их комбинация выбраны из любого из CXCL13, FcRH5 и sFcRH5. Изобретение расширяет диагностические возможности в отношении RA. 4 н. и 16 з.п. ф-лы, 14 ил., 13 табл.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет предварительной заявки США № 61/275948, поданной 3 сентября 2009 года, и предварительной заявки США № 61/252424, поданной 16 октября 2009 года, причем обе они включены, таким образом, путем ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Предоставляются способы идентификации, диагностики и прогнозирования ревматоидного артрита, а также способы лечения ревматоидного артрита. Также предоставляются способы идентификации эффективных терапевтических средств для лечения ревматоидного артрита и способы предсказания восприимчивости к терапевтическим средствам для лечения ревматоидного артрита.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Ревматоидный артрит (RA) является клинически значимым хроническим системным аутоиммунным воспалительным заболеванием, поражающим от 1,3 до 2,1 миллионов человека в Соединенных Штатах Америки (См., например, Alamanosa and Drosos, Autoimmun. Rev., 4:130-136 (2005)). RA является аутоиммунным нарушением неизвестной этиологии. Большинство пациентов с RA страдают от хронического течения заболевания, которое даже при наличии доступных в настоящее время способов лечения может приводить к прогрессирующему разрушению сустава, уродству, инвалидности и даже к преждевременной смерти. Более 9 миллионов визитов к врачу и более 250000 госпитализаций в год вызваны RA.
Диагностика RA, как правило, основывается на клинической и лабораторной оценке признаков и симптомов пациента. В основном, лабораторное исследование пациента с подозрением на RA может включать определение концентрации определенных антител в сыворотке, известных как ревматоидный фактор (RF), и антител против циклического цитруллинированного пептида (анти-CCP). (См., например, Schellekens et al., Arthritis Rheum., 43:155-163 (2000); DiFranco et al., Rev. Rheum. Engl. Ed., 66(5):251-255 (1999); Rantapaa-Dahlqvist et al., Arthritis Rheum., 48:2741-2749 (2003); Li et al., Bioinformatics 22(12): 1503-1507 (2006); Russell et al., J. Rheumatol., 33(7): 1240-1242 (2006); Ota, Rinsho byori. Jap. J. Clin. Pathol., 54(8)861-868 (2006); Avouac et al., Ann. Rheum. Dis., 65(7):845-851 (2006)). В то время как эти антитела часто обнаруживают в сыворотке пациентов с RA, они имеются не у всех таких пациентов. Также можно использовать дополнительный тест крови, известный как скорость оседания эритроцитов (СОЭ). Повышенная СОЭ указывает в общем на присутствие воспалительного процесса, хотя это не обязательно RA. Другие тесты крови можно использовать для оценки уровня других факторов, таких как C-реактивный белок (CRP), которые ассоциированы с RA. Кроме того, можно проводить радиографические анализы вовлеченных суставов. В целом, такие доступные в настоящее время лабораторные тесты для диагноза RA неточны и несовершенны.
В некоторых случаях диагноз RA ставится, если пациент удовлетворяет определенным критериям American College of Rheumatology (ACR). Такие конкретные критерии включают в себя утреннюю скованность в суставах и вокруг них, продолжающуюся, по меньшей мере, в течение 1 часа до максимального улучшения; артрит трех или большего количества областей суставов: по меньшей мере, три суставные области имеют одновременно набухание мягких тканей или жидкость (не только разрастание кости), наблюдаемые врачом; 14 возможных суставных областей (правые и левые) включают в себя проксимальный межфаланговый (PIP), пястно-фаланговый (MCP), запястье, локоть, колено, лодыжку и плюснефаланговый (MTP) сустав; артрит суставов кисти: по меньшей мере, одну суставная область с набуханием, как описано выше, из запястного, MCP или PIP суставов; симметричный артрит: одновременное вовлечение одних и тех же суставных областей (как при артрите трех или большего количества суставных областей из описанных выше) на обеих сторонах тела (билатеральное вовлечение PIP, MCP или MTP суставов принимается без абсолютной симметрии); ревматоидные узелки: подкожные узелки над костными выступами или разгибательными поверхностями или в околосуставных областях, наблюдаемые врачом; сывороточный ревматоидный фактор: демонстрация аномального количества сывороточного ревматоидного фактора любым способом, который дает положительный результат менее чем у пяти процентов из нормальных контрольных пациентов; радиографические изменения: радиографические изменения, обычные для ревматоидного артрита на заднепередних рентгеновских снимках кисти и запястья, которые должны включать эрозии или неоспоримую декальцинацию кости, локализованную на вовлеченных суставах или наиболее заметную в области, прилегающей к вовлеченным суставам (только остеоартритные изменения не квалифицируются). Диагноз RA, как правило, ставят, если пациент удовлетворяет, по меньшей мере, четырем из указанных выше критериев.
В ряде опубликованных исследований сообщается о попытке идентификации надежных биомаркеров для диагностических и прогностических целей. (См. например, Rioja et al., Arthritis and Rheum. 58(8):2257-2267 (2008); Pyrpasopoulou et al., Mol. Diagn. Ther. 14(l):43-48 (2010); WO 2004/0009479; WO 2007/0105133; WO 2007/038501; WO 2007/135568; WO 2008/104608; WO 2008/056198; WO 2008/132176; и WO 2008/154423). Однако, не идентифицировано клинически валидированных диагностических маркеров, например, биомаркеров, которые позволили бы клиницистам и другим специалистам точно определить патофизиологические аспекты ревматоидного артрита, его клиническую активность, ответ на лечение, прогноз или риск развития заболевания. Таким образом, поскольку пациенты с RA нуждаются в лечении, при поиске терапевтического(их) средства(в), эффективных для конкретного пациента, используется метод проб и ошибок. Такие пробы и ошибки часто связаны со значительным риском и дискомфортом для пациента при поиске наиболее эффективного лечения. Таким образом, существует необходимость в более эффективных средствах определения того, какие пациенты ответят на какое лечения, и во внедрении таких сведений в более эффективные схемы лечения пациентов с астмой.
Таким образом, большие преимущества предоставит наличие дополнительных способов диагностики, включая основанные на молекулярных методах способы диагностики, которые можно использовать для объективной идентификации наличия у пациента заболевания и/или его классификации, для определения патофизиологических аспектов ревматоидного артрита, клинической активности, ответа на лечение, включая ответ на лечение различными средствами для терапии RA терапевтические средства, прогноза и/или риска развития ревматоидного артрита. Кроме того, преимущества предоставит наличие молекулярных диагностических маркеров, ассоциированных с различными клиническими, и/или патофизиологическими, и/или другими биологическими индикаторами заболевания. Таким образом, имеется непрерывная потребность в идентификации новых молекулярных биомаркеров, ассоциированных с ревматоидным артритом, а также другими аутоиммунными нарушениями. Такие ассоциации в значительной степени улучшат идентификацию наличия у пациентов ревматоидного артрита или определение чувствительности к развитию заболевания. Такие ассоциации также улучшат идентификацию патофизиологических аспектов RA, клинической активности, ответа на терапию или прогноза. Кроме того, статистически и биологически значимая, и воспроизводимая информация, касающаяся таких ассоциаций, может использоваться в качестве интегрального компонента в попытках идентификации конкретных подмножеств пациентов, которые, как ожидается, получат значимое преимущество от лечения конкретным терапевтическим средством, например, в случаях, когда терапевтическое средство приносит терапевтическую пользу в таких конкретных субпопуляциях пациентов с RA, или это было показано в клинических исследованиях.
Изобретение, описываемое в настоящем документе, отвечает описанным выше потребностям и предоставляет другие преимущества.
Все цитируемые в настоящем документе ссылки, в том числе патентные заявки и публикации, в полном объеме включены путем ссылки для любых целей.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Композиции и способы по изобретению основаны, по меньшей мере, частично на определении четыре новых и различных молекулярных фенотипов (также обозначенных в настоящем документе как молекулярные субтипы) ревматоидного артрита (RA). Эти четыре молекулярных субтипа RA, описываемые в настоящем документе, определяли на основе дифференциальной генной экспрессии между подтипами и на основе значимых ассоциаций каждого из молекулярных субтипов с определенными гистологическими индикаторами патологии суставов, а также с определенными биологическими каскадами. Термины «молекулярный фенотип» и «молекулярный субтип» используют в настоящем документе взаимозаменяемо.
Таким образом, в одном из аспектов предоставлены терапевтические мишени для лечения определенного молекулярного субтипа RA, описываемого в настоящем документе как богатый лимфоидными клетками (L) субтип. В определенных вариантах осуществления терапевтическая мишень L-субтипа выбрана из одного гена из перечисленных в таблице 5 или их комбинации. В определенных вариантах осуществления терапевтическая мишень L-субтипа выбрана из одного гена из перечисленных в таблице 1 или их комбинации. В определенных вариантах осуществления терапевтическая мишень L-субтипа выбрана из одного гена из перечисленных в таблице 10 или их комбинации. В определенных вариантах осуществления терапевтическая мишень L-субтипа выбрана из одного белка или комбинации белков, кодируемых одним геном или комбинацией генов, перечисленных в таблице 5. В определенных вариантах осуществления терапевтическая мишень L-субтипа выбрана из одного белка или комбинации белков, кодируемых одним геном или комбинацией генов, перечисленных в таблице 1. В определенных вариантах осуществления терапевтическая мишень L-субтипа выбрана из одного белка или комбинации белков, кодируемых одним геном или комбинацией генов, перечисленных в таблице 10. В определенных вариантах осуществления терапевтическая мишень L-субтипа RA выбрана из одного или нескольких из CD20 (синоним MS4A1), CTLA4, CD3, CRTAM, IL2Rβ, IL2Rγ, CD19, HLAII, CD79a, CD79b, FcRH5 (синоним IRTA2), CD38, IL21R, IL12Rβ1 и IL12Rβ2.
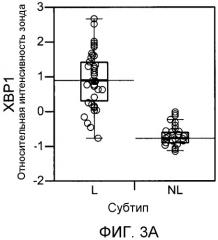
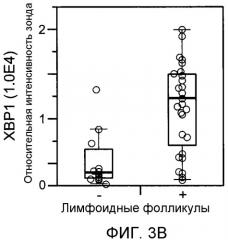
В другом аспекте способы диагностики определенного субтипа RA, описываемого в настоящем документе как L-субтип, включают измерение генной экспрессии одного гена из перечисленных в таблице 5 или их комбинации, или измерение количества белка, экспрессируемого одним геном или их комбинацией из перечисленных в таблице 5. В определенных вариантах осуществления один или несколько генов, идентифицированных в таблице 5, или белки, кодируемые указанными генами, являются биомаркерами L-субтипа. В определенных вариантах осуществления способы диагностики L-субтипа RA включают в себя измерение генной экспрессии одного гена из перечисленных в таблице 1 или их комбинации, или измерение количества белка, экспрессируемого одним геном или их комбинацией из перечисленных в таблице 1. В определенных вариантах осуществления один или несколько генов, идентифицированных в таблице 1, или белки, кодируемые указанными генами, являются биомаркерами L-субтипа. В определенных вариантах осуществления способы диагностики L-субтипа RA включают в себя измерение генной экспрессии одного гена из перечисленных в таблице 10 или их комбинации, или измерение количества белка, экспрессируемого одним геном или их комбинацией из перечисленных в таблице 10. В определенных вариантах осуществления один или несколько генов, идентифицированных в таблице 10, или белки, кодируемые указанными генами, являются биомаркерами L-субтипа. В определенных вариантах осуществления способы диагностики L-субтипа RA включают в себя измерение экспрессии гена или экспрессии белка, представляющего собой один или несколько из CXCL13, FcRH5 (синоним IRTA2), sFcRH5 (синоним sIRTA2), LTβ, ICAM3, IL18, PACAP, TNFRSF7, IgJ, IGM, IgG и XBP1. В определенных вариантах осуществления способы диагностики L-субтипа RA включают в себя измерение экспрессии белка CXCL13, и/или sFcRH5, и/или RF в сыворотке. В определенных вариантах осуществления пациенту ставят диагноз L-субтипа RA, когда уровень CXCL13 в сыворотке превышает 116,6 пг/мл или превышает 150 пг/мл, или превышает 200 пг/мл, или превышает 250 пг/мл, или превышает 300 пг/мл. В определенных вариантах осуществления пациенту ставят диагноз L-субтипа RA, когда уровень sFcRH5 в сыворотке превышает 126,7 нг/мл, или превышает 150 нг/мл, или превышает 200 нг/мл, или превышает 250 нг/мл, или превышает 300 нг/мл. В определенных вариантах осуществления пациенту ставят диагноз L-субтипа RA, когда сыворотка положительна по RF и когда уровень sFcRH5 в сыворотке повышен по сравнению с контрольным образцом. В некоторых таких вариантах осуществления уровень sFcRH5 в сыворотке превышает 126,7 нг/мл, или превышает 150 нг/мл, или превышает 200 нг/мл, или превышает 250 нг/мл, или превышает 300 нг/мл. В определенных вариантах осуществления пациенту ставят диагноз L-субтипа RA, когда сыворотка положительна по RF и когда уровень sFcRH5 и CXCL13 в сыворотке повышен по сравнению с контрольным образцом. В некоторых таких вариантах осуществления уровень sFcRH5 в сыворотке превышает 126,7 нг/мл, или превышает 150 нг/мл, или превышает 200 нг/мл, или превышает 250 нг/мл, или превышает 300 нг/мл, и уровень CXCL13 в сыворотке превышает 116,6 пг/мл или превышает 150 пг/мл, или превышает 200 пг/мл, или превышает 250 пг/мл, или превышает 300 пг/мл.
В другом аспекте предоставляются терапевтические мишени для лечения определенного молекулярного субтипа RA, описываемого в настоящем документе как богатый миелоидными клетками (M) субтип. В определенных вариантах осуществления терапевтическая мишень M-субтипа выбрана из одного гена из перечисленных в таблице 6 или их комбинации. В определенных вариантах осуществления терапевтическая мишень М-субтипа выбрана из одного гена из перечисленных в таблице 2 или их комбинации. В определенных вариантах осуществления терапевтическая мишень M-субтипа выбрана из одного гена из перечисленных в таблице 11 или их комбинации. В определенных вариантах осуществления терапевтическая мишень М-субтипа выбрана из одного белка или комбинации белков, кодируемых одним геном или комбинацией генов, перечисленных в таблице 6. В определенных вариантах осуществления терапевтическая мишень М-субтипа выбрана из одного белка или комбинации белков, кодируемых одним геном или комбинацией генов, перечисленных в таблице 2. В определенных вариантах осуществления терапевтическая мишень М-субтипа выбрана из одного белка или комбинации белков, кодируемых одним геном или комбинацией генов, перечисленных в таблице 11. В определенных вариантах осуществления терапевтическая мишень М-субтипа RA выбрана из одного или нескольких из CLEC5A, CLEC7A, ALCAM, IL1RAP, IRAK1, NRP2, TREM1 и VEGF.
В другом аспекте способы диагностики определенного типа RA, описываемого в настоящем документе как М-субтип, включают измерение генной экспрессии одного гена из перечисленных в таблице 6 или их комбинации, или измерение количества белка, экспрессируемого одним геном или их комбинацией из перечисленных в таблице 6. В определенных вариантах осуществления один или несколько генов, идентифицированных в таблице 6, или белки, кодируемые указанными генами, являются биомаркерами М-субтипа. В определенных вариантах осуществления способы диагностики М-субтипа RA включают в себя измерение генной экспрессии одного гена из перечисленных в таблице 2 или их комбинации, или измерение количества белка, экспрессируемого одним геном или их комбинацией из перечисленных в таблице 2. В определенных вариантах осуществления один или несколько генов, идентифицированных в таблице 2, или белки, кодируемые указанными генами, являются биомаркерами М-субтипа. В определенных вариантах осуществления способы диагностики М-субтипа RA включают в себя измерение генной экспрессии одного гена из перечисленных в таблице 11 или их комбинации, или измерение количества белка, экспрессируемого одним геном или их комбинацией из перечисленных в таблице 11. В определенных вариантах осуществления один или несколько генов, идентифицированных в таблице 11, или белки, кодируемые указанными генами, являются биомаркерами М-субтипа. В определенных вариантах осуществления способы диагностики М-субтипа RA включают в себя измерение экспрессии гена или экспрессии белка, представляющего собой один или несколько из ADAM8, CTSB, CXCL3, ICAM1, IL18BP, IL1B, IL8, MMP12, CCL2, VEGFA и S100A11.
В другом аспекте предоставляются терапевтические мишени для лечения определенного молекулярного субтипа RA, описываемого в настоящем документе как богатый фибробластами субтип 2 (F2). В определенных вариантах осуществления терапевтическая мишень F2-субтипа выбрана из одного гена из перечисленных в таблице 7 или их комбинации. В определенных вариантах осуществления терапевтическая мишень F2-субтипа выбрана из одного гена из перечисленных в таблице 3 или их комбинации. В определенных вариантах осуществления терапевтическая мишень F2-субтипа выбрана из одного гена из перечисленных в таблице 12 или их комбинации. В определенных вариантах осуществления терапевтическая мишень F2-субтипа выбрана из одного белка или комбинации белков, кодируемых одним геном или комбинацией генов, перечисленных в таблице 7. В определенных вариантах осуществления терапевтическая мишень F2-субтипа выбрана из одного белка или комбинации белков, кодируемых одним геном или комбинацией генов, перечисленных в таблице 3. В определенных вариантах осуществления терапевтическая мишень F2-субтипа выбрана из одного белка или комбинации белков, кодируемых одним геном или комбинацией генов, перечисленных в таблице 12. В определенных вариантах осуществления терапевтическая мишень F2-субтипа RA выбрана из одного или нескольких из IL17D, IL17RC, TIMP3 и TNFRSF11B.
В другом аспекте способы диагностики определенного типа RA, описываемого в настоящем документе как F2-субтип, включают измерение генной экспрессии одного гена из перечисленных в таблице 7 или их комбинации, или измерение количества белка, экспрессируемого одним геном или их комбинацией из перечисленных в таблице 7. В определенных вариантах осуществления один или несколько генов, идентифицированных в таблице 7, или белки, кодируемые указанными генами, являются биомаркерами F2-субтипа. В определенных вариантах осуществления способы диагностики F2-субтипа RA включают в себя измерение генной экспрессии одного гена из перечисленных в таблице 3 или их комбинации, или измерение количества белка, экспрессируемого одним геном или их комбинацией из перечисленных в таблице 3. В определенных вариантах осуществления один или несколько генов, идентифицированных в таблице 3, или белки, кодируемые указанными генами, являются биомаркерами F2-субтипа. В определенных вариантах осуществления способы диагностики F2-субтипа RA включают в себя измерение генной экспрессии одного гена из перечисленных в таблице 12 или их комбинации, или измерение количества белка, экспрессируемого одним геном или их комбинацией из перечисленных в таблице 12. В определенных вариантах осуществления один или несколько генов, идентифицированных в таблице 12, или белки, кодируемые указанными генами, являются биомаркерами F2-субтипа. В определенных вариантах осуществления способы диагностики F2-субтипа RA включают в себя измерение экспрессии гена или экспрессии белка, представляющего собой один или несколько из FGF10, FGF18, FGF2, LRP6, TGFβ2, WNT11, BMP6, BTC, CLU, CRLF1, TIMP3, FZD10, FZD7, FZD8 и IL17D.
В другом аспекте предоставлены терапевтические мишени для лечения определенного молекулярного субтипа RA, описываемого в настоящем документе как богатый фибробластами субтип 1 (F1). В определенных вариантах осуществления терапевтическая мишень F1-субтипа выбрана из одного гена из перечисленных в таблице 8 или их комбинации. В определенных вариантах осуществления терапевтическая мишень F1-субтипа выбрана из одного гена из перечисленных в таблице 4 или их комбинации. В определенных вариантах осуществления терапевтическая мишень F1-субтипа выбрана из одного гена из перечисленных в таблице 13 или их комбинации. В определенных вариантах осуществления терапевтическая мишень F1-субтипа выбрана из одного белка или комбинации белков, кодируемых одним геном или комбинацией генов, перечисленных в таблице 8. В определенных вариантах осуществления терапевтическая мишень F1-субтипа выбрана из одного белка или комбинации белков, кодируемых одним геном или комбинацией генов, перечисленных в таблице 4. В определенных вариантах осуществления терапевтическая мишень F1-субтипа выбрана из одного белка или комбинации белков, кодируемых одним геном или комбинацией генов, перечисленных в таблице 13. В определенных вариантах осуществления терапевтическая мишень F1-субтипа RA выбрана из одного или нескольких из CDH11, ITGA11 и CLEC11A.
В другом аспекте способы диагностики определенного типа RA, описываемого в настоящем документе как F1-субтип, включают измерение генной экспрессии одного гена из перечисленных в таблице 8 или их комбинации, или измерение количества белка, экспрессируемого одним геном или их комбинацией из перечисленных в таблице 8. В определенных вариантах осуществления один или несколько генов, идентифицированных в таблице 8, или белки, кодируемые указанными генами, являются биомаркерами F1-субтипа. В определенных вариантах осуществления способы диагностики F1-субтипа RA включают в себя измерение генной экспрессии одного гена из перечисленных в таблице 4 или их комбинации, или измерение количества белка, экспрессируемого одним геном или их комбинацией из перечисленных в таблице 4. В определенных вариантах осуществления один или несколько генов, идентифицированных в таблице 4, или белки, кодируемые указанными генами, являются биомаркерами F1-субтипа. В определенных вариантах осуществления способы диагностики F1-субтипа RA включают в себя измерение генной экспрессии одного гена из перечисленных в таблице 13 или их комбинации, или измерение количества белка, экспрессируемого одним геном или их комбинацией из перечисленных в таблице 13. В определенных вариантах осуществления один или несколько генов, идентифицированных в таблице 13, или белки, кодируемые указанными генами, являются биомаркерами F1-субтипа. В определенных вариантах осуществления способы диагностики F1-субтипа RA включают в себя измерение экспрессии гена или экспрессии белка, представляющего собой один или несколько из ITGA11, MMP11, MMP13, MMP16, MMP28, ADAM12, ADAM22, CTSK, CTHRC1, ENPEP, POSTN, ANGPT2, SFRP2, TIE1 и VWF.
В одном из аспектов генную экспрессию измеряют посредством микрочипа. В другом аспекте генную экспрессию измеряют путем количественной полимеразной цепной реакции в реальном времени (qPCR). В другом аспекте генную экспрессию измеряют путем мультиплексной ПЦР. Согласно другому варианту осуществления генную экспрессию измеряют путем наблюдения уровня экспрессии белка указанного выше гена. Согласно другому варианту осуществления экспрессию интересующего гена считают повышенной при сравнении со здоровым контролем, если относительный уровень мРНК интересующего гена в 2 раза выше уровня мРНК гена в контроле. Согласно другому варианту осуществления относительный уровень мРНК интересующего гена превышает в 3 раза, в 10 раз, в 15 раз, в 20 раз, в 25 раз или в 30 раз уровень экспрессии гена в здоровом контроле. В одном из аспектов уровень генной экспрессии измеряют способом, выбранным из способа на основе ПЦР, способа на основе микрочипа или способа на основе иммунологического анализа. В одном из вариантов осуществления способ на основе микрочипа включает в себя применение чипа с микроматрицей, содержащей одну или несколько молекул нуклеиновой кислоты, которые могут гибридизоваться в жестких условиях с молекулой нуклеиновой кислоты, кодирующей ген, указанный выше, или содержащей один или несколько полипептидов (таких как пептиды или антитела), которые могут связываться с одним или несколькими белками, кодируемыми указанными выше генами. В одном из вариантов осуществления способ на основе ПЦР представляет собой qPCR. В одном из вариантов осуществления способ на основе ПЦР представляет собой мультиплексную ПЦР. Согласно одному из вариантов осуществления способ на основе иммунологического анализа включает в себя связывание антитела с белком, экспрессированным с указанного выше гена в образце от пациента и определение того, повышен ли уровень белка в образце от пациента. В некоторых вариантах осуществления способ на основе иммунологического анализа представляет собой твердофазный иммуноферментный анализ (ELISA). В определенных вариантах осуществления экспрессию белка CXCL13, sFcRH5 и/или RF измеряют путем ELISA.
В одном из аспектов предоставляется способ идентификации у субъекта субтипа ревматоидного артрита, причем данный способ включает измерение в биологическом образце, полученном от субъекта, экспрессии одного или нескольких генов, или одного или нескольких белков, кодируемых указанными генами, ассоциированными с определенным субтипом. В одном из аспектов субтип RA выбран из L-субтипа, М-субтипа, F2-субтипа и F1-субтипа, как описано в настоящем документе. В определенных вариантах осуществления субтип RA представляет собой L-субтип, и один или несколько генов, или один или несколько белков, кодируемых указанными генами, выбраны из одного гена из перечисленных в таблице 1, или в таблице 5, или в таблице 10, или их комбинации. В определенных вариантах осуществления субтип RA представляет собой L-субтип, и один или несколько генов выбраны из одного гена из перечисленных в таблице 1, или в таблице 5, или в таблице 10, или их комбинации, и экспрессию одного или нескольких генов измеряют с использованием соответствующих зондов, перечисленных в таблице 1, или в таблице 5, или в таблице 10, соответственно. В определенных вариантах осуществления субтип RA представляет собой L-субтип, и один или несколько генов или один или несколько белков, кодируемых указанными генами, выбраны из CXCL13, FcRH5 (синоним IRTA2), sFcRH5 (синоним SIRTA2), LTβ, ICAM3, IL18, PACAP, TNFRSF7, IgJ, IGM, IgG и XBP1. В определенных вариантах осуществления биологический образец представляют собой образец сыворотки, и белок, экспрессию которого измеряют, выбран из CXCL13 и sFcRH5. В определенных вариантах осуществления биологический образец представляет собой образец сыворотки, образец сыворотки является положительным по RF, и белок, экспрессию которого измеряют, выбран из CXCL13 и sFcRH5. В определенных вариантах осуществления биологический образец представляет собой образец сыворотки, образец сыворотки является положительным по RF, и белок, экспрессию которого измеряют, выбран из CXCL13 и sFcRH5. В определенных вариантах осуществления субтип RA идентифицируют как L-субтип, когда уровень CXCL13 в сыворотке превышает 116,6 пг/мл, или превышает 150 пг/мл, или превышает 200 пг/мл, или превышает 250 пг/мл, или превышает 300 пг/мл. В определенных вариантах осуществления субтип RA идентифицируют как L-субтип, когда уровень FcRH5 в сыворотке превышает 126,7 нг/мл или превышает 150 нг/мл, или превышает 200 нг/мл, или превышает 250 нг/мл, или превышает 300 нг/мл. В определенных вариантах осуществления субтип RA представляет собой M-субтип, и один или несколько генов, или один или несколько белков, кодируемых указанными генами, выбраны из одного из генов, перечисленных в таблице 2, или в таблице 6, или в таблице 11, или их комбинации. В определенных вариантах осуществления субтип RA представляет собой М-субтип, и один или несколько генов выбраны из одного гена из перечисленных в таблице 2, или в таблице 6, или в таблице 11, или их комбинации, и экспрессию одного или нескольких генов измеряют с использованием соответствующих зондов, перечисленных в таблице 2, или в таблице 6, или в таблице 11, соответственно. В определенных вариантах осуществления субтип RA представляет собой М-субтип, и один или несколько генов или один или несколько белков, кодируемых указанными генами, выбраны из ADAM8, CTSB, CXCL3, ICAM1, IL18BP, IL1B, IL8, MMP12, CCL2, VEGFA и S100A11. В определенных вариантах осуществления субтип RA представляет собой F2-субтип, и один или несколько генов, или один или несколько белков, кодируемых указанными генами, выбраны из одного из генов, перечисленных в таблице 3, или в таблице 7, или в таблице 12, или их комбинации. В определенных вариантах осуществления субтип RA представляет собой F2-субтип, и один или несколько генов выбраны из одного гена из перечисленных в таблице 3, или в таблице 7, или в таблице 12, или их комбинации, и экспрессию одного или нескольких генов измеряют с использованием соответствующих зондов, перечисленных в таблице 3, или в таблице 7, или в таблице 12, соответственно. В определенных вариантах осуществления субтип RA представляет собой F2-субтип, и один или несколько генов или один или несколько белков, кодируемых указанными генами, выбраны из FGF10, FGF18, FGF2, LRP6, TGFβ2, WNT11, BMP6, BTC, CLU, CRLF1, TIMP3, FZD10, FZD7, FZD8 и IL17D. В определенных вариантах осуществления субтип RA представляет собой F1-субтип, и один или несколько генов, или один или несколько белков, кодируемых указанными генами, выбраны из одного из генов, перечисленных в таблице 4, или в таблице 8, или в таблице 13, или их комбинации. В определенных вариантах осуществления субтип RA представляет собой F1-субтип, и один или несколько генов выбраны из одного гена из перечисленных в таблице 4, или в таблице 8, или в таблице 13, или их комбинации, и экспрессию одного или нескольких генов измеряют с использованием соответствующих зондов, перечисленных в таблице 4, или в таблице 8, или в таблице 13, соответственно. В определенных вариантах осуществления субтип RA представляет собой F1-субтип, и один или несколько генов или один или несколько белков, кодируемых указанными генами, выбраны из ITGA11, MMP11, MMP13, MMP16, MMP28, ADAM12, ADAM22, CTSK, CTHRC1, ENPEP, POSTN, ANGPT2, SFRP2, TIE1 и VWF.
В другом аспекте предоставлен способ предсказания того, будет ли субъект RA отвечать на средство для лечения RA, причем способ включает измерение в биологическом образце, полученном от субъекта, экспрессии одного один или нескольких генов из генной сигнатуры, или экспрессии одного или нескольких белков, кодируемых указанными генами (белковая сигнатура), ассоциированных с молекулярным субтипом RA. В одном из аспектов генная сигнатура или белковая сигнатура ассоциирована с молекулярным субтипом RA, выбранным из L-субтипа, M-субтипа, F2-субтипа и F1-субтипа, как описано в настоящем документе. В определенных вариантах осуществления генная сигнатура или белковая сигнатура ассоциированы с L-субтипом, и один или несколько генов или один или несколько белков, кодируемых указанными генами, выбраны из одного из генов, перечисленных в таблице 1, или таблице 5, или таблице 10, или их комбинации. В определенных вариантах осуществления генная сигнатура ассоциирована с L-субтипом, и один или несколько генов выбраны из одного из генов, перечисленных в таблице 1, или таблице 5, или таблице 10, или их комбинации, и экспрессию одного или нескольких генов измеряют с использованием соответствующих зондов, перечисленных в таблице 1, или в таблице 5, или в таблице 10, соответственно. В определенных вариантах осуществления генная сигнатура или белковая сигнатура ассоциирована с L-субтипом, и один или несколько генов или один или несколько белков, кодируемых указанными генами, выбраны из CXCL13, FcRH5 (синоним IRTA2), sFcRH5 (синоним sIRTA2), LTβ, ICAM3, IL18, PACAP, TNFRSF7, IgJ, IGM, IgG и XBP1. В определенных вариантах осуществления белковая сигнатура ассоциирована с L-субтипом, и один или несколько белков, кодируемых указанными генами, выбраны из CXCL13, sFcRH5 и RF. В определенных вариантах осуществления биологический образец представляет собой образец сыворотки. В определенных вариантах осуществления средство для лечения RA представляет собой антагонист В-клеток. В определенных вариантах осуществления антагонист В-клеток выбран из антитела против CD22, антитела против CD20, антитела против BR3 и иммуноадгезинов BR3-Fc. В определенных вариантах осуществления антитело против CD20 выбрано из ритуксимаба, ибритумомаба тиуксетана, тозитумомаба, 1F5, 2H7 и A20. В определенных вариантах осуществления предоставлены способы предсказания того, ответит ли субъект с RA на ритуксимаб, включающие измерение в сыворотке уровней CXCL13, sFcRH5 и/или RF. В одном из вариантов осуществления предсказывается, что субъект с RA ответит на ритуксимаб, когда уровень CXCL13 в сыворотке превышает 116,6 пг/мл. В одном из вариантов осуществления предсказывается, что субъект с RA ответит на ритуксимаб, когда уровень sFcRH5 в сыворотке превышает 126,7 нг/мл. В одном из вариантов осуществления предсказывается, что субъект с RA ответит на ритуксимаб, когда уровень CXCL13 в сыворотке превышает 116,6 пг/мл, и уровень sFcRH5 в сыворотке превышает 126,7 нг/мл. В одном из вариантов осуществления предсказывается, что субъект с RA ответит на ритуксимаб, когда сыворотка положительна в отношении RF, и уровень CXCL13 в сыворотке превышает 116,6 пг/мл, и уровень sFcRH5 в сыворотке превышает 126,7 нг/мл.
В определенных вариантах осуществления генная сигнатура или белковая сигнатура ассоциирована с M-субтипом, и один или несколько генов или один или несколько белков, кодируемых указанными генами, выбраны из одного из генов, перечисленных в таблице 2, или таблице 6, или таблице 11, или их комбинации. В определенных вариантах осуществления генная сигнатура ассоциирована с M-субтипом, и один или несколько генов выбраны из одного из генов, перечисленных в таблице 2, или таблице 6, или таблице 11, или их комбинации, и экспрессию одного или нескольких генов измеряют с использованием соответствующих зондов, перечисленных в таблице 2, или в таблице 6, или в таблице 11, соответственно. В определенных вариантах осуществления генная сигнатура или белковая сигнатура ассоциирована с M-субтипом, и один или несколько генов или один или несколько белков, кодируемых указанными генами, выбраны из ADAM8, CTSB, CXCL3, ICAM1, IL18BP, IL1B, IL8, MMP12, CCL2, VEGFA и S100A11.
В определенных вариантах осуществления генная сигнатура или белковая сигнатура ассоциированы с F2-субтипом, и один или несколько генов или один или несколько белков, кодируемых указанными генами, выбраны из одного из генов, перечисленных в таблице 3, или таблице 7, или таблице 12, или их комбинации. В определенных вариантах осуществления генная сигнатура ассоциирована с F2-субтипом, и один или несколько генов выбраны из одного из генов, перечисленных в таблице 3, или таблице 7, или таблице 12, или их комбинации, и экспрессию одного или нескольких генов измеряют с использованием соответствующих зондов, перечисленных в таблице 3, или в таблице 7, или в таблице 12, соответственно. В определенных вариантах осуществления генная сигнатура или белковая сигнатура ассоциирована с F2-субтипом, и один или несколько генов или один или несколько белков, кодируемых указанными генами, выбраны из FGF10, FGF18, FGF2, LRP6, TGFβ2, WNT11, BMP6, BTC, CLU, CRLF1, TIMP3, FZD10, FZD7, FZD8 и IL17D.
В определенных вариантах осуществления генная сигнатура или белковая сигнатура ассоциированы с F1-субтипом, и один или несколько генов или один или несколько белков, кодируемых указанными генами, выбраны из одного из генов, перечисленных в таблице 4, или таблице 8, или таблице 13, или их комбинации. В определенных вариантах осуществления генная сигнатура ассоциирована с F1-субтипом, и один или несколько генов выбраны из одного из генов, перечисленных в таблице 4, или таблице 8, или таблице 13, или их комбинации, и экспрессию одного или нескольких генов измеряют с использованием соответствующих зондов, перечисленных в таблице 4, или в таблице 8, или в таблице 13, соответственно. В определенных вариантах осуществления генная сигнатура или белковая сигнатура ассоциирована с F1-субтипом, и один или несколько генов или один или несколько белков, кодируемых указанными генами, выбраны из ITGA11, MMP11, MMP13, MMP16, MMP28, ADAM12, ADAM22, CTSK, CTHRC1, ENPEP, POSTN, ANGPT2, SFRP2, TIE1 и VWF.
В определенных вариантах осуществления средство для лечения RA направлено на биологический каскад, выбранный из каскадов, связанных с цитокинами/хемокинами, лимфоцитами, дендритными клетками, макрофагами, фибробластами, остеобластами и остеокластами. В определенных вариантах осуществления средство для лечения RA выбрано из ингибитора TNFα, антагониста В-клеток, средства, связывающего IL-17A/F, средства, связывающего IL-6, ингибитора костимуляции, например, ингибитора каскада CD28/B7, средства, связывающего CD4. В определенных вариантах осуществления ингибитор каскада CD28/B7 представляет собой CTLA4-Ig.
В еще одном аспекте предоставляется способ диагностики или прогнозирования RA у субъекта, причем способ включает измерение в биологическом образце, полученном от субъекта, экспрессии одного или нескольких генов или одного или несколько белков, кодируемы